БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 6. ОБМІН І ФУНКЦІЇ АМІНОКИСЛОТ. БІОСИНТЕЗ БІЛКА
6.3. Перетравлення білків
6.3.2. Перетравлення білків у кишечнику
Шлунковий вміст (хімус) у процесі травлення надходить до дванадцятипалої кишки. Низьке значення рН хімусу викликає в кишечнику виділення білкового гормону секретину, що надходить у кров. Цей гормон, у свою чергу, стимулює виділення з підшлункової залози в тонкий кишечник панкреатичного соку,
який містить HCO3 , що приводить до нейтралізації HCl шлункового соку та інгібування пепсину. У результаті рН стрімко зростає від 1,5-2,0 до ~7,0.
Надходження пептидів у тонкий кишечник викликає секрецію іншого білкового гормону - холецистокініну, який стимулює виділення панкреатичних ферментів з оптимумом рН 7,5-8,0. Під дією ферментів підшлункової залози і клітин кишечнику завершується перетравлення білків.
У підшлунковій залозі синтезуються проферменти протеаз: трипсиноген, хімотрипсиноген, проеластаза, прокарбоксипепти- дази А і В. У кишечнику вони шляхом часткового протеолізу перетворюються на активні ферменти трипсин, хімотрипсин, елас- тазу та карбоксипептидази А і В.
Активація трипсиногену. Активація відбувається під дією ферменту епітелію кишечнику ентеропептидази. Цей фермент відщеплює з N-кінця молекули трипсиногену гексапептид Вал-(Асп)4-Ліз. Зміна конформації вкороченого поліпептидного ланцюга зумовлює формування активного центру й утворюється активний трипсин. Активація проферменту шляхом відщеплення послідовності Вал-(Асп)4-Ліз є характерною для більшості відомих трипсиногенів різних організмів - від риб до людини.
Утворений трипсин активує хімотрипсиноген, з якого утворюється кілька активних ферментів (рис. 6.3). Хімотрипсино- ген складається з одного поліпептидного ланцюга, який містить 245 амінокислотних залишків і п'ять дисульфідних містків. Під дією трипсину розщеплюється пептидний зв'язок між 15-тою і 16-тою амінокислотами, унаслідок чого утворюється активний π-хімотрипсин. Потім під дією π-хімотрипсину відщеплюється дипептид Сер(14)-Арг(15), що приводить до утворення δ-хімотрипсину. Відщеплення дипептиду Тре(147)-Арг(148) завершує утворення стабільної форми активного ферменту - α-хімотрипсину, який складається з трьох поліпептидних ланцюгів, з'єднаних дисульфідними містками.
Інші проферменти панкреатичних протеаз (проеластаза і про- карбоксипептидази А і В) також активуються трипсином шляхом часткового протеолізу. У результаті утворюються активні ферменти - еластаза і карбоксипептидази А і В.
Специфічність дії протеаз. Трипсин переважно гідролізує пептидні зв'язки, утворені карбоксильними групами аргініну і лізину. Хімотрипсини найактивніші щодо карбоксильних груп ароматичних амінокислот (Фен, Тир, Три).
Карбоксипептидази А і В - цинковмісні ферменти, вони відщеплюють С-кінцеві залишки амінокислот. Причому карбоксипептидаза А відщеплює переважно амінокислоти, які містять ароматичні або гідрофобні радикали, а карбоксипептидаза В - залишки аргініну та лізину.
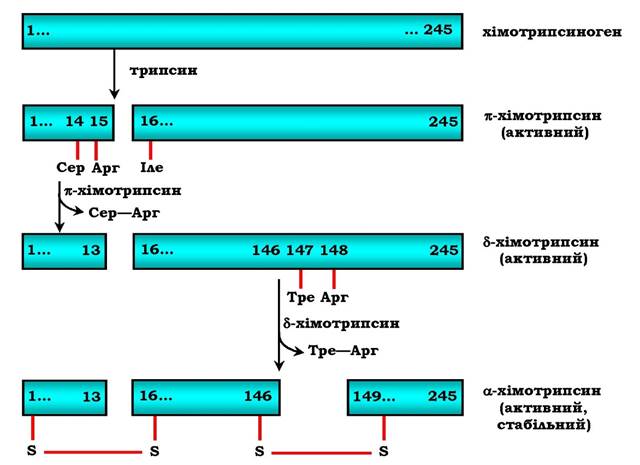
Рис. 6.3. Активація хімотрипсиногену
Останній етап перетравлення - гідроліз невеликих пептидів, він відбувається під дією ферментів амінопептидаз і дипептидаз, які синтезуються клітинами кишечнику в активній формі. Амінопептидази послідовно відщеплюють N-кінцеві амінокислоти поліпептидного ланцюга. Найвідомішою є лейцинамінопептидаза - Zn2+ або Мn2+-вмісний фермент, який, незважаючи на назву, має широку специфічність щодо N-кінцевих амінокислот. Дипептидази розщеплюють дипептиди на амінокислоти, але не діють на трипептиди.
У результаті послідовної дії всіх травних протеаз більшість харчових білків розщеплюється до вільних амінокислот.