БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 6. ОБМІН І ФУНКЦІЇ АМІНОКИСЛОТ. БІОСИНТЕЗ БІЛКА
6.4. Катаболізм амінокислот
6.4.1. Трансамінування
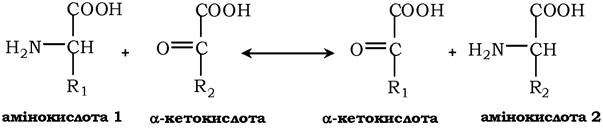
Трансамінування - реакція перенесення α-аміногрупи з амінокислоти на α-кетокислоту, у результаті чого утворюється нова амінокислота й нова кетокислота. Константа рівноваги до більшості таких реакцій наближається до одиниці (Кр~1,0), тому процес амінування є оборотною реакцією:
Реакцію каталізують ферменти амінотрансферази, коферментом яких слугує піридоксальфосфат (ПФ) - похідне вітаміну В6:

Механізм реакції. Амінотрансферази знайдені як у цитоплазмі, так і в мітохондріях клітин еукаріотів. Причому мітохондріальні й цитоплазматичні форми ферментів розрізняються за фізико - хімічними властивостями. У клітинах людини знайдено близько 10 амінотрансфераз, котрі відрізняються за субстратною специфічністю. Вступати в реакції трансамінування можуть практично всі амінокислоти, за винятком лізину, треоніну та проліну.
Амінотрансферази - класичний приклад ферментів, які каталізують реакції, що відбуваються за механізмом "пінг-понг". У таких реакціях перший продукт повинен залишити активний центр ферменту до того, як другий субстрат зможе до нього приєднатися.
Активна форма амінотрансфераз утворюється в результаті приєднання піридоксальфосфату до аміногрупи лізину міцним альдимінним зв'язком (рис. 6.6). Лізин у положенні 258 входить до складу активного центру ферменту. Крім того, між ферментом і піридоксальфосфатом утворюються іонні зв'язки за участю заряджених атомів фосфатного залишку й азоту в піридиновому кільці коферменту.

Рис. 6.6. Приєднання піридоксальфосфату до активного центру амінотрансферази: цифрою "1" позначено альдимінний зв'язок
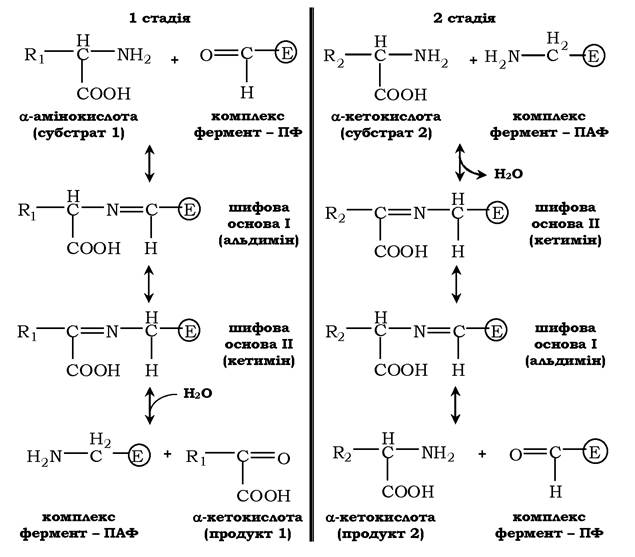
Піридоксальфосфат у даному випадку слугує переносником аміногруп. При цьому найважливішу роль відіграє його альдегідна група, яка може оборотно приєднувати різні аміни з утворенням шифових основ. Реакції трансамінування відбуваються у дві стадії, під час яких піридоксальфосфат зазнає оборотних змін між вільною альдегідною формою (піридоксальфосфат) та амінованою формою (піридоксамінфосфат).
Послідовність реакцій трансамінування складається з двох стадій:
✵ на першій стадії до піридоксальфосфату в активному центрі ферменту за допомогою альдимінного зв'язку приєднується аміногрупа від першого субстрату - амінокислоти. Утворюються комплекс фермент-піридоксамінфосфат (ПАФ) і кетокислота - перший продукт реакції. Цей процес включає проміжне утворення двох шифових основ.
✵ на другій стадії комплекс фермент-піридоксамінфосфат сполучається з кетокислотою (другим субстратом) і знову через проміжне утворення двох шифових основ передає аміногрупу на кетокислоту. У результаті фермент повертається у свою нативну форму й утворюється нова амінокислота - другий продукт реакції. Якщо альдегідна група піридоксальфосфату не зайнята аміногрупою субстрату, то вона утворює шифову основу (альдимін) з ε-аміногрупою радикала лізину в активному центрі ферменту:
Органоспецифічні амінотрансферази АЛТ і АСТ. Найчастіше в реакціях трансамінування беруть участь амінокислоти, кількість яких у тканинах набагато вища за інших - глутамат, аланін, аспартат і відповідні їм кетокислоти - α-кетоглутарат, піруват і оксалоацетат. Основним донором аміногрупи є глутамат.
Сумарно цю реакцію можна зобразити у вигляді схеми:

Акцептором аміногрупи будь-якої амінокислоти, що піддається трансамінуванню (амінокислота 1), слугує α-кетоглутарат, який, приймаючи аміногрупу, перетворюється в глутамат, здатний передавати цю групу будь-якій α-кетокислоті з утворенням іншої амінокислоти (амінокислота 2).
Амінотрансферази мають субстратну специфічність до різних амінокислот. У тканинах людини знайдено понад 10 різних амінотрансфераз. Найпоширенішими ферментами в більшості тканин ссавців є аланінамінотрансфераза (АЛТ), за оборотною реакцією - глутаматпіруватамінотрансфераза (ГПТ), та аспартатамінотрансфераза (АСТ), за зворотною реакцією - глутаматоксалоацетатамінотрансфераза (ГОТ).
АЛТ (АлАТ) каталізує реакцію трансамінування між аланіном і α-кетоглутаратом:
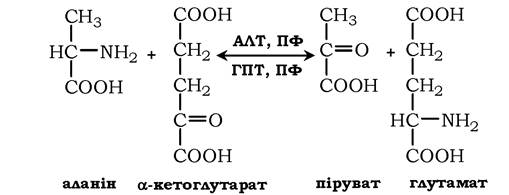
Локалізований цей фермент у цитозолі клітин багатьох органів, але найбільше його виявлено у клітинах печінки та серцевому м'язі.
АСТ (АсАТ) каталізує реакцію трансамінування між аспартатом і α-кетоглутаратом аналогічно попередній:
![]()
У результаті перебігу реакції утворюються оксалоацетат і глутамат. АСТ має як цитоплазматичну, так і мітохондріальну форму. Найбільше його виявлено у клітинах серцевого м'яза та печінці.
Отже, найбільша кількість АЛТ і АСТ зосереджена в печінці та міокарді, вміст ферментів у крові дуже низький, що може свідчити про їхню органоспецифічність.
Унаслідок роботи амінотрансфераз амінний азот багатьох амінокислот переходить до складу глутамату. Є підстави вважати, що накопичення аміногруп у формі глутамінової кислоти відбувається в цитозолі. Потім глутамат за допомогою транслоказ потрапляє в мітохондрії, де активна специфічна АСТ. У результаті дій цього ферменту глутамат знову перетворюється в α-кетоглутарат. Останній використовується для непрямого дезамінування амінокислот, що знаходяться в мітохондріях. Це дуже важливо, тому що тільки глутамат у тканинах ссавців найшвидше може піддаватися окисному дезамінуванню.
Біологічне значення трансамінування. Реакції трансамінування відіграють велику роль в обміні амінокислот. Оскільки цей процес оборотний, ферменти амінотрансферази функціонують як у процесах катаболізму, так і біосинтезу амінокислот. Трансамінування - завершальний етап синтезу замінних амінокислот із відповідних α-кетокислот, якщо вони в даний момент необхідні клітинам. У результаті відбувається перерозподіл амінного азоту в тканинах організму. Трансамінування - перша стадія дезамінування більшості амінокислот, тобто початковий етап їхнього катаболізму. Утворені при цьому кетокислоти окиснюються в ЦТК або використовуються для синтезу глюкози та кетонових тіл. При трансамінуванні загальна кількість амінокислот у клітині не змінюється.
У клінічній практиці широко використовують визначення активності АСТ і АЛТ в сироватці крові для діагностики деяких захворювань. У нормі в крові активність цих ферментів дуже мала (5-40 Е/л). При пошкодженні клітин відповідного органу ферменти виходять у кров, де активність їх стрімко підвищується. Оскільки АСТ і АЛТ найактивніші в клітинах печінки, серця та дещо менше у скелетних м'язах, їх використовують для діагностики хвороб цих органів. У клітинах серцевого м'яза кількість АСТ значно перевищує кількість АЛТ, а в печінці - навпаки. Тому особливе інформативне одночасне вимірювання активності обох ферментів у сироватці крові. Співвідношення активностей АСТ/ АЛТ називають коефіцієнтом де Рітіса. У нормі цей коефіцієнт дорівнює 1,33 ± 0,42. При інфаркті міокарда активність АСТ у крові збільшується у 8-10 разів, а АЛТ - у 1,5-2,0 рази. Найстрімкіше активність АСТ збільшується при некрозі тканин, тому що у кров виходять обидві форми ферменту - і цитоплазматична, і мітохондріальна. При інфаркті міокарда значення коефіцієнта де Рітіса стрімко підвищується.
При гепатитах активність АЛТ у сироватці крові збільшується у ~8-10 разів порівняно з нормою, а АСТ - у 2-4 рази. Коефіцієнт де Рініса знижується до 0,6. Проте при цирозі печінки цей коефіцієнт збільшується, що свідчить про некроз клітин, під час якого в кров виходять обидві форми АСТ.