БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 6. ОБМІН І ФУНКЦІЇ АМІНОКИСЛОТ. БІОСИНТЕЗ БІЛКА
6.10.Біосинтез білка
6.10.3.Активація амінокислот і утворення аміноацил-тРНК
Для виконання адапторної функції тРНК має бути зв'язана з відповідною амінокислотою. Цю функцію розпізнавання та зв'язування виконує молекула ферменту аміноацил-тРНК-синтетази (лігази, КФ 6.1.1). Необхідність точної та специфічної взаємодії між аміноацил-тРНК-синтетазами, тРНК і відповідними амінокислотами було визнано як "вторинний генетичний код». Отже, синтез поліпептидного ланцюга відбувається за участю не вільних, а активованих (із запасом енергії) амінокислот із залученням високоспецифічних ферментних систем. Аміноацил-тРНК- лігази розпізнають лише одну специфічну для них протеїногенну амінокислоту й ті тРНК, які можуть зв'язуватись саме з нею.
Стадія підготовки амінокислот до трансляції (рекогниція) поділяється на два етапи:
![]()
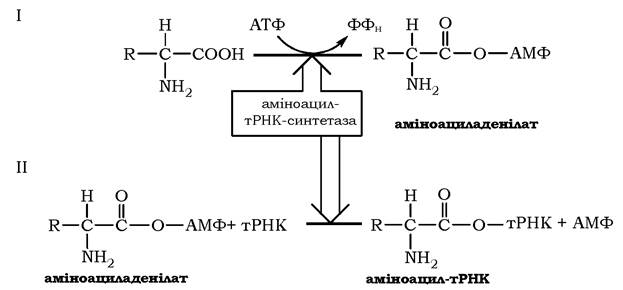
Як видно з рис. 6.34 (1), на першому етапі відбувається нуклеофільна атака карбоксильної групи амінокислоти на фосфоангідридний зв'язок між α- і β-фосфатними залишками в молекулі АТФ з подальшим утворенням проміжного продукту - аміноациладенілату, збагаченого високоенергетичним ангідридним зв'язком, і вивільненням пірофосфату. Гідролітичне розщеплення останнього за участю пірофосфатази (КФ 3.6.1) забезпечує необоротність реакції утворення аміноациладенілату, а вивільнена енергія використовується системою трансляції.

Рис. 6.34. Реакція активації амінокислот за участю аміноацил-тРНК-синтетази другого класу
На другому етапі, який каталізується тим самим ферментом, аміноацильний залишок переноситься з аміноациладенілату на відповідну тРНК, а саме на 2' (3')-гідроксильну групу кінцевого аденозину акцепторного стебла тРНК (3'-ЦЦА), що приводить до вивільнення АМФ і утворення молекули аміноацил-тРНК (рис. 6.34 (2)). Цей продукт реакції - аміноацил-тРНК - є елементом вторинного генетичного коду й містить як інформаційну компоненту, так і енергію у вигляді високоенергетичного складноефірного зв'язку (рис. 6.35). Енергетичний баланс процесу: активування кожної амінокислоти супроводжується використанням двох макроергічних фосфатних зв'язків.
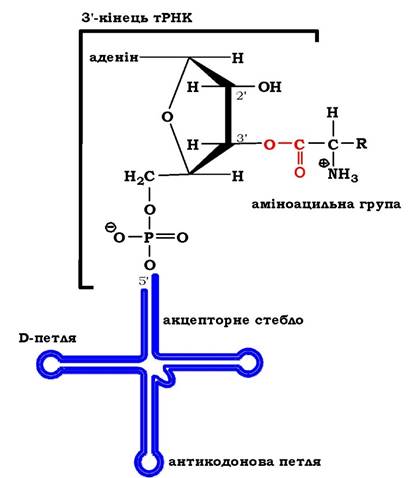
Рис. 6.35. Загальна структура аміноацил-тРНК
Аміноацил-тРНК-синтетази є лабільними ферментами, і для виявлення їхньої максимальної каталітичної активності необхідна присутність іонів Mg2+. Виділяють три субстратзв'язувальні центри в молекулі ферменту: для АТФ (К =10-4 моль/л), амінокислот (К =10-5 моль/л) та тРНК (К =10-8 моль/л). Синтетази є досить "повільними" ферментами, оскільки кількість оборотів не пе
ревищує декілька сотень каталітичних актів за 1 хв. Запропоновано такий перебіг подій синтетазної реакції: першою до аміноацил-тРНК-синтетази надходить АТФ, яка аденілює залишок гістидину (аргініну) в активному центрі ферменту з виділенням пірофо- сфату. На наступній стадії з аденілованим ферментом взаємодіє амінокислота з утворенням аміноациладенілату, який, у свою чергу, передає аміноацильну групу на радикал гістидину активного центру ферменту. Так утворюється аміноацильований фермент:

Після зв'язування ферментом відповідної тРНК аміноацильна група передається на ОН-групу рибози залишку аденозину в складі 3'-ЦЦА тРНК й утворюється аміноацил-тРНК. Залежно від приєднання аміноацильного залишку до 2'- чи (3')-ОН-групи рибози термінального аденозину акцепторного стебла тРНК усі аміно- ацил-тРНК-синтетази поділяються на два класи. До першого належать ферменти, які забезпечують перенесення на (2')-ОН-групу й активують такі амінокислоти: Арг, Вал, Глн, Глу, Іле, Лей, Мет, Три, Тир, Цис. У результаті реакції трансетерифікації відбувається переміщення аміноацильної групи до 3'-ОН-положення, оскільки воно є переважаючим під час утворення пептидного зв'язку. Цей клас синтетаз містить характерну укладку Россмана: певну послідовність розміщення паралельного β-шару та α-спіральних структур, характерних для ферментів, які каталізують реакції з використанням макроергів. До другого класу ферментів належать синтетази, що активують Ала, Асн, Асп, Гіс, Глі, Ліз, Про, Сер, Тре, Фен. Цей клас характеризується антипаралельним β-шаром, який формує активний центр ферменту. Отже, аміноацил-тРНК-синтетази є ферментами, які мають відмінності в структурній організації залежно від субстратної специфічності каталізованої ними реакції. Молекулярна маса АРСаз коливається від 40 до 400 ·103. Для аміноацилтРНК-синтетаз E. coli встановлено, що третина ферментів є α-мономерами; 10 - а2-гомодимерами, а тетрамерна структура характерна для гліцил-(α2β2), фенілаланіл-(α2β2) і аланіл-(а4)-тРНК-синтетаз.
Висока специфічність розпізнавання тРНК своєю синтетазою пов'язана з окремими елементами третинної L-структури тРНК, а також структурою антикодону та складом нуклеотидних залишків, що передують 3'-ЦЦА. За рахунок специфічності у виборі тРНК і амінокислот імовірність похибки при роботі аміноацил-тРНК-синтетаз становить приблизно 1 на 104 включених амінокислот. На цьому передрибосомному етапі спрацьовує механізм корекції помилок трансляції, який реалізується за участю аміноацил-тРНК-синтетаз.
В еукаріотів аміноацил-тРНК-лігази працюють у складі високомолекулярних комплексів - кодосом: 7-9 різних аміноацил-тРНК-синтетаз, метилази, ацетилази, протеїнкінази, неорганічна пірофосфатаза, ліпіди, простагландини й циклічні нуклеотиди, вуглеводи, іони цинку, магнію та марганцю. Функціонування системи фосфорилювання в параметрах комплексу регулює взаємодію з компонентами білоксинтезуючої системи, тоді як неорганічна пірофосфатаза стимулює процес за рахунок розщеплення інгібітору реакції активації - пірофосфату. Комплекси асоціюються з полірибосомами й мембраною ендоплазматичного ретикулума, що забезпечує компартменталізацію еукаріотичного апарату трансляції й таким чином підвищує ефективність його функціонування.