Учебник Биология - ВУНМЦ 2000
Глава 2. БИОЛОГИЯ КЛЕТКИ
2.2. ОРГАНИЧЕСКИЕ ВЕЩЕСТВА
Органические соединения состоят из многих повторяющихся элементов (мономеров) и представляют собой крупные молекулы, называемые полимерами. К органическим полимерным молекулам относят белки, жиры, углеводы, нуклеиновые кислоты.
2.2.1. БЕЛКИ
Белки - высокомолекулярные полимерные органические вещества, определяющие структуру и жизнедеятельность клетки и организма в целом. Структурной единицей, мономером их биополимерной молекулы является аминокислота. В образовании белков принимают участие 20 аминокислот. В состав молекулы каждого белка входят определенные аминокислоты в свойственном этому белку количественном соотношении и порядке расположения в полипептидной цепи. Аминокислота имеет следующую формулу:
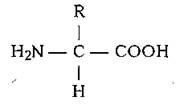
В состав аминокислот входят: NH2 - аминокислотная группа, сдающая основными свойствами; СООН - карбоксильная группа, имеет кислотные свойства. Аминокислоты отличаются друг от друга своими радикалами - R. Аминокислоты - амфотерные соединения, соединяющиеся друг с другом в молекуле белка с помощью пептидных связей.
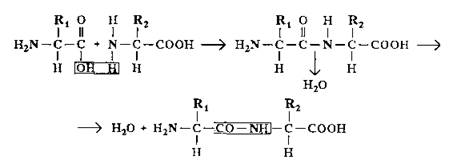
Схема конденсации аминокислот (образование первичной структуры белка)
Есть первичная, вторичная, третичная и четвертичная структуры белка (рис. 2).
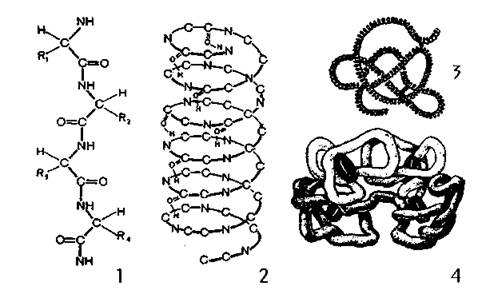
Рис. 2. Различные структуры молекул белка: 1 — первичная, 2 - вторичная, 3 — третичная, 4 — четвертичная (на примере гемоглобина крови).
Порядок, количество и качество аминокислот, входящих в состав молекулы белка, определяют его первичную структуру (например, инсулин). Белки первичной структуры могут с помощью водородных связей соединяться в спираль и образовывать вторичную структуру (например, кератин). Полипептидные цепи, скручиваясь определенным образом в компактную структуру, образуют глобулу (шар), представляющую собой третичную структуру белка. Большинство белков имеют третичную структуру. Аминокислоты активны только на поверхности глобулы. Белки, имеющие глобулярную структуру, объединяются вместе и формируют четвертичную структуру (например, гемоглобин). Замена одной аминокислоты приводит к изменению свойств белка.
При воздействии высокой температуры, кислот и других факторов сложные белковые молекулы разрушаются. Это явление называется денатурацией. При улучшении условий денатурированный белок способен восстановить свою структуру вновь, если не разрушается его первичная структура. Этот процесс называется ренатурацией (рис. 3).

Рис. 3. Денатурация белка.
Белки отличаются видовой специфичностью. Каждый вид животных имеет свои белки.
В одном и том же организме каждая ткань имеет свои белки — это тканевая специфичность.
Организмы характеризуются также индивидуальной специфичностью белков.
Белки бывают простые и сложные. Простые состоят из аминокислот, например, альбумины, глобулины, фибриноген, миозин и др. В состав сложных белков, кроме аминокислот, входят и другие органические соединения, например, жиры, углеводы, образуя липопротеиды, гликопротеиды и другие.
Белки выполняют следующие функции:
✵ ферментативную (например, амилаза, расщепляет углеводы);
✵ структурную (например, входят в состав мембран клетки);
✵ рецепторную (например, родопсин, способствует лучшему зрению);
✵ транспортную (например, гемоглобин, переносит кислород или диоксид углерода);
✵ защитную (например, иммуноглобулины, участвуют в образовании иммунитета);
✵ двигательную (например, актин, миозин, участвуют в сокращении мышечных волокон);
✵ гормональную (например, инсулин, превращает глюкозу в гликоген);
✵ энергетическую (при расщеплении 1 г белка выделяется 4,2 ккал энергии).