БИОЛОГИЯ Том 1 - руководство по общей биологии - 2004
7. АВТОТРОФНОЕ ПИТАНИЕ
7.11. Лабораторные работы
Опыт 7.1. Изучение реакции Хилла
Реакция Хилла
В 1939 г. Роберт Хилл (Нill) работая в Кембридже, обнаружил, что изолированные хлоропласта способны высвобождать кислород в присутствии окисляющего агента (акцептора электронов). Это явление получило название реакции Хилла. Некоторые химические вещества способны заменять природный акцептор электронов НАДФ. Одним из таких веществ является синий краситель ДХФИФ (2,6-дихлорфенолиццофенол), который после восстановления становится бесцветным:
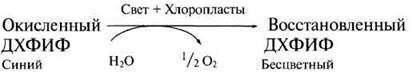
Выделение хлоропласта
Материалы и оборудование
Листья шпината, салата латука или капусты
Ножницы
Охлажденная ступка с пестиком (или мешалка, или бытовой миксер)
Марля или нейлон
Фильтровальная воронка
Центрифуга и пробирки для центрифугирования
Водяная баня со льдом и солью
Стеклянная палочка
Растворы (см. примечания)
0,05 М фосфатный буфер, pH 7,0
Среда для выделения хлоропластов
Раствор ДХФИФ (реакционная среда)
Методика
Хлоропласта можно выделить из измельченных листьев шпината, салата латука или капусты, используя охлажденную среду подходящей осмотической и ионной силы и pH. К таким средам относятся 0,4 М раствор сахарозы, 0,01 М КС1 и 0,05 М фосфатный буфер с pH 7,0. Чтобы сохранить биохимическую активность выделяемых образцов, все используемые растворы и посуда должны быть охлажденными. Все процедуры следует проводить максимально быстро, поэтому необходимо сначала внимательно изучить метод и оборудование.
Данный метод позволяет выделить достаточно большое количество хлоропластов, чтобы их могли изучать несколько групп студентов, если нет возможности обеспечить выделение хлоропластов каждой группой.
1. Разрежьте ножницами три небольших листа шпината, салата латука или капусты, удалив жилки и черенки. Поместите их в холодную ступку или стакан измельчителя, содержащие 20 мл холодной среды для выделения (можно пропорционально увеличить количество измельченных листьев и объем среды).
2. Энергично и быстро разотрите (время измельчения около 10 с).
3. Поместите в воронку четыре слоя марли или нейлона, смочите их холодной средой для выделения.
4. Профильтруйте через воронку полученный гомогенат. Фильтрат соберите в предварительно охлажденные центрифужные пробирки, помещенные в водяную баню со льдом и солью. Края марли соберите вместе и тщательно отожмите в пробирки.
5. Проследите, чтобы во всех пробирках содержалось примерно одинаковое количество фильтрата.
6. Если ваша настольная центрифуга имеет одну определенную скорость, время центрифугирования должно составлять 2—5 мин (необходимо, чтобы появился небольшой осадок, но время центрифугирования должно быть минимальным). Если же у используемой центрифуги скорость можно менять, центрифугировать фильтрат следует 1—2 мин при 100—200 g. Надосадочную жидкость центрифугируйте еще 5 мин при 1000—2000 g (этого времени достаточно для получения небольшого осадка, содержащего хлоропласта).
7. Слейте надосадочную жидкость. При помощи стеклянной палочки ресуспендируйте осадок в одной из центрифужных пробирок, добавив в нее около 2 мл среды для выделения. Образовавшуюся суспензию перенесите во вторую центрифужную пробирку и вновь ресуспендируйте осадок. (Если в работе участвует более одной группы студентов, добавьте по 2 мл среды для выделения в каждую центрифужную пробирку и используйте в каждой группе по пробирке.)
8. Храните полученную суспензию хлоропластов в водяной бане со льдом и с солью и используйте как можно быстрее.
Реакция Хилла
Теперь суспензию хлоропластов можно использовать для изучения реакции Хилла. Раствор ДХФИФ должен быть комнатной температуры.
Подготовьте четыре пробирки, в которые налейте:
1) 0,5 мл суспензии хлоропластов +5 мл раствора ДХФИФ. Оставьте пробирку на ярком свету;
2) 0,5 мл среды для выделения +5 мл раствора ДХФИФ. Оставьте пробирку на ярком свету;
3) 0,5 мл суспензии хлоропластов +5 мл раствора ДХФИФ. Пробирку немедленно поместите в темное место;
4) 0,5 мл суспензии хлоропластов +5 мл дистиллированной воды. Эта пробирка будет служить цветовым стандартом, показывающим, каким должен быть цвет суспензии после восстановления ДХФИФ.
Через 20 мин запишите ваши наблюдения.
Если у вас имеется колориметр, то за развитием реакции можно следить, измеряя уменьшение поглощения света красителем, поскольку в окисленной форме он синий, а в восстановленной — бесцветный. В таком случае образцы 2 и 4 следует готовить прямо в кюветах колориметра. Поставьте красный (или желтый) фильтр и выставьте колориметр на ноль, используя суспензию 4 как контроль. Затем поместите в прибор кювету со смесью 1, немедленно снимите для нее показания и вновь поместите пробу на яркий свет. Продолжайте проводить измерения каждые 30 с. Постройте график скорости реакции. Когда восстановление полностью закончится, проведите измерения для образца 3. Восстановление самого красителя ДХФИФ можно оценить, измерив показания для образца 2, и используя в качестве стандарта среду для выделения; при этом прибор на ноль следует выводить тоже по раствору среды для выделения. В идеале для полного восстановления требуется около 10 мин.
Примечания
Приготовьте следующие растворы:
0,05 М фосфатный буфер, pH 7,0
Na2HPO4 · 12Н2O 4,48 г (0,025 М)
КН2РO4 1,70 г (0,025 М)
Доведите дистиллированной водой до 500 мл и храните раствор в холодильнике при 0—4 °С.
Среда для выделения
Сахароза 34,23 г (0,4 М)
КСl 0,19 г (0,01 М)
Растворите в фосфатном буфере при комнатной температуре, доведите объем до 250 мл. Храните в холодильнике при 0—4 °С.
Раствор ДХФИФ (реакционная среда)
ДХФИФ 0,007-0,01 г (приблизительно 10-4 М)
КСl 0,93 г (0,05 М)
Растворите в фосфатном буфере при комнатной температуре, доведите объем до 250 мл. Храните в холодильнике при 0—4 °С. Используйте при комнатной температуре.
(ВНИМАНИЕ. Хлорид калия является кофактором в реакции Хилла).
7.17. Какие изменения (если таковые имеются) вы наблюдаете в пробирке 1?
7.18. Для чего предназначаются пробирки 2 и 3?
7.19. Какие еще органеллы, по вашему мнению, могут содержаться в суспензии хлоропластов?
7.20. Как вы можете доказать, что они не участвуют в восстановлении красителя?
7.21. Почему среда для выделения должна быть охлажденной?
7.22. Почему среда для выделения готовится на фосфатном буфере?
7.23. Что является а) донором и б) акцептором электронов в реакции Хилла?
7.24. Во время реакции Хилла ДХФИФ действует между акцептором электронов X и ФСI (см. рис. 7.14), при этом выделяется кислород. К какому типу фосфорилирования, по вашему мнению, относится реакция Хилла: циклическому, нециклическому или и тому, и другому?
Обоснуйте свой ответ.
7.25. На рис. 7.23 показано, как выглядят хлоропласты после того, как их использовали в приведенном выше опыте.
На фотографии видны те изменения, которые происходят при переносе хлоропласте из гипертонической среды для выделения, содержащей сахарозу, в гипотоническую реакционную среду.
а) Чем отличается внешний вид хлоропласте, показанных на рис. 7.23, от нормальных хлоропласте?
б) Попытайтесь объяснить, почему перенос хлоропласте в среду с недостатком сахарозы вызывает подобные изменения?
в) Почему желательно, чтобы эти изменения произошли до реакции Хилла?
7.26. Какое, на ваш взгляд, значение имеет открытие реакции Хилла для понимания механизмов фотосинтетического процесса?
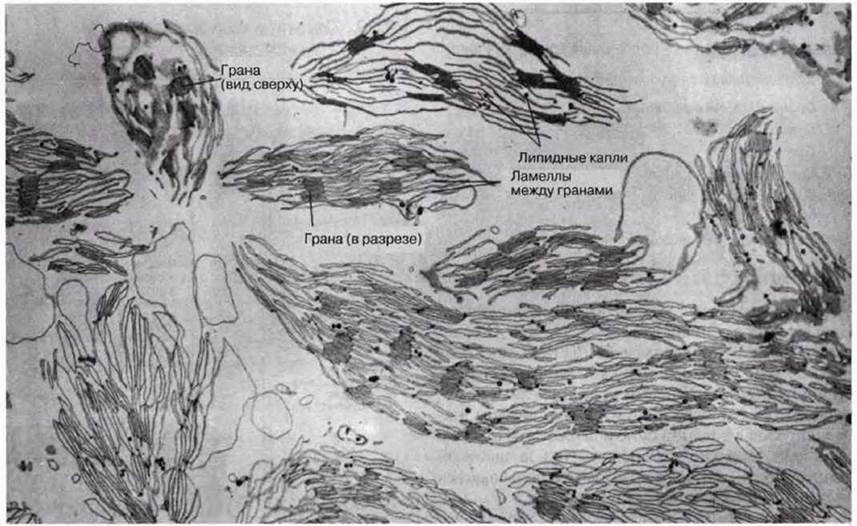
Рис. 7.23. Электронная микрофотография хлоропластов после выделения их в гипотоническом растворе. Оболочки и строма утрачены, х13 485.
Опыты: Изучение условий протекания фотосинтеза и его продуктов
Некоторые продукты можно использовать в качестве индикаторов того, что фотосинтез действительно имеет место. Первым таким продуктом является фосфоглицериновая кислота, которая быстро превращается в ряд соединений, в том числе в сахара, и затем в крахмал. Последнее соединение очень несложно определить и поэтому оно может служить маркером протекания фотосинтеза. Для проведения подобного эксперимента необходимо использовать листья или целые растения, лишенные крахмала.
Разрушение крахмала в растении
Если оставить растение в темноте на 24—48 ч, то крахмал в нем разрушится. До начала проведения опыта 7.2 желательно проверить полноту удаления крахмала из растения.
7.27. Почему, находясь в темноте, растения теряют крахмал?
Опыт 7.2. Определение содержания крахмала в листе
Материалы и оборудование
Лист какого-либо растения
Пробирка
Пинцет
Белая кафельная плитка
Горячая водяная баня 90% этанол
Раствор иода в йодистом калии
Методика
Наличие крахмала можно выявить, используя раствор иода в йодистом калии (I2/КI). Однако сначала лист необходимо обесцветить, поскольку зеленый цвет хлорофилла мешает увидеть происходящие изменения. Для этого лист помещают в пробирку с кипящим 90% этанолом, находящуюся в водяной бане и держат там столько времени, сколько необходимо (из-за высокой способности этанола к возгоранию пользоваться открытыми горелками опасно).
Обесцвеченный лист промывают горячей водой для удаления этанола и смягчения тканей листа. Затем расправляют на белой кафельной плитке и наносят на поверхность красно-коричневый раствор иода, который окрашивает крахмалсодержащие части листа в темно-синий цвет.
Опыт 7.3. Изучение потребности в диоксиде углерода
Материалы и оборудование
Растение с листьями, лишенными крахмала, например герань розовая (Pelargonium)
Настольная лампа
Вата
Материалы, необходимые для выявления крахмала
Коническая колба объемом 250 мл
Штатив с зажимами
Известковая вода
20% раствор гидроксида калия
Методика
На рис. 7.24 показана удобная схема изучения потребности растения в диоксиде углерода. Растение необходимо на несколько часов оставить на свету, а затем определить содержание крахмала в листьях.
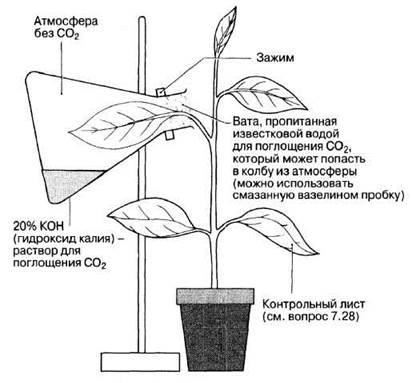
Рис. 7.24. Изучение потребности в диоксиде углерода при фотосинтезе.
7.28. Опишите, в каких условиях должен находится лист в контрольном опыте.
Более точный эксперимент, свидетельствующий об использовании растением диоксида углерода, состоит в применении 14СO2 (радиоактивно меченного соединения), который включается в состав сахаров и других соединений.
7.29. Исходя из уравнения фотосинтеза, попытайтесь определить, по изменению каких исходных веществ и продуктов реакции можно измерить интенсивность фотосинтеза?
7.11.1. Измерение интенсивности фотосинтеза
В разд. 7.8 обсуждалось влияние некоторых внешних факторов (таких, как освещенность, концентрация диоксида углерода и температура) на интенсивность фотосинтеза. При изучении влияния конкретного фактора очень важно, чтобы значения всех остальных факторов оставались постоянными и, если это возможно, оптимальными, для того чтобы они не являлись лимитирующими.
Скорость выделения кислорода
Самым простым способом измерения интенсивности фотосинтеза является определение скорости выделения кислорода у водного растения.
Опыт 7.4. Изучение влияния освещенности на интенсивность фотосинтеза
Материалы и оборудование
Аппарат для сбора газа (рис. 7.25)
Пробирка
Стакан объемом 400 мл
Термометр
Ртутная лампа или лампа от проектора
Гидрокарбонат натрия
Линейка
Секундомер
Источник света типа настольной лампы
Элодея канадская (Elodea), предварительно несколько часов выдержанная на ярком свету
Детергент (моющее средство)
Методика
Целесообразно использовать элодею (Elodea), которая была хорошо освещена и в которой проверена активность протекания фотосинтеза. Если не видно образования пузырьков, то для стимуляции фотосинтеза можно добавить 2—10 г гидрокарбоната натрия на каждый литр воды (это увеличивает содержание диоксида углерода). Кроме того, до начала опыта воду можно аэрировать (пропускать через нее воздух в течение часа).
1. Острым скальпелем срежьте покрытый пузырьками стебелек элодеи длиной около 5 см. Поместите его срезом вверх в пробирку, содержащую ту же воду, в которой растение находилось до этого.
2. Поместите пробирку в стакан с водой комнатной температуры. Запишите температуру воды, которая играет роль теплового щита, и проверяйте ее в течение эксперимента. Она должна оставаться постоянной, а по мере необходимости воду можно обновлять.
3. Заполните аппарат водопроводной водой, проверьте, чтобы нигде не было пузырьков воздуха, затем до упора нажмите поршень шприца (рис. 7.25).

Рис. 7.25. Аппарат для измерения скорости выделения кислорода водным растением в процессе фотосинтеза.
4. Создайте в лаборатории затемнение. Поместите яркий источник света на расстоянии 5 см от растения.
5. В течение 2—3 мин позвольте растению приспособиться (прийти в состояние равновесия) к данной освещенности. Затем удостоверьтесь, что скорость образования пузырьков достаточна (более 10 пузырьков в минуту). Иногда добавляют следовые количества детергента, для того чтобы снизить поверхностное натяжение и облегчить образование пузырьков.
6. Поместите веточку элодеи таким образом, чтобы пузырьки собирались в капиллярной трубке аппарата. Начинайте отсчет времени.
7. Соберите некоторый объем газа за определенное время (например, за 5—10 мин). При помощи поршня продавите пузырек через капилляр в то место, где находится линейка, и измерьте длину пузырька.
8. Переместите пузырек газа дальше в соединительный шланг для того, чтобы не мешать дальнейшим измерениям. Повторите описанную процедуру, увеличивая расстояние между источником света и растением до 10, 15, 20, 30, 40 и 80 см. В каждом случае давайте растению возможность привыкнуть к новой освещенности. Для всех значений запишите следующие параметры: а) расстояние между растением и источником света; б) время, ушедшее на сбор газа; в) длину собранных пузырьков газа (это значение прямо пропорционально объему).
Результаты
Освещенность данного объекта обратно пропорциональна квадрату расстояния от источника света. Другими словами, увеличение расстояния между растением и источником света приведет к уменьшению освещенности растения не в два, а в четыре раза.
![]()
где LI — освещенность, d — расстояние между объектом и источником света. Постройте график, где по вертикальной оси отложите значения интенсивности фотосинтеза (как длину пузырьков газа, проходящих по капилляру в единицу времени), а по горизонтальной — LI (в виде 1/d2 или, что более удобно, — 1000/d2).
7.30. а) Установите, какую закономерность между образованием газа и освещенностью демонстрируют результаты проведенных вами опытов?
б) Для чего необходимо поддерживать постоянными температуру и затемненность лаборатории?
7.31. Каковы основные источники погрешностей в данном эксперименте?
7.32. Если бы собранный газ был проанализирован, то оказалось бы, что это не чистый кислород. Как Вы можете это объяснить?
7.33. Почему до начала эксперимента воду желательно аэрировать?
Существует более простая и быстрая (хотя и менее точная) методика определения скорости образования кислорода: подсчет пузырьков газа, выделяемых со срезанного конца веточки элодеи за определенный промежуток времени. В результате такого опыта получаются вполне удовлетворительные данные, хотя из-за различных размеров пузырьков могут возникать ошибки. Эту проблему можно решить, добавив следовые количества детергента для снижения поверхностного натяжения (см. пункт 5 выше). Элодею можно закрепить на дне пробирки при помощи пластилина.