БИОЛОГИЯ Том 1 - руководство по общей биологии - 2004
3. ХИМИЧЕСКИЕ КОМПОНЕНТЫ ЖИВОГО
3.4. Аминокислоты
3.4.3. Связи, встречающиеся в молекулах белков
Молекулы белков строятся из соединяющихся друг с другом аминокислот. Соединение происходит в результате образования так называемой пептидной связи. Возникшая белковая молекула затем свертывается и принимает свойственную ей форму благодаря образованию четырех других видов связей — ионных, дисульфидных, водородных связей и гидрофобных взаимодействий. Знакомство с природой этих связей необходимо для понимания структуры и поведения белков.
Пептидная связь
Эта связь образуется в результате выделения молекул воды при взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой. Реакция, идущая с выделением воды, называется реакцией конденсации, а возникающая ковалентная азот-углеродная связь — пептидной связью (рис. 3.22). Соединение, образующиеся в результате конденсации двух аминокислот, представляет собой дипептид. На одном конце его молекулы находится свободная аминогруппа, а на другом — свободная карбоксильная группа. Это позволяет ему присоединять к себе другие аминокислоты. Если таким образом соединяется много аминокислот, то образуется полипептид (рис. 3.23).
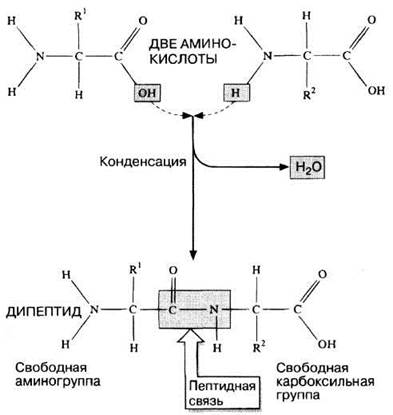
Рис. 3.22. Образование дипептида в результате конденсации двух аминокислот. Реакция конденсации сопровождается выделением воды.
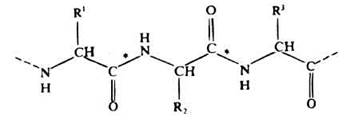
Рис. 3.23. Часть молекулы полипептида, образованная тремя остатками аминокислот. Пептидные связи обозначены звездочкой.
3.11. Напишите структурную формулу трипептида, состоящего из аланина, глицина и серина, соединенных в этом порядке.
Ионная связь
При определенных значениях pH кислотные и основные R-группы ионизованы, т. е. несут заряд, кислотные — отрицательный, а основные — положительный. Благодаря этому они могут взаимодействовать друг с другом, в результате чего возникает ионная связь (рис. 3.24). В водной среде ионные связи значительно слабее ковалентных и могут разрываться при изменении pH среды. Это объясняет, почему при изменении pH может разрушаться структура белка (разд. 3.5.4). Если, например, к молоку добавить кислоту, то молоко свернется: казеин (белок молока) из-за разрыва ионных связей станет нерастворимым.
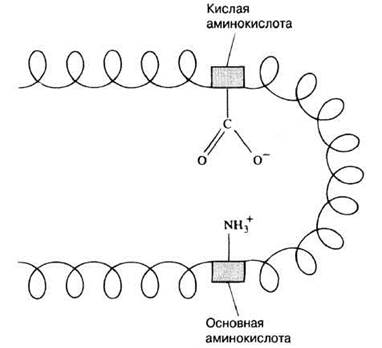
Рис. 3.24. Образование ионной связи. Полипептидная цепь белка представлена в виде спирали. Серые прямоугольники обозначают две аминокислоты, R-группы которых участвуют в образовании ионной связи.
Дисульфидная связь
Молекула аминокислоты цистеина содержит сульфгидрильную (—SH) группу. Когда соединяются две молекулы цистеина, их сульфгидрильные группы, оказавшись по соседству, окисляются и образуют дисульфидную связь (рис. 3.25). Дисульфидные связи могут возникать как между разными полипептидными цепями (в молекуле инсулина, например; рис. 3.28), так и между различными участками одной и той же полипептидной цепи (рис. 3.29). В последнем случае именно они вынуждают молекулу определенным образом свертываться, т. е. приобретать свойственную ей форму. Дисульфидные связи достаточно прочны и разрываются нелегко.
Водородная связь
О водородной связи мы уже говорили выше при обсуждении свойств воды (разд. 3.1.2). Когда водород входит в состав ОН- или NH-группы, он несет небольшой положительный заряд. Объясняется это тем, что обобщенные электроны, заряженные отрицательно, притягиваются атомами О или N сильнее, чем атомом водорода. Водород будет поэтому притягиваться оказавшимися с ним по соседству атомами кислорода С=О-групп или атомами азота NH-групп (рис. 3.26). С=О- и NH-группы регулярно чередуются вдоль полипептидной цепи, поэтому такие взаимодействия ведут к появлению структур, подобных α-спирали, о которой мы будем говорить ниже. Водородные связи слабы, но они возникают очень часто, так что общий их вклад в стабильность молекулярной структуры, например в структуру α-спирали (рис. 3.30) или белка шелка, весьма значителен.
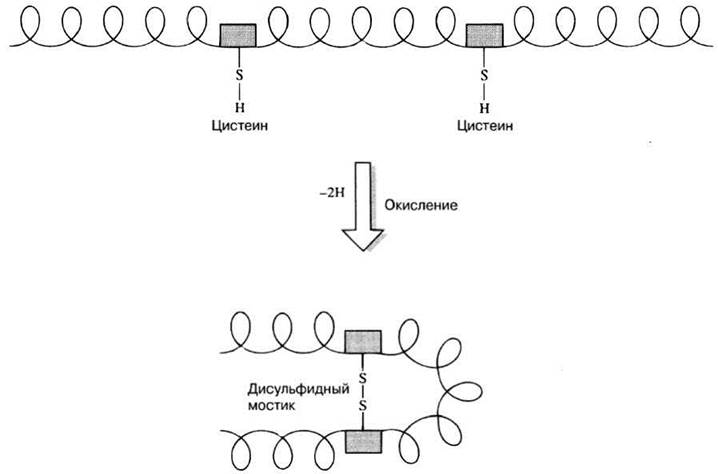
Рис. 3.25. Образование дисульфидной связи (мостика) между сульфгидрильными группами двух остатков цистеина.
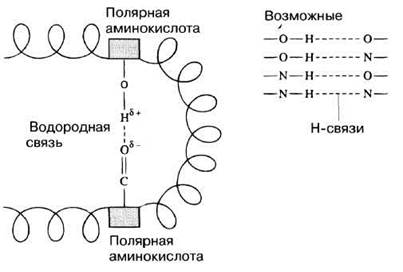
Рис. 3.26. Образование водородной связи. Водородные связи могут возникать между R-группами полярных аминокислот или между С—О- и NH-группами соседних цепей, участвующими в образовании пептидных связей (например, в α-спирали или в β-слое; см. след. разд.).
Гидрофобные взаимодействия
R-группы некоторых аминокислот, например тирозина и валина (табл. 3.5), неполярны и потому гидрофобны. Если в полипептидной цепи содержится много таких групп, то в водной среде эта полипептидная цепь стремится свернуться таким образом, чтобы гидрофобные группы сблизились возможно теснее, вытолкнув воду (рис. 3.27). Так свертываются многие глобулярные белки. Их гидрофобные группы бывают обращены при этом внутрь, к центру молекулы, имеющей почти шарообразную форму, а гидрофильные группы — наружу, к водной среде, что делает белок растворимым. Сходным образом ведут себя белки, входящие в состав мембран: гидрофобные участки их молекул примыкают к гидрофобным хвостам фосфолипидов, а гидрофильные — к гидрофильным фосфатным головам фосфолипидных молекул (см. рис. 5.15).
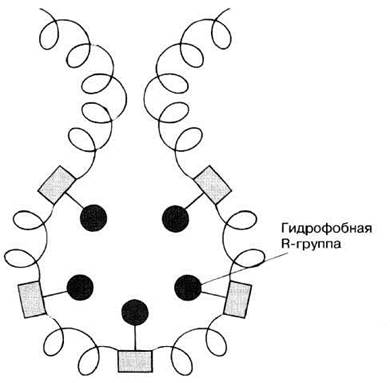
Рис. 3.27. Гидрофобные взаимодействия между гидрофобными R-группами. Эти взаимодействия обусловливают возникновение в молекулах участков, из которых вода выталкивается.