БИОЛОГИЯ Том 1 - руководство по общей биологии - 2004
3. ХИМИЧЕСКИЕ КОМПОНЕНТЫ ЖИВОГО
3.5. Белки
3.5.3. Структура белков
Каждому белку свойственна своя особая геометрическая форма, или конформация. Для описания трехмерной структуры белков рассматривают обычно четыре уровня организации, которые мы здесь и опишем.
Первичная структура
Под первичной структурой понимают последовательность аминокислот в полипептидной цепи. Первым исследователем, определившим аминокислотную последовательность молекулы белка, был Фред Сэнгер (Fred Sanger), работавший в Кавендишской лаборатории Кембриджского университета, той самой, где Уотсон и Крик определили структуру ДНК. Сэнгер работал с гормоном инсулином — самым маленьким белком, какой ему удалось найти. Работа заняла 10 лет и результаты ее были опубликованы в 1953 г. (рис. 3.28). Другой выдающийся молекулярный биолог из Кавендиша, Макс Перуц (Max Perutz), вспоминал: «открытие это явилось сенсацией, ибо в первый раз было показано, что аминокислоты в полипептидных цепях белка располагаются совершенно определенным образом». В 1958 г. Сэнгер за эту работу был удостоен Нобелевской премии (вторую Нобелевскую премию он получил за изучение структуры нуклеиновых кислот). В молекулу инсулина входит 51 аминокислота. Молекула состоит из двух полипептидных цепей, удерживаемых вместе дисульфидными мостиками.
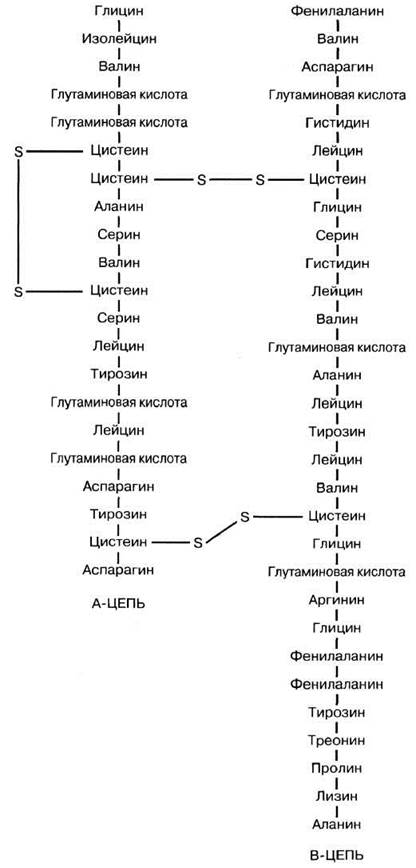
Рис. 3.28. Первичная структура (аминокислотная последовательность) инсулина. Молекула состоит из двух полипептидных цепей, удерживаемых вместе двумя дисульфидными мостиками.
В настоящее время большая часть работ по определению аминокислотных последовательностей автоматизирована, и теперь первичная структура известна уже более, чем для сотни тысяч белков. На рисунке 3.29 изображена первичная структура еще одного белка — фермента лизоцима. Таблица 3.6 дает представление о числе аминокислотных остатков в молекулах некоторых белков.
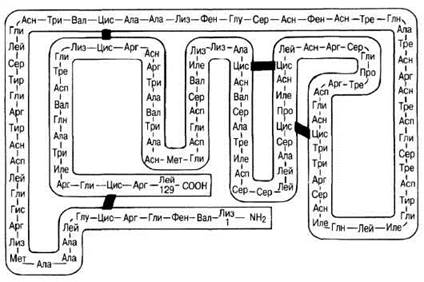
Рис. 3.29. Первичная структура лизоцима. Лизоцим — это фермент, обнаруженный во многих тканях и секретах человеческого тела, в растениях и яичном белке. Этот фермент катализирует разрушение клеточных стенок бактерий. Молекула лизоцима состоит из одной полипептидной цепи, в которую входят 129 аминокислотных остатков. В молекуле имеется четыре внутрицепочечных дисульфидных мостика.
В организме человека тысячи различных белков, и все они построены из одних и тех же 20 стандартных аминокислот. Аминокислотная последовательность белка определяет его биологическую функцию. В свою очередь эта аминокислотная последовательность определяется нуклеотидной последовательностью ДНК (гл. 23). Замена одной-единственной аминокислоты в молекуле данного белка может резко изменить его функцию, как это наблюдается, например, при так называемой серповидноклеточной анемии (гл. 25). Интересные данные могут быть получены в результате анализа аминокислотных последовательностей гомологичных белков, принадлежащих разным биологическим видам; такие данные позволяют судить о возможном таксономическом родстве между этими видами. Вопрос этот будет обсуждаться в гл. 26.
3.12. а) Напишите аминокислотные последовательности всех трипептидов, которые можно построить из двух разных аминокислот А и В.
б) Исходя из того, что у вас при этом получилось, составьте формулу для определения числа различных трипептидов, которые могут быть построены из двух разных аминокислот.
в) Сколько полипептидов длиной в 100 аминокислотных остатков можно построить из двух разных аминокислот?
г) Сколько полипептидов длиной в 100 аминокислотных остатков (а это сравнительно небольшой белок) можно построить из всех 20 стандартных аминокислот?
д) Сколько пептидов или полипептидов (заданной длины) можно построить из всех 20 стандартных аминокислот?
Вторичная структура
Для всякого белка характерна, помимо первичной, еще и определенная вторичная структура. Обычно белковая молекула напоминает растянутую пружину. Это так называемая α-спираль, стабилизируемая множеством водородных связей, возникающих между находящимися поблизости друг от друга СО- и NH-группами. Атом водорода NH-группы одной аминокислоты образует такую связь с атомом кислорода СО-группы другой аминокислоты, отстоящей от первой на четыре аминокислотных остатка (рис. 3.30). Таким образом аминокислота 1 оказывается связанной с аминокислотой 5. аминокислота 2 — с аминокислотой 6 и т. д. Рентгеноструктурный анализ показывает, что на один виток спирали приходится 3,6 аминокислотного остатка.
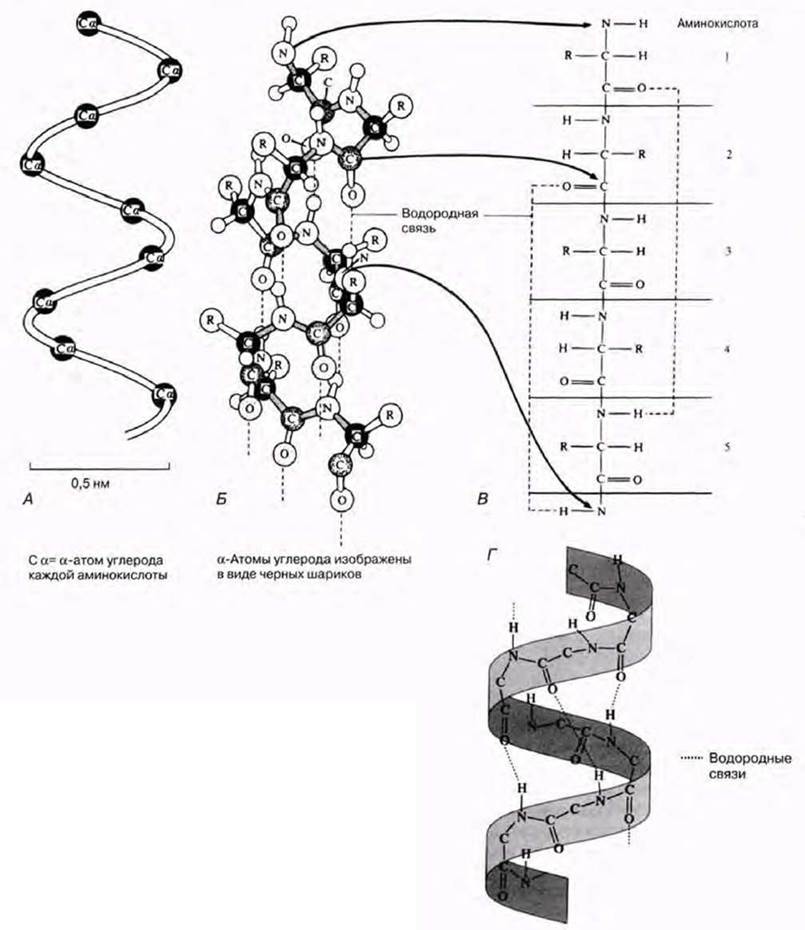
Рис. 3.30. Структура α-спирали. А. Показаны только α-атомы углерода. Соединяющая их линия описывает а-спираль. Б. Модель α-спирали из стержней и шариков. В. Часть α-спирали в растянутом виде. Спираль стабилизируется водородными связями. Г. α-Спираль, представленная в виде ленты.
Полностью α-спиральную конформацию и, следовательно, фибриллярную структуру имеет белок кератин. Это структурный белок волос, шерсти, ногтей, клюва, перьев и рогов, входящий также в состав кожи позвоночных. Твердость и растяжимость кератина варьируют в зависимости от числа дисульфидных мостиков между соседними полипептидными цепями (от степени сшивки цепей).
Теоретически все СО- и NH-группы могут участвовать в образовании водородных связей, так что α-спираль — это очень устойчивая, а потому и весьма распространенная конформация. Участки α-спирали в молекуле напоминают жесткие стержни. Тем не менее большинство белков существует в глобулярной форме, в которой также имеются участки β-слоя (см. ниже) и участки с нерегулярной структурой. Объясняется это тем, что образованию водородных связей препятствует ряд факторов: наличие некоторых аминокислотных остатков в полипептидной цепи, наличие дисульфидных мостиков между различными участками одной и той же цепи и, наконец, тот факт, что аминокислота пролин вообще неспособна образовывать водородные связи.
β-Слой, или складчатый слой — это другой тип вторичной структуры. Белок шелка фиброин, выделяемый шелкоотделительными железами гусениц шелкопряда при завивке коконов, представлен целиком именно этой формой. Фиброин состоит из ряда полипептидных цепей, вытянутых сильнее, чем цепи с конформацией а-спирали. Эти цепи уложены параллельно, но соседние цепи по своему направлению противоположны одна другой (антипараллельны; рис. 3.31). Они соединены друг с другом при помощи водородных связей, возникающих между С=О- и NH-группами соседних цепей. В этом случае в образовании водородных связей также принимают участие все NH- и С=О-группы, т. е. структура тоже весьма стабильна. Такая конформация полипептидных цепей называется β-конформацией, а структура в целом — складчатым слоем. Фиброин обладает высокой прочностью на разрыв и не поддается растяжению, но подобная организация полипептидных цепей делает шелк очень гибким. В глобулярных белках полипептидная цепь может складываться на себя, и тогда в этих точках глобулы возникают участки, имеющие структуру складчатого слоя.
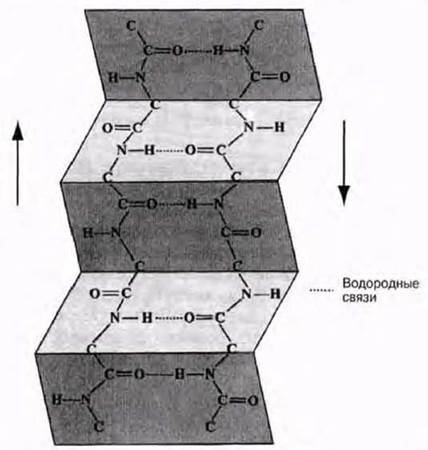
Рис. 3.31. β-Слой, или складчатый слой. Цепи уложены параллельно и удерживаются в этом положении водородными связями между С=О- и NН-группами соседних цепей. Боковые группы (R) не показаны. Они располагаются под и над /носкостью складчатого слоя.
Еще один способ организации полипептидных цепей мы находим у фибриллярного белка коллагена. Это тоже структурный белок, обладающий подобно кератину и фиброину высокой прочностью на разрыв. У коллагена три полипептидные цепи свиты вместе, как пряди в канате, образуя тройную спираль. В каждой полипептидной цепи этой сложной спирали, называемой тропоколлагеном, содержится около 1000 аминокислотных остатков. Отдельная поли пептидная цепь представляет собой свободно свернутую спираль (но не α-спираль; рис. 3.32). Три цепи удерживаются вместе водородными связями. Из многих тройных спиралей, располагающихся параллельно друг другу и удерживаемых вместе ковалентными связями между соседними цепями, образуются фибриллы. Они в свою очередь объединяются в волокна. Структура коллагена формируется, таким образом, поэтапно — на нескольких уровнях — подобно структуре целлюлозы. Коллаген также невозможно растянуть, и это его свойство существенно для той функции, которую он выполняет, например, в сухожилиях, костях и других видах соединительной ткани. Белки, существующие только в полностью спирализованной форме, подобно кератину и коллагену, представляют собой исключение среди прочих белков.
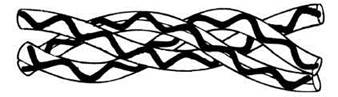
Рис. 3.32. Трехспиральная структура коллагена.
Третичная структура
У большинства белков полипептидные цепи свернуты особым образом в компактную глобулу. Способ свертывания полипептидных цепей глобулярных белков называется третичной структурой. Третичная структура поддерживается уже обсуждавшимися выше связями трех типов — ионными, водородными и дисульфидными, а также гидрофобными взаимодействиями (рис. 3.33). В количественном отношении наиболее важны именно гидрофобные взаимодействия; белок при этом свертывается таким образом, чтобы его гидрофобные боковые цепи были скрыты внутри молекулы, а гидрофильные, наоборот, выставлены наружу.
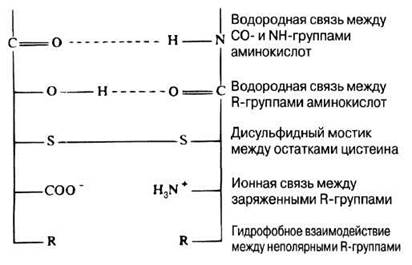
Рис. 3.33. Связи, стабилизирующие вторичную и третичную структуры белков. Для поддержания структуры особенно важны гидрофобные взаимодействия (объединения неполярных молекул или отдельных частей молекул), позволяющие исключить молекулы воды, что очень существенно, например, для мембран, учитывая водное окружение клетки.
Для определения третичной структуры белков можно использовать метод рентгеновского анализа. В результате исследований, растянувшихся на несколько лет, Джон Кендрью и Макс Перуц (Kendrew, Perutz) к началу 1959 г. определили этим методом вторичную и третичную структуру миоглобина и предложили модель его молекулы (рис. 3.34). За эту работу в 1962 г. они были удостоены Нобелевской премии. Теперь для миоглобина были известны:
первичная структура — молекула представляет собой одну полипептидную цепь, построенную из 153 аминокислотных остатков (их последовательность была установлена в начале 60-х годов);
вторичная структура — около 75% цепи имеет α-спиральную конформацию (восемь спиральных участков);
третичная структура — α-спираль свернута нерегулярным образом в компактную глобулу;
простетическая группа — гемогруппа, или гем (содержит железо).
Миоглобин синтезируется в мышцах, где он служит для запасания кислорода. Как и в гемоглобине, кислород в его молекуле связывается с гемом; от гема зависит красный цвет мышц. Подробнее о функциях миоглобина мы будем говорить в гл. 14. Определение третичной структуры белков все еще остается весьма трудоемким процессом. В последнее время в молекулярной биологии все больше усилий затрачивается на попытки использовать компьютеры и прочую технику, которая позволила бы предсказывать третичную структуру белка исходя из его уже известной первичной и вторичной структуры. Это открыло бы возможности для конструирования белков с определенной структурой, предназначенных для определенных функций, что могло бы сыграть очень важную роль и в промышленности, и в медицине.
На рис. 3.34 представлено несколько способов изображения третичной структуры белка. Еще один способ показан на рис. 3.35. У белков с третичной структурой функция теснейшим образом зависит от точной формы молекулы. В этом особенно легко убедиться при знакомстве с ферментами (разд. 4.1.2).
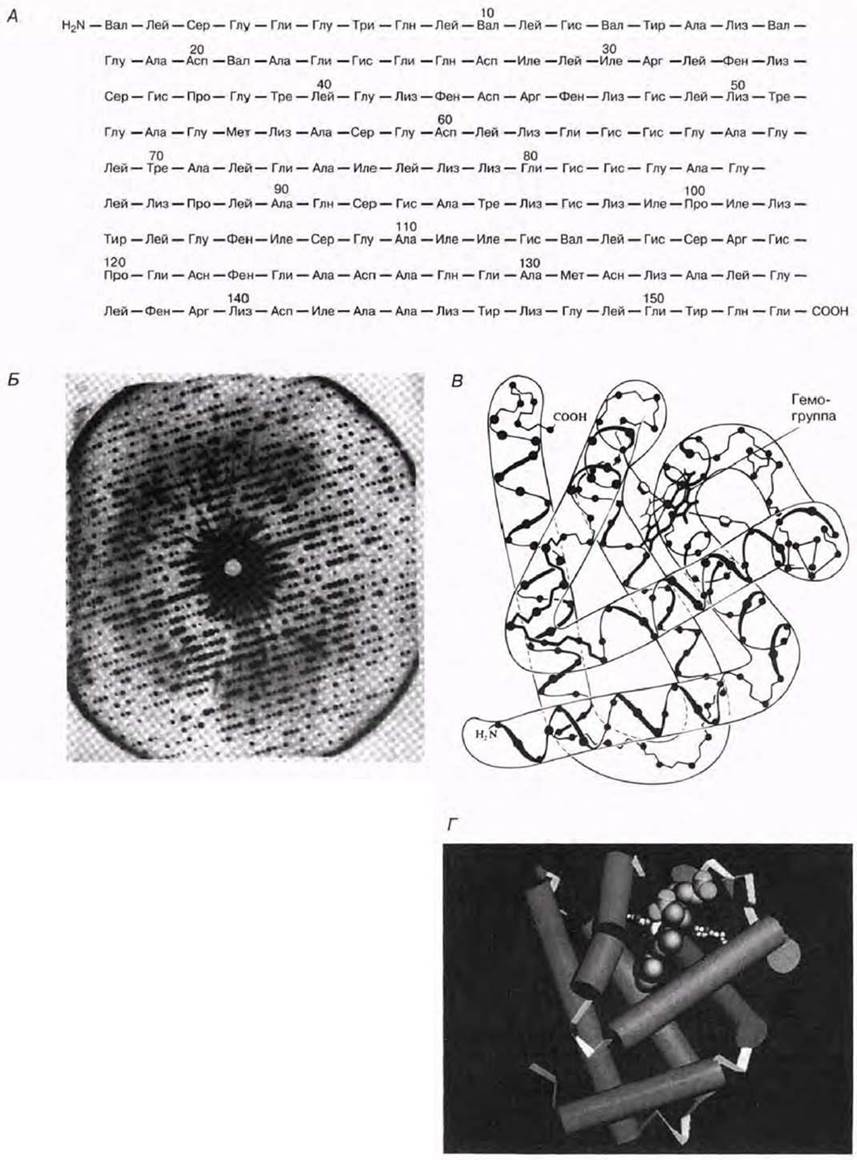

Рис. 3.34. А. Первичная структурамиоглобина. Б. Рентгенограмма миоглобина (из мышц кашалота). Регулярное расположение пятен есть результат рассеяния (дифракции) падающего на фотопленку рентгеновского изучения вследствие его взаимодействия с атомами миоглобина в кристалле. Фотография — это двумерное сечение трехмерного расположения дифракционных пятен. По распределению и интенсивности дифракционных пятен определяют положение отдельных атомов в молекуле. (По J. G. Kendrew, Scientific American, December, 1961.) В. Конформация миоглобина, установленная на основе рентгеновского анализа с высоким разрешением. Восемь участков α-спирали окружают гем, имеющий форму плоского диска. Г. Еще один способ изображения трехмерной структуры белков. На этой схеме, созданной с помощью компьютера, участки α-спирали в молекуле миоглобина представлены в виде цилиндров (видно, что таких участков восемь). Представленная модель изображает гем, который удерживают на месте две аминокислоты (маленькие белые шарики). Д. Модель миоглобина из стержней и шариков.

Рис. 3.35. Третичная структура лизоцима. Стрелками обозначены участки со структурой β-слоя. Регулярные витки — участки, имеющие структуру α-спирали. Остальная часть молекулы изображена в виде извитой ленты, а четыре дисульфидных мостика — в виде четырех зигзагов (см. рис. 3.29).
Четвертичная структура
Многие белки с особо сложным строением состоят из нескольких полипептидных цепей, удерживаемых в молекуле вместе за счет гидрофобных взаимодействий, а также при помощи водородных и ионных связей. Способ совместной упаковки и укладки этих полипептидных цепей называют четвертичной структурой белка. Четвертичная структура имеется, например, у гемоглобина — содержащегося в эритроцитах позвоночных красного пигмента, связывающего и переносящего кислород. Молекула гемоглобина состоит из четырех отдельных полипептидных цепей двух разных типов: из двух α-цепей и двух β-цепей. Цепи эти по своему строению напоминают полипептидную цепь миоглобина. Две α-цепи содержат по 141 аминокислотному остатку, а две β-цепи — по 146 остатков. Полную структуру гемоглобина определили Кендрью и Перуц. В схематическом виде она представлена на рис. 3.36.
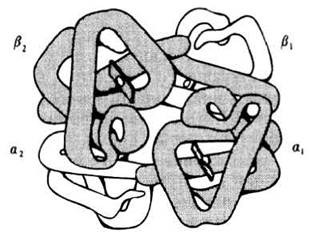
Рис. 3.36. Структура гемоглобина. Молекула состоит из четырех полипептидных цепей: двух α-цепей и двух β-цепей. С каждой цепью связана одна группа гема, к которой присоединяется молекула кислорода. Гемоглобин — пример белка, состоящего из отдельных субъединиц, т. е. обладающего четвертичной структурой.
Как и у других глобулярных белков, гидрофобные боковые цепи гемоглобина скрыты внутри молекулы, а гидрофильные выставлены наружу, что делает гемоглобин растворимым в воде. Мутация, вызывающая замену одной из гидрофильных аминокислот на гидрофобную и тем самым снижающая растворимость гемоглобина, служит причиной болезни, известной как серповидноклеточная анемия (гл. 25).
Некоторые вирусы, например вирус табачной мозаики, имеют белковую оболочку, состоящую из многих полипептидных цепей, упакованных высокоупорядоченным образом (см. рис. 2.18).