БИОЛОГИЯ Том 2 - руководство по общей биологии - 2004
18. ОПОРНО-ДВИГАТЕЛЬНАЯ СИСТЕМА ЖИВОТНЫХ
18.4. Мышечная система
18.4.4. Механизм мышечного сокращения; теория скользящих нитей
Когда была выявлена ультраструктура миофибрилл, две независимые группы исследователей (X. Хаксли/Дж. Хансон и А. Хаксли/Р. Нидергерке) предложили гипотезу мышечного сокращения, основанную на скольжении относительно друг друга актиновых и миозиновых нитей (рис. 18.20). Ее легко понять, вдвигая пальцы одной руки между пальцами другой: если считать обе ладони эквивалентом одного саркомера, то эта система будет укорачиваться, т. е. сокращаться. В пользу такого механизма говорит, в частности, тот факт, что при мышечном сокращении ширина зоны I и зоны Н уменьшается, тогда как ширина зоны А не меняется. Сейчас эта гипотеза окончательно подтверждена, повсеместно признана и называется теорией скользящих нитей.
Для того чтобы понять, какие силы обеспечивают скольжение, необходимо ознакомиться со строением тонких (актиновых) и толстых (миозиновых) миофиламентов.

Рис. 18.20. Схема сокращения саркомера. Актиновые нити скользят вдоль нитей миозина. На толстых миофиламентах показаны миозиновые головки. (Объяснения см. в тексте.)
Миозиновые (толстые) миофиламенты
Молекула миозина состоит из двух частей: длинного палочкообразного участка («хвоста») и присоединенного к одному из его концов глобулярного участка, который представлен двумя одинаковыми «головками» (рис. 18.21, А). Молекулы миозина расположены в миозиновой нити таким образом, что головки регулярно распределяются по всей ее длине. В тех местах, где нити актина и миозина перекрываются, миозиновые головки могут прикрепляться к соседним актиновым нитям. Насколько важно такое взаимодействие, мы оценим при рассмотрении собственно механизма сокращения capкомера.

Рис. 18.21. А. Структура миозина: видны его линейная часть (хвост) и две головки. Б. Структура актина.
Актиновые (тонкие) миофиламенты
Каждый актиновый миофиламент образован двумя цепочками из глобулярных молекул актина (G-актина), закрученными одна вокруг другой наподобие спирали (рис. 18.21, Б). Весь комплекс актиновых молекул называется F-актином (фибриллярным актином). Полагают, что с каждой молекулой G-актина связана одна молекула АТФ.
Механизм сокращения
Схема механизма сокращения следующая. Там, где актиновые и миозиновые миофиламенты перекрываются, миозиновые головки как крючки «зацепляются» за соседние F-актиновые нити, образуя с ними поперечные мостики. Эти мостики загибаются, как пальцы, в одном направлении, протаскивая актиновые миофиламенты вдоль миозиновых. Затем головки отделяются от актина, распрямляются, соединяются с новыми его участками, и цикл повторяется. При сокращении в каждый данный момент времени примерно половина головок «тянет», а остальные возвращаются в исходное положение, что обеспечивает плавность процесса. Энергию для него дает АТФ. Молекулы АТФ гидролизуются до АДФ и фосфата под действием АТФазы, содержащейся в миозиновых головках. Происходящие события иллюстрируются рис. 18.22. Между двумя последовательными образованиями мостиков одной головкой проходит 1/50—1/100 с. Очевидно, для этого необходимо очень интенсивное расходование АТФ. Этим объясняется наличие в мышечном волокне огромного числа митохондрий, которые восполняют запас АТФ в процессе аэробного дыхания. Саркомер способен укоротиться на 30—60% исходной длины.

Рис. 18.22. Движение актиновой нити под действием миозиновой при мышечном сокращении. Пунктирная вертикаль в левой части каждой стадии помогает заметить происходящий сдвиг.
18.2. Как изменяется ширина зоны А при сокращении саркомера?
Как запускается и прекращается процесс сокращения? Его активируют ионы кальция (см. ниже «Роль тропомиозина и тропонина»). Они накапливаются в саркоплазматическом ретикулуме (специализированном эндоплазматическом ретикулуме мышечного волокна), который образует расширенные цистерны вокруг линий Z (рис. 18.23). Эти цистерны контактируют с поперечными трубочками (Т-трубочками, или Т-системой), образованными впячиванием сарколеммы и пронизывающими саркоплазму (цитоплазму мышечного волокна) (рис. 18.23 и 18.18). Когда нервный импульс по мотонейрону достигает нервно-мышечного соединения на поверхности мышечного волокна, потенциал действия из области концевой пластинки волной распространяется по Т-системе, передается от нее саркоплазматическому ретикулуму и приводит к высвобождению ионов кальция в саркоплазму.
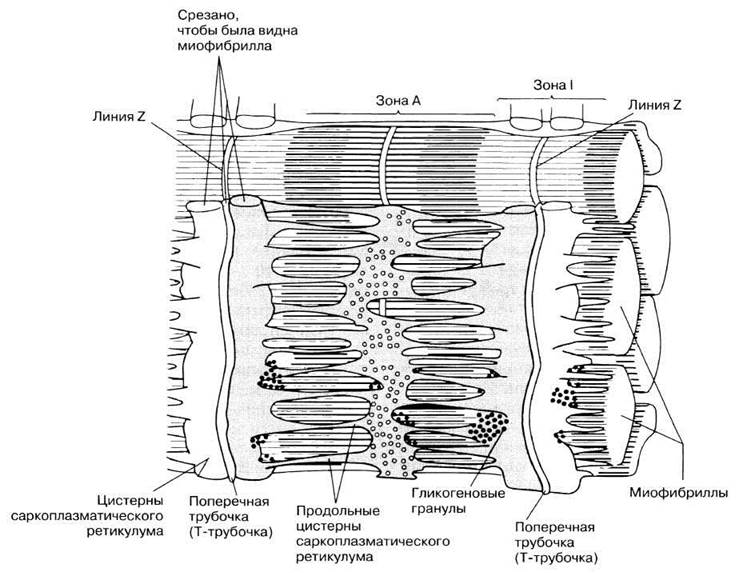
Рис. 18.23. Саркоплазматический ретикулум и Т-система.
Роль тропомиозина и тропонина
Актиновые филаменты состоят из F-актина и двух вспомогательных белков — тропомиозина и тропонина. Молекулы тропомиозина образуют две довольно растянутые спиральные цепочки, которые обвивают F-актин, как показано на рис. 18.24. Тропомиозин служит для включения и выключения механизма сокращения. С тропоми- озином связан глобулярный белок тропонин, способный обратимо присоединять ионы кальция.
Когда мышца в покое (расслаблена), тропомиозин блокирует на тонком миофиламенте участки для прикрепления миозиновых головок (рис. 18.24, А), «отключая» актин. Ионы кальция, высвобождаясь из саркоплазматического ретикулума, соединяются с тропонином, заставляя его и одновременно тропомиозин, с которым он связан, смещаться. Это приводит к разблокированию участков прикрепления миозиновых головок (рис. 18.24, Б) — актин «включается», и начинается скольжение нитей по описанному выше механизму (рис. 18.22). Когда раздражение мышечного волокна стимулирующими импульсами прекращается, ионы кальция закачиваются из саркоплазмы в саркоплазматический ретикулум кальциевым насосом вес мембране, т. е. путем активного транспорта, также требующим энергии АТФ. Тропонин и тропомиозин приобретают исходную конфигурацию, тонкий миофиламент «отключается», и мышечное волокно расслабляется.
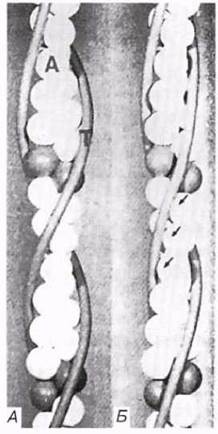
Рис. 18.24. Модем, иллюстрирующая изменение структуры актиновых нитей. А. «Выключенное» состояние при низком уровне Са2+: тропомиозин блокирует участки связывания миозина с актином. Б. «Включенное» состояние при высоком уровне Са2+: тропамиозин смещается, обнажая участки связывания с миозином (указаны стрелками). А — актин; Т — тропамиозин. Тропонин не показан, он расположен ближе к субъединицам актина.