БИОЛОГИЯ Том 2 - руководство по общей биологии - 2004
12. МИКРОБИОЛОГИЯ И БИОТЕХНОЛОГИЯ
12.16. Ферментные технологии
12.16.7. Иммобилизованные ферменты
Преимущества иммобилизованных ферментов
Как уже обсуждалось во введении к данному разделу, коммерческое использование ферментов ограничено рядом факторов. Важнейшие из них — нестабильность ферментов и их высокая стоимость. Стоимость можно существенно снизить за счет иммобилизации фермента. Это означает, что фермент закрепляют на поверхности или внутри твердой подложки, которую легко удаляют из реакционной смеси после завершения ферментации. Фермент может быть использован повторно, что существенно снижает стоимость процесса.
Другое преимущество иммобилизации заключается в том, что фермент становится более стабильным, вероятно, за счет ограничения его способности денатурировать при изменениях pH, температуры и растворителей. К примеру, иммобилизованная глюкозоизомераза стабильна при 65 °С в течение года, тогда как в растворе она денатурирует при 45 °С за несколько часов.
Иммобилизованный фермент можно использовать для непрерывного (открытого) производства, пропуская реагенты через фермент и собирая продукт на конечном этапе.
Методы иммобилизации ферментов
Существуют различные способы иммобилизации ферментов (рис. 12.28). Они включают либо механическое включение (захват) фермента, либо его присоединение к определенной структуре, или матрице. Преимуществом метода захвата является то, что фермент сохраняется в естественном состоянии. Однако крупным молекулам трудно добраться до фермента.
Захват шариками альгината легко продемонстрировать на лабораторных занятиях; он является наиболее распространенным промышленным методом. Раствор, содержащий фермент и альгинат натрия, по каплям вносят в раствор хлористого кальция. Как только капельки вступают в контакт с хлористым натрием, они немедленно начинают превращаться в гель; при этом образуются идеальные по форме шарики геля, содержащие внутри захваченный фермент. Для длительного использования гель можно стабилизировать полиакриламидом или приготовить его в виде пластин, если поместить его на тканевую основу.
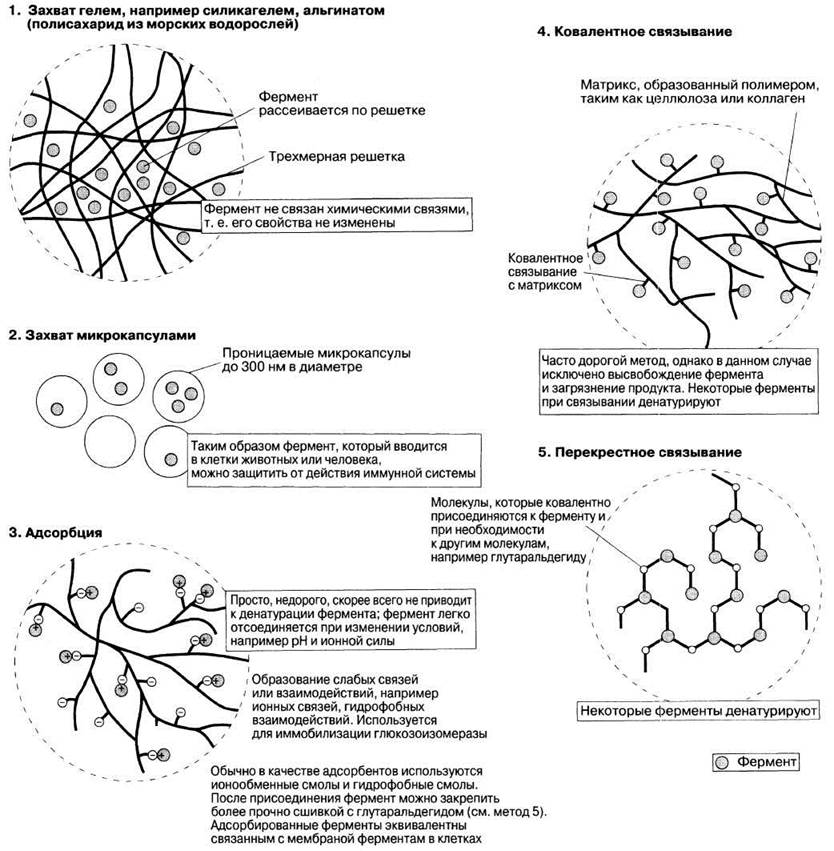
Рис. 12.28. Методы иммобилизации ферментов.
Применение иммобилизованных ферментов
Лучшим примером процесса, в котором успешно используются иммобилизованные ферменты, является производство кукурузного сиропа с высоким содержанием фруктозы. Он широко используется в США и Японии в качестве подсластителя, например во фруктовых напитках, так как он значительно дешевле сахарозы. Сироп готовят из относительно дешевого источника углеводов — крахмала, получаемого из кочерыжек кукурузных початков. Процесс осуществляется с участием трех ферментов. Сначала получают крахмальную массу путем перемалывания (растирания) кукурузы, затем две амилазы превращают крахмал в глюкозный сироп. Обесцвеченный и сконцентрированный сироп добавляют в различные пищевые продукты и напитки. С помощью фермента глюкозоизомеразы можно превратить этот сироп в смесь, содержащую равные количества глюкозы и фруктозы. Для этого сироп пропускают через колонку, в которой содержится фермент, иммобилизованный путем адсорбции на целлюлозном ионообменнике (метод 3, рис. 12.28). Активность фермента со временем постепенно снижается, поэтому обычно используют несколько колонок, работающих одновременно. Фруктоза слаще глюкозы, хотя обе содержат одинаковое число калорий на единицу массы. Это означает, что, используя кукурузный сироп с высоким содержанием фруктозы, можно получить такой же сладкий продукт как с глюкозой, но с меньшим количеством калорий. Ежегодно в США производится около 4 млн. тонн сиропа.
Первым иммобилизованным ферментом, примененным в промышленном масштабе, была аминоацилаза. Она была использована в Японии в 1969 г. для производства аминокислот, добавляемых в корм животных. На мировом рынке эта продукция пользуется большим спросом. Каждая молекула аминокислоты может существовать в двух формах, одна из которых является зеркальным отображением другой, как правая и левая рука. Эти две формы называются оптическими изомерами и являются право- и левовращающими формами, или D- и L-формами (по направлению вращения ими плоскости поляризации света). Все существующие в природе аминокислоты являются L-аминокислотами. Гораздо легче получить аминокислоты путем химического синтеза, чем выделять их из клеток, однако синтезированные аминокислоты образуются в виде смеси равных количеств D- и L-изомеров. Проблема получения L- аминокислот решается с помощью ферментов, специфически катализирующих превращения только одной из форм. Основные стадии процесса представлены в виде диаграммы на рис. 12.29.

Рис. 12.29. Схема процесса получения Ь-аминокислот, добавляемых в корм животным.
Фермент иммобилизуют путем ионного связывания на колонке с носителем (метод 3, рис. 12.28). После непрерывной автоматизированной работы в течение 30 дней при 50 °С активность фермента снижается до 40%; для восстановления активности добавляют свежий фермент. В результате благодаря иммобилизации экономится 40% фермента.
Другой пример использования иммобилизованных ферментов — производство полусинтетических пенициллинов из природных пенициллинов. Иммобилизованный фермент химически модифицирует одну из боковых групп молекулы пенициллина, что приводит к повышению антибиотической активности пенициллинов.