БИОЛОГИЯ Том 2 - руководство по общей биологии - 2004
13. ТРАНСПОРТ У РАСТЕНИЙ
13.1. Водный режим растений
13.1.9. Влияние на мембраны нагревания и спиртов
Некоторые воздействия, например обработка этанолом или нагревание, нарушают избирательную проницаемость клеточных мембран. Хотя мембраны и сохраняются, но они ведут себя так, будто в них пробиты бреши, т. е. они перестают быть барьером для крупных молекул типа сахарозы. Высокие температуры и спирты денатурируют мембранные белки, а концентрированные спирты, кроме того, растворяют липиды.
Опыт. 13.2. Определение среднего осмотического потенциала клеточного сока в препарате растительных клеток методом начального плазмолиза
Осмотический потенциал растительных клеток определяют разными путями, но удобнее всего делать это методом начального плазмолиза. Он основан на следующих соотношениях:
1) ψ клетки = ψ0 + ψг; ψ раствора — ψ0.
2) ψ клетки = ψ раствора, когда эти две системы находятся в состоянии равновесия.
Набор образцов растительной ткани приводят в состояние равновесия с растворами различной концентрации (с разными водными потенциалами); цель этого — подобрать раствор, который вызывает начальный плазмолиз, т. е. заставляет протопласты сморщиваться настолько, что они только-только начинают отставать от клеточной стенки. В этот момент гидростатический потенциал клетки равен нулю, поскольку протопласт уже не давит на клеточную стенку, так что ψ клетки = ψ0 клетки = ψ раствора = ψ0 раствора (см. уравнения выше). Другими словами, осмотический потенциал раствора, вызывающего начальный плазмолиз, такой же, как и у цитоплазмы.
На самом деле осмотические потенциалы клеток одной и той же ткани неодинаковы, так что одни клетки плазмолизируются в более разбавленных растворах, чем другие. Условно считается, что плазмолиз начинается тогда, когда плазмолизируется 50% клеток. В этом случае остальные 50% неплазмолизированы, т. е. «средняя клетка» как бы находится в состоянии начального плазмолиза. Полученная величина отражает среднее значение осмотического потенциала ткани.
Материалы и оборудование
Луковица или черешок ревеня
6 чашек Петри
6 пробирок
Штатив для пробирок
Этикетки или восковой карандаш
2 градуированные пипетки на 10 или 25 мл
2 мензурки на 100 мл
Тонкая кисточка
Дистиллированная вода
1 М раствор сахарозы
Тонкие пинцеты
Пастеровские пипетки
Предметные и покровные стекла
Микроскоп
Миллиметровка
Бритвенное лезвие или острый скальпель
Методика
После этой методики будет описана альтернативная методика с использованием корнеплода свеклы.
1. Пометьте 6 чашек Петри и 6 пробирок в соответствии со следующими концентрациями раствора сахарозы: 0,3 М; 0,35 М; 0,4 М; 0,45 М; 0,5 М и 0,6 М.
2. Используя мерную пипетку, мензурку с дистиллированной водой и мензурки с 1 М раствором сахарозы, приготовьте растворы перечисленных выше концентраций (см. табл. 13.3) и залейте по 20 мл каждого из них в соответствующие пробирки.
Таблица 13.3. Таблица разведения сахарозы в опыте 13.2
Концентрация раствора сахарозы, М |
Объем дистиллированной воды, мл |
Объем 1 М раствора сахарозы, мл |
0,30 |
14 |
6 |
0,35 |
13 |
7 |
0,40 |
12 |
8 |
0,45 |
11 |
9 |
0,50 |
10 |
10 |
0,60 |
8 |
12 |
3. Перемешайте растворы, энергично встряхивая пробирки (это очень важно), и разлейте их по чашкам Петри.
4. Лук. Отделите одну из мясистых чешуй луковицы. На ее внутренней стороне лезвием или скальпелем нарежьте 6 квадратиков со стороной около 5 мм. Пинцетом снимите с них слой эпидермиса и положите по одному такому лоскуту в чашки Петри. Осторожно перемешайте в них раствор, чтобы он полностью покрыл образцы ткани. Оставьте на 20 мин.
Ревень. Нарежьте на наружной стороне черешка 6 квадратиков со стороной около 5 мм, снимите с них лоскуты эпидермиса и обработайте, как описано выше для лука.
5. Выньте лоскут из 0,60 М раствора и с помощью кисточки расправьте его на предметном стекле в растворе такой же концентрации. Накройте покровным стеклом и рассмотрите под микроскопом.
6. При малом увеличении выберите участок с хорошо различимыми клетками. Переключаясь на среднее или сильное увеличение и перемещая препарат, определите состояние (плазмолизированное или неплазмолизированное) первых 100 попавших в поле зрения клеток. Клетку считают плазмолизированной, если протопласт в ней хотя бы чуть-чуть отошел от клеточной стенки.
7. Повторите эту процедуру с остальными образцами, помещенными в соответствующие по концентрации растворы.
8. Подсчитайте процент плазмолизированных клеток в каждом растворе. Постройте график, отложив по оси ординат процент плазмолизированных клеток, а по оси абсцисс — молярную концентрацию раствора сахарозы (см. рис. 13.5).
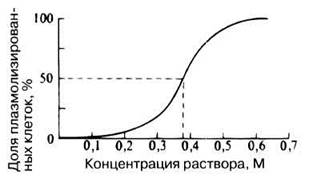
Рис. 13.5. Доля плазмолизированных эпидермальных клеток лука при разных концентрациях сахарозы в растворе.
9. По этому графику определите молярность раствора, при котором плазмолизируется 50% клеток (рис. 13.5).
10. Используя данные из табл. 13.4, постройте график зависимости осмотического потенциала (по оси ординат) от молярной концентрации сахарозы (по оси абсцисс).
11. По этому графику определите осмотический потенциал раствора, приводящего к плазмолизу 50% клеток. Он считается равным среднему для них осмотическому потенциалу цитоплазмы.
Таблица 13.4. Осмотические потенциалы растворов сахарозы различной концентрации при 20 °С
Концентрация раствора сахарозы, М |
Осмотический потенциал, кПа |
Осмотический потенциал, атм |
0,05 |
- 130 |
- 1,3 |
0,10 |
- 260 |
- 2,6 |
0,15 |
- 410 |
- 4,0 |
0,20 |
- 540 |
- 5,3 |
0,25 |
- 680 |
- 6,7 |
0,30 |
- 820 |
- 8,1 |
0,35 |
- 970 |
- 9,6 |
0,40 |
- 1120 |
- 11,1 |
0,45 |
- 1280 |
- 12,6 |
0,50 |
- 1450 |
- 14,3 |
0,55 |
- 1620 |
- 16,0 |
0,60 |
- 1800 |
- 17,8 |
0,65 |
- 1980 |
- 19,5 |
0,70 |
- 2180 |
- 21,5 |
0,75 |
- 2370 |
- 23,3 |
0,80 |
- 2580 |
- 25,5 |
0,85 |
- 2790 |
- 27,5 |
0,90 |
- 3010 |
- 29,7 |
0,95 |
- 3250 |
- 32,1 |
1,00 |
- 3510 |
- 34,6 |
1,50 |
- 6670 |
- 65,8 |
2,00 |
-11 810 |
-116,6 |
Результаты
На рис. 13.5. приведен типичный график для эпидермиса лука. Для эпидермиса ревеня он примерно такой же.
13.5. Каков осмотический потенциал эпидермальных клеток лука, если 50% их плазмолизируется в 0,38 М растворе сахарозы?
Опыт с тканями свеклы
Корнеплод свеклы — менее удобный материал; однако если этот опыт объединить с опытом 13.3, то можно оценить гидростатический потенциал клеток ее корнеплода. Следует, впрочем, помнить, что водный и осмотический потенциалы у разных корнеплодов этой культуры могут быть разными. Обычно осмотический потенциал у свеклы ниже, чем у лука и ревеня, потому что в вакуолях у нее содержится больше сахаров и неорганических солей.
Особенности методики следующие:
Этапы 1 — 3 те же, что и в опыте с луком и ревенем. Единственное отличие — это концентрации растворов: 0,4; 0,45; 0,5; 0,55; 0,6 и 0,7 М,
4. Вырежьте из корнеплода прямоугольный столбик квадратного сечения размерами примерно 5x5 мм. Лезвием сделайте тонкие квадратные срезы (не более 0,5 мм толщиной). Чем тоньше будут срезы, тем легче будет считать плазмолизированные клетки. Окрашенный клеточный сок облегчает подсчет клеток. Препараты следует делать непосредственно перед практическими занятиями и хранить их в дистиллированной воде. В ходе опыта поместите по нескольку срезов в приготовленные растворы разной концентрации на 30 мин. В это время рассмотрите под микроскопом такой же квадратик, находящийся в дистиллированной воде, чтобы ознакомиться с видом неплазмолизированных клеток (края образца обычно бывают тоньше, и наблюдения поблизости от них вести легче). Некоторые поврежденные клетки могут оказаться обесцвеченными, а около проводящей ткани иногда будут видны более мелкие клетки. Их не следует включать в подсчет.
5—7. Этапы те же, что и в предыдущем опыте. Подсчет начинайте с раствора, концентрация которого равна 0,7 М.
Результаты
Серия данных, полученных для свеклы, приведена в табл. 13.5.
Таблица 13.5. Процентные доли плазмолизированных клеток свеклы (для выборки из 200 клеток) в растворах сахарозы различной концентрации
Концентрация раствора, М |
Доля плазмолизированных клеток, % |
0,30 |
2,5 |
0,40 |
3,5 |
0,45 |
13,5 |
0,50 |
74,0 |
0,55 |
100,0 |
0,60 |
100,0 |
(В описании опыта указаны другие концентрации растворов. — Прим. перев.) |
|
13.6. Каков средний осмотический потенциал в клетках свеклы, использованных в этом опыте? (Чтобы ответить на этот вопрос, вам необходимо построить график.)
Опыт 13.3. Определение водного потенциала растительной ткани
Водный потенциал отражает тенденцию молекул воды перемещаться из одного места в другое. Принцип опыта состоит в подборе раствора с известным водным потенциалом, в котором исследуемая ткань не будет ни поглощать, ни терять воду. Препараты ткани помещают для уравновешивания в растворы различной концентрации. Ткань будет иметь тот же водный потенциал, что и раствор, в котором ни объем, ни масса ткани не изменятся. Описанная ниже методика основана на регистрации изменений объема, а не массы.
Материалы и оборудование
Свежий клубень картофеля или корнеплод свеклы
6 чашек Петри
5 пробирок
Штатив для пробирок
Этикетки или восковой карандаш
2 градуированные пипетки на 10 или 25 мл
Кафельная плитка
Дистиллированная вода
1 М раствор сахарозы
Скальпель или нож
2 мензурки на 100 мл
Миллиметровка
Методика
1. Пометьте шесть чашек Петри следующим образом: дистиллированная вода, 0,1 М; 0,25 М; 0,5 М; 0,75 М и 1,0 М. Пометьте пять пробирок указанными выше концентрациями раствора сахарозы.
2. С помощью градуированной пипетки, мензурки с дистиллированной водой и мензурки с 1 М раствором сахарозы приготовьте в отдельных пробирках по 20 мл раствора сахарозы перечисленных выше концентраций. Для разведения удобно пользоваться табл. 13.3.
3. Как следует перемешайте растворы в пробирках, энергично их встряхивая.
4. Разлейте эти растворы в соответствующие чашки Петри. В шестую чашку Петри налейте 20 мл дистиллированной воды.
5. Поставьте чашки Петри на миллиметровку (нижняя сторона их должна быть сухой).
6. Ножом или скальпелем сделайте срез толщиной около 2 мм из середины большой картофелины или свеклы и вырежьте из него 12 прямоугольных полосок толщиной 2 мм, шириной 5 мм и максимально возможной длиной (порядка 5 см). Работать надо быстро, чтобы избежать потери воды в результате испарения, так как это понизит водный потенциал ткани.
7. В каждую чашку Петри положите по две полоски, полностью погрузив их в раствор, и тотчас же измерьте длину по миллиметровке, на которой стоят чашки. Покачайте каждую чашку, чтобы промыть полоски.
8. Закройте чашки Петри и оставьте их не менее, чем на 1 ч, а лучше — на 24 ч.
9. Снова измерьте длину полосок и рассчитайте среднее изменение длины в процентах. Постройте график зависимости среднего изменения длины полоски (по оси ординат) от молярной концентрации раствора сахарозы (по оси абсцисс). Изменения длины полосок означает и изменение объема.
10. Определите по графику концентрацию сахарозы, при которой длина полосок совершенно не изменилась.
11. Постройте график зависимости осмотического потенциала раствора (по оси ординат) от его молярной концентрации (по оси абсцисс), воспользовавшись данными табл. 13.4.
12. По этому графику определите осмотический потенциал раствора, при котором длина полосок не меняется. Водный потенциал растительной ткани определяется следующим соотношением:
ψ клетки = ψ наружного раствора = ψ0
13. Если использовался корнеплод свеклы, осмотический потенциал которой уже определен в опыте 13.2, рассчитайте гидростатический потенциал по уравнению:
ψ = ψ0 + ψг
Результаты
Более точные цифры обычно получаются, если свести воедино результаты всей группы учащихся. Данные одного из опытов приведены в табл. 13.6.
Таблица 13.6. Изменение длины полосок свеклы, оставленных на 24 ч в дистиллированной воде и растворах сахарозы различной концентрации
Концентрация сахарозы, М |
Длина полоски в начале опыта, см |
Длина полоски через 24 ч, см |
||||
1 |
2 |
3 |
1 |
2 |
3 |
|
0,00 (диет, вода) |
4,8 |
5,0 |
5,3 |
5,0 |
5,3 |
5,6 |
0,10 |
5,1 |
4,8 |
4,9 |
5,3 |
4,9 |
5,1 |
0,20 |
5,1 |
4,9 |
4,9 |
5,2 |
4,9 |
5,0 |
0,25 |
5,2 |
4,8 |
5,0 |
5,2 |
4,9 |
5,0 |
0,30 |
4,9 |
4,9 |
5,0 |
4,9 |
5,0 |
5,1 |
0,40 |
4,9 |
5,0 |
4,8 |
4,9 |
5,0 |
4,8 |
0,50 |
5,0 |
4,8 |
5,1 |
4,8 |
4,7 |
5,0 |
0,60 |
4,8 |
5,0 |
5,0 |
4,6 |
4,9 |
4,9 |
0,75 |
4,9 |
4,9 |
5,0 |
4,6 |
4,7 |
4,8 |
0,90 |
4,9 |
5,0 |
4,9 |
4,5 |
4,7 |
4,7 |
1,00 |
4,8 |
4,9 |
4,9 |
4,7 |
4,6 |
4,4 |
1,50 |
4,9 |
4,9 |
4,9 |
4,5 |
4,1 |
4,5 |
13.7. Каков средний водный потенциал клеток свеклы поданным табл. 13.6?
(Для ответа надо рассчитать средние изменения длины (в процентах) и построить график.)
13.8. Зачем в каждую из чашек Петри следует класть по меньшей мере две полоски ткани?
13.9. Зачем накрывают чашки Петри, когда их оставляют стоять на длительное время?
13.10. Если осмотический потенциал клеток свеклы равен -1400 кПа, а их водный потенциал составляет -950 кПа, каков их гидростатический потенциал?
13.11. Обдумайте опыт, представленный на рис. 13.6.
Полый цветонос (стебель) одуванчика (Taraxacum officinale) сначала разрезают вдоль на четыре полоски длиной 3 см, а затем погружают их в дистиллированную воду и растворы сахарозы различной концентрации.
а) Почему при продольном разрезании стебля полоски сразу же загибаются наружу?
б) Почему в дистиллированной воде полоска В еще больше закручивается наружу?
в) Почему в концентрированном растворе сахарозы полоска С закручивается внутрь?
г) Почему в разбавленном растворе сахарозы полоска С не изменила своей кривизны?
д) Какой показатель определяется этим методом для клеток стебля - осмотический, гидростатический или водный потенциал?
Спланируйте постановку опыта, позволяющего количественно получить соответствующую величину.
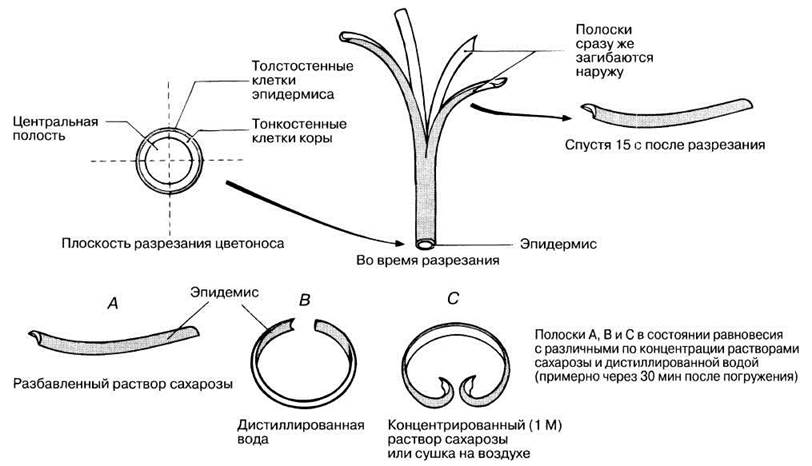
Рис. 13.6. Эксперимент с цветоносом одуванчика. Исследование влияния дистиллированной воды и растворов сахарозы на скручивание полосок, вырезанных из полого стебля.
13.12. Красный пигмент свеклы находится в клеточных вакуолях. Исходя из этого, спланируйте опыты для изучения влияния высоких температур и спиртов на полупроницаемость мембран клеток свеклы.