БИОЛОГИЯ Том 3 - руководство по общей биологии - 2004
25. ПРИКЛАДНАЯ ГЕНЕТИКА
25.7. Генетика человека
25.7.9. Генетический скрининг и пренатальная диагностика
В разд. 25.7.1 отмечалось, что, возможно, каждый человек является носителем нескольких генетических дефектов. Поиск мутантных генов у пациентов называется генетическим скринингом. С использованием современных методов генетики эта процедура становится значительно проще, чем была в недалеком прошлом. В трех ситуациях, которые рассматриваются ниже, генетический скрининг имеет особенно важное значение: это пренатальная диагностика, диагностика носительства, и прогнозируемый диагноз.
ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА. Этот термин включает всю совокупность современных методов медицины, используемых для выявления любых отклонений от нормы у еще не родившихся младенцев. Сюда входит выявление и генетических заболеваний. Если такое заболевание обнаружено, проводится консультирование родителей относительно качества жизни будущего ребенка и других возможных проблем. Обычно родителям предлагают обдумать целесообразность аборта.
ДИАГНОСТИКА НОСИТЕЛЬСТВА. Этот метод заключается в выявлении людей, которые несут единственную копию дефектного гена, т. е. являются гетерозиготными носителями. Вероятно, мы все гетерозиготны гю генам нескольких генетических заболеваний. Но если молодые люди, которые собираются вступить в брак, имеют в семьях случаи одной и той же наследственной болезни (например, серповидноклеточной анемии), им следует посоветовать пройти обследование, чтобы выявить, не являются ли они оба носителями. В случае, если гетерозиготность подтверждена, им можно объяснить, что с вероятностью 1:4 их ребенок родится больным. Консультант-генетик может ответить на все волнующие пару вопросы и обсудить возможные варианты выбора (разд. 25.7.10), На наших глазах расширяется круг болезней, для которых возможна диагностика носительства, однако для массовых обследований необходимы большие затраты. Смогут ли службы здравоохранения реализовать программу массового скрининга хотя бы на одно заболевание, например на муковисцидоз?
ПРОГНОЗИРУЕМЫЙ ДИАГНОЗ. Этот термин подразумевает диагностирование болезни, которая в данный момент еще не проявляется, но, судя по выявленному генотипу, должна проявиться в будущем. Классический пример такой «генетической бомбы замедленного действия» — хорея Гентингтона, при которой симптомы становятся заметными обычно в зрелом возрасте. В этом случае за заболевание отвечает один доминантный ген, и если человек живет достаточно долго, он должен заболеть, однако для многих других заболеваний такой фатальности нет. Например, люди могут быть генетически предрасположены к заболеваниям сердца и раку легких, однако они могут избежать этих болезней, если будут заниматься спортом, соблюдать диету и не будут курить. Желающие уже сейчас могут проверить, не несут ли они ген хореи Гентингтона, а скоро станут общедоступными тесты, позволяющие оценить риск болезней сердца. Общество должно заранее решить ряд связанных с этим вопросов. Например, имеют ли право страховые компании требовать, чтобы прежде чем застраховать свою жизнь клиент прошел генетическое тестирование? Будет ли позволено таким компаниям создавать невыгодные условия для тех, кто имеет повышенный риск заболевания? Кроме того, с развитием тестирования должна возрастать потребность в генетическом консультировании со всеми его приложениями. Эта проблема обсуждается в конце данного раздела.
Каким же образом проводится генетический скрининг? Наиболее важными являются четыре метода: биопсия ворсинок хориона, амниоцентез, диагностика эмбриона перед имплантацией и анализ ДН К с помощью генных зондов.
Биопсия ворсинок хориона
Хорион — наружная зародышевая оболочка, тонкий слой клеток, окружающих эмбрион. Ворсинки хориона (нитевидные выросты на его поверхности) входят в состав плаценты и омываются материнской кровью. Благодаря этому кислород и питательные вещества поступают в кровь эмбриона, а продукты его жизнедеятельности выводятся из организма. Метод был разработан в Китае в 1970-х годах (рис. 25.30). Чаще применяется абдоминальный (брюшной) способ забора материала (рис. 25.30, А), который включает введение пустотелой иглы через брюшную стенку и стенку матки. В этом случае применяется местное обезболивание. При цервикальном способе (рис. 25.30, Б) материал для биопсии отбирают с помощью тонкой гибкой трубки, которая называется катетером; обезболивания при этом не требуется. К трубке или игле присоединен шприц, который нужен для того, чтобы мягко отсосать небольшие кусочки ткани. Процедуру в таких случаях проводят под ультразвуковым контролем.
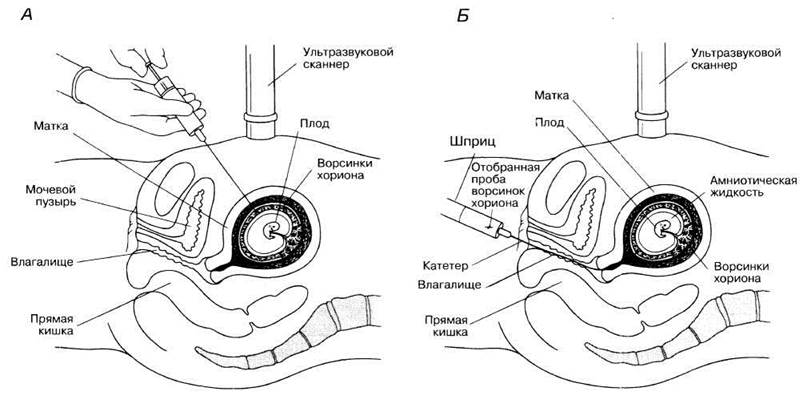
Рис. 25.30. Получение образца ворсинок хориона Л. Трансабдоминальный забор. Б. Трансцервикальный забор. Длина образца составляет несколько миллиметров.
Все клетки хориона, как и клетки эмбриона, произошли от зиготы, и, следовательно, генетически идентичны им. Поскольку клетки хориона на ранних стадиях развития активно делятся, их можно сразу использовать для хромосомного анализа (кариотипирования). При этом диагностируются болезни, связанные с хромосомными аномалиями, такие как синдромы Дауна, Клайнфельтера или Тернера. Можно также сделать вывод о поле ребенка, что чрезвычайно важно, если подозревается сцепленное с полом заболевание. Отобранные клетки можно культивировать в подходящей среде и использовать для анализа ДНК. Таким образом выявляют, например, муковисцидоз, хорею Гентингтона или талассемию.
Клетки растут быстро и результаты можно получить через 5—12 дней. Большое преимущество этого метода состоит в том, что его проводят на ранних стадиях беременности, между 8 и 12 нед. Однако риск повреждения плода при этом методе выше, чем при амниоцентезе. Подсчитано, что риск повреждения примерно на 2% выше, чем частота естественных нарушений. Если в результате тестирования принято решение удалить плод, аборт оказывается физически и эмоционально менее тяжелой и рискованной процедурой, чем более поздние аборты, которые проводятся после амниоцентеза.
Амниоцентез
Амниоцентез (взятие пробы амниотической жидкости для последующего анализа) — более старый и более доступный метод, нежели биопсия ворсинок хориона. Впервые он был использован в 1967 г. Обычно амниоцентез проводят на 15-16 неделе беременности, однако тест можно сделать раньше или позже — до 18 недели. Его нельзя проводить прежде, чем накопится достаточное для анализа количество амниотической жидкости или клеток. Метод более безопасен, чем биопсия ворсинок хориона, и лишь на 0,5% повышает риск самопроизвольного аборта (примерно 1 из 200). Пустотелую иглу вводят через брюшную стенку в полость матки под контролем ультразвукового сканнера при местном обезболивании (рис. 25.31). Из амниотического мешка отсасывают примерно 20 см3 амниотической жидкости. Его стенка обладает упругостью и отверстие от прокола закрывается само по себе. Жидкость в норме прозрачная и желтая, как моча. Ребенок постоянно заглатывает амниотическую жидкость и она проходит через его кишечник. Поэтому в ней присутствуют живые клетки плода. Помимо этого амниотическая жидкость содержит клетки амниона, который, подобно хориону, происходит из зиготы и генетически идентичен плоду. Клетки осаждают в центрифуге и культивируют. При этом получают большое количество делящихся клеток, годных для хромосомного анализа и анализа ДНК. Процедура занимает 3—4 недели, что крайне неудобно в тех случаях, когда по результатам тестирования оказывается необходим аборт. Амниотическую жидкость исследуют и на наличие продуктов дефектных генов, например α-фетопротеина, высокий уровень которого свидетельствует о повышенном риске определенных врожденных дефектов, например, расщелины нёба.

Рис. 25.31. Врач отбирает пробу амниотической жидкости у беременной женщины. В другой руке врач держит ультразвуковой датчик, с помощью которого определяется положение плода и плаценты внутри матки. Изображение плода видно на экране дисплея на заднем плане фотографии.
Диагностика перед имплантацией
Это одна из разновидностей пренатальной диагностики, которую проводят на эмбрионе перед его имплантацией в матку. Диагностика перед имплантацией — один из этапов программы экстракорпорального оплодотворения (разд. 21.7.4). После оплодотворения вне материнского организма приблизительно на 8-клеточной стадии из развивающегося эмбриона можно изъять одну клетку, не нарушая его способности к дальнейшему нормальному развитию. По результатам тестирования решают, можно ли данный эмбрион имплантировать в материнский организм. При этом исключается необходимость аборта. Однако этот дорогостоящий метод не всегда приносит успех и он вряд ли станет рутинной процедурой.
Генные зонды и анализ ДНК
Генетический скрининг, подразумевающий исследование ДНК определенного человека, называют анализом ДНК. Он состоит из следующих этапов (рис. 25.32).
1. Сначала ДНК экстрагируют из клеток. Клетки берут либо из плода с помощью описанных выше методов, либо из организма ребенка или взрослого, например из крови или слюны.
2. Затем ДНК разрезают на фрагменты различной длины с помощью рестриктаз.
3. Фрагменты разделяют по размерам с помощью гель-электрофореза в агарозном геле, как это было описано ранее (рис. 25.4). Фрагменты меньшего размера гораздо быстрее продвигаются к концу геля, чем большие фрагменты.
4. Цель данного этапа — выявить в каком из фрагментов находится интересующая нас последовательность ДНК. Это делают с помощью генного зонда. Поскольку зонд плохо продвигается в геле, используют метод, называемый Саузерн-блоттингом (Эдвард Саузерн разработал этот метод в 1975 г.). Последовательность операции представлена на рис. 25.32 (см. также раздел о генетической дактилоскопии, 25.7.12).
ДНК в геле сначала переводят в одноцепочечное состояние (денатурируют) путем нагревания. Затем ее переносят на нитроцеллюлозный или нейлоновый фильтр с помощью блоттинга, при этом получается точная копия геля. Стопка бумажных полотенец действует как фитиль, который протягивает буфер через губку, гель и фильтр. При этом ДНК прочно прикрепляется к фильтру.
5. Далее используют генный зонд (разд. 25.1.6). Это короткий одноцепочечный фрагмент ДНК, последовательность оснований которого комплементарна участку интересующего нас гена. Зонд можно получить в больших количествах путем клонирования. В него вводят радиоактивную метку 32Р, а затем добавляют его в раствор для гибридизации (комплементарного связывания) с ДНК на нитроцеллюлозном или нейлоновом фильтре.
6. Затем проводят радиоавтографию, помещая фильтр на рентгеновскую пленку. Радиоактивное излучение от любой полосы, с которой связался зонд, засветит пленку (рис. 25.32). Многие мутации приводят к делециям в хромосоме, что в свою очередь вызывает уменьшение длины рестрикционного фрагмента. Такой фрагмент более подвижен в геле и при радиоавтографии дает свою отдельную полосу. Таким способом можно выявить ген серповидноклеточной анемии.
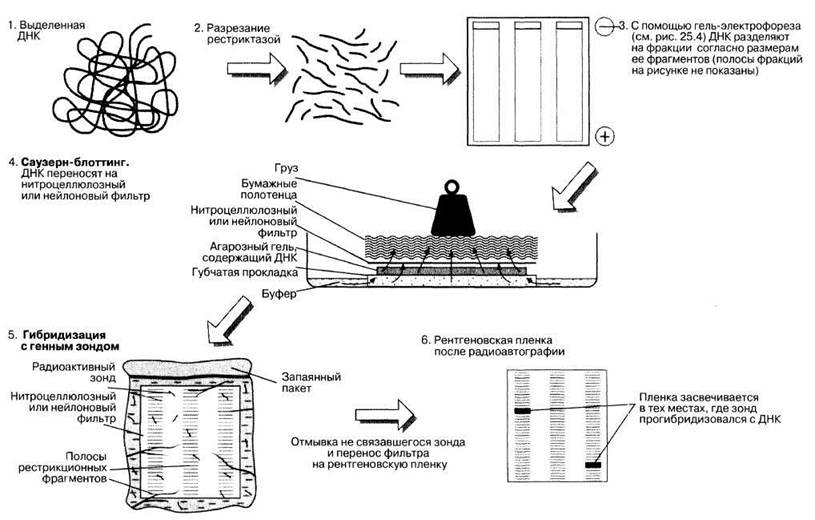
Рис. 25.32. Некоторые этапы анализа ДНК при генетическом скрининге. В процессе Саузерн-блоттинга денатурированная (одноцепочечная) ДНК переносится из агарозного геля на нитроцеллюлозный или нейлоновый фильтр. В настоящее время бумажные полотенца обычно не употребляются; вместо этого используют метод электроблоттинга или вакуумного блоттинга.
Другие методы
Ультразвуковое сканирование можно использовать для выявления тяжелых пороков развития, многие из которых имеют наследственную природу, например расщелина позвоночника.
Анализ крови матери во время беременности позволяет определить содержание химических веществ (например, α-фетопротеина), связанных с определенными наследственными заболеваниями плода.
Преимущества генетического скрининга
Как уже отмечалось, несмотря на очевидные преимущества генетического скрининга, при его использовании возникает ряд проблем. Ниже рассмотрим как достоинства этого метода, так и его недостатки. Все перечисленные пункты требуют обдумывания и обсуждения.
1. Генетический скрининг позволяет избежать драматических ситуаций в семье. Можно утверждать, что мы не имеем морального права давать жизнь ребенку, заранее зная, что он будет страдать. Генетический скрининг дает супружеской паре возможность выбора; она может решиться или не решиться на рождение ребенка с генетическим дефектом.
2. Генетический скрининг снижает экономические затраты страны. Например, подсчитано, что текущие расходы Национальной службы здравоохранения Великобритании на поддержание здоровья ребенка, страдающего муковисцидозом, составляют ежегодно около 40 000 фунтов стерлингов.
3. Многие хотят пройти тестирование, однако пока Национальная служба здравоохранения Великобритании не может проводить тест на муковисцидоз в широких масштабах. Тем не менее 80—90% людей, которым тестирование было предложено, прошли обследование.
4. Если человек знает, что генетически предрасположен к определенному заболеванию, он может вести такой образ жизни, который позволит снизить вероятность заболевания. Например, зная о предрасположенности к ишемической болезни сердца, кто-то, возможно, откажется от курения.
5. Программы скрининга болезней, если они находили понимание и одобрение общества, приводили к снижению уровня заболеваемости. Примером может служить скрининг талассемии на Кипре. Талассемия, которая подобно серповидноклеточной анемии обусловлена рецессивным геном, вызывает тяжелую гемоглобинопатию; при этом носительство по данному гену повышает устойчивость к малярии. На Кипре талассемия была весьма распространенным заболеванием до тех пор, пока не ввели программу скрининга женщин. Женщин вынашивающих пораженный плод, информировали об этом и рекомендовали сделать аборт.
6. Национальная служба здравоохранения Великобритании предлагает всем беременным старше 35 лет бесплатный амниоцентез или биопсию ворсинок хориона, так как вероятность рождения ребенка с синдромом Дауна у них очень высока.
Проблемы, связанные с генетическим скринингом
1. Со временем мы научимся определять, кто имеет высокую вероятность получить инфаркт или заболеть ревматоидным артритом. Будут ли страховые компании или работодатели требовать сведений о генотипе каждого человека и каким-либо образом дискриминировать предрасположенных к тяжелым заболеваниям, хотя заболевание у них может и не развиться? Окажутся ли в невыгодном положении те компании, которые не пользуются данными тестирования? Следует ли принимать законы, гарантирующие генетическую тайну?
2. Генетические дефекты отличаются друг от друга по степени тяжести обусловливаемых ими синдромов, и образуют по этому признаку непрерывный ряд. Кто должен решать, где проходит граница между тяжелыми и средними по тяжести нарушениями? В Великобритании в случаях «тяжелых нарушений» разрешен аборт при сроках беременности больше 24 нед. Будет ли разрешен или поддержан программами скрининга аборт в случае излечимой болезни, такой как фенилкетонурия?
3. Человек, страдающий наследственным заболеванием, часто ощущает себя неполноценным членом общества. Существует опасность, что по мере роста наших успехов в борьбе с этими болезнями и снижением числа людей с генетическими дефектами, человек, имеющий генетическую аномалию, будет чувствовать себя изгоем. Мировоззрение таких людей сильно отличается от взглядов на мир здоровых людей. Жизненные ценности тоже различны. Общество должно научиться уважительно относиться к мнению больных. Не является ли ложным наше представление о жизненных ценностях?
4. Евгенические движения в начале XX в. показали, какие опасности связаны со знанием генетики. Евгеника — это учение о возможном улучшении генетики вида. Одним из используемых для этого методов является избирательное скрещивание. Негативная евгеника заключается в удалении вредных генов; позитивная — в добавлении генов, создающих преимущества. Нацисты, например, оправдывали уничтожение психически и физически ущербных людей благой целью — создать генетически «чистую» расу. Известны попытки расовой дискриминации на основе генетики. Если удаление вредных генов станет нормой, не вдохновит ли это генетиков на разработку методов «конструирования» детей по желанию родителей: музыкальных, спортивных или, например, с математическими способностями?
5. Программы скрининга, призванные искоренить болезни, могут привести к усилению общественного давления на женщин или супружеские пары, заставляя их делать аборт, когда они сами этого не хотят. Так случилось с некоторыми женщинами на Кипре в результате проведения программы скрининга талассемии.
6. Если заболевание встречается в пределах одной расы, программы скрининга могут усилить дискриминацию. Это произошло при скрининге серповидноклеточной анемии в США в 1970-х годах.
7. То, что сейчас считается небольшим отклонением от нормы, может в дальнейшем рассматриваться как нежелательный признак, например низкий коэффициент умственного развития (IQ).
8. Насколько точным должен быть тест, чтобы он мог быть использован? Этично ли, например, сказать кому-нибудь, что с вероятностью 80% он заболеет смертельной болезнью?
9. Что должен говорить генетик человеку, у которого диагностировано наследственное заболевание с поздним началом проявления, приводящее к ограничению его физических возможностей и довольно быстрому смертельному исходу (например, хорея Гентингтона)?
10. Если супруги решили не прерывать беременность, которая, как они узнали, принесет в мир ребенка с наследственной патологией, должны ли они оплачивать стоимость лечения, или это должно делать общество? В 1963 г. Фрэнсис Крик предсказал, что наступит день, когда нам придется получать лицензию на право иметь детей. Согласно закону, принятому в Китае в 1995 г., супруги, для которых существует повышенный риск наследственных дефектов, не имеют права завести ребенка без специального разрешения. В США было предложено лишать медицинской страховки те пары, которые, не взирая на информацию о патологии плода, решили не прерывать беременность.
11. Не подадут ли дети в суд на родителей, которые позволили им родиться, зная, что они будут больны? В США известны успешные судебные процессы детей против их родителей по другим медицинским проблемам.
12. Гены, которые позднее окажут вредное влияние на жизнь человека, в начале жизни могут создавать для него жизненные преимущества.
13. Имеющиеся методы создают возможность для определения пола человека, поэтому родители могут избавиться от плода нежелательного пола.