Біофізика і біомеханіка - В. С. Антонюк - 2012
Розділ 2. ТЕРМОДИНАМІКА БІОЛОГІЧНИХ ПРОЦЕСІВ ТА СИСТЕМ
2.5. Основні положення лінійної нерівноважної термодинамічної біосистеми
Термодинаміка рівноважних систем ґрунтується на принципах, які певною мірою ідеалізовані. Біологічні об’єкти не перебувають у стані рівноваги. Процеси, що відбуваються в таких системах, є необоротними. Термодинаміка нерівноважних процесів грунтується на таких принципах і поняттях, як лінійні співвідношення, вироблення ентропії, стаціонарний стан, теорема Пригожина.
У лінійній нерівноважній термодинаміці особливе значення має співвідношення взаємності Онзагера: Lkn = Lnk, яке вказує на рівність коефіцієнтів взаємозв’язку двох необоротних процесів, коли система має стан, близький до термодинамічної рівноваги. При цьому основне рівняння лінійної нерівноважної термодинаміки:
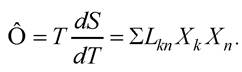
Закон лінійних співвідношень визначає залежність між термодинамічними силами та змінами (потоками) в термодинамічних системах. Термодинамічними силами є різні градієнти (концентрації, електричні, температурні тощо). Закон лінійних співвідношень вказує на те, що зміна фізичної величини J є лінійною функцією відповідної термодинамічної сили X, де L - коефіцієнт прямої пропорційності: J = LX.
Лінійний закон узагальнює багато емпіричних принципів, наприклад, закон Фіка (залежність перенесення речовин від концентраційного градієнта), закон Ома (залежність перенесення електричного заряду від градієнта електричного потенціалу) тощо.
Кожна окрема зміна в системі може зумовлювати тільки зменшення її вільної енергії та підвищення ентропії. Але інші зміни в цій же системі можуть відбуватися так, що підвищення ентропії унаслідок однієї зміни компенсуватиметься її зменшенням через іншу зміну. Наприклад [71], деякі частинки можуть переміщуватися через мембрану клітини у напрямку їх вищої концентрації. При цьому зменшується ентропія системи, що компенсується гідролізом АТФ, у результаті якого ентропія системи збільшується.
Термін «самоорганізація» визначає процеси (явища), які замовляються зміною структури та забезпеченням узгодженої поведінки системи завдяки наявності внутрішніх зв’язків і контактів із зовнішнім середовищем. Здатність до самоорганізації та утворення впорядкованих структур мають системи живої та неживої природи, а також штучні системи.
Гіпотеза про впорядкування в системі за рахунок її внутрішньої динаміки висловлювалася філософом Рене Декартом у п’ятій частині «Міркування про метод». Пізніше він детально розробив цю ідею в так і не опублікованій книжці «Le Monde».
Іммануїл Кант висунув небулярну гіпотезу, згідно з якою планети утворилися з туманності за рахунок тяжіння та відштовхування, які властиві матерії [78].
Варто зазначити, що уявлення про спонтанне виникнення порядку і самоорганізації нетотожні. Згідно з атомізмом Демокріта або статистикою Больцмана виникнення порядку є випадковістю, причому категорія порядку - суб’єктивною, а наявність порядку - умовною.
У 1947 р. цей термін з’явився в науковій публікації Уїльяма Ешбі [10]. У 1960-ті роки термін використовувався в теорії систем, а в 1970- 1980-ті - у фізиці складних систем.
Герман Хакен - засновник синергетики - визначив її як науку про самоорганізацію. До XXI ст. синергетика була синонімом самоорганізації. У зв’язку із співпрацею представників природних наук у галузі нанотехнологій з’ясувалося, що термін «самоорганізація» у галузях супрамолекулярної хімії та еволюційної біології визначається іншим чином для інших феноменів, ніж у синергетиці. Крім того, визначення, подане в межах синергетики, через міждисциплінарність цієї науки, розпорошилося по різних дисциплінах, стало нечітким.
Відомі три підходи до визначення поняття «самоорганізація» в біосистемах: дисипативна (синергетичний підхід), консервативна (супра- молекулярна хімія та фазові переходи), континуальна (концепція еволюційного каталізу)[26].
Дисипативна самоорганізація (синергетичний підхід). Визначення, подане Германом Хакеном у 1980-ті роки в межах синергетики: «Самоорганізація - це процес упорядкування (просторового, часового або просторово-часового) у відкритій системі за рахунок узгодженої взаємодії безлічі елементів її складових».
Характеристики системи:
- відкрита (наявність обміну енергією або речовиною з навколишнім середовищем);
- необмежена кількість елементів (підсистем);
- стаціонарний стійкий режим системи, в якому елементи взаємодіють хаотично (некогерентно).
Характеристики процесу:
- інтенсивний обмін енергією або речовиною з навколишнім середовищем (абсолютна хаотичність, що зумовлює впорядкування в системі);
- макроскопічна поведінка системи, що описується декількома величинами - параметром порядку та керувальними параметрами (запобігає інформаційній перевантаженості системи);
- деяке критичне значення керувального параметра (залежить від надходження енергії або речовини), за якого система спонтанно переходить у новий впорядкований стан (перехід до сильної нерівноваги);
- новий стан, зумовлений узгодженою (когерентною) поведінкою елементів системи (ефект упорядкування виявляється тільки на макроскопічному рівні);
- новий стан, що існує тільки в разі безупинного потоку енергії або речовини в систему. Зі збільшенням інтенсивності обміну система проходить через ряд критичних переходів; у результаті структура ускладнюється аж до виникнення турбулентного хаосу.
Методи синергетики були використані майже в усіх наукових дисциплінах: від фізики і хімії до соціології та філології. Соціум та нейрон- ні мережі описані як дисипативні структури. Останнім часом майже не використовують математичного апарату нелінійних рівнянь. Це призвело до того, що будь-яку систему природного походження, що не належить до рівноважної термодинаміки, стали розглядати як самоорганізовувальну.
Консервативна самоорганізація (супрамолекулярна хімія та фазові переходи). У 1987 р. інший Нобелівський лауреат Жан-Марі Лен - засновник супрамолекулярної хімії - увів терміни «самоорганізація» та «самоскладання» для опису явищ упорядкування в системах високомолекулярних сполук за рівноважних умов, зокрема утворення дезоксирибонуклеїнової кислоти (ДНК).
Вивчення речовини в наностані, утворення складної структури в процесі кристалізації без зовнішньої дії також потребували опису цих явищ як таких, що самоорганізуються. Але на відміну від синергетичного підходу ці явища відбуваються в умовах, близьких до термодинамічної рівноваги.
Таким чином, рівноважні фазові переходи, такі як кристалізація та утворення рідких кристалів в біології, також виявилися самоорганізацією. При цьому феномен упорядкування в рівноважних умовах часто визначають як консервативну самоорганізацію.
Континуальна самоорганізація (концепція еволюційного каталізу). Концепція еволюційного каталізу, розроблена А. П. Руденком, є альтернативною концепцією самоорганізації для біологічних систем. Крім когерентної самоорганізації в дисипативних системах з великою кількістю елементів (макросистем), розглядають континуальну самоорганізацію для індивідуальних мікросистем. Відповідно до цієї концепції самоорганізацію визначають як саморозвиток системи, що відбувається за рахунок внутрішньої корисної роботи проти рівноваги. Прогресивна еволюція з природним відбором можлива лише як саморозвиток континуальної самоорганізації індивідуальних систем. Приклади впорядкованих структур в медико-біологічних системах: фотосинтез, коливальна динаміка чисельності популяцій; спіральні хвилі та гексагональні структури у сітківці ока; поширення епідемій (пандемій) і забруднення.
Один з основних чинників самоорганізації та впорядкування формулюється у вигляді принципу, який можна назвати принципом узагальненого дарвінізму, а саме: просторові, часові та просторово-часові структури в органічному та неорганічному світі виникають як прояв сумарних коливань через флуктуації, їх взаємодію і відбір тих з них, які мають найбільший час загасання (релаксації). Такі найтриваліші живучі процеси характеризуються змінними, які називаються параметрами порядку або керувальними модами (коливаннями). Саме вони визначають еволюцію системи, яка первісно мала множину степенів вільності. В результаті колективної взаємодії різних мод у такій системі можуть виокремитися лише кілька параметрів порядку. У цьому полягає зміст принципу підпорядкування, котрий відіграє дуже важливу роль у процесах, які відбуваються в лінійній нерівноважній термодинамічній системі.
Сучасні підходи до основних проблем самоорганізації та впорядкування ґрунтуються на потужних і добре апробованих методах, на які спираються: а) теорія фазових перетворень; б) теорія нелінійних коливань та автохвиль; в) кінетичні моделі типу «брюселятора» і «орегонатора»; г) теорія катастроф і т. ін.
Основним критерієм рівноважної термодинаміки є прямування ентропії до максимального значення Smax, коли замкнена система набуває рівноважного стану. Найважливішим результатом лінійної нерівноважної термодинаміки стало визначення критерію переходу до стаціонарного стану у відкритій термодинамічній системі.
Зміна ентропії dS у відкритій системі складається з двох компонентів. Один з них - dSi - вироблення ентропії у системі в результаті необоротності процесів. Другий компонент - dSe - відображає взаємодію між системою та навколишнім середовищем:
![]()
Термодинаміка необоротних процесів є показником вироблення ентропії у відкритих системах:
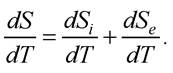
Як видно, два компоненти відіграють безпосередню роль у процесі вироблення ентропії у відкритій системі: показник вироблення ентропії в системі та показник зміни ентропії через енергообмін з навколишнім середовищем. Згідно з другим законом термодинаміки перший компонент завжди додатний. Другий компонент може бути як додатним, так і від’ємним залежно від напрямку енергетичного обміну в системі.
Ентропія притаманна будь-якій складній системи. Між ними в процесі еволюції відбувається обмін інформацією, який супроводжується обміном ентропії. Наприклад, у процесі випаровування води втрачається інформація про просторове розміщення молекул (ентропія збільшується); під час замерзання води невизначеність зменшується (ентропія знижується). Фізична та інформаційна ентропії пов’язані між собою, при цьому кожен біт інформації становить:
![]()
Стан системи називають стаціонарним, якщо величина ентропії не змінюється в часі, тобто dS = 0. Це можливо, коли вироблення ентропії в системі повністю компенсується ентропією, що виходить із системи (dSi = -dSe).
Розглянемо відкриту систему, в якій переміщуються два необоротні спряжені потоки - теплоти J1 та речовини J2. Дисипативна функція:
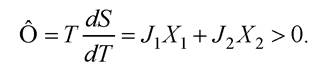
Ураховуючи співвідношення взаємності Онзагера L12 = L21, отримують:
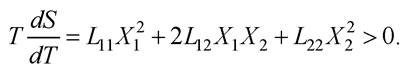
Теорема Пригожина: У стаціонарному стані за фіксованих зовнішніх параметрів швидкість продукції ентропії у відкритій системі набуває мінімального значення dS/dt → min, або локальна продукція ентропії у відкритій системі набуває мінімального значення σ → min.
Теорема Пригожина пояснює стійкість стаціонарних станів у відкритих системах. Якщо система випадково виходить з цього стану, її ентропія збільшується. Тоді в системі виникають процеси, які прагнуть повернути її в стаціонарний стан. Теорема Пригожина про мінімум швидкості продукції ентропії в стаціонарному стані є кількісним критерієм еволюції відкритої системи: відкрита система прямує до стаціонарного стану, в якому розсіювання енергії є мінімальним.
Стаціонарний стан відкритої системи подібний до термодинамічної рівноваги, оскільки обом станам притаманна стійкість параметрів стану, що характеризують їх. Але стаціонарний стан істотно відрізняється від стану рівноваги, оскільки відбувається обмін енергії з навколишнім середовищем: кількість вільної енергії в системі необхідно підтримувати. Ентропія системи в стаціонарному стані стабільна, але не максимальна.
Багато фізіологічних параметрів є досить стабільними. Їх стаціонарний рівень регулюють спеціальні фізіологічні механізми. Як приклад підтримання стаціонарного стану можна навести терморегуляцію організму. Сталість температури забезпечується підтриманням балансу теплопродукції та тепловіддачі. Як наслідок температура тіла підтримується незмінною, попри коливання зовнішньої температури. Механізми, за допомогою яких живі організми підтримують гомеостаз, тобто статичні умови їх внутрішнього середовища, вивчає фізіологія.