Біофізика і біомеханіка - В. С. Антонюк - 2012
Розділ 3. МОЛЕКУЛЯРНА БІОФІЗИКА
3.1.Фізична будова білків
3.1.1.Первинна та вторинна будова білків
Амінокислотна послідовність у поліпептидному ланцюзі становить первинну структуру білка. Важливим етапом дослідження структури білків є встановлення послідовності у них амінокислотних залишків (аналіз виконується автоматично секвінаторами). Первинна структура білка - це одновимірне зображення білкової молекули (рис. 3.1). Знання первинної структури дає змогу передбачити вторинну та третинну структури білка. Одночасне використання амінокислотної послідовності і кристалографічних карт електронної густини дає змогу відобразити просторову локалізацію всіх атомів у білку.
У поліпептидному ланцюзі пептидна група є плоскою і жорсткою. Тоді поліпептидний ланцюг являє собою послідовність пептидних груп (однотипних площин), які з’єднані між собою поодинокими зв’язками N-Ca і С-Са. Обертання навколо цих зв’язків не повністю довільне через стеричні обмеження. Конформації білкових молекул стабілізуються слабкими взаємодіями пептидних (вторинна структура) і бокових груп амінокислотних залишків (третинна структура). Вторинна структура білка - це швидке локальне впорядкування поліпептичного ланцюга внаслідок утворення водневих зв’язків між пептидними групами (рис. 3.2, а). Енергетично і стерично вигідною вторинною структурою в білках є права α-спіраль. Лише теоретично можлива π-спіраль, яку експериментальними методами у білках не було виявлено. Вторинними структурами в білках є паралельні та антипаралельні або β-структури.

Рис. 3.1. Первинна структура білка
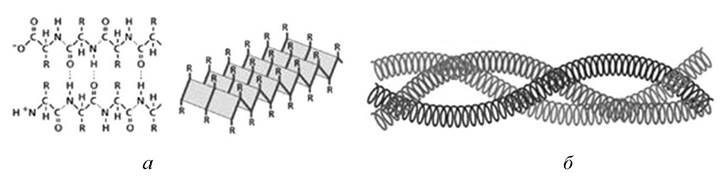
Рис. 3.2. Вторинна (а) та надвторинна (б) структури білка
Надвторинна структура. Наступним рівнем організації білкових молекул є надвторинні структури (рис. 3.2, б). Прикладом таких структур є суперспіральні структури, в яких дві α-спіралі (у тропоміозині, легкому мероміозині, параміозині) чи три α-спіралі (у фібриногені) скручені одна з одною.
За амінокислотною послідовністю в поліпептидному ланцюзі теоретично передбачено вторинну структуру білка, існування якої ґрунтується на припущенні, що конформації поліпептидних ланцюгів визначаються локальними, ближніми взаємодіями.
Оптичні методи дисперсії оптичного обертання (ДОО) та колового дихроїзму (КД) широко використовують для дослідження вторинної структури білків. Їх основу становить фізичне явище - взаємодія лінійно поляризованого світла з оптично активними молекулами. Амінокислоти мають асиметричні атоми вуглецю, які зумовлюють появу оптичної активності. Спектри ДОО і КД реєструються в ділянці поглинання пептидних груп (ультрафіолетова ділянка спектра 180.. .230 нм).
Дисперсія оптичного обертання. Розглянемо взаємодію оптично активної речовини з лінійно поляризованим світлом. Кут обертання пропорційний різниці nL - nR і товщині шару d(товщина кювети) оптично активної речовини:
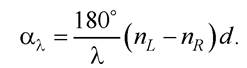
Питоме обертання розчину з концентрацією речовини С (г-см-3) і товщиною d (дм) становить:
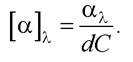
Молярне обертання
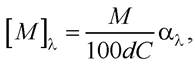
де М - молекулярна маса речовини, моль.
Кут обертання залежить від довжини хвилі світла, яке поглинається оптично активною речовиною. Залежність [α]λ або [Μ]λвід λ називається дисперсією оптичного обертання. Спектральні прилади, які з високою точністю реєструють ДОО, називають спектрополяриметрами.
У максимумі λ0 смуги поглинання речовини ДОО стає аномальним, набуваючи нульового значення (ефект Коттона). За ділянкою смуги поглинання ДОО плавно змінюється залежно від λ, що відповідає рівнянню Друде:
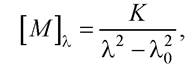
де К - стала Коттона.
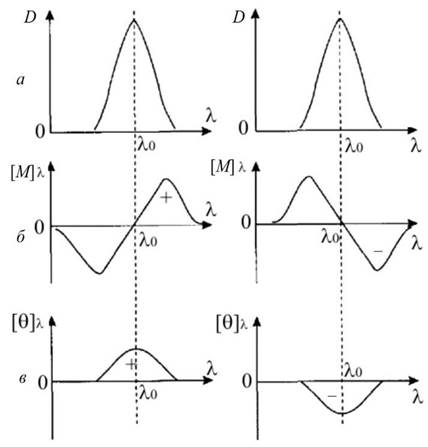
Рис. 3.3. Ефект Коттона в смузі поглинання: а - смуга поглинання з оптичною густиною D; б - ДОО; в - КД; «+» - додатний коттон-ефект; «-» - від’ємний коттон-ефект
Залежно від форми ДОО можливі два ефекти Коттона. Якщо λ > λ0і величина [Μ]λ має додатне значення, тоді маємо додатний коттон-ефект, якщо від’ємне - від’ємний коттон-ефект (рис. 3.3).
Коловий дихроїзм. Оптично активна речовина по- різному поглинає L- та R- компоненти світла і тому має різні коефіцієнти молярної екстинції εL та εR. Як результат різних оптичних густин D для L- та R-компонент лінійно поляризоване світло після проходження розчину з оптично активною речовиною перетворюється в еліптично поляризоване світло. Вимірюють еліптичність речовини так:
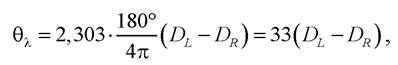
де Dl та Dr - оптична густина для L- та R-компонент відповідно.
Молярна еліптичність
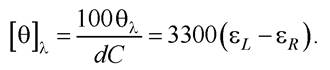
Залежність [θ]λ від λ називають спектром колового дихроїзму. Прилад, на якому реєструють спектри КД, називають дихрографом.
За допомогою методів ДОО і КД доведено, що білки надто розрізняються за кількістю упорядкованих структур. Фібрилярні білки - високовпорядковані, глобулярні білки - менш упорядковані.
Змінення температури, кислотності, додавання до розчину денатурованих речовин, таких як сечовина, хлорид гуанідину, спричиняє перехід поліпептидного ланцюга від упорядкованої конформації до неупорядкованої структури.