АДАПТАЦІЯ РОСЛИН ДО АНТРОПОГЕННИХ ЧИННИКІВ - 2017
3. ЗАБРУДНЕННЯ ДОВКІЛЛЯ ПРОМИСЛОВИМИ ХІМІЧНИМИ ВІДХОДАМИ
3.2. Компоненти забруднення атмосфери
Полютанти, які надходять в атмосферу, за своєю природою являють собою газоподібні речовини та аерозолі. Перші з них поєднують справжні гази і пари з властивої ним молекулярною роздробленістю, а другі - тверді і рідкі частки. Агрегатний стан атмосферного забруднювача визначає його фізико-хімічні властивості, поширення в атмосфері і фітотоксичність. Гази і пари, наприклад, можуть легко вступати в хімічну взаємодію з іншими речовинами, а пари, крім того, конденсуватися й осідати. Газоподібні речовини легко проникають у внутрішні тканини рослини, а пилоподібні частки осідають на його поверхні. У лист можуть проникати лише розчинені речовини разом із потоком води (Рис. 6).
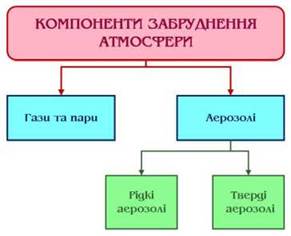
Рис. 6 - Компоненти забруднення атмосфери
Аерозолі бувають тверді і рідкі. Аерозолі - це дрібні тверді і краплиннорідкі частки, які містяться у повітрі, як дисперсійному середовищі, (диспергенти) у зваженому стані. Сукупність твердих часток виявляється у вигляді диму, а рідких - туману чи хмари. Розмір часток аерозолів коливається в широких межах - від сотих часток мікрона до десятків і сотень мікрон. Частки, менші 5 мк, можуть тривалий час знаходитися в повітрі у вигляді суспензій, а при досягненні розміру більш 10 мк вони швидко осідають.
Особливо високе забруднення атмосферного повітря аерозолями створюється у великих містах і біля підприємств, що викидають в атмосферу багато пилоподібних часток, які розповсюджуються в напрямку вітру.
Тверді частки аерозолю різноманітні за хімічним складом. Найбільш часто в складі твердої фракції забруднювачів повітря зустрічаються сполуки кремнію, кальцію, вуглецю (частки незгорілого вугілля), смолисті речовини, рідше окисли металів - заліза, алюмінію, магнію, цинку, марганцю, міді й ін.
Основними джерелами викиду твердих і рідких часток в атмосферу є теплові електростанції, що спалюють буре вугілля, металургійні підприємства, збагачувальні (агломераційні) фабрики, цементні і сажові заводи, хімічні підприємства, які виготовляють дусти, а також транспорт тощо. Доменний цех у добу викидає понад 190 т пилоподібних часток. Метали, що випаровуються в процесі плавки і надходять у вільну атмосферу, знаходяться в зваженому стані у вигляді найтоншого пилу з окислів заліза, марганцю, міді, цинку, свинцю, срібла, сурми, вісмуту, кадмію, селену, телуру та ін. Під час виготовлення кожної тонни цементу завод втрачає 240 кг продукції у вигляді пилу.
Тверді суспензії в атмосфері утворюються також у результаті хімічної взаємодії газоподібних речовин, що надходять у неї. Так, аміак легко реагує з хлором або хлористим воднем, унаслідок чого утворюється хлористий амоній. Кристали амонійних солей і окислів металів високодисперсні, тривалий час вони знаходяться в повітрі у зваженому стані і розносяться повітряними потоками на величезні відстані, іноді сягаючі тисяч кілометрів.
Сажові заводи викидають в атмосферу за добу декілька сотень кілограмів часток сажі розміром 0,033-0,04 мм. При висоті вентиляційних труб 20-25 м вміст сажі в приземному шарі повітря з навітряної сторони від заводу на відстані 0,2 км складає 0,9-10,7 мг/м3, 0,5 км - 0,5-1,6, 1 км - 0,37-1,1, 2 км - 0,030,1. У зимовий час, коли зменшується вертикальне перемішування повітря, зміст у ньому часток сажі підвищується.
Рідкі частки аерозолю утворюються під час конденсації парів кислот, основ, фенолів, смол та інших речовин, а також під час хімічного реагування забруднювачів з водяною парою або крапельками води, що містяться в атмосфері при тумані чи дощі. Так, у насиченому вологою повітрі утворюються сірчиста, сірчана, соляна, фторидна та інші кислоти з відповідних ангідридів, що надійшли в атмосферу у вигляді газу.
Аерозолі, які викидаються промисловими підприємствами та автотранспортом, поступово осідають на земну поверхню і забруднюють ґрунт. За цих умов у ґрунті створюються підвищені концентрації сірки, хлору, фторидів, важких металів (залізо, цинк, мідь тощо). Це призводить до значного погіршення стану ґрунту, його засолення (сульфатного, хлоридного). За цих умов пригнічується діяльність ґрунтової мікрофлори, зменшується родючість ґрунту.
Іншими джерелами забруднення ґрунту є підприємства агропромислового комплексу. Так, необґрунтоване застосування мінеральних добрив, пестицидів, інсектицидів, гербіцидів та інших отрутохімікатів призводить до накопичення їх у ґрунті, що створює несприятливі умови для росту рослин, до накопичення в рослинах отруйних речовин.
Промисловість та сільське господарство є також джерелами масового забруднення водойм шкідливими речовинами. Стічні промислові води містять значну кількість токсичних речовин. Усі речовини, які вносяться людиною або потрапляють у ґрунт з повітря, можуть вимиватися опадами у ґрунтові води, а далі потрапляти у водойми.
Діючі підприємства викидають в атмосферу, як правило, суміш газів, парів і твердих часток, до складу яких входять речовини, що беруть участь чи утворюються у виробничому процесі.
Більшість виробничих відходів викидається в атмосферу примусово через труби, аспіраційні і вентиляційні системи, де велика частина їх уловлюється. Неорганізовані викиди надходять в атмосферу з виробничих систем, що втратили герметичність (через вікна, двері, аераційні пристрої), а також у місцях видобутку, навантаження і транспортування сировини на відкритих розробках і при самозайманні порід, що містять сірку, на териконах. Одним з найважливіших джерел забруднення атмосферного повітря є топки для спалювання палива і печі для виплавки і переплавляння металу.
До складу речовин, які викидаються в атмосферу підприємствами і транспортом, входять біля сотні ідентифікованих і значна частина ще не ідентифікованих. Найбільш розповсюдженими газами, що забруднюють повітря, є: сірчистий і сірчаний ангідриди, сполуки фтору, хлору, окисли азоту, сірковуглець, сірководень, аміак, ненасичені вуглеводні, окис вуглецю та ін.
Тверді частки, що надходять в атмосферу, найчастіше складаються з незгорілих часток вугілля, золи, сульфатів і сульфідів металів (заліза, міді, цинку, свинцю), кремнезему, хлоридів, сполук кальцію, натрію тощо.
До складу рідких аерозолів крім парів кислот, фенолів та інших речовин, що надходять в атмосферу, входять сполуки, які утворюються в результаті взаємодії газів і твердих часток з водяною парою (Рис. 7).
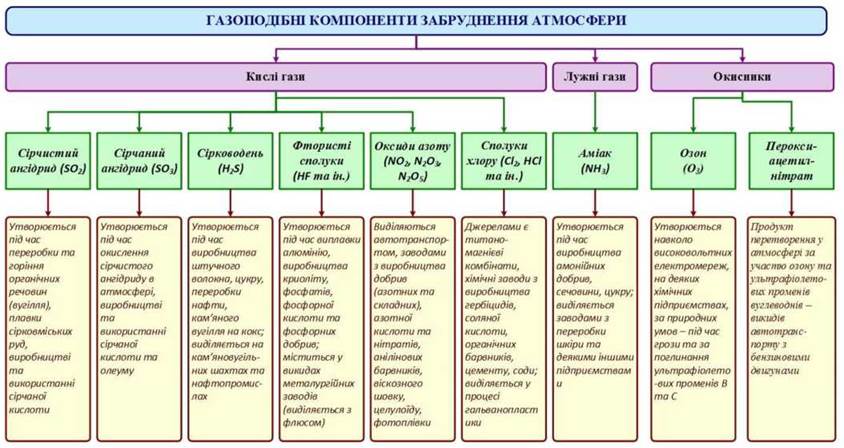
Рис. 7 - Компоненти забруднення атмосфери
Кислі та лужні гази
Сірчистий ангідрид (SO2) утворюється під час переробки і горіння органічних речовин (кам’яне і буре вугілля, нафта і нафтопродукти, деревина), випалу і плавки сірковмісних руд, виготовлення та застосування у виробничому процесі сірчаної кислоти. Викидають сірчистий ангідрид у великій кількості теплові електростанції, підприємства чорної і кольорової металургії, коксохімічні, цементні, аміачні заводи; фабрики з виробництва синтетичних волокон целюлози, цукру тощо.
Теплова електростанція, яка спалює в добу 4 500 т кам’яного вугілля, що містить 3 % сірки, викидає в повітря 270 т сірчистого ангідриду, а за виплавки міді з 2 250 т концентрату руди, що містить 30 % сірки, виділяється в атмосферу 1 360 т сірчистої ангідриду. Під час виплавки чавуну утворюється велика кількість доменного газу, з якого близько 10 % надходить в атмосферу. За статистичними даними, виплавка 1 т чавуну, супроводжується викиданням в атмосферу в середньому 22,4 кг сірчистого ангідриду. Величезна кількість сірчистих сполук надходить в атмосферу зі збагачувальних фабрик залізної руди, під час виплавки міді, цинку, нікелю та інших металів, а також під час коксування вугілля.
Самозаймання сполук сірки, що містяться в породах, які викидаються з вугільних шахт, супроводжується виділенням сірчистого ангідриду. Кількість SO2, який надходить у повітря, залежить від складу шахтних териконів і може у напрямку поширення диму досягати 0,2-5,0 мг/м3 і викликає ушкодження рослин на території радіусом до 200-300 м від терикона. Найвища концентрація сірчистого ангідриду спостерігається на відстані до 300 м від териконів.
У великих містах і промислових районах Європи і Північної Америки середньорічна концентрація сірчистого ангідриду складає 0,8-4,0-10"3 мг/м3. У північних районах навіть менш потужні джерела забруднення атмосфери, ніж металургійні заводи, створюють більш високу концентрацію діоксиду сульфуру та нітрогену в приземному шарі повітря. Це обумовлюється часто повторюваною високою хмарністю, що зменшує вертикальний обмін повітря.
Сірчистий ангідрид здатний вступати у взаємодію з крапельками водяної пари, що містяться в повітрі, або туману, дощу, й утворювати сірчисту кислоту.
Розчинність сірчистого ангідриду у воді вивчили Террагліо і Манганеллі. Згідно з їх даними, швидкість розчинення SO2 у воді залежить від концентрації цього ангідриду в атмосферному повітрі. Так, за вмісту SO2 у повітрі 0,81 мг/м3 у розчині виявлялося його 4,53 мкг/мл, за 2,54 мг/м3 - 8,88 мкг/мл, за 5,54 мг/м3 - 12,83 мкг/мл і за 8,73 мг/м3 - 16,75 мкг/мл. Одночасно знижувалася кислотність розчину. Різке зниження кислотності обумовлене дисоціацією сірчистої кислоти, що утворюється, а також утворенням водневих (Н+) і бісульфатних (SO32-) іонів. У розчині сульфітів виявлялося понад 98,5 % бісульфатних іонів і лише 1,5 % сполук сірчистої кислоти.
Сірчиста кислота є нестійкою сполукою і дисоціює з виділенням сірчистого ангідриду.
За наявності в атмосфері окиснювачів (озону та ін.), а також вологи частина сірчистого ангідриду легко перетворюється в сірчаний ангідрид і різко підвищується їхня спільна фітотоксичність. Співвідношення аерозолів сірчаної кислоти і сірчистого ангідриду за ясної погоді складало 3,2 %, а за мрячної - 15,7 %. Під час надходження в атмосферу діоксиду сульфуру до неї домішується близько 2 % сірчаного ангідриду, але через якийсь час частка останнього підвищується до 16 %.
Сірчаний ангідрид має високу гігроскопічність і, з’єднуючись з водяною парою, утворює аерозоль сірчаної кислоти, що утримується в повітрі у вигляді туману. Сірчана кислота має сильні окисні властивості, активно приєднує воду. Наявність в атмосферному повітрі спільно сірчистого і сірчаного ангідридів обумовлює високу їхню токсичність для рослин.
Сірководень (H2S) надходить в атмосферу разом з іншими забруднювачами у відносно невеликій кількості порівняно із сірчистим ангідридом. Він постійно знаходиться у викидах коксохімічних підприємств, виділяється під час виготовлення штучного волокна, цукру, у кам’яновугільних шахтах, на нафтових промислах, нафтопереробних заводах та ін. Сірководень має сильні відновні властивості і є токсичним для рослин.
Сполуки нітрогену викидають підприємства, які виробляють мінеральні добрива, азотисту кислоту і нітрати, анілінові барвники, нітросполуки, віскозний шовк, целулоїд, фотоплівку, а також вихлопні гази автотранспорту.
У суміші окислів азоту (NO, NO2, N2O3, N2O5), що викидаються у повітря у вигляді жовто-коричневого диму («лисячий хвіст»), переважають NO2 і N2O5. Це обумовлено тим, що окис азоту (NO) не стійкий й окисляється киснем повітря до двоокису. Двоокис азоту, у свою чергу, може окислятися до азотного ангідриду в зазначеній вище послідовності.
Оксиди нітрогену (NO2, N2O3, N2O5) легко розчиняються у воді, що міститься в повітрі, і утворюють аерозоль азотної (HNO3) і малостійкої азотистої (HNO2) кислот. Легкість взаємного переходу одного оксида азоту в іншій ускладнює роздільний облік вмісту кожного з них у повітрі, і тому звичайно виражають їхню сумарну концентрацію. Високий відсоток окислів азоту в атмосфері створюється і у містах з інтенсивним рухом автотранспорту.
Аміак (NH3) виділяється в атмосферу в невеликих кількостях під час виробництва амонійних добрив, сечовини, азотної кислоти, на цукрових, шкіряних та інших підприємствах. У повітрі аміак реагує з вугільним ангідридом з утворенням (NH4)2CO3, або з водою, перетворюючись у NH4OH. За наявності в повітрі більш реакційноздатних аніонів аміак вступає з ними у взаємодію і перетворюється в амонійні солі (сульфати, фториди та ін.). Вони носяться в повітрі у вигляді дрібних кристалів і повільно осідають.
Аміак має відновні властивості зі слабко вираженою токсичністю.
Фтористі сполуки є одними з найбільш шкідливих для рослин. Фтор легко вступає в реакцію майже з усіма елементами. Тому у вільну атмосферу він надходить не в чистому вигляді, а в сполуці з іншими речовинами у вигляді газу або пилоподібних часток (HF, NH4F, H2SiF6, NaF тощо). Джерелами забруднення повітря фтористими речовинами є алюмінієві і кріолітові заводи, підприємства, що виробляють фосфати і фосфорні добрива, емалеві і керамічні вироби і т. д. Деяка кількість фтористих сполук виділяється з топок під час спалювання вугілля та з флюсів, які застосовуються у виплавці чавуна. Газоподібні і розчинені у воді сполуки фтору проникають у рослину через листки і корені.
Деякі види рослин здатні накопичувати високі дози фтору і за систематичного потрапляння в організм тварин викликати захворювання флюорозом. Фтористі сполуки є високотоксичними для рослин. Часті випадки повної загибелі листя дерев поблизу заводів емальованого посуду, які викидають в атмосферу фтористий водень і чотирифтористий кремній. Згубна дія фтору на рослини підсилюється при високій вологості повітря й опадах.
Сполуки хлору є високореакційними окиснювачами. У вільному стані в природі і викидах підприємств хлор майже не зустрічається. Забруднення атмосферного повітря хлористими сполуками походить від титаномагнієвих заводів, хімічних підприємств, що виробляють інсектициди, гербіциди, соляну кислоту, органічні барвники, цемент, суперфосфат, оцтову кислоту, гідролізний спирт, хлорне вапно, соду, при гальванопластиці й ін. Численні джерела викидів сполук хлору обумовлюють наявність останніх в атмосферному повітрі більшості сучасних міст. Концентрація хлору в містах середньому складає 2,6-9,5-10-8 %. Хлористий водень та інші його сполуки необхідні рослинам в обмеженій кількості. У випадку потрапляння в організм у високих дозах хлор викликає глибокі структурні і функціональні порушення, що нерідко ведуть до загибелі рослин.
Окис вуглецю виділяється усюди при неповному згорянні речовин, що містять вуглець (кам’яне вугілля, нафтопродукти, природний газ). Наприклад, вміст CO складає в доменному газі до 30 %, у вихлопних газах автотранспорту - від 1 до 13,7 % (у середньому 6,3 %), у газах, що викидаються вагранкою, від 13 до 15 % і т. д. Окис вуглецю є відновником. Він негативно впливає на рослини при порівняно високій концентрації понад 1 %.
Окиснювачі
Озон (O3) є ймовірно найбільш важливою отруйною для повітря речовиною у всіх країнах світу. Шар озону дивно тонкий. Якби цей газ зосередити біля поверхні Землі, то він утворив би плівку лише у 2-4 мм завтовшки (мінімум - у районі екватора, максимум - біля полюсів). Саме ця плівка надійно захищає нас, майже повністю поглинаючи небезпечні ультрафіолетові промені. За відсутності озонової плівки життя збереглося б лише в глибинах вод (глибше 10 м) і в тих шарах ґрунту, куди не проникає сонячна радіація.
За дії високих концентрацій у рослинних організмів ушкоджується листя, а при подальшому підвищенні концентрації протягом короткого проміжку часу можливе значне ураження рослини, що проявляється, зокрема, у вигляді некрозу, змінюючи при цьому колір від металево-сірого до коричневого. За дії невисоких концентрацій на рослини протягом тривалого часу може проявлятися накопичувальний ефект. До ознак хронічного ушкодження належать бронзове зафарбування листя, хлороз (знебарвлення), їхнє передчасне старіння (Рис. 6, 7). Дія озону змінює проникність рослинних тканин для води, глюкози, іонів, призводить до інгібування процесів фотосинтезу: знижує не тільки активність електронно-транспортної системи, але і вмісту хлорофілу. За дії озону на процеси дихання рослин може відбуватися як стимулювання, так і інгібування. Пошкоджуюча концентрація для різних видів змінюється у широких межах: для чутливих видів рослин вона може складати 0,05-0,1 млн-1 за 2-4 години, для толерантних - 0,4 млн-1. Дуже чутливими до дії озону є хвойні породи (Рис. 8).
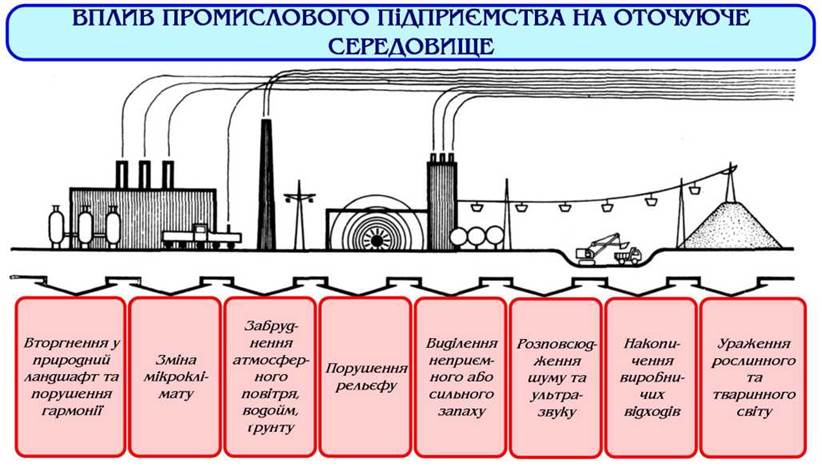
Рис. 8 - Вплив промислових підприємств на довкілля
Пероксіацетилнітрат (PAN) - найотрутнішій для установки окисник поряд з озоном, є PAN. Пероксіацетилнітрат - сполука, що утворюється з вуглеводнів HCs і оксидів азоту NOx під дією сонячного світла. Етанол, який може потрапляти у повітря, також є джерелом утворення атмосферного ацетальдегіду і пероксіацетилнітрату, який сприяє накопиченню NOx в атмосфері. Ця сполука визиває пошкодження тканин у рослин. Подібно до озону, PAN за дії сонячного світла реагує з різним відпрацьованими газами. Через постійне надходження у повітря промислових міст PAN здійснює негативний вплив на всі живі організми.
Органічні сполуки
Етилен (H2C-CH2) - газ, який добре розчиняється у воді і має характерний запах. Етилен міститься у викидах автотранспорту та утворюється у результаті неповного згорання вугілля та газу і є побічним продуктом поліетиленового виробництва. Він визиває пошкодження, які схожі з дією, що викликає PAN і озон у міському середовищі. Вперше вплив етилену на ріст рослин виявив у 1901 р. Д. М. Нелюбов. Він вивчав причини опадання листків при освітленні їх так званим світильним газом, серед інгредієнтів якого найбільш активним був етилен. Д. М. Нелюбов встановив, що у дуже малих концентраціях цей газ викликав у рослин потрійну реакцію: гальмував ріст стебла у довжину, сприяв його потовщенню і змінював горизонтальну орієнтацію. Дещо пізніше було показано, що етилен прискорює дозрівання плодів. Р. Гейн у 1934 році довів, що самі рослини здатні синтезувати етилен. У дуже малих концентраціях, порядку 0,001-0,1 мкл/л, він здатний гальмувати і змінювати характер росту рослин, прискорювати дозрівання плодів. Встановлено, що по рослині пересувається його попередник - 1-аміноциклопропан-1-карбонова кислота (АСС), яка і бере участь у передачі сигналу. Сам етилен, виділяючись в атмосферу, може забезпечувати сигналізацію між рослинами. Локальні центри синтезу етилену не виявлені, він з’являється у будь-якому рослинному органі.
Добра розчинність етилену у воді дозволяє йому транспортуватись по водному розчині у рослині. Етилен, як газ, відрізняється від інших фітогормонів своєю летючістю, з цієї причини етилен однієї рослини може впливати на перебіг процесів в іншій рослині, яка знаходиться поряд. Класичний ефект дії етилену спостерігається у плодоовочевих сховищах, або при тривалих морських транспортуваннях - перезрілі плоди посилюють дозрівання сусідніх менш стиглих плодів.
Важливим ефектом фізіологічної дії етилену вважається також стимуляція опадання листків: він впливає на розростання прошарку відокремлення, який знаходиться біля основи черешка листки. Л. І. Мусатенко та Т. П. Маменко вважають, що рослинний гормон етилен, незважаючи на просту двовуглецеву структуру, є ефективним модулятором росту і розвитку рослин. Він контролює багато важливих фізіологічних процесів у рослинному організмі і є посередником експресії 7 % рослинного геному. Етилен включається у важливі аспекти рослинного життєвого циклу, зумовлюючи проростання насіння, розвиток кореневих волосків, модуляцію коренів, зацвітання квіток, опадання і дозрівання плодів. Утворення етилену рослинами регулюється внутрішніми сигналами в процесі їх росту і розвитку, а також у відповідь на зовнішні стимули біотичної й абіотичної природи, такі як поранення, гіпоксія, озон, замерзання, посуха тощо. Науковцями широко досліджуються мутантні рослини не чутливі до етилену, мутанти з етилен-чутливими фенотипами, які включають etr 1, etr 2, etr 3, ein 5/ain 1, ein 4, ein 6, eir 1. Також ідентифіковано мутанти, здатні до надпродукції етилену (eto 1, eto 2, eto 3), постійної активації етиленових сигнальних шляхів (ctr 1) чи неспроможні до домінування апікальної верхівки (hls 1). Наявність цих мутантів дає можливість використовувати їх для виділення генів, які відповідають за сприйняття і передачу етиленового сигналу в рослинах, і допомагають частково розшифрувати молекулярні шляхи, якими сигнал проходить, викликаючи включення чи пригнічення певних фізіологічних програм.
Етилен є не лише важливим регулятором багатьох фізіологічних процесів у вищих рослин, він також функціонує і як медіатор відповідних реакцій рослин на стрес-фактори біотичної й абіотичної природи. Він відіграє важливу роль у стійкості рослин до хвороб, однак, залежно від типу патогена і виду рослин, функції етилену можуть відрізнятися. Частіше етилен пригнічує розвиток симптомів при некротрофному інфікуванні патогенами, але підвищує смертність клітини, викликану іншими типами патогенних інфекцій, беручи участь у запрограмованій смерті клітин. При інфікуванні патогеном їх авірулентні сигнали розпізнаються завдяки наявності специфічного гена стійкості рослин (R). Ця avr/R взаємодія називається ген-ген стійкістю і часто запускає механізм захисту, що включає програму клітинної смерті в місцях інфікування (відома як гіперчутлива відповідь). Ідентифіковано транскрипційний фактор Pti 4 - це білок, який просторово подібний з амінокислотною послідовністю EREBPS і може специфічно зв’язувати GCC-box cis елемент, присутній у промоторі багатьох етилен-регульованих патоген-відповідних генів (PR). Експресія Pti 4 в листках томату швидко індукується етиленом, що зумовлює експресію GCC-box-вмісних PR генів. Ці результати свідчать про те, що відповідь етилену є ланкою ген-ген стійкості у рослин.
У випадку, коли відбувається активація гіперчутливої відповіді, запускається тривала відповідь, відома як системно набута стійкість (СНС), що забезпечує імунітет проти послідовного інфікування, спричинений широким спектром патогенів. У багатьох випадках СНС характеризується підвищенням ендогенного вмісту саліцилової кислоти (СК) і експресією PR генів, призводячи до підвищення стійкості до широкого спектра вірулентних патогенів. Однак, деякі патогени можуть індукувати захисну стійкість рослин через активацію етилену і жасмонової кислоти (ЖК) у сигнальних трансдукційних шляхах. Хоча СК-залежні й ЖК/етилен-залежні шляхи беруть участь у формуванні стрес-захисних реакцій рослин і їх стійкості до різних патогенів, спостерігається значна взаємодія між цими двома шляхами в СНС. Тут використовують термін «cross-talk» (перехресний зв’язок), який забезпечує взаємодію між двома окремими, лінійними сигнальними трансдукційними шляхами, що одночасно активуються в однакових клітинах. Таким чином, компоненти двох сигнальних шляхів експресуються в однакових клітинах і показують взаємодію в нормальних фізіологічних умовах. Етиленові сигнальні трансдукційні шляхи можуть взаємодіяти з ЖК шляхами для співрегулюючої експресії захисних PR генів, наприклад, PDF 1.2, включених у стійкість рослин до хвороб. Крім того, існує взаємодія між ЖК/етиленом і СК-залежними шляхами. За некротрофного інфікування патогенами розвиток симптомів прискорюється та підвищує смертність клітини, викликану іншими типами патогенних інфекцій, беручи участь у запрограмованій смерті клітин.
Припускають, що абіотична стрес-індукована відповідь частково має подібність з патогензахисними шляхами, а взаємодія між СК, ЖК та етиленом модулює відповідь на дію активних форм кисню. Виявлено, що стимуляція біосинтезу етилену за дії стресових факторів, таких як озон, УФ радіація, поранення тощо, включається генерацією активних форм кисню, до яких відносять супер- оксидні аніони, гідроксильні радикали і пероксид водню, які викликають пошкодження клітинних органел внаслідок пероксидного окиснення ліпідів. Крім того, активні форми кисню, особливо, пероксид водню, функціонують як сигнальні молекули. Зокрема, надлишок у тканинах пероксиду водню та інших активних форм кисню може стимулювати АСО чи індукувати новоутворення її ізоформ. Тому вважають, що підвищення біосинтезу етилену в умовах стресу залежить від швидкого перетворення АСС на етилен, активності АСО, яка каталізує останній етап біосинтезу етилену. Однак, головним процесом регуляції біосинтезу етилену є експресія АСС-синтази (АСS).