Анатомія рослин - 2013
ДОДАТКИ
Реактиви для проведення кольорових реакцій ідентифікації
Досліджувана речовина |
Реактив |
Забарвлення продукту реакції |
Крохмаль |
1% розчин І2 в КІ (розчин Люголя) |
Синє |
Жири |
розчин Судану - ІІІ в гліцерині |
Оранжеве |
Клітковина, або целюлоза |
10,0 ZnCl2, 10,0 КІ, 2,0 І2 в 15 млН2О |
Синє |
розчин І2 |
Жовтувато- коричневе |
|
фуксин кислий |
Червоний |
|
Кутин |
розчин Судану - ІІІ |
Рожево- оранжеве |
розчин хлор - цинк - йоду |
Жовте |
|
Суберин |
розчин Судану - ІІІ |
Рожево- оранжеве |
концентрований розчин калію гідроксиду |
Пожовтіння і набрякання оболонки |
|
Лігнін |
1% розчин флороглюцину з концентрованою HCl |
Малинове |
хлор - цинк - йод + Н2Б04 |
Жовте |
|
сірчанокислий анілін |
Лимонно-жовте |
|
0,5% спиртовий розчин сафроніну |
Червоне |
|
Білки |
біуретова реакція; розчин СиБ04 в K0H |
Фіолетове |
розчин Люголя |
Жовте |
|
нагрівання в присутності азотної кислоти (ксантопротеїнова реакція) |
Яскраво-жовте |
|
Слиз |
розчин метиленового синього |
Блакитне або синє |
розчин туші |
Світлі плями на темному фоні |
|
Мінеральні речовини |
розчин фенолу |
Рожеве |
Примітка 1. При проведенні реакції виявлення лігніну спочатку капають розчин флороглюцину, а через 1-2 хв. додають кислоту. Після почервоніння кислоту збирають смужкою фільтрувального паперу і вносять в воду. Для зберігання препарату замість води вносять гліцерин.
Примітка 2. В постійних препаратах флоема ( луб) має голубе забарвлення від хлор - цинк - йоду - це ознака живої тканини; ксилема ( деревина ) має малинове забарвлення від розчину флороглюцину з конц. НСІ або Н2Б04- це ознака здерев’янілої тканини.
Матеріали рослинного походження і реактиви, які потрібні для
практичних занять
№ заняття |
Сировина |
Реактиви |
1 |
2 |
3 |
1. |
Лусочки цибулі, листки елодеї, плоди шипшини, листки традесканції, шматки картоплі, зернівки пшениці, кукурудзи і рису; насінини гороху і рицини ( якщо є ); листки алое, черешки щавлю кінського і белладонни, зовнішні луски цибулі, стебла щавлю кислого |
розчин метиленового синього, дистильована вода, розчин хлорал -гідрату, розчин Люголя, реактивні папірці на визначення вмісту алкалоїдів, дубильних речовин та лакмусові папірці . |
2. |
Корені цибулі або пшениці (заздалегідь проростити у воді),гілочки бузини, стебла гарбуза |
розчин хлоралгідрату |
3. |
Листки бузини, ірису, герані, м’яти , стебла бузини, жовтушника, насінини льону, листки кропиви, кору дуба |
розчин хлоралгідрату, розчин Судану - ІІІ |
4. |
Кора дуба, стебла гарбуза або соняшника, стебла кропиви собачої, стебла бузини, корені ірису, корені валеріани, черешки липи |
|
5. |
Стебла кукурудзи, стебла гарбуза, кореневище конвалії, кореневище папороті -щитника чоловічого |
розчин хлоралгідрату |
6. |
Корені ірису, корені алтеї, корені валеріани |
розчин хлоралгідрату |
7. |
Стебла кукурудзи і жита, кореневище конвалії |
розчин хлоралгідрату |
8. |
Стебла деревію, конюшини, соняшника, стебла собачої кропиви, кореневище бадану, кореневище м’яти, стебла бузини |
розчин хлоралгідрату |
9. |
Листки ірису або аспарагусу, листки лавру, хвоя сосни, листки хлорофітуму |
розчин хлоралгідрату |
10. |
Листки, стебла, корені, кореневища невідомих рослин (контрольна робота); Здача Модулю 1 Анатомія рослин |
Правила виконання кольорових реакцій малюнків в альбомах
При виконанні малюнків досліджуваних об’єктів з мікроскопа доцільно використовувати кольорові олівці для позначення як окремих клітин, так і вмісту та тканин в цілому. Для цього прийнято позначати окремі типи клітин і тканин певними кольорами, зокрема:
Назва тканинних клітин або їх вмісту |
Колір зображення |
Епідерма жива |
Чорний |
Епідерма здерев’яніла |
Червоний |
Корок |
Коричневий |
Коленхіма |
Голубий |
Хлоренхіма |
Зелений |
Хлоропласти |
Зелений |
Ендодерма здерев’яніла |
Червоний |
Ендодерма пропускні клітини |
Синій |
Ендодерма жива |
Чорний |
Крохмальні зерна |
Синій |
Екзодерма жива |
Чорний |
Екзодерма здерев’яніла |
Червоний |
Пропускні клітини |
Чорний |
Перицкл живий |
Чорний |
Перицикл здерев’янілий |
Червоний |
Флоема (ситовидні трубки і клітини супутниці) |
Синій |
Ксилема (судини) |
Червоний |
Ксилема - здерев’яніла паренхіма |
Червоний |
Ксилема - слабоздерев’яніла |
Чорний |
Камбій |
Чорний |
ПРАВИЛА РОБОТИ З МІКРОСКОПОМ
Мікроскоп слід зберігати у футлярі або під скляним ковпаком так, щоб на нього не осідав пил. Перед початком роботи мікроскоп виймають з футляра (беруть за зігнуту частину штатива й обережно ставлять на робоче місце біля лівого плеча) і протирають м'якою серветкою окуляр та об'єктиви. Потім забезпечують оптимальне освітлення препарату. Для цього револьвером підводять об'єктив малого збільшення під тубус до легенького клацання. Важливо, щоб об'єктив був повністю підведений під тубус і не був зміщений від центру, бо тоді частина поля зору буде затемненою. Поле зору мікроскопа — це світле коло, яке можна побачити неозброєним оком. Світло спрямовують за допомогою увігнутого дзеркала, направляючи його на джерело світла (вікно, електролампу). Слід уникати надто яскравого освітлення, оскільки воно може засліпити око. У такому разі око на деякий час втрачає чутливість.
Матеріал, що вивчають під мікроскопом, повинен бути тоненьким. Грубий препарат не пропускає світло і під мікроскопом можна побачити лише його контури.
В окуляр дивляться лівим оком, а праве не заплющують, щоб очі не втомлювались. Після наведення освітлення мікроскоп до кінця роботи не переставляють, оскільки це призводить до порушення умов освітлення. Препарат спочатку розглядають при малому збільшенні. Не дивлячись в окуляр, за допомогою макрометричного гвинта об'єктив наближують до предметного столика приблизно на 0,5 см, потім дивляться в окуляр і піднімають тубус на такий рівень, за якого з'являється чітке зображення. Зображення об'єкта в мікроскопі можна спостерігати лише тоді, коли він буде знаходитися на відповідній відстані від лінзи об'єктива. Цю відстань називають фокусною. У разі малого збільшення фокусна відстань дорівнює приблизно 1 см.
Після вивчення загального вигляду препарату при малому збільшенні можна переходити до великого. Для цього препарат слід закріпити клемами, щоб ознака, яку потрібно розглянути при великому збільшенні, знаходилась у центрі поля зору. За допомогою револьвера змінюють об'єктиви з 8* на 40*. Револьвер повертають до легенького клацання. Чіткість зображення препарату забезпечують за допомогою макрометричного гвинта, який повільно обертають проти годинникової стрілки. Фокусна відстань при великому збільшенні дорівнює приблизно 1 мм. Мікрометричним гвинтом користуються лише при великому збільшенні, коли фокус уже наведений на препарат. Протягом роботи з мікрометричним гвинтом фокусна відстань зміщується і це дає змогу розглянути весь зріз препарату. Під час роботи потрібно стежити за чистотою об'єктивів, не допускати потрапляння рідини на лінзи. Діагностичні ознаки препарату замальовують в альбомі, який розміщують із правого боку від мікроскопа. Після закінчення роботи мікроскоп переводять у режим малого збільшення і лише тоді препарат знімають з предметного столика.
МІКРОСКОПІЧНИЙ АНАЛІЗ РОСЛИННОЇ СИРОВИНИ
Мікроскопічний аналіз є основним методом визначення ідентичності подрібненої (різаної, порошкованої, різано-пресованої) ЛРС.
Техніка виготовлення мікроскопічних препаратів різна і залежить від морфологічної групи досліджуваного об'єкта, а також від стану сировини: ціла, подрібнена, різана, порошкована.
Під час вивчення цілих, не подрібнених об'єктів готують різні препарати залежно від морфологічної групи сировини, що досліджують. Ніжні органи, що легко просвітлюються, такі, як листки, квітки, не здерев’янілі стебла та ін., розглядають, як правило, з поверхні. З коренів, кореневищ, кори, насіння, грубих, шкірястих листків тощо готують поперечні й повздовжні зрізи або препарати зіскоблювання, грубого порошку; також використовують препарати ізольованих тканин після мацерації.
Уся мікроскопічна техніка необхідна для отримання різних структур, які добре розрізнюються під мікроскопом. Цьому сприяє забарвлення препаратів, просякання їх тими або іншими рідинами тощо.
Включаючі і просвітлювальні рідини. Для виготовлення мікропрепарату використовують включаючі (індиферентні) та просвітлюючі (неіндиферентні) рідини. Включаючі рідини не реагують з досліджуваним об'єктом і є лише середовищем, у якому його розглядають. До включаючих рідин належать вода, гліцерин. Порівняно з іншими рідинами вода найменше видозмінює препарат: форма й величина клітин, структура і забарвлення тканин не змінюються, добре видно кристали оксалату кальцію і крохмальні зерна, алейронові зерна розпадаються, а жирні олії з'єднуються у великі краплі, слиз розчиняється; тканини залишаються темними і нечіткими для розпізнавання. Гліцерин зазвичай використовують після розведення водою у співвідношенні 1:2, додаючи шматочок камфори або кристалик карболової кислоти. Нерозведений гліцерин має властивість поглинати з тканин воду, зморщувати їх та деформувати. У розчині гліцерину тканини довго не висихають. Крім того, гліцерин має слабкі просвітлювальні властивості.
До неіндиферентних рідин належать розчини калію або натрію гідроксиду, фенолу, перекису водню. Гідроксиди калію або натрію використовують у вигляді 3-5 %, рідше — 10 % водного розчину. Концентрація розчину і тривалість його дії залежать від властивостей об'єкта. У разі тривалої дії цих розчинів крохмальні зерна набухають і перетворюються на клейстер; жири обмилюються, білки розчиняються, а тканини, забарвлені в темний колір, просвітлюються. Недоліком основ є те, що під їх дією клітини сильно розбухають і легко руйнуються під час натискування. Фенол швидко проникає в тканини, внаслідок цього повітря з об'єкта витісняється, крохмальні зерна розбухають і розпливаються; краплі жирних та ефірних олій спочатку збільшуються, а потім поступово розчиняються; білкові речовини, хлорофіл та інші включення руйнуються; забарвлені тканини світлішають; кристали не змінюються, але їх погано видно. З % розчин перекису водню використовують як просвітлювальну рідину. Можна використовувати й вищі концентрації для мацерації препарату, тобто для ізоляції різних елементів (провідних, механічних тканин та ін.).
Перед вивченням під мікроскопом ЛРС спочатку розм'якшують різними способами.
Холодне розм'якшування. Грубі частини рослини — кора, плоди, насіння, підземні органи, шкірясті листки — заливають сумішшю гліцерину з 96° спиртом (1 : 1) і витримують до повного просякнення тканин рідиною. Така підготовка об'єкта відбувається дуже повільно (від кількох днів до кількох тижнів і залежить від товщини об'єкта та особливостей його будови), але вона достатньо ефективна, оскільки тканини повністю звільняються від повітря й частково просвітлюються.
Квіти й не шкірясті листки можна помістити в суміш води й гліцерину (2:1) або води, гліцерину й спирту 96° (1 : 1 : 1), або тільки у воду на 1-5 діб. Після розмочування об'єкти кладуть у спирт 96° з невеликою кількістю гліцерину для ущільнення тканин.
Розм'якшування матеріалу можна проводити у вологій камері. Наприклад, в ексикатор наливають воду і вміщують туди сировину таким чином, щоб вона безпосередньо не стикалася з водою, а зволожувалась і розм'якшувалася за рахунок парів атмосфери камери. Для того щоб сировина не пліснявіла, у воду додають невелику кількість карболової кислоти.
Гаряче розм'якшування. Невеликі шматочки сировини кип'ятять у воді (кору протягом 3-5 хв, підземні органи — 20-30 хв). Плоди і насіння розм'якшують розпарюванням. Для цього сировину кладуть у марлю, зав'язують і підвішують таким чином, щоб сировина знаходилась у парах і не занурювалась у воду. Розпарювання триває 15-30 хв. Тривалість розпарювання залежить від твердості об'єкта.
Для розм'якшування й просвітлювання квітів і трави шматочки матеріалу кип'ятять у 3-5 % розчині натрію або калію гідроксиду протягом 2-5 хв, залежно від товщини й щільності об'єкта (сильне розм'якшування не допускається). Після кип'ятіння сировину кілька раз промивають водою (2-3 рази), щоразу зливаючи її. Оброблений у такий спосіб матеріал переливають у чашку Петрі або випаровувальну чашку, залишають у воді і використовують для виготовлення мікропрепарату.
Способи мацерації та ізолювання тканин. Об'єкти кип'ятять у 3-5 % розчині натрію гідроксиду протягом 30 хв, а потім тканини роз'єднують препарувальною голкою.
Для виготовлення мікропрепарату необхідно використовувати предметне і покривне скельця, які повинні бути чистими й сухими. Підготовлений препарат за допомогою препарувальної голки розміщують на предметному склі в краплі реактиву і накривають покривним склом. У разі неакуратного накладання покривного скла в препараті можуть утворюватися бульбашки повітря, які під час мікроскопії мають вигляд темної плями. Тому скло необхідно встановлювати похило: спочатку його прикладають одним боком до краплі реактиву, а потім, притримуючи голкою, щільно прикладають до предметного скла. Якщо бульбашки повітря все-таки утворились, то їх можна видалити легким постукуванням тупим кінцем голки по покривному склу або підігріваючи препарат над полум'ям спиртівки (нагрівати препарат можна тільки тоді, коли він не містить речовин, що змінюються в разі підвищення температури). Якщо рідини, яку використовували для виготовлення мікропрепарату, забагато, то її видаляють за допомогою смужки фільтрувального паперу. Фільтрувальний папір прикладають збоку від покривного скла. Якщо рідина не заповнює всього простору між предметним і покривним скельцями, то її додають збоку невеликими краплями поряд із покривним склом, під яке вона швидко затікає.
ГТ1 • • •
Іехніка виготовлення тимчасових мікропрепаратів
1) З листя, трав, квітів
Під час дослідження цілої сировини беруть шматочки пластинки листка з краєм і жилкою; з трав беруть листок, іноді шматочок стебла і квітку; у квіток — чашечку та віночок. Під час досліджування різаної сировини беруть кілька різних шматочків.
Просвітлюють сировину таким способом: декілька шматочків сировини вміщують у колбу або пробірку і кип'ятять протягом 1-2 хв у 5 % розчині натрію гідроксиду, попередньо розведеному у співвідношенні 1:1. Потім рідину обережно виливають у чашку Петрі або випаровувальну чашку. З води шматочки сировини виймають скальпелем (або лопаткою), препарувальною голкою і вміщують на предметне скло в краплю розчину гліцерину.
Просвітлений шматочок сировини ділять за допомогою скальпеля або препарувальної голки на дві частини. Одну з них обережно перевертають для того, щоб можна було вивчати препарат зверху й знизу. Препарат накривають покривним склом, злегка підігрівають до повного видалення бульбашок повітря і після охолодження розглядають під мікроскопом, спочатку при малому, а потім при великому збільшенні. У разі приготування препаратів з товстих листків їх попередньо розчавлюють скальпелем.
Під час дослідження стебла його шматочки кип'ятять у 5 % розчині натрію гідроксиду, ретельно промивають водою, знімають епідерміс скальпелем або препарувальними голками і розглядають його поверхню; з інших тканин готують препарат, розчавлюючи об'єкт скальпелем на предметному склі в розчині гліцерину.
Для отримання поперечних зрізів листків і стебел матеріал попередньо розмочують у воді, потім вміщують у суміш вода— гліцерин—вода (1:1:1) на кілька днів. Підготовлений таким чином матеріал розмішують між двома шматочками серцевини бузини і готують поперечні зрізи за допомогою небезпечної бритви або леза безпечної бритви і вміщують у краплю розчину гліцерину на предметне скло. Препарат накривають покривним склом, злегка підігрівають для видалення бульбашок повітря і після охолодження розглядають під мікроскопом.
Основні діагностичні ознаки листків:
— епідерміс, що характеризується відповідною формою клітин (з прямими або звивистими бічними стінками; з тонкими або стовщеними оболонками тощо);
— наявність, характер та товщина шару кутикули;
— форма продихів (рис. 12), їх розміщення (з однієї або з обох боків листка), характер оточення їх клітинами епідермісу;
— наявність водяних продихів;
Рис. 12. Основні типи продихових комплексів
А — двосім'дольнірослини: 1 — аномоцитний; 2 — анізоцитний; 3 — парацитний; 4 — діацитний. Б — односім'ядольні рослини: 1 — аперигенний; 2 — біперигенний; 3 — тетраперигенний; 4 — гексаперигенний
- волоски (рис. 13) є одним із характерних діагностичних елементів листків, завдяки їх різноманітній формі (одноклітинні, багатоклітинні, головчасті, пучкові, гіллясті, ретортоподібні та ін.);
Рис. 13. Різні види трихом
А — волоски: 1 — простий багатоклітинний; 2 — простий одноклітинний; 3 — головчастий з одноклітинною голівкою; 4 — головчастий з двоклітинною голівкою; 5 — головчастий з багатоклітинною голівкою; 6 — одноклітинний багатокінцевий (трикінцевий); 7 — пучковий; 8 — Т-подібний; 9 — зірчастий.
Б — ефірно-олійні залозки: 1 — круглі з радіальним розміщенням видільних клітин (тип ясноткові); 2 — овальні з ярусним розміщенням видільних клітин (тип айстрові); а — вид зверху; б — вид збоку
—ефірноолійні залозки, вмістища з ефірною олією, молочні судини є характерними ознаками для кожного виду рослин, а іноді й усієї родини (наприклад, будова ефірноолійних залозок родини айстрових і ясноткових )рис. 12);
— кристали оксалату або карбонату кальцію, друзи, рафіди, призматичні кристали, цистоліти та ін. (рис. 14).
Рис. 14. Різні форми кристалів кальцію оксалату
1 — поодинокі кристали; 2 — кристалоносна обкладка жилок; 3 — кристалоносна обкладка волокон; 4 — друзи; 5 — рафіди; 6 — клітини з кристалічним піском
Основні діагностичні ознаки квітів:
— будова епідермісу внутрішньої і зовнішньої сторін пелюсток, віночка та чашолистків;
— характер розміщення і будова волосків, залозок, кристалічних включень;
— форма і розміри пилкових зерен.
Основні діагностичні ознаки стебла трав:
— провідні пучки, їх будова;
— будова судин;
— розміщення механічних тканин.
2) З плодів і насіння
Під час дослідження цілої сировини готують препарати шкірочки насіння та оплодня з поверхні або поперечні зрізи.
Для виготовлення препаратів шкірочки та оплодня з поверхні 2-3 насінин або плоду їх кип'ятять у пробірці в розчині 5 % натрію гідроксиду протягом 2-3 хв і ретельно промивають водою. Об'єкт розміщують на предметному склі, за допомогою препарувальних голок відділяють шкірочку насінини або тканини оплодня і розглядають їх у розчині гліцерину.
Для виготовлення поперечних зрізів сировину попередньо розм'якшують у вологій камері або способом розпарювання. Будову плоду або насінини вивчають на зрізах, які роблять через увесь плід. Зрізи повинні бути тоненькими, їх роблять від верхівки або основи плоду, причому перші зрізи не використовють. Для вивчення потрібно брати зрізи з середньої частини матеріалу, в якій всі елементи представлені найповніше.
Дуже дрібні плоди й насіння зазвичай запаюють у парафіновий блок розміром 1x1x1,5 см. Кінчиком нагрітої препарувальної голки парафін розплавлюють і в ямку, що утворилася, швидко занурюють об'єкт. Для отримання поперечного зрізу об'єкт у парафіні слід розміщувати вертикально, а для отримання поздовжніх зрізів — горизонтально. Поверхня об'єкта повинна бути сухою. Після застигання парафіну готують зрізи. Зрізи об'єкта роблять разом з парафіном. Потім їх вибирають із парафіну препарувальною голкою, змоченою гліцерином, і готують препарат у розчині гліцерину. Окрім парафінових блоків можна використовувати серцевину бузини або бархатний корок. Плід кладуть між двома шматочками серцевини бузини або корка і роблять зріз.
Основні діагностичні ознаки плодів і насіння:
— будова оплодня (механічна тканина, ефірно-олійні канальці, волоски на епідермісі);
— хімічна природа запасних речовин (жирна олія, слиз тощо).
3) З кори
Під час дослідження цілої сировини готують поперечні або поздовжні зрізи. Шматочки кори розміром 2-3х0,5-1 см розм'якшують холодним або гарячим способом. Для виготовлення зрізів розм'якшені шматочки розрівнюють скальпелем так, щоб вони мали чіткий поперечний або поздовжній розріз. Роблять тоненькі зрізи і готують препарати у відповідних реактивах для виявлення різних структур або речовин (здерев'янілі елементи, крохмаль, дубильні речовини, похідні антрацену тощо).
Основні діагностичні ознаки кори:
— товщина і характер будови корка (іноді діагностичне значення має колір корка — кора крушини);
— механічні елементи — луб'яні волокна і кам'янисті клітини, їх будова, розміщення, кількість;
— кристали кальцію оксалату (вони можуть міститися в окремих клітинах, а також утворювати кристалоносну обкладку);
— наявність крохмалю, ефірних олій та інших діючих речовин, що визначають мікрохімічними реакціями.
Анатомія вегетативних органів
✵ Корені і коренеплоди
✵ Стебла і кореневища
Рисунок 15 - Корінь первинної будови (зона всмоктування)
Рисунок 16 - Корінь вторинної будови трав’янистої дводольної рослини непучкового типу (зона проведення)
Рисунок 17 - Корінь вторинної будови трав’янистої дводольної рослини пучкового типу (зона проведення)
Рисунок 18 - Корінь деревинної покритонасінної рослини непучкового типу -ясеня високого Fraxinus excelsior L.
Рисунок 19 - Коренеплоди
Рисунок 20 - Стебла однодольних рослин
Рисунок 21 - Стебло трав’янистої дводольної рослини пучкового типу -Cucurbita pepo L.
Рисунок 22 - Стебло трав’янистої дводольної рослини пучкового типу -Trifolium pretense L.
Рисунок 23 - Стебло трав’янистої дводольної рослини перехідного типу Helianthus annuus L.
Рисунок 24 - Кореневище дводольної рослини Convallaria majalis L.
Рисунок 25 - Кореневище дводольної рослини перехідного типу - Tussilago farfara L.
Рисунок 26 - Стебло голонасінної рослини - Pinus silvestris L.
Рисунок 27 - Стебла дерев’янистих покритонасінних рослин: А - Betula verrucosa Ehrn.; Б - Tilia cordata Mill.
Рис. 15. Корінь первинної будови (зона всмоктування)
А. однодольної рослини Iris germanica L.
Б. дводольної рослини Ranunculus acris L.: 1. - епіблема, 2 - екзодерма, 3 -мезодерма, 4 - ендодерма( а - клітини з U-подібно потовщеними оболонками, б - пропускна клітина, в - з поясками Каспарі), 5 - перицикл, 6 - радіальний пучок(г - флоема, д - ксилема, е - склеренхіма)
Рис. 16. Корінь вторинної будови трав’янистої дводольної рослини непучкового типу (зона проведення)
А. при малому збільшенні, Б. при великому збільшенні: 1 - перидерма, 2 - корова паренхіма, 3 - вторинна флоема, 4 - камбій, 5 - вторинна ксилема, 6 -серцевинний промінь, 7 - первинна ксилема.
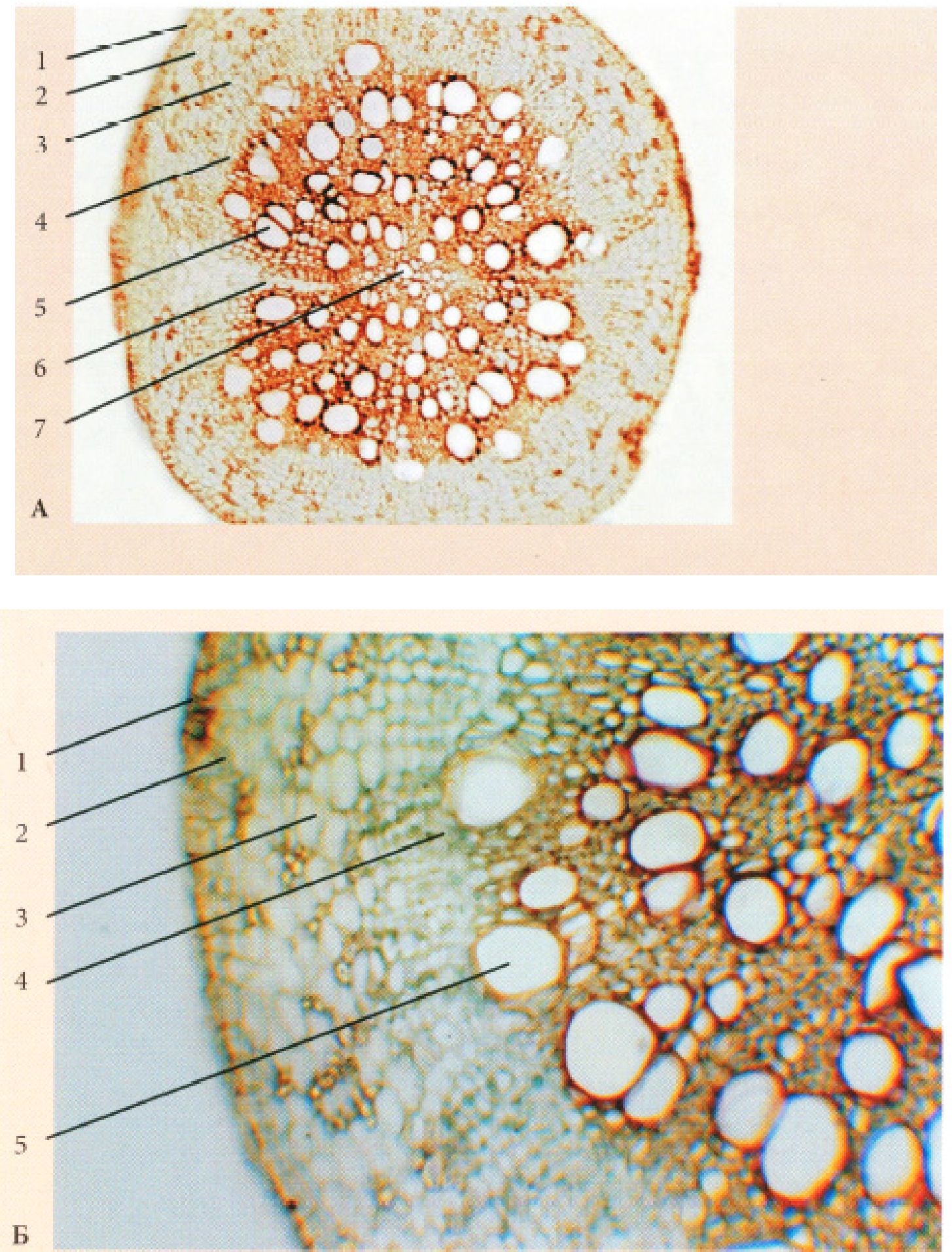
Рис. 17. Корінь вторинної будови трав’янистої дводольної рослини пучкового типу (зона проведення) - Cucurbita pepo L.
А. - при малому збільшенні; Б. - при великому збільшенні: 1 - перидерма, 2 -корова паренхіма, 3 - відкритий колатеральний пучок (а - вторинна флоема, б - камбій, в - вторинна ксилема), 4 - серцевинний промінь, 5 - первинна ксилема.
Рис. 18. Корінь деревинної покритонасінної рослини непучкового типу - ясеня високого Fraxinus excelsior L.
1 - перидерма,2 - корова паренхіма, 3 - вторинна флоема (луб) (а -склеренхімні волокна (товстостінний луб), б - ситовидні трубки з клітинами супутницями, лубна паренхіма (тонкостінний луб)), 4 - камбій, 5 - вторинна ксилема (деревина)(в - весняна, г - осіння (в, г - річне кільце)), 6 - серцевинний промінь, 7 - первинна ксилема.
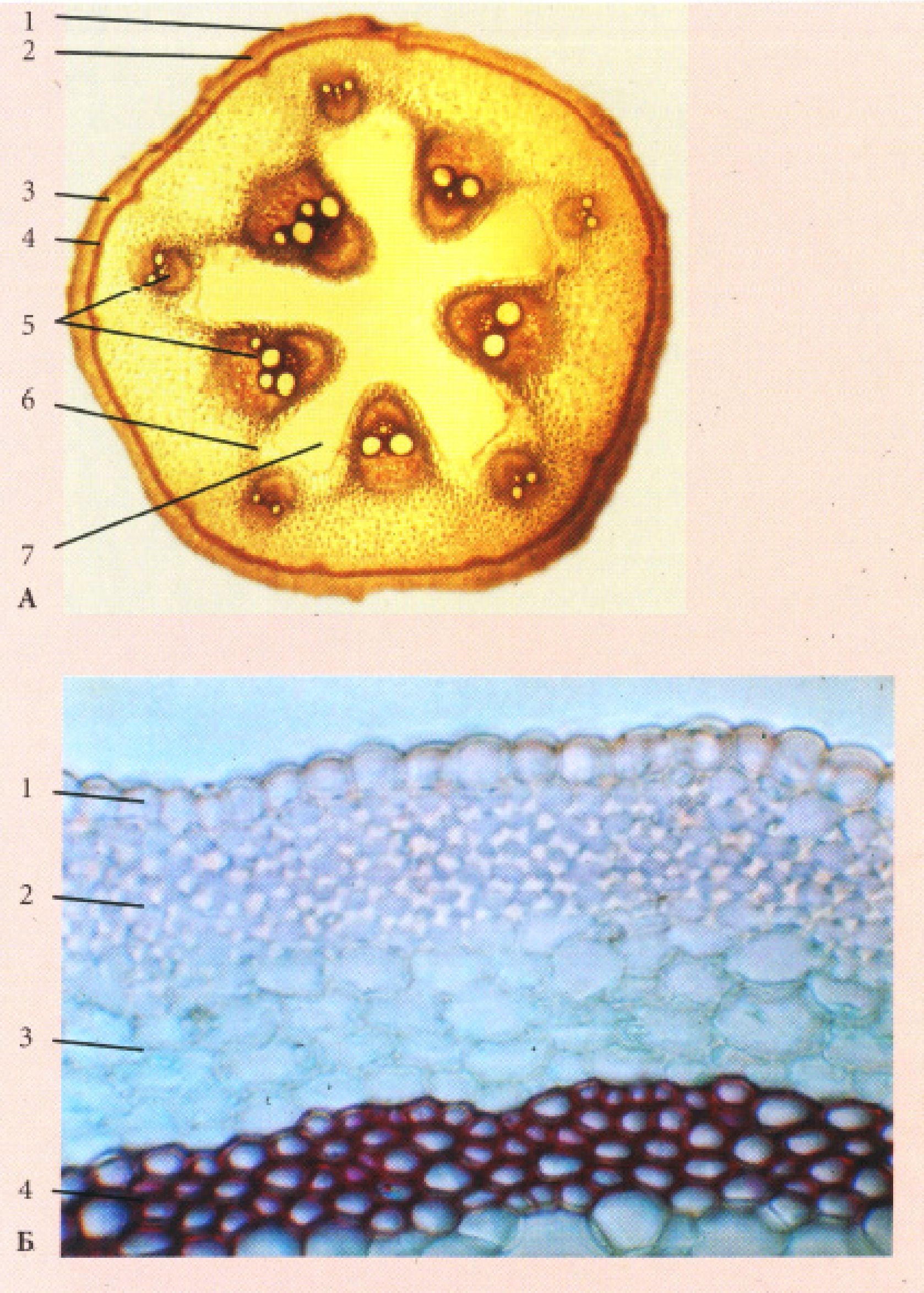
Рис. 19. Коренеплоди
А - Petroselinum sativum Hoffn. (тип моркви); Б - Raphanus sativus L. (тип редису); В - Beta vulgaris (тип буряка): 1 - перидерма, 2 - запасаюча паренхіма кори, 3 - вторинна флоема, 4 - схизогенний ефіроолійний каналець, 5 - камбій, 6 - вторинна ксилема, 7 - додаткові кільця камбію, 8 - відкриті колатеральні пучки, 9 - запасаюча паренхіма серцевинного променя, 10 - первинна ксилема.
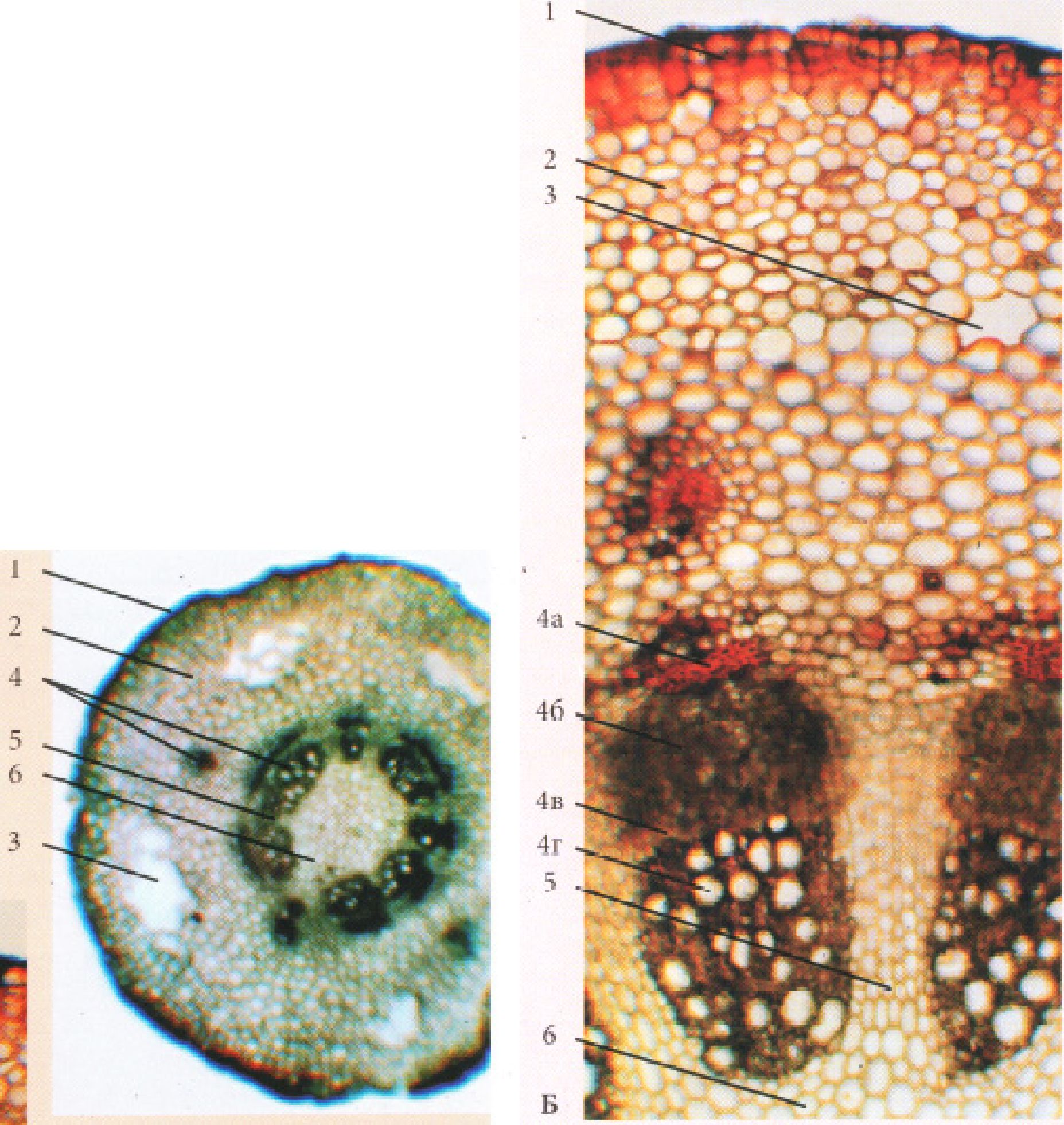
Рис. 20. Стебла однодольних рослин:
А - Secale cerale L.: 1 - при малому збільшенні, 2 - при великому збільшенні (фрагмент); Б - Zea mays; В - Polygonatum multiflorum L.: 1 - епідерма, 2 -хлоренхіма, або корова паренхіма, 3 - перициклічна склеренхіма, 4 - закритий колатеральний пучок (а - флоема, б - ксилема, в - обкладова склеренхіма), 5 -основна паренхіма осьового циліндра, 6 - порожнина соломини.
Рис. 21. Стебло трав’янистої дводольної рослини пучкового типу -
Cucurbita pepo L.:
А - при малому збільшенні; Б - при великому збільшенні (фрагмент): 1 -епідерма,2 - кутова коленхіма, 3 - корова (хлорофілоносна) паренхіма, 4 -перициклічна склеренхіма, 5 - біколатеральний пучок, 6 - серцевинний промінь, 7 - серцевина з порожниною.
Рис. 22. Стебло трав’янистої дводольної рослини пучкового типу - Trifolium pretense L.
1 - епідерма, 2 - корова паренхіма, 3 -відкритий колатеральний пучок, 4 -серцевинний промінь, 5 - серцевина.
Рис. 23. Стебло трав’янистої дводольної рослини перехідного типу
Helianthus annuus L.:
А. - при малому збільшенні, Б - при великому збільшенні: 1 - епідерма з волосками, 2 - коленхіма, 3 - корова паренхіма, 4 - схизогенний каналець, 5 -ендодерма, 6 - відкритий колатеральний пучок(а - склеренхіма, б - флоема, в -камбій, г - ксилема), 7 - додатковий пучок, 8 - серцевинний промінь, 9 -серцевина.
Рис. 24. Кореневище дводольної рослини СопуаІІапа та^ІіБ Ь.:
А - при малому збільшенні, Б - при великому збільшенні: 1 - епідерма, 2 -запасаюча паренхіма кори, 3 - ендодерма з и - подібними потовщеннями, 4 -закритий колатеральний пучок, 5 - концентричний центрофлоемний пучок (а -флоема, б - ксилема), 6 - запасаюча паренхіма осьового циліндра
Рис. 25. Кореневище дводольної рослини перехідного типу - Тшбі^о
Гагїага Ь.:
А - при малому збільшенні, Б - при великому збільшенні: 1 - перидерма, 2 -запасаюча паренхіма первинної кори, 3 - порожнина, 4 - провідний пучок(а -склеренхіма, б - флоема, в - камбій, г - ксилема), 5 - серцевинний промінь, 6 -запасаюча паренхіма серцевини.
Рис. 26. Стебло голонасінної рослини - Ріпш бііуєбіхів Ь.:
1 - перидерма, 2 - корова паренхіма, 3 - смоляний хід, 4 - вторинна флоема (луб), 5 - камбій, 6 - вторинна ксилема (деревина) (а - весняні трахеїди, б -осінні трахеїди (а,б - річне кільце)), 7 - серцевинний промінь, 8 - первинна ксилема, 9 - серцевина
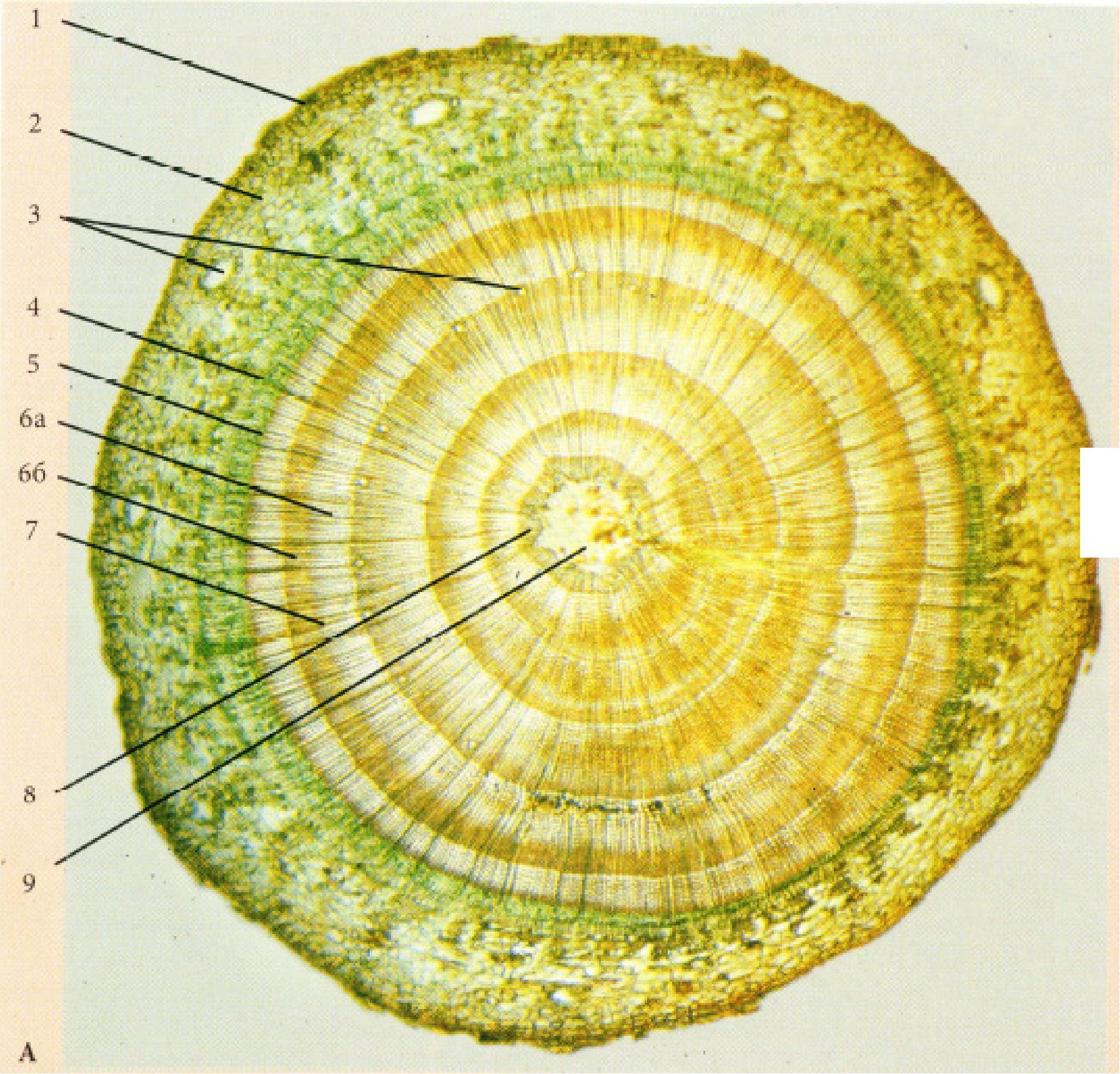
Рис. 27. Стебла дерев’янистих покритонасінних рослин:
А - Betula verrucosa Ehrn.; Б - Tilia cordata Mill.: 1 - при малому збільшенні, 2 -при великому збільшенні: 1 - перидерма, 2 - коленхіма, 3 - корова паренхіма з друзами, 4 - паренхіма верхівки серцевинного променя, 5 - вторинна флоема (луб) (а - луб ’яні волокна, б - склереїди (товстостінний луб), в - ситовидні трубки з клітинами супутницями і луб ’яна паренхіма (тонкостінний луб)), 6 -камбій, 7 - вторинна ксилема (деревина) (г - весняні елементи, д - осінні елементи (г,д - річне кільце)), 8 - серцевинний промінь, 9 - первинна ксилема, 10 - серцевина.
Додаток 8
і-о • • • •••
Іістохімічні реакції
Виявлення клітковини (целюлози).
Для виявлення клітковини найчастіше використовують дві класичні реакції : з реактивом хлор-цинк-йод і з йодом в калію йодиді з сірчаною кислотою. Реакція з реактивом хлор-цинк-йод (за Новопокровським).
Хлор-цинк-йод готується шляхом змішування двох розчинів: I- 20,0 сухого цинку хлориду розчиняють в 8,5 мл дистильованої води при нагріванні і розчин охолоджують; II- 1,5 кристалічного йоду і 3,0 калію йодиду розчиняють у 60 мл холодної дистильованої води. При постійному збовтуванні розчин II (приблизно 1,5 мл) краплями додають до розчину I до насичення, тобто до появлення осаду. Суміш відстоюють, прозору частину зливають і зберігають у посуді із темного скла з притертою пробкою. Зріз поміщають в краплю води, обсушують фільтрувальним папером, додають до нього реактив і накривають покривним склом. Хлор - цинк - йод забарвлює клітковину в синій, фіолетовий чи синє-фіолетовий колір, а здерев’янілі оболонки - в жовто-коричневі відтінки. Забарвлення маскується присутністю в клітинній оболонці лігніну, жироподібних речовин, пігментів і т. д .
Реакція з розчином йодом в калію йодиді з сірчаною кислотою (метод
Іогансена).
Зрізи після попереднього поміщення в дистильовану воду і обсушування фільтрувальним папером поміщають в краплю 1% розчину йоду в калію йодиді (2,0 калію йодиду, 0,2 кристалічного йоду, 100 мл дистильованої води), накривають покривним склом і витримують приблизно 10 хвилин в темному місці. Потім під покривне скло вводять краплю 65% сірчаної кислоти (або суміш з двох частин сірчаної кислоти концентрованої і 1 частини води). Після змішування розчинів відразу проводиться спостереження під мікроскопом. Целюлозна оболонка забарвлюється в синій (до фіолетового) кольору. На якість забарвлення можуть вплинути інші компоненти оболонки. Здерев’яніла оболонка забарвлюється в оранжево-жовті відтінки. Ця реакція потребує підвищеної стійкості, так як випаровування сірчаної кислоти призводить до погіршення оптичних властивостей лінз об’єктива.
Виявлення здерев’янілої оболонки(лігнінів).
До найбільш характерних реакцій на лігнін відносяться флюроглюцинова і перманганатна, часто проводяться реакції з аніліном сірчанокислим, з сафранілом.
Флороглюцинова реакція.
Зріз поміщають в краплю дистильованої води, висушують фільтрувальним папером і витримують протягом 3-4 хвилин в 2-3 краплях 1-5% спиртового розчину флороглюцину, потім додають 3-4 краплі 25% сірчаної кислоти і накривають покривним склом. Зріз можливо також обробити 0,5% розчином
флороглюцином в суміші спирту з дистильованою водою (1:1) і через 1-2 хвилини діють 20% сірчаною кислотою. В залежності від товщини зрізу і ступеню здерев’яніння оболонки, які містять лігнін набувають вишневого, червоно-фіолетового забарвлення чи інші відтінки червоного кольору. Забарвлення нестійке і через 5-7 хвилин зникає, особливо в присутності води і при нагріванні.
Перманганатна реакція.
На зрізи наносять 2-3 краплі 1% розчину перманганату калію і після побуріння промивають 10% кислотою хлористоводневою до повного знебарвлення тканин. Потім зрізи промивають дистильованою водою, залишки якої видаляють фільтрувальним папером, поміщають в концентрований розчин аміаку, накривають покривним склом і спостерігають результат реакції під мікроскопом. Оболонки, що містять лігнін забарвлюються на нетривалий час в томатно-червоні відтінки.
Реакція з аніліном сірчанокислим.
В краплі суміші, яка складається з 2,0 аніліну сульфату, 4 мл кислоти оцтової і 194 мл 50% етилового спирту або 1,0 аніліну сульфату, 70 мл дистильованої води, 30 мл 96% етилового спирту, 3 мл кислоти сірчаної концентрованої, здерев’янілі оболонки набувають колір від жовтуватого до лимонно-жовтого і канаркового кольору.
Реакція з сафраніном.
Зрізи об’єкту поміщають на 30-60 хвилин в 0,5 - 1,0 % розчин барвника
сафраніну в 50% етиловому спирті. Після цього зрізи промивають водою, переносять 96% етиловий спирт для відмивання зайвої фарби і промивають підкисленим етиловим спиртом ( до 100 мл 96% етилового спирту додають 2 краплі хлористоводневої концентрованої кислоти ) до видалення забарвлення із нездерев’янілих тканин. Потім зрізи переносять в гліцерин. В залежності від ступеню здерев’яніння спостерігається забарвлення оболонок від рожевого до малиново - червоного.
Виявлення крохмалю.
Крохмаль рекомендується спостерігати у воді чи сильно розбавленому гліцерині.
Класичною є йодна реакція - з розчином Люголя. Для його приготування 2,0 калію йодиду розчиняють при нагріванні в 5 мл дистильованої води, добавляють 1,0 кристалічного йоду, об’єм розчину доводять водою до 300 мл. Зберігати реактиви необхідно у посудині із темного скла. Під дією розчину Люголя крохмальні зерна можуть зафарбовуватись в колір від блакитного, слабо - фіолетового до інтенсивного синього, майже чорного. Крохмальні зерна деяких злаків під дією йодовмісних реактивів забарвлюються в червонуватий колір з відтінками від коричневого до фіолетового, крохмальний клейстер - в червонувато - фіолетовий колір.
Виявлення запасаючих білків ( алейронові зерна).
Найпростіша і доступна реакція на алейронові зерна - реакція з розчином Люголя. Під його дією вони зафарбовуються в жовтий колір. У багатих жирними маслами об’єктах для найкращого виявлення реакції зрізи рекомендуються спостерігати не у воді, а в концентрованому цукровому сиропі чи безводному гліцерині.
Виявлення слизу.
Слиз легко розчиняється у воді і вимивається у зрізі. Спирт, концентровані розчини цукрів і гліцерин перешкоджають його набуханню. Якщо зріз помістити в етиловий спирт і накрити покривним склом, після того під скло додати воду, а з протилежної сторони фільтрувальним папером відсмоктувати спирт, то буде спостерігатись набухання слизу. Слиз, який міститься у клітині у краплі свіжовиготовленого розчину чорної туші (1 : 10 ) має вид різко виділених на темно - сірому фоні скловидних незафарбованих грудочок, які по мірі розчинення у воді поступово набухають та розтікаються, або на препараті помітні потовщені слизові оболонки. На зрізах, поміщених на 5-10 хвилин у насичений розчин міді сульфату, промитих водою та перенесених у 50% розчин калію гідроксиду, в залежності від хімічного складу слиз забарвлюється у голубий ( родина Мальвових) колір. Пектиновий слиз після попередньої обробки у 10% водному розчині свинцю оцтовокислого забарвлюється йодом у жовтий колір. Клітчатковий слиз слабо забарвлюється йодом у голубий колір, а під дією розчину конго червоного у лужному середовищі яскраво забарвлюється у червоний колір. Спиртовий розчин метиленового синього (1:5000) забарвлює слиз у більш інтенсивний колір, ніж інші клітини.
Виявлення жирних та ефірних олій, смол, восків, кутинізованих та
скорковілих оболонок.
Для виявлення спільних ліпідів, в тому числи і жирів, частіше використовують реакцію з розчином жиророзчинного барвника - Судан ІІІ . Для його приготування 0,1 барвника розчиняють у 20мл 96% етиловому спирті або 0,01 барвника у 10мл суміші рівних об’ємів 96% етилового спирту та гліцерину. Розчин поміщають у посуд із темного скла та через тиждень фільтрують. Зрізи на 10 хвилин поміщають у розчин барвника, після забарвлення заключають у гліцерин. Жири, олії, віск та вільні жирні кислоти під дією Судану ІІІ забарвлюються у рожевий, помаранчевий та помаранчево-червоний колір. Судан чорний забарвлює жири у темно-синій колір. Для можливості відрізнити жири від ефірних олій зрізи поміщають у краплю суміші, яка складається з 50% водного розчину калію гідроксиду та концентрованого розчину аміаку (1:1), накривають покривним склом, герметизують його краї герметиком. Через декілька днів по периферії крапель жирної олії виділяються голковидні кристали мила, добре помітні у поляризаційному мікроскопі. На відміну від жирних олій, ефірні олії добре розчиняються в ефірі, хлороформі, етиловому спирті, концентрованій оцтовій кислоті, хлоралгідраті та т.д. У концентрованій сірчаній кислоті вони розчиняються з появою жовтого або коричневого забарвлення. При підігріванні препаратів, в яких рідиною являється вода, і у подальшому слабкому кип’ятінні протягом декількох хвилин ефірні олії вивітрюються, а жирні - зберігаються.
Для виявлення смол використовують реакцію по Цалевському. Зрізи поміщають в краплю насиченого водного розчину оксалату міді і підігрівають на водяному огрівнику до 100°С, при цьому розплавлена смола забарвлюється в смарагдово-зелений колір. Під дією насиченого розчину Судану ІІІ у 50% спирті протягом 10-15 хвилин смоли у зрізах, підкислених азотною кислотою, забарвлюються в рожевий колір.
Віск добре розчинний в ефірі. Якщо на предметне скло помістити зріз досліджуваної епідерми, накрити покривним склом, дати ефіру вивітритися, то на склі залишаться різноманітні по формі кристали воску. Віск не розчиняється у холодній воді, але при кип’ятінні розплавляється та збирається у вигляді крапель.
Скорковілі та кутинізованні оболонки, так як і жири, забарвлюються Суданом ІІІ. Під дією реактиву хлор-цинк-йоду вони забарвлюються у жовтий до коричневого кольору.
Виявлення кристалічних включень.
Кристали оксалату кальцію (друзи, рафіди, поодинокі кристали та ін.) у концентрованих кислотах хлористій та азотній поступово розчиняються без виділення пухирців вуглекислого газу та утворення осаду. У концентрованій сірчаній кислоті кристали розчиняються, але на їхньому місці утворюються кристали гіпсу, в оцтовій кислоті - не розчиняються. Кристали карбонату кальцію (цистоліти) у концентрованих кислотах хлористій та азотній розчиняються з виділенням пухирців вуглекислого газу. Кальцій ортофосфат випадає у вигляді кристалів під дією 2% розчину сірчаної кислоти. При розміщенні зрізів на тривалий час в етиловий спирт випадають безбарвні або блідо-жовті сферокристали. Вони повільно розчиняються в воді та аміаку, добре - в хлористій, сірчаній та азотній кислотах. Оксид кремнію, просочуючий оболонки хвощів і злаків або утворюючий «кремнієві тільця», виявляється у вигляді кремнієвого скелету при спалюванні та прокалюванні рослинного матеріалу на слюді. При додавані до сухого рослинного матеріалу кристалів фенолу і наступному розплавленні на горілці всі тканини стають прозорими, а кремнієвий скелет або кремнієві включення набувають рожево-зеленого блиску.