БОТАНИКА ТОМ 1 - КЛЕТОЧНАЯ БИОЛОГИЯ. АНАТОМИЯ. МОРФОЛОГИЯ - 2007
2. СТРОЕНИЕ И УЛЬТРАСТРУКТУРА КЛЕТКИ
2.2. Растительная клетка
2.2.1. Обзор
На рис. 2.2, 2.6—2.8 показаны типичные растительные клетки, видимые с помощью светового и электронного микроскопа. Здесь одновременно представлены важнейшие структурные компоненты растительных клеток. Прежде всего дадим четкие определения клеточных компонентов, а строение, функции и генезис отдельных органелл детально будут рассмотрены в последующих разделах. Под органеллами мы понимаем внутриклеточные функциональные единицы (от лат organellum — маленький аппарат, поэтому в единственном числе корректнее было бы говорить «органелл»; однако это слово употребляется в женском роде)1.
1 Исходное слово в латыни — среднего рода. При заимствованиях грамматический род может не сохраняться — Примеч. ред.
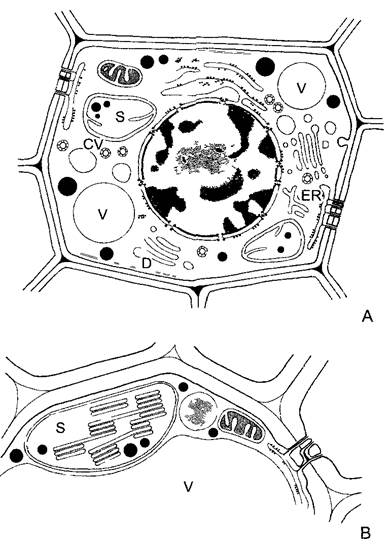
Рис. 2.6. Ультраструктура растительной клетки.
А—зародышевая клетка клеточная стенка со срединной пластинкой и плазмодесмами, в цитоплазме две диктиосомы, гладкий и шероховатый ЭР, рибосомы и полисомы, различные пузырьки (в том числе и coated vesicles) и липидные тельца (олеосомы) Под клеточной мембраной местами микротрубочки, в продольном и поперечном сечении, вакуоли; в расположенном в центре клеточном ядре ядрышко и плотный хроматин; две пропластиды (с пластоглобулами и крахмалом) и митохондрия (с кристами). Органеллы содержат собственную ДНК; неплазматические компоненты показаны белым (см. бокс 2 3) В—фрагмент среза клетки ткани (например, клетки листа) с сильно увеличенной вакуолью Разросшаяся первичная стенка (саккодерма), возле углов клеток межклеточные пространства — межклетники (показаны точками), в цитоплазме рядом с митохондрией, шероховатым ЭР и олеосомами — пероксисома с кристаллом каталазы, а также хлоропласт с тилакоидами, пластоглобулами и крахмальным зерном. CV—везикулы (coated vesicles); D—диктиосомы, ER—эндоплазматический ретикулум (ЭР), S—крахмал, V—вакуоль
Клеточная стенка (англ, cell wall). Окружает тело живой клетки (+ протопласт) как формообразующий внешний скелет (экзоскелет), содержит прочные фибриллы из целлюлозы или хитина, пронизана тонкими каналами (плазмодесмами) — плазматическими соединениями между соседними клетками (греч. désmos — узы, связь).
Клеточная мембрана (плазматическая мембрана, плазмалемма; англ, cell membrane). Биомембрана (от лат. membrana — кожа), окружающая весь протопласт, как и большинство биомембран, обладает избирательной проницаемостью: пропускает воду и незаряженные молекулы, напротив же, ионы и более крупные полярные частицы проходят через мембрану только тогда, когда для них имеются специфические переносчики.
Биомембраны представляют собой вязкую жидкость (толщина 6 — 11 нм). Главный элемент всех биомембран — двойной липидный слой, пронизанным поперек интегральными мембранными белками; периферические мембранные белки прикреплены к поверхности. Биомембраны ограничивают структурные элементы, или компартменты (англ, compartments), окружая их сплошным слоем, — таким образом, у биомембран нет боковых краев. Они отделяют «внутреннее» от «внешнего» биомембрана — это не лист, а «воздушный шар».
Цитоплазма (англ, cytoplasm) — основная масса протопласта, имеющая консистенцию от вязкой до слизистой. В ней расположены различные органеллы; место многих реакций обмена веществ; выпадает при фракционировании клетки как цитозоль («растворимая фракция»).
Цитоскелет (англ, cytoskeleton) — внутренний скелет (эндоскелет), может в отдельных местах укреплять цитоплазму (золь → гель); с другой стороны, обеспечивает с помощью моторных молекул процессы движения внутри клетки (например, ток цитоплазмы, перемещение пузырьков, движение хромосом при ядерном делении); у растений это прежде всего микротрубочки и актиповые микрофиламенты (лат. túbulus — трубочка, filum — нить).
Рибосомы — мелкие (30 нм) плотные частицы в цитоплазме и на мембранах эндоплазматической сети (от греч. soma — тельце, частица), чаще всего объединены в полисомы.Органеллы биосинтеза белка (трансляции).
Эндоплазматическая сеть (эндоплазматический ретикулум — ЭС, ЭР) (от лат. reticulum — сеть) пронизывает цитоплазму в виде разветвленной мембранной системы. Существует в клетке в двух формах: шероховатый ЭР (rER) — на мембранах внешней стороны располагаются полисомы, и гладкий ЭР (sER, от англ, smooth — гладкий), без полисом. Внутренние пространства шероховатого ЭР чаще всего плоские, и мембраны ЭР проходят параллельно через цитоплазму («двойные мембраны»); в этом случае говорят о цистернах. Типичный пример: ядерная оболочка = перинуклеарная цистерна (англ, nuclear envelope).
Диктиосомы (от греч. diktyon — сеть) — мелкие стопки свободных от рибосом цистерн (цистерны Гольджи), которые получают материал от шероховатого ЭР путем притока мелких пузырьков, перерабатывают его в секреты (например, материал клеточной стенки) и через пузырьки Гольджи доставляют к клеточной мембране; там происходит выделение секретов наружу (экзоцитоз)
Диктиосомы являются элементами аппарата Гольджи, названного в честь К. Гольджи, открывшего органеллы биосинтеза белка.
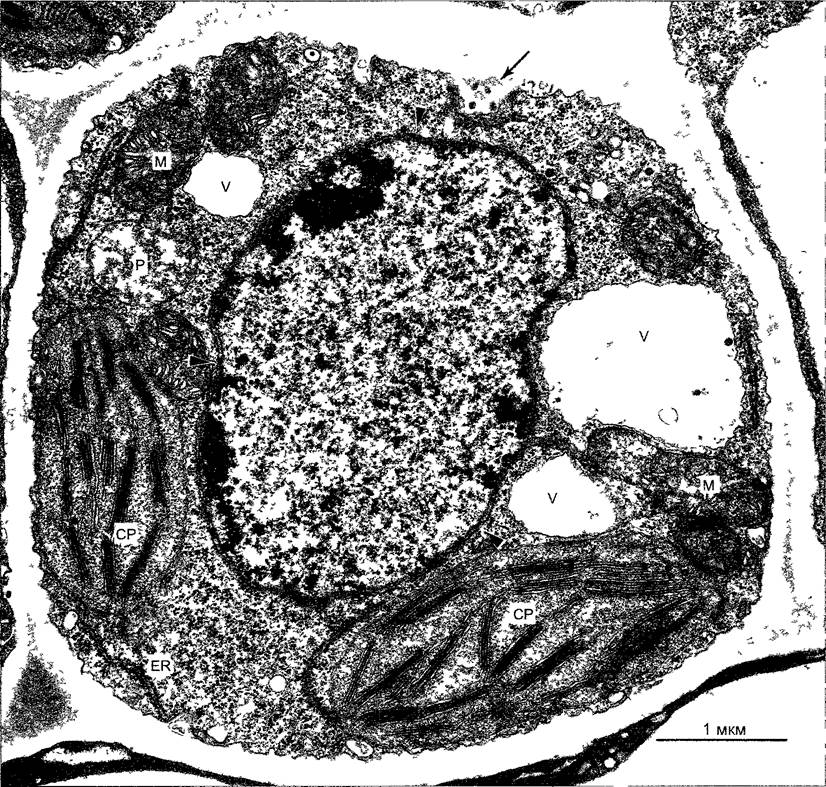
Рис. 2.7. Электронная микрофотография растительной клетки (ультратонкий срез, клетка паренхимы флоэмы фасоли Phaseolus vulgaris) (препарат и электронная микрофотосъемка Н. Falk)
Видны особенности молодой клетки, где идет активный обмен веществ (многочисленные мелкие вакуоли, в цитоплазме много рибосом/полисом), однако, с другой стороны, здесь имеются хлоро- пласты, митохондрии и пероксисомы Ядрышко находится вне плоскости среза, стрелками в виде треугольников показаны ядерные поры Стрелка—плазмодесмы в поперечном сечении По соседству с диктиосомами четыре мембранных пузырька В центре ядра преимущественно рыхлый эухроматин, у ядерной оболочки местами плотный гетерохроматин, СР—хлоропласты, М—митохондрии; Р—пероксисома, остальные обозначения, как на рис 2 6
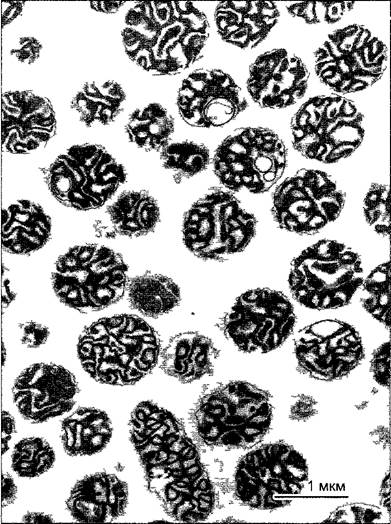
С помощью ультрацентрифуги можно получить однородные фракции внутриклеточных частиц для биохимических или аналитических исследований (рис А). От сохранения клеточных структур при этом конечно приходится отказаться. Более крупные массы однородных клеток с максимальными предосторожностями помещают в соответствующие среды для выделения и измельчают, например, с помощью миксера путем растирания или ультразвуком. Возникающий при этом гомогенат в идеальном случае больше не содержит целых клеток, однако еще могут сохраняться неповрежденные ядра, пластиды, митохондрии и т. д. Отдельные компоненты клеток можно теперь разчичным образом отделить от гомогената.
Рис. 2.8. Электронная микрофотография эмбриональной растительной клетки из апекса вегетативного побега цветной капусты (препарат получен путем замораживания скалывания) (препарат и электронная микрофотосъемка К. A. Platt-Aloia и W. W. Thomson с любезного разрешения J. Electron Мicг Techn John Wiley & Sons N. Y.)
Разлом замороженных клеток происходит местами вдоль мембран, которые проходят примерно параллельно плоскости скалывания такие мембраны оказываются здесь в рассматриваемой плоскости. Здесь, это имеет место в случае оболочки обоих ядер N с многочисленными ядерными порами. Митохондрии М и пропластиды РР частично расколоты частично видны как пластичный рельеф. Также, клеточные мембраны (плазматическая мембрана РМ) и тонопластные мембраны вакуолей местами представлены на поперечном сломе (срезе) в других местах по ним проходит слом Кроме того видны цистерны эндоплазматического ретикулума ER, а также диктиосома D. В клеточной стенке W местами различимы целлюлозные фибриллы (стрелки)

При дифференциальном центрифугировании гомогенат последовательно центрифугируют при разном числе оборотов (100 — 50 000 об/мин при большом числе оборотов ускорение может более чем в 100 000 раз превышать g — ускорение свободного падения на Земле). Фракционирование в этом случае осуществляется в основном по массе или размеру частиц. Сначала при малых оборотах (соответственно примерно 103 g в течение10 мин) из гомогената осаждаются ядра и пластиды Осадок посте сливания супернатанта ресуспедируют и считают более или менее «чистой» фракцией. Супернатант за тем вновь центрифугируют при более высоких оборотах, при этом осаждается следующая фракция — митохондрии (104 g в течение 30 мин) — и т д.
Рис. А. Фракция митохондрий, полученная путем изопикнического центрифугирования гомогената ткани шпината Матрикс митохондрий сморщен (ср рис 2 79), однако внутренняя дифференциация в значительной мере сохраняется Примесь других органелл клетки крайне незначительна (препарат В. Liedvogel, электронная микрофотография Н. Falk)
При центрифугировании в градиенте плотности плотность среды в центрифужных пробирках возрастает сверху вниз вследствие повышающихся концентраций сахарозы, С5СI1 и т. п. В этом случае частицы гомогената разделяются по их плавучей плотности. Каждая частица располагается там независимо от размера и веса в градиентах, где плотность окружающей среды соответствует ее собственной (изопикническое, или равновесное, центрифугирование). Ультрацентр и фуга позволяет не только осуществлять сортировку внутриклеточных частиц, но и получать их характеристику по числу S (S — в честь Т. Сведберга (T. Svedberg), изобретателя ультрацентрифуги). Эти числа указывают дтя определенных частиц скорость осаждения (седиментации) при соответствующем ускорении центрифуги в единицах Сведбергa, 1S = 10-13 с. У сферических частиц число Sпропорционально М2,3 (М — масса частицы). Число S обычно наиболее широко используется для характеристики рибосом и их субъединиц (особенно частиц рибонуклеопротеидов) и белковых комплексов.
1 Хлористый цезий обладает высокой ионной силой, из-за которой нарушаются связи в белковых и нуклеопротеиновых комплексах. Поэтому его используют только для выделения индивидуальных веществ, но не органелл. — Примеч. ред.
Пузырьки, или везикулы (от лат. vesica — пузырь; уменьшительная форма vesícula) — мелкие, округлые элементы клетки; часто служат для накопления запасных веществ внутри клетки; возникают из более крупных элементов клетки путем отшнуровывания; особая форма: пузырьки диаметром только 0,1 мкм, с плотной оболочкой (coated vesicles). Транспорт путем перемещения потока пузырьков трактуется как совокупность процессов мембранных потоков (цитозы; англ, membrane flow).
Вакуоли (от лат. vácuus — пустой) — более крупные округлые компоненты, покрытые мембраной. Во взрослых растительных клетках часто образуется центральная вакуоль, которая часто занимает свыше 90 % объема клетки; содержит клеточный сок, чаще всего имеющий кислую реакцию; он отграничен от цитоплазмы мембраной вакуоли (топопластом; от греч. tonos — напряжение, давление, plástis — создание). Вакуоли часто содержат запасные вещества и вещества, подтежащие выделению, а также пигменты и токсины.
Пероксисомы — относительно крупные, плотные пузырьки (около 1 мкм в диаметре), которые наряду с другими веществами содержат фермент каталазу для разложения клеточного яда — перекиси водорода (Н2О2), возникающего в ходе процессов обмена веществ.
Олеосомы — капельки масла в цитоплазме (лат. oleum — масло); раньше их из-за округлой формы называли сферосомами.
Пластиды (англ, plastids) — во всех зеленых клетках водорослей, мхов и сосудистых растений это содержащие хлорофилл хлоропласты(chloroplasts; греч. chloros — желто-зеленый) — органеллы фотосинтеза. Преобразование энергии света (греч. phos — солнечный свет) в химическую энергию осуществляется на комплексных мембранных системах, которые образованы из содержащих хлорофилл мембранных цистерн (тилакоидов; греч. thylakos — мешок). Здесь возникает наряду с прочим аденозинтрифосфат (АТФ, англ. АТР — энергетическая «разменная монета» клетки; химическая энергия высвобождается за счет отщепления конечных фосфатных остатков и может использоваться для энергоемких реакций: синтезов, движения, активного транспорта на мембранах и т.д.; см. 6.1.5). В клетках тканей растений не зеленого цвета содержатся другие формы пластид, например, в образовательных тканях (меристемах) — мелкие, непигментированные пропластиды. В качестве хромопластов (от греч. chroma — цвет, окраска), окрашенных в цвета от желтого до красного, они служат в цветках и плодах для привлечения животных. Пластиды
всегда окружены оболочкой из двух мембран1 и содержат собственную ДНК (плДНК = ctDNA) и рибосомы, которые отличаются от рибосом цитоплазмы (пластидные рибосомы). Размножение пластид осуществляется путем их деления — подобные возникают из подобных. Все формы пластид способны к образованию зерен крахмала и капелек масла (пластоглобул).
1 В дополнение к двум мембранам хлоропласта, пластиды могут иметь дополнительные мембраны: так, у Оchrophyta (Неterokontophyta) они окружены еще складкой эндоплазматической сети, так что фактически получается оболочка из четырех мембран — Примеч. пер.
Митохондрии (англ, mitochondria; от греч. mitos — нить, chóndros — зерно — из-за нитевидной или же короткоовальной формы), как и пластиды, имеют собственную ДНК (мтДНК - mtDNA) и рибосомы. Митохондрии возникают только из себе подобных путем деления. Окружены двойной мембраной. Это органеллы клеточного дыхания, при котором образуется АТФ. Образование АТФ и этапы клеточного дыхания осуществляются на внутренней мембране, площадь которой увеличена за счет впячиваний (крист, лат. crista — гребень) внутрь тела органеллы.
Клеточное ядро (Nucleus, Karyon; англ, cell nucleus; лат. nucleus; греч. káryon — ядро) — у большинства эуцитов (= эукариотных клеток) это самая крупная плазматическая органелла (около 10% объема клетки); чаще всего клетка имеет одно ядро. Ядро окружено двойной мембраной с характерными ядерными порами (англ, nuclear pores), а внутри него мембраны отсутствуют. Оно содержит большую часть наследственного материала клетки: генетическую информацию, закодированную в виде последовательностей оснований на длинных двойных спиралях ДНК. Молекулы ДНК представляют собой центральные структурные и функциональные элементы хромосом. В хроматине (веществе хромосом), наряду с ДНК в комплексе с основными белками — гистонами, находятся также в разных пропорциях негистонные белки. Ядро содержит одно или несколько ядрышек, где образуются предшественники цитоплазматических рибосом. Размножение ядер происходит путем деления (митоза). В нормальном случае исчезают ядерная оболочка и ядрышки, а хроматин из физиологически активной, деконденсированной «рабочей формы» путем конденсации отдельных хромосом переходит в «транспортную форму». (Для сильно окрашивающихся структур, имеющих форму от палочковидной до нитевидной, которые представляют собой конденсированный хроматин во время митоза, был исходно предложен термин «хромосомы».) Хромосомы благодаря аппарату веретена деления (англ, mitotic spindle: цитоскелетная структура, состоящая прежде всего из микротрубочек) поровну распределяются по дочерним клеткам, в которых затем заново образуются ядерные оболочки и ядрышки и происходит деконденсация хроматина по меньшей мере «эухроматических» компонентов, тогда как гетерохроматин остается конденсированным и неактивным. В эухроматине синтезируется РНК на определенных последовательностях ДНК (транскрипция активных генов). Закономерно следующие друг за другом, повторяющиеся от деления к делению, стадии составляют клеточный цикл (англ, cell cycle). В S-фазе клеточного цикла происходит репликация ДНК и за счет нее удваивается число хромосом.
При процессах дифференцировки клетки изменяются, однако многие органеллы сохраняют свои облики функции. Только пластиды, вакуоли и клеточные стенки в целом изменяются сильнее,
В общем, ультраструктура клетки у высших растений варьирует значительно меньше, чем у водорослей и грибов, которые филогенетически древнее и родство между ними еще меньше, чем у различных по облику мохообразных, папоротникообразных и семенных растений.
2.2.2. Цитоплазма
Термин «протоплазма»1 означает вязкую или студенистую массу, в которой расположены рибосомы и элементы цитоскелета и в которую погружены пластиды и митохондрии, клеточное ядро и часто также скопления запасных веществ (олеосомы, у грибов гранулы гликогена). Она богата ферментами. Общая концентрация белков составляет от 10 до 30 %. В цитоплазме значительная часть воды находится в связанном с белками состоянии. Белки протоплазмы преимущественно глобулярные. За счет активных, т. е использующих АТФ, ионных насосов на граничащих мембранах в цитоплазме поддерживается определенная ионная среда. По сравнению с внешней средой цитоплазма богата К+, бедна Na+ и содержит незначительное количество Са2+; pH составляет немногим более 7, что для ферментов цитоплазмы оптимально
1 Термины «протоплазма» и «цитоплазма» часто употребляются как синонимы. — Примеч. ред.
В протоплазме протекают многие важные реакции и осуществляются обменные процессы (гликолиз, образование запасных липидов, синтез аминокислот и — на рибосомах — биосинтез белка, а кроме того, синтез нуклеотидов и сахарозы, см 6.10 — 6.17). В протоплазме клеток многих растений и грибов образуются вещества, используемые в фармакологии (алкалоиды, гликозиды); они откладываются в вакуолях или клеточных стенках и там накапливаются. У грибов (и животных) в цитоплазме синтезируются жирные кислоты; у растений этот синтез локализован в пластидах.
Протоплазма может существовать в форме золя и геля. Сгущающее действие оказывают элементы цитоскелета. Растворы глобулярных макромолекул (таковыми являются коллоиды из сферических частиц — ферментные белки протоплазмы) даже при высоких концентрациях сохраняют низкую вязкость1. Напротив, вытянутые в длину частицы (линейные коллоиды) уже при низких концентрациях образуют студенистую массу 2. Из-за большой поверхности они склонны к уплотнению. Актиновые нити и микротрубочки образуют явные линейные коллоиды, однако одновременно они являются агрегатами глобулярных белков В живой клетке эти агрегаты могут быстро собираться и разбираться, так что вязкость цитоплазмы может в короткий срок изменяться в соответствии с потребностями. Поскольку растительные и грибные клетки имеют жесткий внешний скелет в виде клеточной стенки, жидкая цитоплазма встречается у них значительно чаще, чем в клетках животных или голых клетках многих жгутиковых и низших грибов. Во всех клетках части цитоплазмы, преимущественно расположенные по периферии, — эктоплазма - кортикальная цитоплазма (лат cortex — кора) — представлены в виде геля, тогда как расположенная в середине клетки эндоплазма часто жидкая. Заметный ток характерен только для эндоплазмы
1 Именно такие коллоидные растворы называют золями — Примеч. ред.
2 Те образуют гели — Причеч. ред.
Интенсивный ток цитоплазмы наблюдается прежде всего в особенно крупных клетках. Он служит для быстрого внутриклеточного транспорта веществ, для которого недостаточно одной диффузии. У имеющих стенку клеток различают ротационный и циркуляционный токи. В случае ротации цитоплазмы эндоплазма, окружающая центральную вакуоль, постоянно однообразно перемещается вокруг нее, просто циркулируя или двигаясь восьмерками. Этот вид тока цитоплазмы наблюдается в чрезвычайно крупных клетках междоузлий водорослей Chara и Nimlla (см рис 5 9), а также в клетках листьев широко известных аквариумных растений Elodea и Vallisneria. В клетках с верхушечным ростом (гифы грибов, корневые волоски, пыльцевые трубки), в клетках волосков (например, в жгучих волосках крапивы) и многих эпидерматьных клетках ток цитоплазмы осуществляется в виде многочисленных, иногда встречных течений, преимущественно также в плазматических тяжах, которые пронизывают центральную вакуоль (см рис 2 59, С) (о физиологии внутриклеточных движений см в разделе 8 2 2)
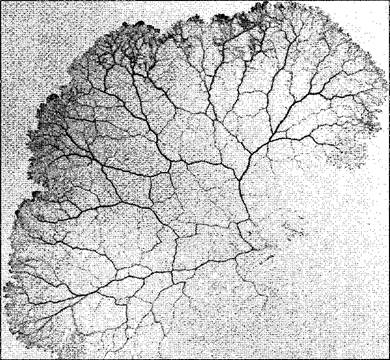
Амебоидное движение клеток, не имеющих стенки или же плазмодиев, также основывается на плазматических токах Рекорд скорости — 1 мм/с — достигается при так называемом маятникообразном токе в сетевидном плазмодии слизевиков (рис 2.9) Он происходит оттого, что сократительный эктоплазматический слой в некоторых местах жилок, составляющих сеть плазмодия, сжимается, а в других расширяется Направление тока меняется на противоположное каждые 2,5 мин. Не только здесь, но и при токах, на порядок более медленных циркуляционных и ротационных, движущая сила обусловлена актомиозиновой системой (см. 2.2.2.2). В противоположность маятникообразному току у миксомицетов, здесь возникают не гидравлические, а силы деформации сдвига, которые смещают эндоплазму относительно неподвижной эктоплазмы.
Рис. 2.9. Плазмодий слизевика Рhysarum confertum (1,25х) (фотография R. Stiemerling)
2.2.2.1. Цитоскелет
Лишенные стенки клетки (протопласты)1 под влиянием сил поверхностного натяжения, действующих у плазматической мембраны, имеют тенденцию к приобретению круглой формы, к сокращению своей поверхности до минимума. Искусственно лишенные стенки растительные, грибные и бактериальные клетки соответственно принимают круглую форму (ср. рис. 2.48). Отклонения от круглой формы возможны за счет выступающих жестких структур вне клеточной мембраны (дерматобластов2, с клеточной стенкой) и/илицитоскелета в самой цитоплазме. Цитоскелет, разумеемся, развит особенно сильно у клеток, лишенных стенки: яйцеклеток и клеток тканей животных и человека. В амебоидных, многоядерных плазмодиях слизевиков (рис. 2.9) цитоскелетный белок актин составляет примерно 1/5 всего белка. Если клеточные стенки в нормальном случае могут лишь медленно изменяться в ходе необратимого роста и только в исключительных случаях разрушаться, цитоскелет может быстро воссоздаваться и деградировать. Он проявляет себя как динамичный образователь структуры, который определяет облик клеток, внутреннюю архитектуру и все происходящие в них движения, и в конечном счете, морфогенез органов.
1 В исходном тексте был использован термин, встречающийся в немецкой литературе, —- гимнобласты. В переводе он заменен на более распространенный. — Примеч. ред.
2 Русского эквивалента этому термину найти не удалось. — Примеч. ред.
Цитоскелет водорослей, высших растений и грибов составляют прежде всего актиновые микрофиламенты и микротрубочки (рис. 2.10).
Рис. 2.10. Цитоскелет в растительных клетках (препараты и фотография: A—F — D. Menzel: G, Н — Н.Quader; I, К — М. Braun и A.Sievers): А—F — образование цист у дазикладовой водоросли Acetabularia cliftoni (ср. рис. 11.92). А, В — переход вторичных ядер в клетку «зонтика» водоросли и начинающееся формирование цист путем свободного образования клеток (см. 2.2.3.6); С, D — микротрубочки становятся видимыми благодаря применению непрямой иммунофлуоресценции; в середине картины во всех случаях клеточное ядро (С— х350; D— х235); Е, F — соответствующая локализация актиновых микрофиламентов при образовании цист; при более сильном увеличении (F) видны отдельные нити (Е— 60х; F— 235х); G—актиновые микрофиламенты в клетках эпидермиса чешуи лука (в середине клеточное ядро), видимые при применении флуоресцентной микроскопии благодаря образованию комплекса с фаллоидином — компонентом токсина гриба бледной поганки. Циклический полипептид фаллоидин с высокой специфичностью присоединяется к актину; он связывается с красителем родамином, который в ультрафиолетовом свете дает красное свечение; Н — разрушение микрофиламентов цитохалазином (G. Н— 400х); I, К — актиновые микрофиламенты в ризоидах харовой водоросли Chara globularis (ср. рис. 11.106) после флуоресцентной окраски родаминфаллоидином, позади кончика ризоида микрофиламенты сетевидные, в базальной зоне — в виде более густых пучков (1000х)
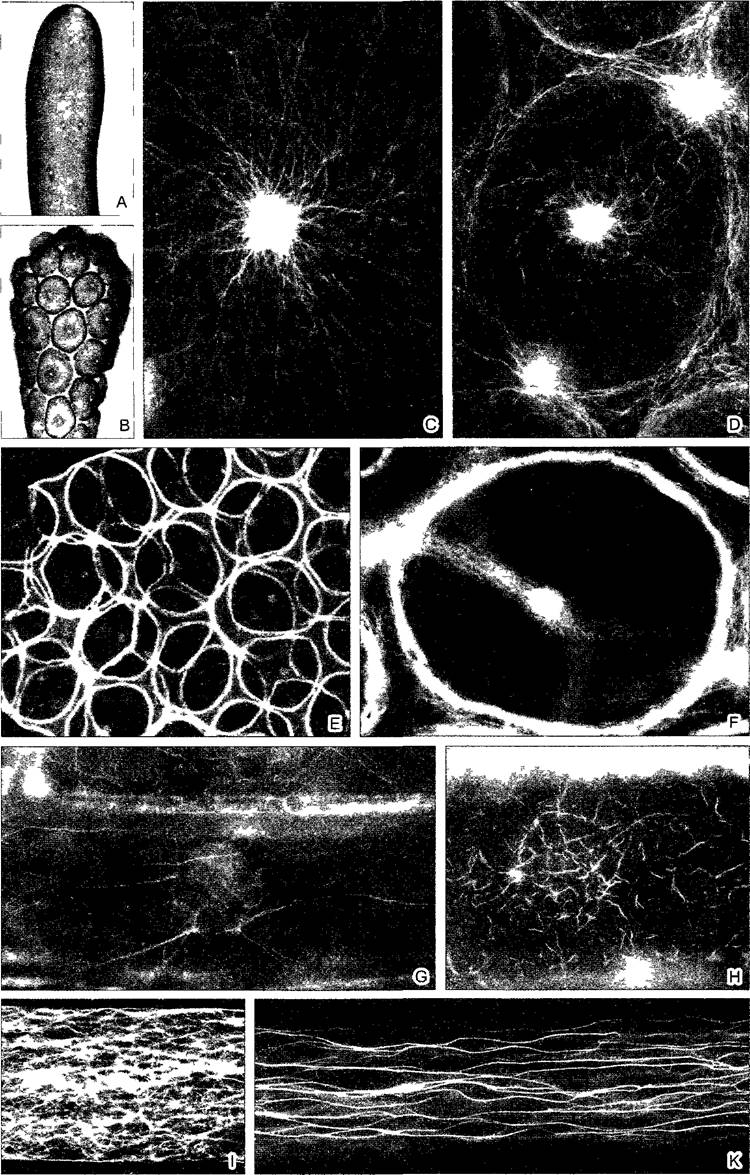
Актин был первоначально выделен из мышечных волокон. Позже было установлено его наличие во всех эукариотических клетках. Глобулярная молекула актина (G- актин) имеет диаметр 40 нм и массу 42 кДа. В области соединения более крупного С- концевого и меньшего N-концевого домена локализован центр связывания для АТФ. В растворах G-актина легко образуются актиновые нити — микрофиламенты (F-актин; рис. 2.11). При этом АТФ G-актина расщепляется, АДФ остается связанной с протомерами F-актина. Гидролиз АТФ не является обязательной предпосылкой для образования нитей, но за счет стабилизации нитей оказывает аллостерический эффект.
Рис. 2.11. Актиновый микрофиламент.
Глобулярные (точнее; эллипсоидные) актиновые мономеры группируются в спирали примерно с двумя молекулами на оборот. Это придает микрофиламенту вид растянутой двойной спирали с шагом примерно 40 нм
Микрофиламенты обладают кинетической полярностью. Встраивание дальнейших актиновых молекул осуществляется преимущественно у так называемого плюс-конца. Образование нитей начинается в живой клетке в особых местах нуклеации, предпочтительно в определенных местах клеточной мембраны, которые заняты образующими актин белками (например, α-актинином). Поразительным образом на этих центрах образования находится плюс-конец нити. Рост микрофиламентов осуществляется, таким образом, путем удлинения у фиксированного, а не у свободного конца. (Микротрубочки ведут себя в этом плане противоположным образом.)
На скорость и масштаб роста микрофиламентов, на их положение и ориентацию могут влиять также многие природные и искусственные факторы. В живой клетке микрофиламенты стабилизируются или же дестабилизируются. группируются в сети или пучки, испытывают подавление дальнейшего роста или перемежаются ассоциированными с актином белками. На действии этих белков — в наиболее хорошо изученных клетках млекопитающих их имеется свыше 100 типов — основывается высокая динамика актинового цитоскелета. В растениях при этом встречаются два белка, действующих как антагонисты; профилин и деполимеризующий актин фактор (ADF). Они всегда накапливаются в местах локальных структурных преобразований на поверхности клеток как при усиленном верхушечном росте (корневые волоски, пыльцевые трубки), так и при клеточном делении (образование срединной пластинки и первичных плазмодесм, см. 2.2.3.6 или 2.2.7.3). В эксперименте цитохалазин В — яд грибного происхождения — разрушает микрофиламенты. В результате блокируются внутриклеточные процессы движения, в которых участвуют микрофиламенты. Это относится, например, к токам цитоплазмы и перемещению хлоропластов. Такой же эффект вызывает фаллоидин — яд бледной поганки (Amanita phalloïdes). Правда, под его влиянием, наоборот, происходит агрегация всего клеточного актина в нити, которые больше не могут разделяться («Ph-актин»), и таким образом подавляет жизненно важную динамику цитоскелета. Актин является одним из наиболее консервативных белков эукариот: последовательность его аминокислот почти не изменилась на протяжении всего времени эволюции. Однако в геноме большинства эукариот имеется несколько генов актинов (например. 10 — у Агаbidopsis), продукты которых не полностью идентичны. Речь идет об изотипах, или изовариантах. В клетках, не относящихся к мышцам, обычно синтезируется γ-изотип актина.
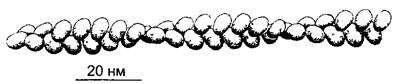
Молекулярный компонент микротрубочек (рис. 2.12) — димерная единица из двух сходных, но не идентичных белков: α- и β-тубулина («гетеродимер»). Гетеродимеры тубулина (100 кДа) показывают при наличии ГТФ и в отсутствие ионов кальция сильно выраженную тенденцию к агрегации. Типичная структура их самосборки — микротрубочка (microtubulus; лат. tubulus — трубочка). Стенка микротрубочки состоит в целом из 13 продольных рядов (протофиламентов) из одинаково ориентированных тубулиновых гетеродимеров. Внешний диаметр третичной структуры микротрубочки составляет порядка 25 нм, тогда как диаметр микрофиламента актина — только 6 нм. Поэтому, микротрубочки — сравнительно жесткие вытянутые образования В случае чрезмерных изгибов (чего, правда, в нормальной клетке не происходит) они ломаются.
Рис. 2.12. Тубулин и микротрубочки (электронная микрофотосъемка В — I Dorr, С —N FaJk)
А—гетеродимеры из глобулярного α- и β-тубулина (показаны соответственно темным и светлым, каждый примерно 50 кДа 4 нм в диаметре) организованы в продольные ряды — протофиламенты, 13 протофиламентов образу ют полую цилиндрическую микротрубочку. Гетеродимеры соседних протофиламентов при этом слабо сдвинуты друг относительно друга так что возникает плоская спиральная структура. У так называемой каймы (на схеме спереди) единицы тубулина располагаются не так, как в остальных местах (a-единица рядом с α-единицей β-единица рядом с β-единицей), а α- единица находится рядом с β-единицей, В—микротрубочки банана Musa paradisiaca в негативном контрасте, С—поперечный разрез микротрубочки препрофазного пучка (см рис 2 23 В) в зародышевой клетке корневого чехлика лука, местами различимы 13 протофиламентов

Молекулярные структуры α- и β-тубулина очень сходны, хотя последовательности аминокислот совпадают только на 40 % К удивлению, можно установить их гомологию с белком клеточного лечения FtsZ у бактерий Каждая молекула тубу- лина обладает местом связывания с ГДФ/ ГТФ. Свободные гетеродимеры тубулина, в изобилии встречающиеся в большинстве клеток, связывают ГТФ, а после агрегации — ГДФ, что соответствует аналогичным взаимоотношениям в случае G-/F- актина относительно соединения АТФ/ АДФ.
Места образования «затравки» для микротрубочек в клетке называют центрами организации микротрубочек, или ЦОМТ (англ, microtubuli organizing center, МТОС).
В качестве таковых выступают прежде всего базальные тельца жгутиков, они соответствуют центриолям (см 2 2 2 3), а те и другие — полярным областям веретена ядерного деления (бокс 2 2) и, кроме того, определенным участкам мембран Как и микрофиламенты, каждая микротрубочка обладает плюс- и минус-концом, что выражается в одинаковой ориентации тубулиновых тетеродимеров по всей длине каждой микротрубочки Однако в противоположность микрофиламентам у микротрубочек минус-конец прикрепляется к ЦОМТ, а плюс-конец отходит оттуда в сторону Места образования новых микротрубочек на ЦОМТ, имеющие форму коротких левовращающих спиралей (места образования «затравки»), состоят из нескольких специфических белков и содержат третий изотип тубулина — у-тубулин. Последний взаимодействует с β-тубулином Минус-конец микротрубочек является их β-концом, тогда как плюс-конец соответствует α-концу. У высших растений у- тубулин ассоциирован не только с местами нуклеации, так называемыми кольцевыми комплексами у-тубулина; скорее он встречается вдоль целых микротрубочек, а также на эндомембранах.
Скорость и масштаб удлинения микротрубочек зависят не только от наличия тубулиновых димеров и ГТФ, но и от ряда других факторов и могут ими регулироваться. Так, агрегация тубулина происходит только при концентрациях кальция <10-7 М. В живой клетке важную роль играют различные белковые факторы. Они в совокупности обозначаются как ассоциированные с микротрубочками белки (microtubuli associated proteins, МАР). (Внимание! Аббревиатура МАР часто применяется также для «активирующих митоз белков — mitosis activating proteins»; недоразумений можно избежать, только учитывая контекст.) Имеется два класса таких белков:![]() -фактор (тау-фактор, 55 — 65 кДа), который встраивается в микротрубочки, и высокомолекулярные МАР (250 — 350 кДа), которые обычно отходят от микротрубочек как боковые «руки» длиной до 30 нм и могут функционировать как мостики между ними и, например, мембранами. Некоторые из высокомолекулярных МАР — ферменты: они могут,
-фактор (тау-фактор, 55 — 65 кДа), который встраивается в микротрубочки, и высокомолекулярные МАР (250 — 350 кДа), которые обычно отходят от микротрубочек как боковые «руки» длиной до 30 нм и могут функционировать как мостики между ними и, например, мембранами. Некоторые из высокомолекулярных МАР — ферменты: они могут,
например, фосфорилировать белки или являются АТФазами, из них важнейшие — динеин и кинезин (см. следующий раздел).
Как и в случае микрофиламентов, на сборку и разборку микротрубочек могут влиять в эксперименте специфические вещества. Давно известен колхицин — алкалоид безвременника осеннего (Colchicum autumnale). Он присоединяется к ß-тубулину свободных тубулиновых гетеродимеров и блокируем их встраивание в микротрубочки. В настоящее время для экспериментальной разборки микротрубочек применяются более сильно и специфично действующие гербициды — оризалин и амипрофосметил (АПМ). Противоположное действие оказывает таксол — алкалоид тиса (Taxus; см. рис. 6.123). Он стабилизирует микротрубочки и стимулирует агрегацию свободных гетеродимеров.
Стабильность микротрубочек одной и той же клетки зачастую не одинакова: различают «стабильные» и «лабильные» микротрубочки. Под воздействием колхицина дезинтеграции подвергаются лабильные (например, микротрубочки веретена ядерного деления), но не стабильные (в жгутиках) микротрубочки. Микротрубочки жгутиков сохраняются даже при низких температурах и фиксации тетроксидом (четырехокисью) осмия, тогда как лабильные микротрубочки исчезают в обоих случаях. Широкое распространение микротрубочек лабильного типа удалось установить только после внедрения в практику электронной микроскопии фиксации глутаральдегилом. В основе различной стабильности микротрубочек лежит, возможно, существование различных изотипов тубулина (у Arabidopsis, например, известны девять α-тубулинов и шесть β-тубулинов) и/или специфические сопутствующие белки.
Во многих клетках встречаются комплексные структурные образования из микротрубочек — иногда они временные, для ограниченных во времени функций, в других случаях это длительно существующие образования.
Наиболее известный пример таких функциональных структур — веретено деления ядра (см. бокс 2.2). Однако не только при митозе, но и во время других фаз клеточного цикла в клетках высших растений часто возникают характерные группировки микротрубочек — цикл микротрубочек (рис. 2.13). В интерфазе микротрубочки преимущественно локализованы непосредственно под клеточной мембраной в кортикальной цитоплазме. Они играют там важную роль при образовании клеточной стенки (ориентация целлюлозных микрофибрилл; локальное отхождение клеточной мембраны от клеточной стенки для ограниченных в пространстве вторичных образований стенки, как при дифференцировке спиральных сосудов в ксилеме; ср. рис. 2.74, С; 3.24, Е) и при морфогенетических процессах.
Рис. 2.13. Изменения расположения микротрубочек перед началом митоза в клетках корневой меристемы (по М. С. Ledbetter): А—интерфаза, В—образование препрофазного пучка перед вступлением в профазу, его положение определяют последующий экватор и плоскость деления клетки, С—поздняя профаза
Хорошо выраженные стабильные микротрубочки распространены у лишенных покровов протистов и сперматозоидов, где они связаны с выработкой характерных жестких клеточных форм и/или закреплением жгутикового аппарата.
В клетках позвоночных животных наряду с актиновыми и миозиновыми нитями и микротрубочками встречаются также другие элементы цитоскелета в виде нитей диаметром порядка 10 нм. Таким образом, по размеру они находятся между микротрубочками (25 нм) и микрофиламентами (6 нм) и поэтому получили название промежуточные филаменты (intermediate filaments — IF = 10-нм-филаменты). К тому же в цитоплазме млекопитающих 1F часто образуют вытянутые в длину, плотные волокнистые структуры. Они отличаются тем, что нерастворимы — за исключением концентрированного раствора мочевины. Промежуточные филаменты представляют собой пучки вытянутых в длину белковых молекул. К настоящему времени известно 6 подсемейств; примерно 40 различных 1F-белков гомологичны по своим последовательностям. (Сюда относятся также ламины — белки ядерной пластинки; см. 2.2.3.4.) На основании данных по последовательностям ДНК гены 1F-белков выявлены и у низших животных. Растительные клетки также содержат белки, которые взаимодействуют с антителами к 1F-белкам животных. Для некоторых из этих белков установлена сильно выраженная тенденция к агрегации со структурами типа промежуточных филаментов.
2.2.2.2. Моторные белки и процессы движения в клетке
Цитоскелет принимает решающее участие в процессах движения в клетке (сократимость, подвижность). С одной стороны, движения направлены как по рельсам поезда или трамвая. С другой стороны, по закону Ньютона (действие численно равно противодействию) — каждый действующий элемент нуждается в противодействующем (например, мускулатура и скелет). В клетке специфические АТФазы, функционируя как хемомеханические преобразователи энергии (моторные молекулы), поставляют энергию, высвобождающуюся при расщеплении АТФ, для структурных изменений и таким образом непосредственно взаимодействуют с элементами цитоскелета. У эукариот соответственно двум основным компонентам цитоскелета широко распространены две подобные системы: актомиозиновая система и система микротрубочки—дине- ин/кинезин.
Партнером актина при создании сил растяжения и сдвига является миозин — комплексная АТФаза (греч. myon — мышца), которая активируется актином. Миозин был особенно детально изучен на мышцах позвоночных животных и насекомых. Имеющийся у них в большом количестве миозин II обладает четвертичной структурой (470 кДа) из 2 параллельных длинных («тяжелых») и 4 более коротких («легких») цепей (рис. 2.14, А, В). Сильно анизометрическая элементарная часть миозинового комплекса имеет α-спиральную область («хвост») и два N-концевых глобулярных участка («головки»). Последние идентичны и функционируют при сократительных процессах независимо друг от друга. В них локализована активность АТФазы и они же являются местом связывания актина; связывающие Са2+легкие цепи находятся по соседству. Над хвостовыми доменами миозин II агрегируется в поперечнополосатых мышечных волокнах в заметные стабильные миозиновые нити. При достаточно высокой (примерно мил- лимолярной) концентрации Са2+ одна из двух миозиновых головок ложится на актиновую нить, и продукты уже осуществившегося расщепления АТФ высвобождаются. Это приводит к радикальному изменению структуры миозина: головка изгибается и сдвигает микрофиламент примерно на 10 нм, за счет нового накопления АТФ связь с актином разрывается, и головка при расщеплении АТФ снова выпрямляется. При мышечном сокращении эти процессы циклически повторяются, происходит взаимное перемещение миозина и актина. Двухкомпонентная система из нитей актина и миозина действует, таким образом, не столько за счет укорочения самих нитей, сколько благодаря смещению друг относительно друга. Модель скользящих волокон (модель «slidingfilament») подходит в основных чертах также для системы микротрубочки— динеин/кинезин.
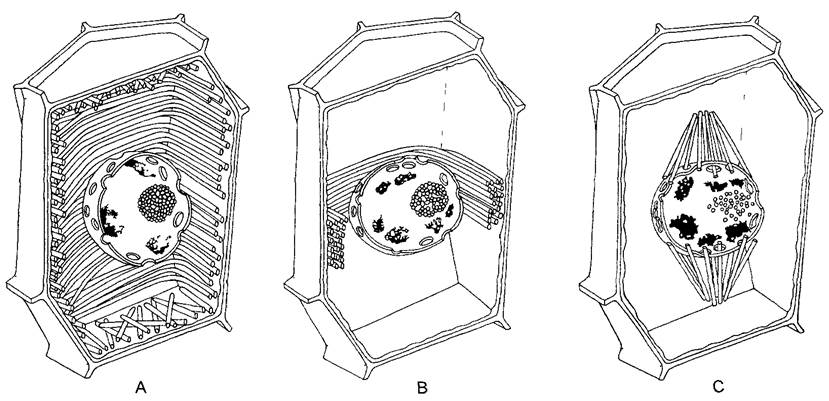
Рис. 2.14. Моторные молекулы (В—Е — по D. Menzel): А—миозин II из мышцы млекопитающих — наиболее давно известная и лучше всего изученная моторная молекула. Она расщепляется про- теиназой трипсином (Т) на головную и хвостовую части. Папаин (Р) разлагает головную часть на N-концевые глобулярные домены тяжелых миозиновых цепей с местом соединения с актином и АТФазной активности и шейковый участок, с которым ассоциированы легкие цепи (здесь не изображены). Шейковый и хвостовой участки представляют собой вытянутые α-спиральные домены. Места воздействия Т и Р находятся в местах ослабления вторичной структуры, у которых миозиновые субъединицы могут надламываться, как в суставах. На изгибах «сустава» возле Р основывается взаимное смещение актиновых и миозиновых филаментов; В—структура домена миозина II. Глобулярные единицы на шейковых участках соответствуют (как и на С—Е) легким цепям; С—Е —миозины из растительных клеток: С, D — миозины соответственно классов XI и VIII подсолнечника и ре- зуховидки (Arabidopsis thaliana)', Е—миозин класса XII из сифональной зеленой водоросли Acetabularia; F—кинезин; обе α-цепи образуют у своих N-концов (справа) глобулярные домены с АТФазной активностью и местом присоединения тубулина; две легкие цепи расположены у С-концов. Миозины класса II имеют длину 160 нм, тетрамеры кинезина — только примерно половину этой длины
Путем сравнения ДНК-последовательностей генов и исследования подвижности (белковые фракции тестируют на способность вызывать движения у изолированных нитей актина) в последние годы были обнаружены многочисленные миозины, причем некоторые из них существенно отличаются от миозина II из мышечных клеток. Это касается прежде всего растительных миозинов, которые были отнесены к классам VIII, XI и XII надсемейства миозинов (см рис 2 14 С —Е). По характер) действия они сходны с миозином II однако их хвостовые области не образуют миозиновых нитеи (они имеются только в мышечных клетках), а прикрепляются непосредственно к мембранам, пузырькам или другим клеточным структурам за исключением микротрубочек). Токи цитоптазмы и перемещения хлоропластов вызываются в подавляющем большинстве случаев актомиозиновои системой.
В противоположность актомиозиновои системе при движениях, обусловленных микротрубочками, задействованы два разных класса моторных белков динеины и кинезины (греч dynamis — сила, kinesis — движение). Динеин — высокомолекулярный комплекс — выявляется прежде всего в жгутиках и ресничках (см следующий раздел), где он и был открыт. Вместе с тем, широко распространен «цитоплазматический динеин» более простого строения — он имеется и в клетках, лишенных жгутиков. Динеин действует совместно с динактином — другим крупным белком динаминового комплекса, а также с другими, от случая к случаю меняющимися сопутствующими белками Сообщаемые динеином движения происходят всегда в направлении к минус-концу микротрубочек, функционирующих как упор/рельсовый путь динеины представляют собой минус-моторы Кинезины, напротив, — в большинстве плюс-моторы (Лишь немногие представители надсемейства кинезинов, отличающиеся по своему строению — у них моторные домены локализованы на карбоксильном, а не на N-конце, — действуют как минус-моторы ). Они были открыты на осевых придатках нервных клеток. Между тем, достоверно подтверждено их наличие и у растений. По молекулярному строению (см рис 2 14, F) они сходны с миозинами, которые также (только именно на актиновых микрофиламентах) являются плюс-моторами. Хотя кинезины и не гомологичны миозинам по последовательности аминокислот, трехмерная структура моторных доменов в обоих случаях сходна.
Клеточные движения осуществляются в некоторых случаях без участия описанных систем. Так, простое удлинение или же укорачивание микрофиламентов или микротрубочек может вызывать перемещение органелл или изменение их формы. Механизм движения основан на совершенно иных молекулярных взаимодействиях. Например, ножка одноклеточных сувоек (сидячие инфузории) сокращается при прикосновении к клетке (телу животного) При этом центральный тяж в ножке — спазмонема — скручивается в спираль с малым шагом (рис 2 15). Спазмонема состоит в основном из низкомолекузярного фосфопротеина (≈20 кДа), который относится к семейству центринов (- спазминов = кальтрактинов) Он резко изменяет свою пространственную структуру (и тем самым облик спазмонемы) под воздействием ионов кальция АТФ при этом не расщепляется. Однако необходим сравнительно длительный процесс, чтобы посте сокращения удалить Са2+ и снова вытянуть спазмонему. Центрины по постедоватетьности аминокислот близко родственны белку кальмодулину, связывающему кальций. С помощью специфических антитез центрин удалось выявить у очень многих эукариот, даже у высших растений. Он ассоциирован прежде всего с базальными тельцами и центриолями, а также со структурами прикрепления жгутиков. Центрин встречается при клеточных делениях также в центральной части цитоптазмы и во фрагмопластах (см. 2 2 3 6), но его функции здесь пока неизвестны.
Рис. 2.15. Сократительная спазмонема сувойки Vorticella (слева — в вытянутой ножке справа — после раздражения) спазмонема и ножка спиралевидно укорочены (420х, интерференционный контраст)
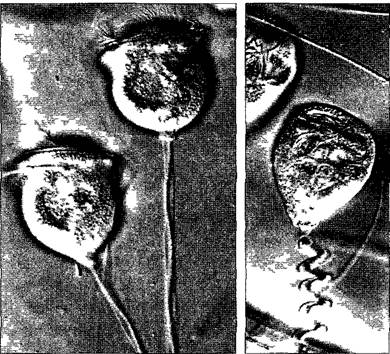
2.2.2.3. Жгутики и центриоли
Постоянные жгутики эукариот (= flagellа; лат. flagellum — бич, жгут) по структуре в основных чертах сходны. Вообще, здесь мы имеем дело с чрезвычайно консервативными клеточными структурами.
Даже широко распространенные у животных и человека реснички показывают, в основном, сходную ультраструктуру. Реснички короче, чем жгутики, и всегда многочисленны на несущих их клетках (клетки ресничного эпителия; одноклеточные организмы — инфузории). Для жгутиков и ресничек эукариот стал популярным (как обобщающее название) термин ундулиподии (лат. undulare — извиваться, podium — придаток в виде ножки) Аналогичные органеллы передвижения бактерий построены по иным принципам и функционируют совершенно другим образом (см. 2.3.2).
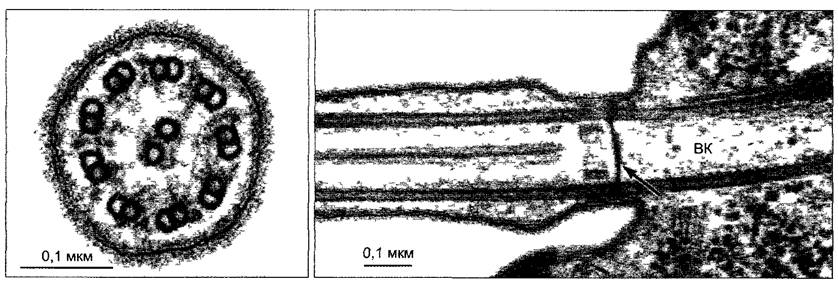
На поперечном срезе жгутика можно различить характерное расположение 20 микротрубочек (рис. 2.16), известное как модель 9 + 2. Две центральные одиночные микротрубочки (синглеты) симметрично окружены венцом из 9 двойных жгутиков (дуплетов). Дуплеты ориентированы не строго тангентально: так называемая А-
трубочка находится несколько ближе к центру, чем В-трубочка. Только А-трубочка построена из 13 протофиламентов. В-трубочка, имеющая больший диаметр и включающая 11 протофиламентов, расположена сбоку от А-трубочки и использует 4 из ее протофиламентов. За счет этого она имеет вид также замкнутой (правда, не совсем округлой) трубки. Синглеты и дуплеты вместе с многочисленными другими белками образуют сложный цитоскелет жгутиков (рис. 2.17). Вместе с динеином в качестве моторной молекулы он осуществляет биение жгутика. Подвижная общая структура, которая проходит по длине жгутика и имеет диаметр 200 нм, носит название аксонема (от греч. axon — ось, nema — нить).
Рис. 2.16. Жгутик Scourfieldia caeca — зеленой жгутиковой водоросли (электронная микрофотосъемка М.Меlkoniai).
Слева — поперечный разрез, справа — основание жгутика с базальным телом на продольном разрезе. Центральные синглеты, которые отсутствуют в базальном теле, начинаются только на расстоянии 100 нм кнаружи от этой пластинки. На поперечном срезе не очень четко видны динеиновые рукоятки и радиальные спицы; ВК— базальное тело, стрелка—базальная пластинка у перехода базального тела в жгутик
Динеин жгутиков представляет собой очень сложную АТФазу, активируемую тубулином. Динеин так называемых «рукояток» имеет, например, массу, едва ли достигающую 2 МДа и состоит из примерно 12 различных протомеров. В ЭМ он выглядит как многочленная структура. Динеиновые рукоятки, которые отходят от А-трубочек и направлены к соседним В-трубочкам, могут передвигать соседние дуплеты друг относительно друга — здесь также работает модель скользящих волокон (см. рис. 6.6). Радиальные «спицы» и нексиновые мостики преобразуют получающиеся в результате продольные сдвиги в характерные изгибы жгутика.
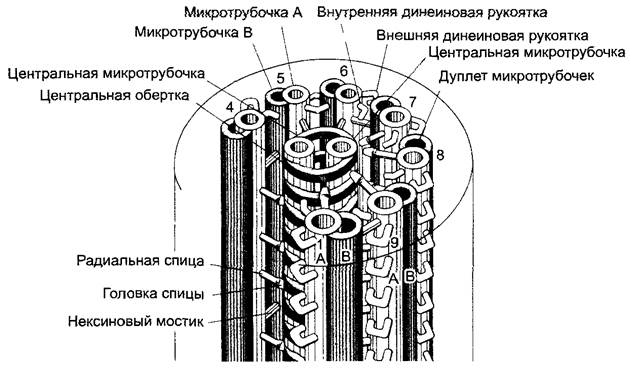
Рис. 2.17. Схема ультраструктуры эукариотического жгутика (по Р.Эайг)
Обе центральные микротрубочки (синглеты) окружены спиральным влагалищем, с которым периферические дуплеты связаны через эластичные радиальные спицы. В каждом дуплете А-микротрубочка (показана светлым) непрочно соединена с В-микротрубочкой (показана темным) соседнего дуплета эластичной белковой «рукой» (нексин). Каждая А-микротрубочка, кроме того, несет внутренние и внешние динеиновые рукоятки. Отсчет дуплетов начинается от плоскости симметрии синглетов с 1 и продолжается в направлении динеиновых рукояток (при рассмотрении в направлении от основания к свободному концу жгутика — почасовой стрелке). Для большей наглядности показано только 7 дуплетов; отсутствие дуплетов 2 и 3 отражено в прерывании круга, который отмечает положение плазматической мембраны
Поверхность жгутиков у разных организмов может различаться. Перистые жгутики снабжены расположенными по их бокам нитевидными мастигонемами (от греч. mastix — жгутик), за счет чего сильно увеличивается трение о воду (см. рис. 11.20, А—С; 11.72, Г). Мастигонемы образуются в аппарате Гольджи как оформленный секрет и доставляются путем направленного экзопитоза на поверхность жгутика. Гладкие жгутики отличаются удлиненной тонкой верхушечной зоной, в которую заходят только синглетные микротрубочки.
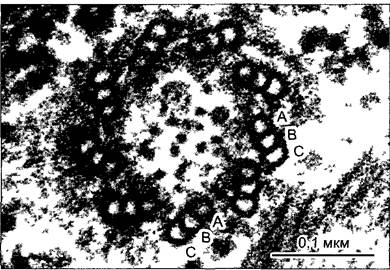
Каждый жгутик прикрепляется в периферической цитоплазме базальным телом — коротким цилиндром из 9 триплетов микротрубочек (трубочки А, В, С); центральные синглеты отсутствуют (см. рис. 2.16; 2.18). Базальное тело ориентировано перпендикулярно к поверхности клетки. При возникновении жгутиков оно функционирует как центр образования, от которого вырастает жгутик. В переходной зоне между базальным телом и телом жгутика С-трубочки заканчиваются и берут начало обе синглетные трубочки. Трубочки А и В базального тела продолжаются в 9 дуплетах аксонемы. Базальные тела имеют также функцию ЦОМТ, а плюс-концы микротрубочек жгутиков находятся на свободном конце жгутика.
Структура базальных тел идентична структуре центриолей. Они встречаются в основном попарно. В клетках, имеющих базальные тела, чаще всего они функционируют как пары центриолей, но, что примечательно, центриоли не всегда служат полюсами веретена деления.
В свое время ошибочно предполагали, что центриоли являются центрами образования аппарата веретена. Однако имеются организмы и без центриолей, например, все покрытосеменные1, которые тем не менее вполне способны образовывать веретено деления при митозе, но не образуют жгутиков (и поэтому также не имеют сперматозоидов, так что сближение ядер гамет у этих растений осуществляется за счет быстро растущей пыльцевой трубки — сифоногамия). Таким образом, центриоли — это потенциальные базальные тела, которые при необходимости могут перемещаться к поверхности клетки и там разрастаться в жгутики. Во время митоза они в первую очередь занимают полюса веретена, за счет чего обеспечивается их равномерное распределение по дочерним клеткам.
1 Кроме того, без центриолей обходятся клетки красных водорослей (Rhodophyta), часть зеленых водорослей (Соnjugatae) и часть голосеменных. Клетки многих грибов также лишены центриолей. — Примеч. ред.
Рис. 2.18. Базальное тельце Scourfieldia, поперечный разрез (электронная микрофотосъемка М.Меlkonian).
В триплетах микротрубочек местами различимы протофиламенты на поперечном срезе. Только самые внутренние микротрубочки триплета (А) комплектны; обе косо направленные наружу микротрубочки В и С желобчатые, они имеют несколько протофиламентов, общих с соседней микротрубочкой, расположенной ближе к середине. С-микротрубочки заканчиваются у базальной пластинки, А и В продолжаются в дуплетах аксонемы жгутика
Базальные тела (и соответственно центриоли) возникают не путем деления из подобных себе, а каждый раз образуются заново. Правда, часто это происходит в непосредственной близости от базальных тел/центриолей, которые, очевидно, оказывают индуцирующее действие. Базальные тела высокоразвитых папоротникообразных и голосеменных1, которые еще образуют сперматозоиды (в некоторых случаях со жгутиками в числе свыше 1 000 на клетку), возникают в сферической обла сти уплотненной цитоплазмы — так называемых блефаропластах (греч. blepharon — ресница). Блефаропласты (рис. 2.19) представляют собой четко структурированную форму центроплазмы = центросомы — обычно структурно не означенную область плазмы, которая функционирует как ПОМТ и, например, у лишенных центриолей цветковых растений организует полюса веретена ядерного деления.
1 Имеются в виду прежде всего саговниковые (Сусаdales) и гинкговые (Сinkgoales). — Примеч. ред.
Рис. 2.19. Возникновение заново центриолей базальных тел при микроспорогенезе водного папоротника Marsilea (по P.K.Hepler): А—С — в уплотненной части цитоплазмы вблизи ядерной оболочки возникает симметричная структура из 2 блефаропластов. Они разделяются перед ближайшим ядерным делением (D) и образуют два полюса веретена (Е, F). Из каждого блефаропласта получается в конечном счете примерно 150 базальных телец имеющих жгутики сперматозоидов. Весь процесс в целом показывает, что такие комплексные характерные структуры, как центриоли или же базальные тельца, могут возникать de novo
Базальные тела чаще всего закрепляются сложной системой микротрубочек в цитоплазме, часто будучи еще связанными с клеточным ядром. Микротрубочки в
свою очередь часто ассоциированы с характерными волокнистыми структурами двух видов. Поперечнополосатые волокна системы I построены из нитей толщиной 2 нм. В качестве главного компонента они содержат белок ассемблин массой 34 кДа и не способны к сокращению. Сократимые волокна системы II построены из нитей толщиной 4 — 8 нм и содержат цен- трин.
2.2.3. Клеточное ядро
Генетическая информация всех клеток, как прокариот, так и эукариот, заключена в последовательности нуклеотидов молекул ДНК. У эукариот ДНК содержится прежде всего в ядре, но также в митохондриях и пластидах. Ядро — это основная структура для хранения и размножения (репликации) ДНК, а также для синтеза (транскрипции) и созревания (процессинга) РНК. Все эти процессы происходят в нуклеоплазме (= кариоплазме), которая отграничена от окружающей цитоплазмы двухслойной ядерной оболочкой (англ, nuclear envelope). Она соответствует сферической цистерне ЭР. Отличительная особенность ядерной оболочки — многочисленные поровые комплексы для обмена макромолекулами между ядром и цитоплазмой. Молекулы тРНК, иРНК и образуемые в ядрышке прерибосомы покидают пространство ядра через эти поровые комплексы, а специфичные для ядра белки проникают через них в ядро (см. рис. 2.20; 7.9; 7.17).
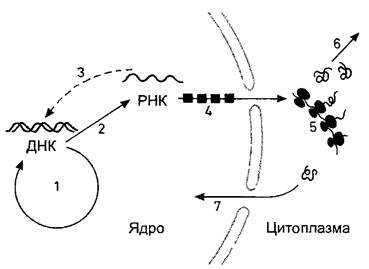
Рис. 2.20. «Центральная догма» молекулярной биологии гласит, что поток информации в клетке идет от ДНК через РНК к белкам: «ДНК создает РНК, РНК создает белок».
Однако ДНК служит не только матрицей для синтеза РНК (транскрипция 2), но еще и осуществляет собственное размножение (репликация 1). От РНК возможен однозначный обратный перевод в последовательности ДНК (обратная транскрипция 3, происходящая, в частности, у РНК-вирусов, которые встраивают свой геном в ДНК клетки хозяина). У эукариот эти процессы и процессинг вновь образованной РНК (4) происходят внутри пронизанной порами ядерной оболочки. Образованные в ядре и процессированные молекулы РНК становятся в цитоплазме активными при синтезе белка на рибосомах (трансляция 5). Многие белки в качестве ферментов управляют обменом веществ и энергии в клетке (6); другие же мигрируют в ядро (7), где они, например, принимают участие в репликации и транскрипции или берут на себя важные функции в хроматине как белки, сопутствующие ДНК
Внутри ядра мембран нет, но имеются молекулы ДНК длиной в сантиметры и дециметры (1 — 100 млрд Да). Необходимый функциональный и структурный порядок обеспечивается своего рода ядерным скелетом — ядерным матриксом. В этом геле из структурных белков распределен дезоксирибонуклеиновобелковый комплекс — хроматин. В нем главенствующую роль играют основные гистоны как белки, непосредственно взаимодействующие с ДНК. Имеются различные степени уплотнения (конденсации) хроматина. Хроматин, участвующий в репликации или транскрипции, находится в ядре в деконденсированной форме (эухроматин). Особенно плотные «хромоцентры», напротив, очень плотно конденсированы и генетически неактивны (гетерохроматин). То же самое относится и к компактным хромосомам во время делений ядер. Активация генов как предпосылка для транскрипции достигается различными негистонными белками, прежде всего факторами транскрипции (ТР), связывающимися с определенными локусами последовательностей ДНК. Различные варианты подавления и активации генов обусловливают дифференцировку клеток тканей многоклеточных организмов (дифференциальная экспрессия генов).
Большинство молекулярных и надмолекулярных структурных компонентов клеточного ядра — функциональные и недолговечные структуры. Ядерная оболочка и ядрышки распадаются, например, на начальных стадиях деления и только в его конечной фазе образуются заново. Ядерный скелет проявляет себя так же как динамическая структура. Его молекулярные компоненты меняются в клеточном цикле — характерной последовательности событий между ядерными делениями и во время них. Единственный компонент ядра, который, один раз возникнув путем репликации, в нормальной ситуации не подвергается никакому преобразованию или разложению, — это ДНК, несущая наследственную информацию (гены).
Между объемом клеточного ядра как обширного архива генетической информации в эукариотической клетке и общим объемом цитоплазмы в нормальном случае имеется соотношение объемов примерно 1:10. Оно сохраняется постоянным при изменении объема клетки. Крупные, богатые цитоплазмой клетки чаще всего имеют также крупные ядра, которые почти всегда отличаются увеличением в несколько раз содержащегося в них набора хромосом (см. 2.2.3.5).
2.2.3.1. Хроматин
Большая часть ядерной ДНК находится в комплексе с гистонами. Гистоны имеются у подавляющего большинства эукариот. (Исключение составляют только динофлагелляты1 — см. рис. 11.70, — хроматин которых организован иначе. Однако во всем остальном эти одноклеточные организмы — типичные эукариоты.) Соотношение по массе гистон/ДНК составляет примерно 1:1. Гистоны встречаются в живой клетке только в комплексе с ДНК. Они синтезируются синхронно с ДНК в фазе репликации клеточного цикла (S-фазе) в цитоплазме и сразу же перемещаются в ядро. ДНК, имеющая сильно кислую реакцию, притягивает как полианион молекулы гистонов, которые, в свою очередь, за счет наличия многочисленных остатков лизина и аргинина имеют щелочную реакцию (pI ≈ 12) и представляют собой поликатионы (табл. 2.1)1. Расположение в ряд от Н1 до Н4 отражает уменьшение доли лизина и увеличение доли аргинина. Гистоны, особенно НЗ и Н4, лишь незначительно изменились в ходе эволюции. Однако имеются специфичные для определенных тканей вариации, которые могут быть обусловлены дифференциальной активностью несколько отличающихся друг от друга кодирующих гистоны генов (изотипы) или же обратимыми модификациями молекул гистонов после трансляции (ацетилирование или фосфорилирование отдельных аминокислот; см. 7.2.2.2).
1 В последнее время гистоны в очень ограниченном количестве обнаружены и у динофлагеллят. — Примеч. пер.
Четыре гистона — от H2A до Н4, которые имеют сходные размеры и конфигурации молекул, самостоятельно, даже без ДНК, образуют плоско-эллипсоидные четвертичные структуры. В этих частицах диаметром 10 нм и толщиной 5 нм имеются 2 молекулы каждого из составляющих гистонов. Поэтому их называют гистонными октамерами, а их компоненты — гистоновыми ядрами (histone cores). Каждый октамер по диаметру, вдоль которого находятся N-концы молекул гистонов с особенно щелочной реакцией, охвачен петлей ДНК, представляющей собой отрезок длиной в 145 пар нуклеотидов (п. н.) (рис. 2.21). Двойная спираль ДНК делает при этом не более 2 оборотов вокруг октамера гистона, а затем идет к следующему. Промежуточный участок длиной примерно 60 п. н., линкер (англ, linker — соединитель), является предпочтительным местом атаки эндонуклеаз. В соответствующих опытах с расщеплением эндонуклеазами сюда присоединялись нуклеогистонные комплексы, имеющие единую массу частиц, — нуклеосомы. В ЭМ очень рыхлый хроматин, свободный от Н1, образует типичную структуру «нитки жемчуга» (рис. 2.22, А).
Таблица 2.1. Обзор основных пяти типов гистонов
Обозначение |
Молекулярная масса, кДа |
Молекулярная форма |
Н1 |
>24 |
С 2 положительно заряженными доменами (С- и N-концы) и глобулярным центральным доменом |
Н2А |
≈ 18,5 |
Глобулярная, N-терминальная |
Н2В |
≈ 17 |
Домены с уплотненным расположением |
H3 |
15,5 |
Основные остатки аминокислот по бокам |
Н4 |
11,5 |
Расставленная |
Картина изменяется, когда добавляется Н1. Этот гистон с большой молекулярной массой (в ходе эволюции менее консервативный) не участвует в построении октамеров или же нуклеосом, однако может тесно связывать друг с другом нуклеосомы путем специфичного для определенных последовательностей присоединения к линкерной ДНК и к занятым ДНК октамерам. Н1 называют поэтому линкерным гистоном. Он вызывает конденсацию хроматина, который с увеличением доли Н1 становится все более компактным (рис. 2.22, В —D). При этом сначала образуются нуклеофиламенты (= элементарные, или базисные, фибриллы) с поперечным диаметром 10 нм, при продолжающемся уплотнении — различные дополнительные структуры, например, соленоиды (спиральные структуры с 6 нуклеосомами на оборот; от греч. solen — трубка), менее правильные ломаные структуры или гранулы из нуклеосом — нуклеомеры. Наконец, возникает нитевидная структура толщиной примерно 35 нм — хроматиновая фибрилла. Двойная спираль ДНК, содержащаяся в хроматиновой фибрилле, будучи вытянутой, длиннее более чем в 20 раз.
Рис. 2.21. Нуклеосомы (схематично)
А—«нитка жемчуга» 3 гистонных октамера (показаны точками) окружены левозакрученной петлей двойной спирали ДНК и соединены участком ДНК, поперечные штрихи: места действия нуклеазы Micrococcus, В—супрануклеосомальные структуры, которые образуются с помощью Н1, справа — нуклеофиламент, слева — фибрилла хроматина (здесь Н1 не показан)
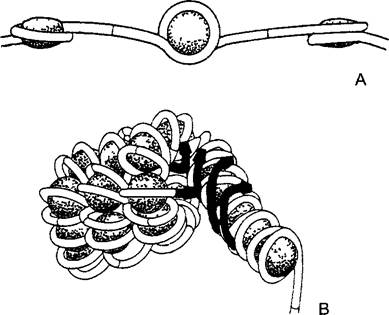
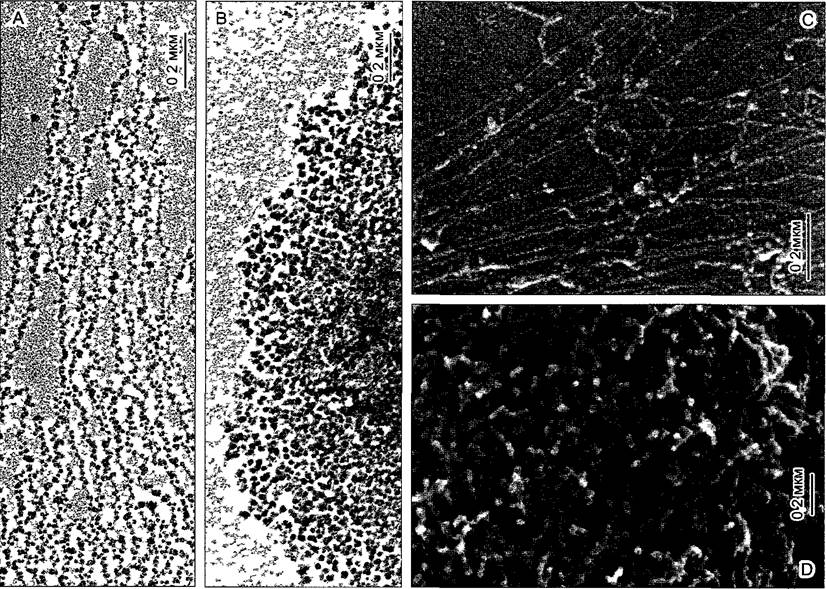
Рис. 2.22. Выделенный хроматин из ядер лука репчатого Afhum сера (А В) и ячменя Hordeum vulgare (С, D — при растровой электронной микроскопии) (электронная микрофотосъемка А В — Н Zentgraf РЭМ-изображения С D~G Wanner)
А—«нитки жемчуга» расплетенного хроматина при низкой ионной силе В — супрануклеосомальные структуры при физиологической концентрации соли (100 мМ NaCI) С— хроматин после обра ботки протеиназой К рядом с голой ДНК видны нукпеофиламенты и хроматиновые фибриллы, D—после кратковременной обработки протеиназои К из хромосомы выступают прежде всего хроматиновые фибриллы
Еще более высокая степень упаковки хроматина встречается во время деления клетки. Различные негистонные белки образуют в это время нитевидный скелет хромосомы, от которого по всем направлениям отходят хроматиновые фибриллы в виде боковых петель. Уже при световой микроскопии видны хромонемы, имеющие поперечное сечение 0,2 мкм (см. 2.2.3.7). Крайняя степень упаковки хроматина достигается, наконец, путем прогрессирующего скручивания хромосом в метафазе митоза, а еще более выражена она при мейозе (см. рис. 2.23; 2.24, 2.29, F; 2.35, Р-Н). Двойная спираль ДНК была бы в вытянутом состоянии более чем в 10 000 раз длиннее, чем в сильно конденсированной хромосоме.
Рис. 2.23. Спиралевидная структура хромосом при мейозе у Tradescantia virginiana (4050х) (по С D Darlington L F La Cour)

В противоположность неактивному, конденсированному хроматину, активный хроматип крайне рыхлый. Гистоны в прилегающих областях модифицированы за счет метилирования, ацетилирования или фосфорилирования, что снижает их сродство с ДНК. Сама ДНК становится из-за этого более легко доступной для факторов транскрипции и репликационных и транскрипционных ферментов, но также и особенно чувствительной к ДНКазе I. Факторы транскрипции(transcription factors, TF) присоединяются, специфично узнавая соответствующие последовательности, к промоторным участкам ДНК, которые расположены перед генами, и дают начало их транскрипции (см. 7.2.2.2).
2.2.3.2. Хромосомы и кариотип
Термин «хромосома» (от греч. chroma — цвет, из-за того, что конденсированные хромосомы хорошо окрашиваются красителями) был предложен более 100 лет назад анатомом В. Вальдейером. После того как стало известно, что ДНК является носителем генетической информации, понятие «хромосома» стали часто применять ко всем структурам, несущим гены, так что этот термин часто фигурирует и применительно к пластидам и митохондриям, к бактериям и даже к вирусам, хотя там гистоны не участвуют в структурировании ДНК и отсутствуют характерные циклы конденсации/ деконденсации. Совокупность всех генов или же несущих гены структур организмов носит название геном (греч. génos — потомство, род). Наряду с ядерным геномом (нуклеомом) в растительной клетке имеется еще пластом (геном пластид) и хондром (= хопдриом) митохондрий (см. 7.2.1), которые меньше нуклеома (см. рис. 7.4). Размер генома в настоящее время чаще всего дается как общее число пар оснований ДНК (см. табл. 7.2).
Набор хромосом, содержащийся в ядрах представителей одного вида, называют его кариотипом. Этот термин охватывает всю совокупность свойств хромосом, рассматриваемых цитологией (размер, облик, число). Кариотип — особенно важный признак для генетики, систематики и филогении. Число однородных хромосомных наборов в ядре определяет степень его плоидности (n). Ядра с одинарным набором хромосом являются гаплоидными (1 n; haplos — простой). Соматические клетки (клетки тканей) у папоротникообразных и семенных растений преимущественно диплоидны1 (2n). Ядра чрезвычайно больших размеров чаще всего полиплоидны: они содержат от нескольких до многих копий генного и хромосомного набора соответствующего вида. Клетки с искусственно полученными полиплоидными ядрами и сами имеют соответственно большие размеры. Под значением Спонимают общее количество гаплоидного генома, выражаемое в пикограммах (1 пг = = 10-12 г). Значение С бактерии Escherichia coli составляет 0,04 пг, табака — 1,6 пг, кукурузы — 7,5 пг, а у некоторых лилий превышает 30 пг.
1 Имеются в виду ткани спорофита. В вегетативных клетках гаметофита (заросток папоротника или вегетативное ядро пыльцы семенных растений) один набор хромосом. — Примеч. ред.
Отдельные хромосомы одного набора содержат различные части генетической информации и соответственно чаще всего имеют также различный облик (см. рис. 2.24). Схематическое изображение гаплоидного набора хромосом фигурирует в литературе под названиями карио-, или идиограмма (см. рис. 10.10; бокс 7.1C). Карио- типизация основывается на исследовании с помощью светового микроскопа той стадии ядерного деления, на которой хромосомы максимально конденсированы (метафаза, см. 2.2.3.5). При этом особенно важны следующие признаки хромосом (см. рис. 2.24): длина, положение центромеры, наличие или отсутствие области ядрышкового организатора и гетерохроматические участки. Центромера (- первичная перетяжка; от греч. kentron — центр, meros — часть) — это такое узкое место хромосомы, где хромосомы при перемещении начинают расходиться и где прикрепляются микротрубочки веретена деления. Эти микротрубочки оканчиваются в плоской или полукруглой многослойной структуре, которая расположена сбоку центромеры и известна как кинетохор (от греч. kinesis — движение, choros — место). Центромера разделяет хромосому на два плеча, относительная длина которых может быть от очень близкой до очень разной. Численное выражение соотношения этих длин — центромерный индекс (отношение длины короткого плеча к длине всей хромосомы). У хромосом некоторых (немногих) видов, например, у ожики (Luzula), центромеры вообще невозможно выявить, а нити веретена прикрепляются ко многим местам хромосом («диффузные» центромеры).
Рис. 2.24. Хромосомы выглядят при ядерных делениях (например, в мета- и анафазе митоза) как компактные единицы. Именно для них и было исходно введено понятие «хромосома» (В—препарат R. Martin, съемка в сканирующем электронном микроскопе G Wanner; С—СМ- фотография D. Schweizer): А—схема SAT-хромосомы с обеими теломе- рами, центромерой с обоими кинетохорами (местами прикрепления микротрубочек аппарата веретена), полосами гетерохроматина (дополнительных участков на теломерах и в области центромер), а также характерной для SAT- хромосом областью ядрышкового организатора (NOR) и гетерохроматическим сателлитом Хромосома расщеплена по длине на 2 хроматиды, которые позже станут дочерними хромосомами: В—хромосомы в анафазе у ячменя Ногdeum vulgare, двойной набор хромосом 2n = 28, хорошо различимы в каждом наборе дочерних хромосом 2 SAT-хромосомы, 4 NOR и 4 сателлита (1880х); С—хромосомный набор Anemone blanda (2n - 16); гетерохроматические полосы (за исключением тех, которые на центромерах) выделены способом дифференциальной окраски (600х)
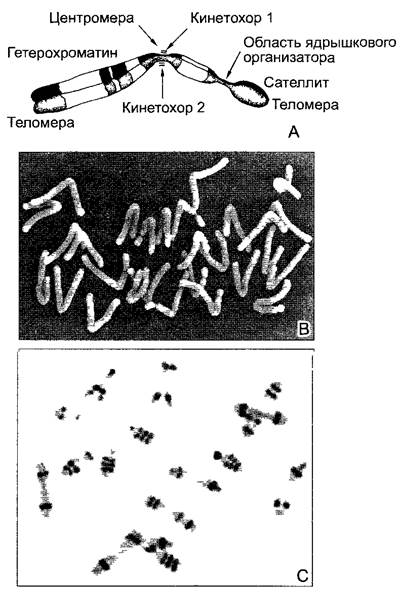
На концах хромосом формируются особые теломеры. Чтобы предотвратить слияние хромосом, которое возможно, например, после образования хромосомных мостиков, кроссинговер в теломерных районах не происходит (см. 7.2.1.1). С помощью специальных белков может осуществляться прикрепление теломер к ядерной оболочке. ДНК теломер отличается обширными повторами последовательностей. Репликация этой ДНК производится особой теломеразой, работающей с РНК.
Опыты по обработке клеток эндонуклеазами показывают, что каждая хромосома имеет только один тяж ДНК (после репликации в S-фазе клеточного цикла два тяжа) (одноцепочечная модель). После того как стало возможным секвенирование ДНК, все чаще и чаще становятся известными полные последовательности целых хромосом и геномов. Благодаря этому в настоящее время выяснены многие детали организации последовательностей ДНК хроматина, например, относительное положение и особая структура стартовых мест репликации ДНК (origins), кодирующие и некодирующие участки последовательностей, экзоны и интроны или регулятивные и множественные последовательности. Все это мы рассмотрим в разделах 7.2.1 и 7.2.2.
2.2.3.3. Ядрышки и прерибосомы
Ядрышки — это места биосинтеза рибосом. Они хорошо различимы уже при световой микроскопии как компактные, плотные структуры в ядрах. Каждое ядрышко пронизано отрезком хромосомной ДНК, который обозначается как область ядрышкового организатора(nucleolus organizer region, NOR) и несет повторяющиеся гены для рРНК, за исключением 5SрРНК (рДНК). Хромосомы с ядрышковым организатором обозначают как сателлитные, или SAT-хромое омы. В метафазе ядрышковый организатор различим даже под световым микроскопом как тонкое место плеча хромосомы (рис. 2.24, А, В). Эта хромосомная структура носит название вторичная перетяжка (первичная соответствует центромере). В гаплоидном наборе хромосом имеется по крайней мере одна SAT-хромосома; у растений она обычно только одна, так что число ядрышек соответствует плоидности: ядра диплоидных клеток тканей содержат 2 ядрышка, триплоидные ядра эндосперма у покрытосеменных — 3.
Гены рРНК представляют собой пример множественных (повторяющихся) последовательностей ДНК. Многочисленные транскрипционные единицы располагаются тандемно друг за другом и отделены более короткими некодирующими промежуточными участками (спейсерами). Каждая транскрипционная единица содержит гены для «крупных» рРНК всегда в одной и той же последовательности и транскрибируется как единое целое Первичный транскрипт — пре-рРНК — потом расщепляется на отдельные рРНК и освобождается от фланкирующих последовательностей, а остатки рибозы и основания местами метилируются. Для этого ядрышко имеет свой механизм, отличный от функций прочего пространства ядра1.
1 В районе ядрышка сосредоточены особые малые ядерные РНК (мяРНК), а также ферменты, осуществляющие процессинг РНК, которые часто кооперируются с мяРНК. — Примеч. Pед.
Рибосомальная ДНК свободна от нуклеосом. Ее транскрипция осуществляется постоянно присутствующей в ядрышке РНК-полимеразой I, лишь незначительно чувствительной к аманитину. На транскрипционных единицах плотно расположены в ряд молекулы РНК-полимеразы I. Каждая такая единица синхронно транскрибируется примерно 100 раз. Кроме этого, высокая скорость синтеза обеспечивается высокой повторяемостью генов рРНК. У высших растений достигается крайняя степень повторяемости (у пшеницы до 15 000 копий на ядро, у тыквы до 20 000, у кукурузы до 23 000). Это проявление того, что потребность в рибосомах, особенно в растущих клетках, невероятно велика. Поскольку срок жизни рибосом составляет всего лишь несколько часов, набор рибосом таких клеток должен постоянно возобновляться. Размер ядрышек соответствует интенсивности биосинтеза белка в клетке. В клетках, которые не синтезируют белков (например, генеративные клетки пыльцевых трубок), ядра содержат лишь маленькие ядрышки или вообще лишены их.
По мере созревания транскриптов все больше встречаются также рибосомные белки, затем готовые прерибосомы в качестве непосредственных предшественников больших и малых субъединиц рибосом отделяются от ядрышка и перемещаются к поровым комплексам ядерной оболочки.
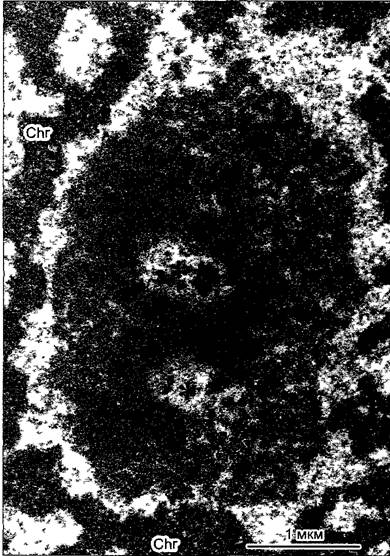
Последовательность этих процессов во времени отражается в структуре ядрышек (рис. 2.25), где имеются три различные зоны. В ядрышковом организаторе рДНК уложена в форме петель и изгибов и окружена тонким нитчатым материалом (фибриллярные центры); эти центры — места транскрипции. К периферии от них нитчатый материал уплотняется в плотные фибриллярные зоны — места процессинга. Наконец, в гранулярной зоне на периферии ядрышка скапливаются прерибосомы.
Рис. 2.25. Ядрышко в ядре клетки корневой меристемы AIlium сера (лук репчатый) (электронная микрофотография H. Falk)
Места локализации ядрышкового организатора (*) окружены плотно упакованным фибриллярным материалом Он содержит первичные транскрипты, тогда как в наружной, гранулярной зоне скапливаются прерибосомы; Chr — хроматин
2.2.3.4. Ядерный матрикс и ядерная оболочка
Если у выделенных ядер разрушить мембраны оболочки детергентами и осторожно удалить все растворимые белки, то даже после обработки нуклеазой останется студенистая рыхлая структура, которая по форме и размеру еще соответствует исходному ядру. Этот ядерный матрикс(nuclear matrix, ядерный скелет) состоит из смеси различных белков. С ним тесно связаны части хромосом, участвующие в репликации или транскрипции. То же относится и к ферментам репликации ДНК, и к РНК-полимеразам. Они прикрепляются к ядерному скелету и протягивают ДНК вдоль себя. С помощью иммунофлуоресцентной микроскопии удалось показать, что транскрипция и дальнейшее созревание РНК-продуктов сосредоточены у определенных мест ядерного пространства, где в массе скапливаются все необходимые факторы и ферменты. Даже на самой ДНК с некоторыми промежутками располагаются последовательности для прикрепления ядерного матрикса, и между этими пунктами фиксации ДНК образует петли, которые, несмотря на линейность хромосомной ДНК, ведут себя как кольцевая ДНК. В каждой такой петле транскрипция или же репликация может регулироваться независимо от соседней петли той же хромосомы.
Непосредственно внутри ядерной оболочки ядерный матрикс уплотняется в ядерную пластинку(nuclear lamina), которая у растений выражена не так четко, как во многих ядрах клеток животных. Она состоит из характерных белков — ламинов. Разрушение ядерной оболочки при делении ядра сопровождается сильным фосфорилированием ламинов. Наоборот, формирование ядерной оболочки заново при образовании дочерних ядер связано с дефосфорилированием ламинов. Остальной ядерный скелет также частично исчезает при ядерном делении, и в компактных хромосомах можно выявить только хромосомный скелет гораздо более простого строения.
Ядерная оболочка во многих местах находится в непосредственной связи с цистернами ЭР (ЭС) и несет на своей наружной стороне рибосомы. Этим она проявляет себя как часть ЭР, хотя отличается особым положением между карио- и цитоплазмой и наличием ядерных поровых комплексов (англ, nuclear pore complexes, NPC) (рис. 2.26). Через ядерные поры осуществляется транспорт из ядра РНК (например, мРНК, тРНК) и рибонуклеопротеиновых частиц (например, субъединиц рибосом), транспорт внутрь ядра «кариофильных» белков (например, гистонов, ДНК- и РНК-полимераз) и повторное перемещение туда и обратно, определенных белков и комплексов, которые курсируют между пространствами ядра и цитоплазмы (например, импортины; см. 7.3.1.4, рис. 7.17) На 1 мкм 2 ядерной оболочки может быть до 80 ядерных поровых комплексов.
Рис. 2.26. Поровые комплексы ядерной оболочки (А — электронная микрофотография V Sреth).
А—ядерная оболочка Аllium сера, замораживание-скалывание, В—модель ультраструктуры порового комплекса. В перинуклеарной цистерне находится наружное кольцо со спицами, которое вместе с ядерным и цитоплазматическим кольцами несет радиальные спицы. Области между спицами уплотнены аморфным материалом. Цитоплазматическое кольцо несет 8 субъединиц, от которых отходят в цитоплазму нити (филаменты). Спицы держат над внутренним кольцом центральную трубковидную пробку (центральную гранулу). Через нее проходят различные частицы, которыми обмениваются ядро и цитоплазма
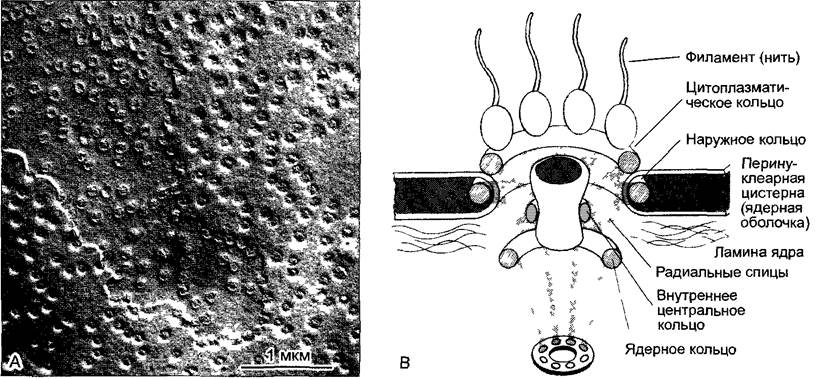
Поровые комплексы, которые выглядят очень сходно у всех эукариот, имеют очень сложное строение (рис. 2.26, В) Масса всего комплекса, составляющая более 100 МДа, превосходит массу одной рибосомы в 10 — 30 раз В его построении участвует от 30 до более 100 белков. Они известны под названием нуклеоноринов. Многие нуклеопорины содержат многократно повторяющуюся последовательность из двух аминокислот: фенилаланин- глицин. Это указывает на филетическое родство нуклеопоринов.
2.2.3.5. Митоз и клеточный цикл
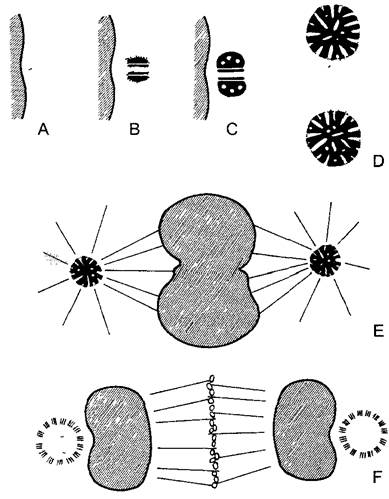
Под митозом мы понимаем наиболее частую форму клеточного деления (кариокинеза). В результате него из одного ядра получается два дочерних. Название происходит от появления при митозе конденсированных хромосом (от греч mitos — нить, первые детальные исследования митозов были проведены Э. Страсбургером1, основателем этой книги, на растениях и В. Флеммингом — на животных с особенно длинными хромосомами, рис 2 27). Перед каждым митозом в интерфазе (фазе между двумя следующими друг за другом делениями ), находящаяся в клетке генетическая информация реплицируется. Митоз — это такой процесс, при котором c помощью веретена деления (= митотическое веретено = аппарат веретена) оба идентичных набора хромосом разделяются точно поровну по двум дочерним клеткам. Митоз с генетической точки зрения является эквационным делением (лат. aequális — равный). Все клетки, происходящие из одной исходной путем митозов, представляют собой клеточный клон — множество генетически идентичных клеток (от греч klon — ветвь, побег). В результате мутаций однообразие в клоне может быть нарушено. Митоз часто — но ни в коем случае не всегда — связан с делением клетки (цитокинезом).Последнее, несмотря на эквационное деление ядра, может быть совершенно неравным и приводить, например, к образованию двух дочерних клеток разного размера. Такие неравные клеточные деления всегда происходят в начале процессов дифференцировки.
1 Честь открытия митоза принадлежит И. Д. Чистякову, который впервые наблюдал его на растительных клетках Э. Страсбургер был знаком с работой Чистякова, но опубликовал результаты от своего имени на год позже. Русский приоритет в открытии митоза на сегодня несправедливо забыт — Примеч. ред.
Митоз не характерен для прокариот. Однако, и у них обеспечивается равномерное распределение реплицируемого наследственного материала, хотя и посредством совершенно других механизмов (см 2 3 1), так что и у них имеются клеточные клоны. Клонирование ДНК, т. е. идентичное тиражирование тех или иных последовательностей ДНК в быстро растущих бактериальных культурах, — основной метод генной инженерии.
Ход митоза известен уже примерно более 100 лет. Обычно, он подразделяется на пять этапов (рис. 2.27; 2.28). В течение относительно длительной подготовительной фазы — профазы, в которой хромосомы медленно конденсируются, чувствительный к механическим воздействиям генетический материал переводится из рыхлой «рабочей» формы в компактную «транспортную» форму (рис. 2.29). При световой микроскопии это выглядит как огрубление хроматиновой структуры, хромосомы становятся различимыми поодиночке, а их плечи как бы рассечены в длину. Происшедшая перед этим репликация ДНК проявляется, таким образом, также и в структуре ДНК. Конденсация хроматина осуществляется белками, из которых основную роль играют связующие гистоны группы Н1 и так называемые SMC- белки (аббревиатура SMC происходит от открытого у дрожжей Saccharomyces гена SMC1, продукт которого обеспечивает стабильность мини-хромосом —- Stabüity of mini-chromosomes).
Рис. 2.27. Митоз и деление эмбриональной клетки (кончик корня Аlое thraskii) (по G. Schaffstein): А—интерфаза, В—D — профаза, Е—прометафаза, F—метафаза; G— анафаза; Н, I—телофаза и деление клетки (1000х), n—ядро; nI—ядрышко; сh—хромосомы, рI—цитоплазма; s—веретено, к—полярная шапка; кр—экваториальная пластинка; t—дочерние ядра; z—растущая срединная пластинка во фрагмопласте; m—клеточная пластинка, которая позже превратится в срединную пластинку новой клеточной стенки
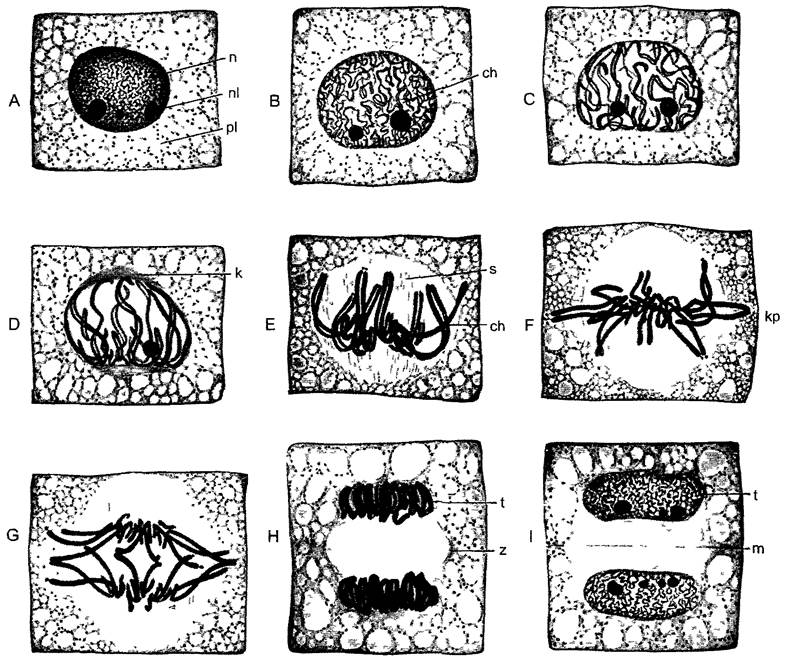
Рис. 2.28. Митоз и клеточное деление в апикальной клетке волоска тычиночной нити Tгаdescantia virgimana, живой препарат (680х): 1—конец профазы, четко видны полярные шапки над и под конденсированными хромосомами; 2—прометафаза (метакинез, длительность 15 мин); 3—метафаза (15 мин), 4, 5—анафаза (10 мин); 6— начинающаяся телофаза и деление клетки путем образования клеточной пластинки
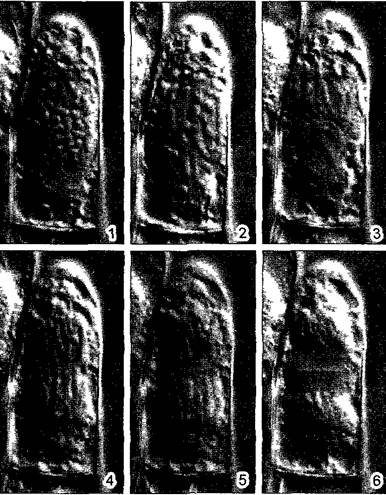
Рис. 2.29. Конденсация и деконденсация хроматина при митозе (по G. Wanner).
А—интерфаза, В, С—усиливающаяся конденсация во время профазы и метакинеза, D—метафаза (останавливаемая метиламипрофосом, который особенно сильно действует на конденсацию); Е—анафаза; F—деконденсация в телофазе. Для приготовления препаратов из фиксированных кончиков корней ячменя Hordeum vulgare была приготовлена суспензия клеток путем ферментативного разложения клеточных стенок Протопласты лопаются при нанесении на охлажденное предметное стекло. Далее под покровными стеклами препараты подвергают глубокой заморозке, после удаления покровных стекол осторожно обезвоживают и исследуют в сканирующем электронном микроскопе
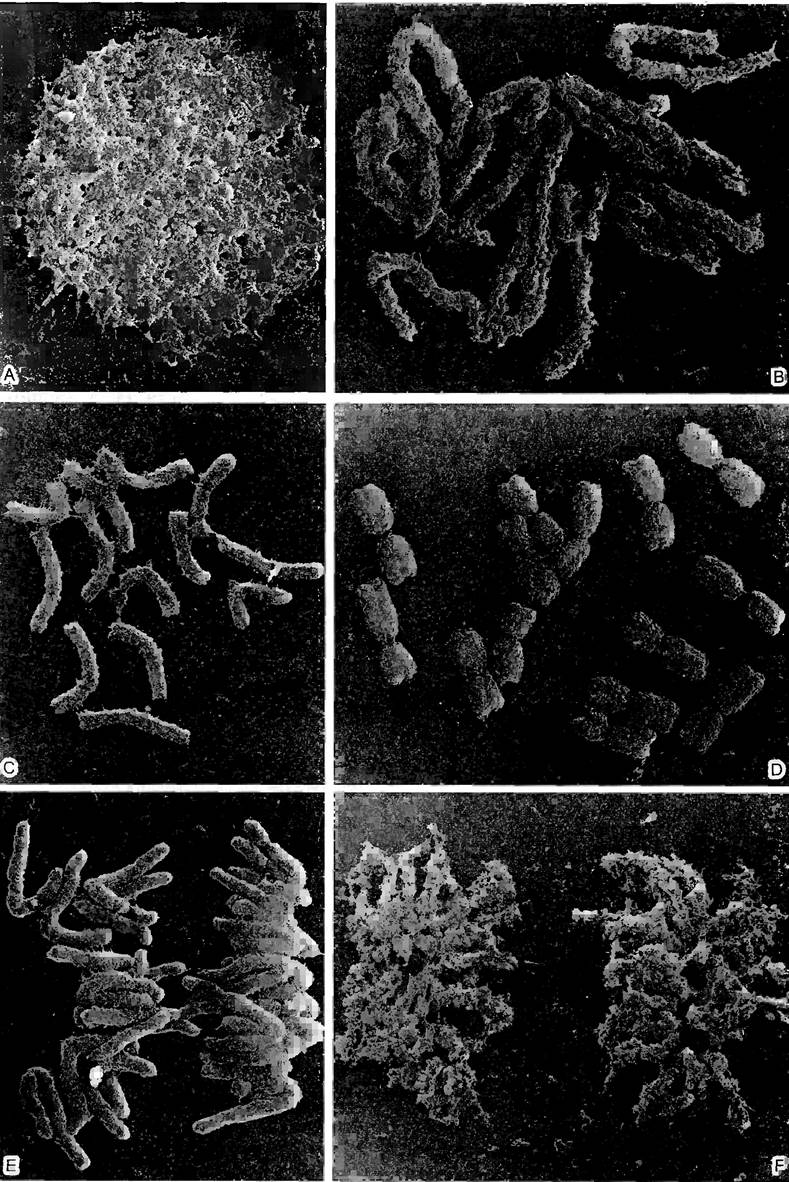
В цитоплазме во время профазы формируется аппарат веретена. Уже до конденсации хроматина во многих случаях периферические микротрубочки придвигаются друг к другу, образуя препрофазный пучок, который обозначает будущий экватор клетки (см. рис. 2.13). Позже микротрубочки группируются в характерное митотическое веретено (см. бокс 2.2). Все более крупные цитоплазматические органеллы вытесняются из области веретена. Конец профазы наступает тогда, когда распадается ядерная оболочка. Перинуклеарная цистерна при этом быстро разбирается на пузырьки и мелкие цистерны, которые перемещаются к полюсам веретена. После они будут снова использованы при образовании оболочек дочерних ядер.
За профазой следует переходная фаза, в которой сначала кинетохоры хромосом приходят в контакт с микротрубочками веретена и перемещаются на экватор клетки — плоскость симметрии между полюсами веретена (метакинез вовремя так называемой прометафазы). Непосредственно после фрагментации ядерной оболочки ядрышки также отделяются от вторичных перетяжек SАТ-хромосом1 и мигрируют из области веретена. Чаще всего они рассеиваются в цитоплазме. Правда, часть материала ядрышек находится адсорбированной на поверхности хромосом и позже переносится ими в дочерние ядра.
1 ДНК генов рибосомальной РНК остается в составе хромосомы! — Примеч. ред.
Центромеры отличаются особыми, часто повторяющимися последовательностями ДНК, которые никогда не транскрибируются. Здесь к хромосоме присоединяются многочисленные специфические белки (СЕNP, центромерные белки), которые, в частности, формируют имеющие форму пластинок кинетохоры и прикрепляют их к хромосомальной ДНК. Наружная пластинка кинетохоров имеет большое сродство с плюс-концами микротрубочек веретена, внутренняя — с внутренним хроматином центромер.
Постепенно центромеры хромосом, теперь максимально конденсированных, располагаются по экватору клетки; их плечи чаще всего направлены в сторону полюсов от «экваториальной пластинки». Так начинается метафаза (от греч. metа — посередине). На этой стадии лучше всего наблюдать хромосомный набор, используя световой микроскоп (см. рис. 2.24, В, С). С помощью алкалоида колхицина, который вызывает разрушение микротрубочек веретена, митоз можно остановить в метафазе.
Метафаза продолжается сравнительно долго. Это делает возможным правильное расположение только слегка качающихся хромосом в аппарате веретена. Одновременно подготавливается окончательное разделение реплицирующихся хромосом, будущие дочерние хромосомы становятся все четче различимы как их продольно рассеченные половины (хроматиды). Под конец хроматиды часто соединены вместе только у центромер. Соединение их обеспечивается когезином — мультимерным белковым комплексом.
С синхронным протеолитическим разложением когезиновых комплексов резко начинается анафаза: ставшие самостоятельными дочерние хромосомы с помощью веретена деления (бокс 2.2) перемещаются к полюсам веретена (от греч. аnа — вверх, вдоль). При этом одна из гомологичных дочерних хромосом перемещается к одному, а другая — к другому полюсу: в анафазе генетический материал распределяется по будущим дочерним ядрам и соответственно клеткам. Еще не разделенная клетка находится в этой фазе на наивысшем уровне плоидности. Если, например, ядро было диплоидным (2n), то теперь клетка временно тетраплоидна (4n).
Бокс 2.2
Движения хромосом при митозе и мейозе обеспечиваются почти исключительно аппаратом веретена. Для каждого ядерного деления оно образуется заново и после окончания деления снова исчезает.
То, что при световой микроскопии при благоприятных условиях видно, как нити веретена, при электронной микроскопии оказывается пучком микротрубочек, которые относятся к лабильному типу. На рис А схематично представлены три микротрубочковых компонента веретена деления, различающиеся по положению и функции. Весь аппарат веретена представляет собой биполярную, зеркально симметричную структуру, которая состоит из двух полуверетен. Оба полюса веретена функционируют как центры организации микротрубочек (microtubule organization centers, ЦОМТ, см 2 2 2 1). От них отходят:
Рис. А. Веретено ядерного деления, схема, ранняя анафаза
Звездчатые и полярные микротрубочки — черные, кинетохоры и кинетохорные микротрубочки — светло-серые, стрелки — экватор
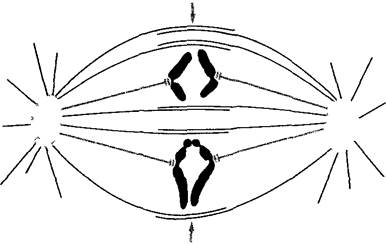
✵ Кинетохорные микротрубочки, которые тянутся до центромер хромосом и там вступают в контакт с трехслойными контактными пластинками — кинетохорами. Образованные из кинетохора и микротрубочек нити веретена раньше называли хромосомными нитями.
✵ Полярные микротрубочки (ранее называвшиеся непрерывными нитями или полярными нитями), которые тянутся к экватору веретена и там, в плоскости симметрии веретена, образуют зону наложения. В этой области в телофазе возникает фрагмопласт (см 2 2 3 6).
✵ Звездчатые микротрубочки (астеры), которые не идут ни к кинетохорам, ни к зоне наложения, а расходятся от полюсов в разных направлениях Астеры (от греч asteron — небесное светило) в массе образуются в некоторых животных клетках, они окружают расположенные по полюсам пары центриолей этих клеток как один плотный венец из лучей. У растений этот компонент веретена часто развит лишь скудно, а иногда полностью отсутствует.
Аппарат веретена оплетен ЭР, и отростки этой мембранной системы внедряются между микротрубочками веретена (митотическая сеть).
В профазе микротрубочки веретена формируются вокруг ядра. При световой микроскопии непосредственно за ядерной оболочкой видны плоские, сильно преломляющие свет области, внутри которых нет никаких более крупных клеточных органелл (полярные шапки). У растительных клеток центриоли при этом, в отличие от большинства животных клеток, часто не играют никакой роли. Это относится не только к покрытосеменным, у которых вообще нет никаких центриолей, но и ко многим голосеменным и даже некоторым грибам и водорослям (по меньшей мере, в вегетативных частях тела). У полюсов веретена находятся уплотненные зоны плазмы, резко не отграниченные, — центроплазма (часто их называют центросомами; внимание: не путать с центромерами хромосом). Они функционируют как ЦОМТ.
В анафазе более или менее синхронно происходят движения двух типов. С одной стороны, центромеры дочерних хромосом мигрируют при сокращении кинетохорных микротрубочек по направлению к полюсам (анафаза А), с другой стороны, полюса отдаляются друг от друга (анафаза В). Оба процесса движения происходят непрерывно и медленно, со скоростью порядка 1 мкм-мин-1. Вместе они гарантируют максимальное отдаление дочерних наборов хромосом друг от друга.
Поскольку в аппарате веретена только его полюса функционируют как ЦОМТ, все микротрубочки обращены к полюсам своими минус-концами, а плюс-концы находятся в экваториальной зоне наложения и у кинетохоров. В зоне наложения микротрубочки располагаются антипараллельно обоим полуверетенам. Здесь во время анафазы АТФаза, сходная с кинезинами, осуществляет скольжение друг относительно друга противоположно ориентированных микротрубочек и, таким образом, расхождение полуверетен (действие толкающего тела полярных микротрубочек, анафаза В). Механизм анафазы А выяснен хуже. Опыты с ингибиторами показали, что актомиозиновая система клетки здесь не участвует. Поразительно, что кинетохорные микротрубочки во время анафазы не перемещаются, они укорачиваются не у полюса, а у кинетохора, т.е. у своего плюс- конца. Здесь также концентрируется цитоплазматический динеин. Насколько в разборке кинетохорных микротрубочек участвует локальное повышение в разных местах концентрации ионов Са2+(эти ионы могут высвобождаться из митотической сети), еще не выяснено. Кальмодулин связывается с кинетохорными микротрубочками, тогда как полярные микротрубочки от него свободны.
Это можно использовать при искусственном получении полиплоидных растений. При применении колхицина возникает много тетраплоидных клеток в меристематических тканях побега. Разделившиеся хромосомы при нарушении аппарата веретен деления наконец объединяются в одном-единственном «воссоединенном» ядре, которое соответственно крупнее обычных и при последующих митозах остается тетраплоидным. Из-за увеличения отношения ядро/цитоплазма увеличиваются также размеры клеток и в конечном счете урожай данного культурного растения. Многие современные культурные растения полиплоидны.
Как результат перемещений при анафазе оба хромосомных набора дочерних ядер в еще не разделившейся материнской клетке отходят друг от друга насколько воз
можно далеко. Движение их при этом прекращается и наступает конец анафазы, самой короткой стадии митоза.
В заключительной фазе (телофаза; от греч. télos — конец, цель) основные этапы профазы протекают в обратном направлении и обратной последовательности. Аппарат веретена исчезает, вокруг тесно скученных в полярных областях хромосом путем слияния цистерн ЭР снова образуются замкнутые ядерные оболочки, в которых также вскоре снова возникают ядерные поры. Хромосомы располагаются более рыхло, а их эухроматические части превращаются в типичный хроматин интерфазных ядер — генетический материал снова «распаковывается», чтобы иметь возможность стать физиологически активным. Очень быстро снова образуются ядрышки, сначала путем конденсации материала, который привносится на поверхности хромосом, но вскоре также за счет возобновления синтеза предшественников рРНК у ядрышковых организаторов SAT- хромосом. В цитоплазме снова начинается синтез белка, который при митозе временно приостанавливается, и в целом клеточное деление завершается (см. 2.2.3.6).
С окончанием телофазы наступает интерфаза — собственно рабочая фаза хроматина. Она продолжается значительно дольше, чем весь митоз. Закономерное чередование интерфазы и митоза называют клеточным циклом (см. рис. 2.30; 7.20). В клетках образовательных тканей клеточный цикл протекает постоянно, в клетках других тканей он после некоего митоза останавливается. Исследования с помощью изотопов показали, что репликация хромосомной ДНК осуществляется в середине интерфазы. Этот период обозначается как S-фаза («S» — synthesis, синтез; причем важен синтез ДНК, поскольку РНК и белки образуются на протяжении всей интерфазы). Временной интервал между митозом (М-фазой) и S-фазой — G1-фаза, стадия между S-фазой и следующим митозом — соответственно G2-фаза (G от англ, gap — промежуток, интервал). В следующих друг за другом клеточных циклах постоянно чередуются друг с другом удвоение и распределение, т.е. репликация и сегрегация генетического материала. Промежуточные G-фазы служат для роста клетки (прежде всего G1) и подготовки следующего митоза (G2). Решающий момент бывает перед началом S-фазы; в это время определяется, будет ли данная клетка вновь претерпевать митоз, т.е. повторится ли клеточный цикл. Если, напротив, решающий момент не пройден, ядро и клетка больше не делятся, и происходит дифференцировка клетки в тканевую или покоящуюся (Go-фаза).
Рис. 2.30. Последовательность фаз в клеточном цикле: М—митоз, G1—постмитотическая фаза роста, D—дифференцировка в тканевые клетки, ДНК которых остается нереплицированной (G0), R—реэмбрионализация, например, при регенерации, S—репликация ДНК, G2—премитотическая фаза, треугольные стрелки 1 и 2—точки контроля. О сложной регуляции клеточного цикла информирует рис. 7 19
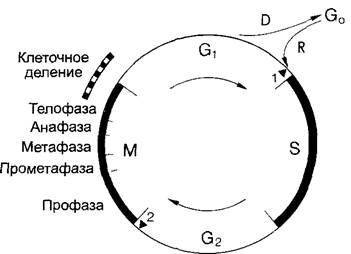
В некоторых случаях нормальный ход клеточного цикла в значительной степени отклоняется Хотя, в целом, G1 является фазой эмбрионального (основанного не на увеличении вакуолей, а на синтезе белка и мембран) клеточного роста, она оказывается особенно укороченной или вообще отсутствует при быстрых ядерных или клеточных делениях. Это имеет место, например, у слизевика Рhysarum, в многоядерном плазмодии которого все ядра синхронно делятся (происходит кариокинез), а плазма не разделяется в фазу G2 (цитокинез отсутствует). Еще более сильное отклонение от нормального клеточного цикла ведет к появлению автополиплоидных клеток: здесь повторяются S-фазы без вклинивающихся между ними М-фаз (эндоредупликация). Общепринятый термин «эндомитоз» в этом отношении вводит в заблуждение. Процессы регуляции клеточного цикла (контроль клеточного цикла)будут рассмотрены в физиологической части книги (см. 7.3.2).
Ядра слюнных желез многих насекомых, характеризующиеся высокой автополиплоидностью, показывают знаменитые политенные гигантские хромосомы с характерными поперечными полосами. У растений сходные впечатляющие образования можно встретить лишь как исключение, хотя автополиплоидные клетки встречаются нередко, а в области зародышевого мешка, например, регулярно (рис. 2.31).
Рис. 2.31. Различные хроматиновые структуры эндополиплоидных ядер в клетках-антиподах (зародышевом мешке) мака-самосейки Papa- ver rhoeas, схематизировано (по G. Hasitschka)

2.2.3.6. Клеточное деление — ценобласты и энергиды
С ядерными делениями обычно связаны деления клеток. В то время как в телофазе разрушается аппарат веретена, по экватору клетки возникают многочисленные новые, относительно короткие микротрубочки, ориентированные перпендикулярно плоскости экватора. За счет их равномерного расположения вся плазматическая область между дочерними ядрами разделяется надвое. Такая система микротрубочек носит название фрагмопласт1 («образователь стенки»; от греч. рhragma — разграничение, рlastes — образователь). В нем также накапливаются актиновые нити. Вблизи фрагмопласта собирается много активных диктиосом. От них наполненные матриксом клеточной стенки пузырьки аппарата Гольджи мигрируют во фрагмопласты, располагаются в экваториальной плоскости и сливаются друг с другом после образования особых «трубочек слияния». При этом важную роль играет концентрирующийся здесь белок — фрагмопластин (гомолог динамина, при помощи которого происходит везикулярный транспорт в животных клетках). Так возникает как первый слой стенки между дочерними клетками внутриклеточная срединная пластинка.
1 Нередко к фрагмопласту относят также везикулы, содержащие матричные полимеры клеточной стенки (фрагмосомы). — Примеч. ред.
Процесс образования перегородки начинается в середине бывшей материнской клетки. Затем срединная пластинка нарастает путем постоянного включения новых пузырьков из аппарата Гольджи в ее края, вплоть до стенки материнской клетки. Этот процесс, как правило, протекает быстро разделение дочерних клеток — часто вопрос лишь нескольких минут. В случае крупных клеток, например, в инициальных клетках камбия (рис. 2.32; см. 3.1.2), центробежный рост клеточной пластинки может длиться значительно дольше. Уже при возникновении срединная пластинка оказывается пронизанной тяжами ЭР, вокруг которых образуются первичные плазмодесмы. Как только взаимное разграничение дочерних клеток завершится, каждая из них начинает выделять внутрь от первичных пластинок собственную первичную клеточную стенку с целлюлозными фибриллами.
Рис. 2,32. Образование клеточной пластинки в клетке камбия (по I.W. Bailey): А—телофаза, образование фрагмопластов, В, С—фрагмопласт нарастает центробежно и достигает сначала боковых стенок вытянутых клеток; концы клеток еще не разделены
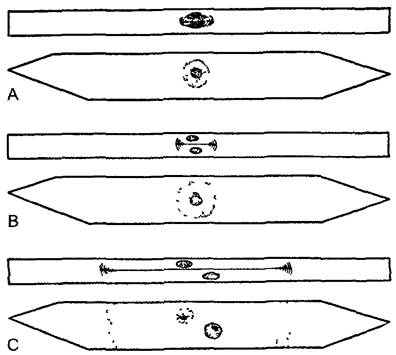
Не всегда за кариокинезом следует цитокинез. Результатом таких «свободных» ядерных делений бывают многоядерные клетки — плазмодии. Они могут достигать макроскопических размеров (см. рис. 2.9; плазмодии слизевика Рhysarum polycephalum, размеры которых могут быть со столовую тарелку, содержат порядка 1 млрд ядер). Плазмодии не редки у водорослей (например, у сифоновых зеленых) и грибов (оомицетов, хитридио- и зигомидетов), они встречаются иногда даже у высших растений. Например, многоядерный эндосперм некоторых семян представляет собой плазмодий (наиболее известный пример кокосовое молоко), так же, как и млечники молочаев (см 3 2 5 1) Правда, многоядерные клетки (ценобласты) могут возникать также путем слияния одноядерных клеток. В этих случаях говорят о синцитиях. Например, синцитиальные ценобласты находятся в расчлененных млечниках — сосудах одуванчика (Taraxacum) или в тапетуме пыльников.
Открытие ценобластов было сделано физиологом растений Ю Саксом, который ввел понятие энергида (от греч energos — действенный). Под этим понимается функциональная единица из одного ядра с физиологически приуроченной к нему областью цитоплазмы. У одноядерных клеток понятия «клетка» и «энергида» совпадают, такие клетки моноэнергидны. Ценобласты, как плазмодии, так и синцитии, напротив, полиэнергидны. И в этих случаях понятие «энергида» не является только мысленной конструкцией, поскольку подтверждается таким фактом, что при определенных обстоятельствах полиэнергидные клетки очень быстро за счет деления своей плазматической массы (так называемые свободное, т е не зависящее от ядерных делений, образование клеток) распадаются на моноэнергидные клетки Так, например, многоядерный протопласт желтозеленой водоросли Botrydium (см рис 11 73, G, Н) быстро делится на одноядерные подвижные клетки со жгутиками, когда место произрастания водоросли заливается водой (рис 2.33)
Рис. 2.33. Полиэнергидный эндосперм Reseda с продвигающимся вправо образованием клеточных стенок (240х) (по Е. Strasburger)
Как и митоз, клеточное деление у многих низших растений и грибов значительно отклоняется от схем, представленных в учебнике. У жгутиковых и некоторых водорослей наблюдается деление бороздой, которое вообще-то типично для животных клеток перешнуровка материнской клетки с помощью экваториального актомиозинового кольца. У дрожжей материнская клетка вообще не делится, вместо этого одно из двух дочерних ядер выталкивается в уже предварительно образовавшийся вырост клетки, который позже отшнуровывается (почкование) (рис 2.34). У базидиомицетов клетки гиф дикариотичной стадии, которые содержат пары генетически неоднородных ядер, делятся с образованием боковых выростов — «пряжек» (см рис 11 52), оба ядра делятся синхронно и параллельно, одно — в самой клетке гифы, другое — в пряжке. При этом обеспечивается воспроизведение в каждой дочерней клетке пары несестринских ядер.
Рис. 2.34. Почкование клеток у пивных дрожжей Saccharomyces cerevisiae (100х) (по А Guilliermond)
2.2.3.7. Мейоз
При митозе оба дочерних ядра получают точно одинаковые наборы генетической информации, которые идентичны также набору информации материнского ядра. Напротив, при мейозе из одной диплоидной материнской клетки в результате двух следующих друг за другом этапов деления возникают 4 гаплоидные дочерние клетки (гоны)1, которые в генетическом отношении точно не соответствуют ни друг другу, ни материнской клетке. За счет сингамии, при слиянии двух гаплоидных — правда, принадлежащих одному виду, но генетически различающихся — гамет (зародышевых клеток, греч. gamètes — супруг), наоборот, возникает диплоидная клетка с двумя сходными, но не идентичными наборами хромосом — зигота (греч — объединенный). Сингамия — центральный процесс оплодотворения на клеточном уровне. Мейоз и сингамия составляют основу раздельнополости в научно-биологическом смысле.
1Термин «гоны» практически не применяется в отечественной литературе. По отношению к растениям правильнее считать, что в процессе мейоза образуются споры — Примеч. ред.
Точность удвоения ДНК и деления хромосом с помощью аппарата веретена исключают нежелательные случайности при митозе. Образно можно сказать, что при половом процессе случайности, наоборот, дается шанс. В полном жизненном цикле с половым процессом в трех местах может участвовать случайное распределение генетической информации
✵ В профазе мейоза (см ниже) происходит обмен участками между соответствующими (гомологичными) отцовскими и материнскими хромосомами диплоидного набора (интрахромосомная рекомбинация), место и масштаб этих взаимных обменов фрагментами в значительной мере случайны.
✵ При первом мейотическом делении отцовские и материнские хромосомы произвольно распределяются по двум дочерним клеткам (интерхромосомная рекомбинация)
✵ При слиянии гамет опять только случай определяет, какие гаметы в конкретной ситуации сливаются между собой в зиготу.
Раньше мейоз называли редукционным делением, так как при нем диплоидный набор хромосом (2n) сокращается до гаплоидного (1n) Как предпосылка для сингамии это действительно очень важный процесс Однако сокращение 2n до 1n могло бы быть достигнуто и при одном-единственном этапе деления1. Фактически уже после первого мейотического деления (мейоза I) обе дочерние клетки гаплоидны Однако везде, где в мире живых организмов встречается мейоз, за мейозом I следует мейоз II, и только за счет него возникают четыре гона В дальнейшем будет показано, что только таким путем с полным успехом может быть достигнута новая комбинация наследственного мате риала (рекомбинация). Мейоз — это не только редукционное деление, а прежде всего, также рекомбинационное деление2
1 Эта возможность реализована у некоторых простейших (Hypermastigma) — Примеч. ред.
2 В традиционной биологической литературе термин не используется Он правомерен только в философском контексте — Примеч. ред.
Мейоз и сингамия как комплементарные — генетические и клеточные — основные процессы каждого полового размножения обеспечивают постоянный обмен наборов генов (соответственно аллетей) вида (пул генов, gene pool), что, в свою очередь, может трактоваться как воображаемое размножающееся сообщество (Аллели — различные формы одного гена, которые занимают одно и то же положение в гомологичных хромосомах, однако определяют различное проявление соответствующего признака, греч alloios — различный). Правда, имеются и организмы, у которых полового размножения2 не наблюдалось. Это в основном прокариоты, а среди эукариот — эвглены и Cryptophyta, а также многие динофлагелляты и многочисленные грибы. У этих организмов понятие вида должно трактоваться иначе.
2 Здесь авторы употребляют не совсем точную терминологию, заимствованную из биологии животных. Для растений лучше отдельно говорить о размножении (например, при образовании спор, из которых вырастает множество новых гаметофитов), а отдельно — о половом воспроизведении (при слиянии гамет число клеток уменьшается, однако воспроизводится спорофит — «исходное» 2n-растение) — Примеч. ред.
Мейоз начинается со сложной, протяженной во времени профазы. Здесь можно различить несколько стадий, так как хромосомы в поле светового микроскопа видны внутри интактной ядерной оболочки и претерпевают серию характерных изменений (рис 2 35, А—Е).
Рис. 2.35. Мейоз в клетках спорогенной ткани пыльника Аlое thraskii (1000х) (по G. Schaffstein)
А—Е — профаза мейоза I (А—лептотена, В—зиготена, С—пахитена, D—диплотена, E—диакинез), F—метафаза I,G—анафаза I, Н—телофаза I,I—интеркинез, К—М — мейоз II, образование 4 ядер гонов
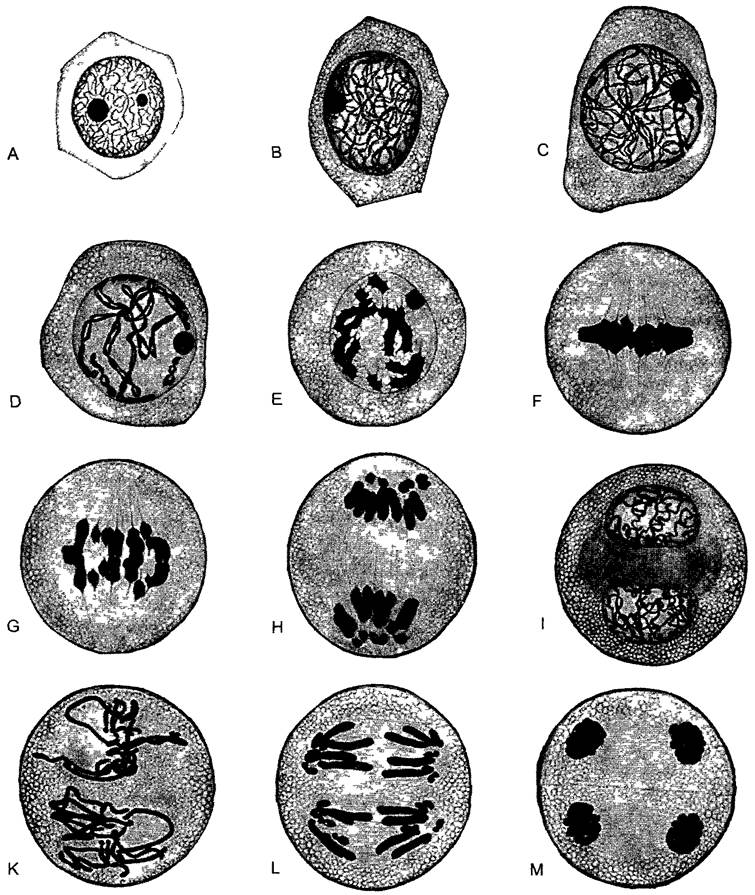
На стадии лептотены (после продолжительной S-фазы и увеличения ядра в размере) хромосомы становятся видимыми как тонкие хромонемы (от греч leptós — тонким, tamía — лента, néma — нить) Во многих местах, которые характерны для каждой хромосомы, хромонема свертывается в хромомеры (рис 2.36). Теломеры отдельных хромосом закрепляются у ядерной оболочки или у ядерной пластинки (ламины). О том, что хромосомы уже реплицированы, судить на этой и последующей стадии мейотической профазы нельзя.
Рис. 2.36. Лептотена (А) и зиготена (В) в клетке спорогенной ткани пыльника Trillium erectum (1500х) (по C.L.Huskins, S.G. Smith).
При спаривании гомологов аналогичные хромомеры располагаются друг возле друга: картина «веревочной лестницы»
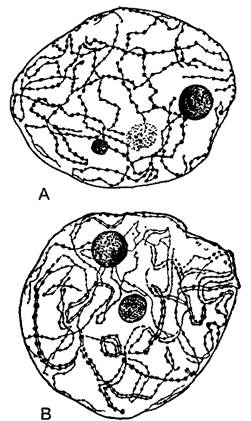
На стадии зиготены гомологичные хромосомы (т е соответствующие друг другу хромосомы из материнского и отцовского наборов) попарно сходятся друг с другом по всей длине (синапсис). Обычно синапсис начинается в районе теломер и постепенно идет до центромер. Такие случаи, когда между конъюгирующими хромосомами вклинивается другая хромосома (так называемый interlocking), бывают крайне редко. Синапсис служит предпосылкой соответствующего расположения хромосом в интерфазном ядре, которое достигается путем прикрепления теломер к внутренней стороне ядерной оболочки и последующего взаимного перемещения соответствующих мест прикрепления. Между спаренными гомологами образуется хорошо видимый при электронной микроскопии синаптонемальный комплекс — белковая структура, которая стабилизирует взаимодействие двух молекул ДНК.
Рис. 2.37. Синаптонемальный комплекс (SC) между спаренными хромосомами С1 и С2 у сумчатого гриба аскомицета Neottiela (по D von Wertstem)
А—продольный разрез в поле электронного микроскопа, В—схема Уже перед началом спаривания реплицированные хромосомы снабжены с одной стороны перпендикулярно расположенными синаптомерами, которые в регулярной последовательности образуют лентовидный латеральный элемент L Латеральные элементы гомологичных хромосом в зиготене схвачены друг с другом белковыми комплексами с сильной тенденцией к агрегации, возникает плотный, фланкируемый нечеткими поперечными элементами центральный элемент Р В SC местами происходит молекулярное спаривание гомологичных последовательностей ДНК по 2 из 4 хроматид Это является предпосылкой для межхромосомной рекомбинации путем кроссипговера
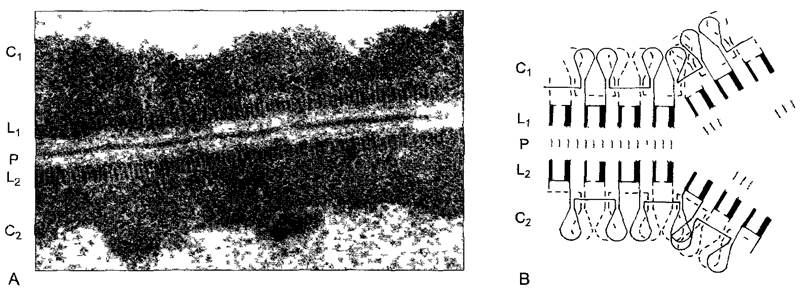
На стадии пахитены конъюгация гомологичных хромосом завершается (рис. 2.38). Число хромосомных пар (бивалентов) в ядерном компартменте соответствует гаплоидному числу хромосом п соответствующего биологического вида. В этой фазе происходит интрахромосомальная рекомбинация (т.е. между двумя гомологичными хромосомами). Она выражается во временном усилении репаративного синтеза ДНК1, а морфологически в появлении рекомбинационных узелков — плотных округлых структур диаметром примерно 100 нм, которые прилегают сбоку к синаптонемальному комплексу. Непосредственный, молекулярный процесс обмена — кроссипговер (crossing over — перекрест) остается невидимым.
1 Об усилении репаративного синтеза судят по включению 3Н-тимидина в состав ДНК с дальнейшей радиоавтографией. Это указание имеет, скорее, исторический характер. — Примеч. ред.
Рис. 2.38. Спаренные гомологичные хромосомы (биваленты) ржи Secale cereale (тычинки, ранняя пахитена) (съемка в сканирующем электронном микроскопе G Wanner)
Биваленты вышли из разорванного профазного ядра слева вверху, справа интактное ядро (масштаб 20 мкм)
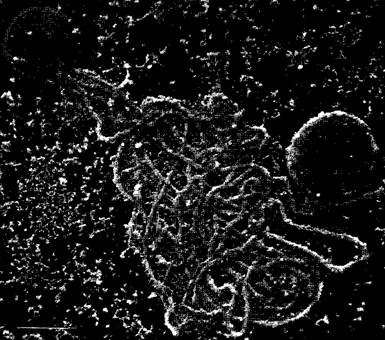
Постепенно хромосомы укорачиваются за счет дальнейшей конденсации, становясь при этом толще (греч. pachys — толстый). Этим подготавливается следующая стадия — диплотена. Ее начало соответствует концу синапсиса, синаптонемальные комплексы исчезают, а гомологичные хромосомы начинают отходить друг от друга, но остаются соединенными в местах, где происходил кроссинговер. Места перекреста, теперь хорошо различимые даже при световой микроскопии, называют хиазмами по греческой букве х (хи). Каждая хиазма представляет собой видимое проявление молекулярного перекреста (кроссинговера), который лежит в основе интрахромосомальной рекомбинации (см. 2.2.3.8). Хромосомы укорачиваются дальше, и теперь становится ясно, что они уже реплицированы: каждая хромосома разделена по длине на 2 хроматиды; из бивалентов возникли тетрады (стадия четырех тяжей). Более точные наблюдения показывают, что из 4 хроматид одной гомологичной пары в каждом случае фактически претерпевают кроссинговер только 2 хроматиды (рис. 2.39, D, F).
Рис. 2.39. Возникновение хиазм (по R.Rieger, А. Michaelis): А, В—спаривание гомологов; С—возникновение соответствующих друг другу разрывов хроматид; D— перекрестный обмен двух гомологичных отрезков хроматид; Е—прередукция для соседних с центромерой («проксимальных») отрезков хромосом; для «дистальных» отрезков (по другую сторону хиазмы) постредукция; F, G—двойной кроссинговер с обменом между тремя хроматидами, причем второй обмен осуществляется между хроматидой, которая уже участвует в первом обмене и ранее не участвовавшей хроматидой
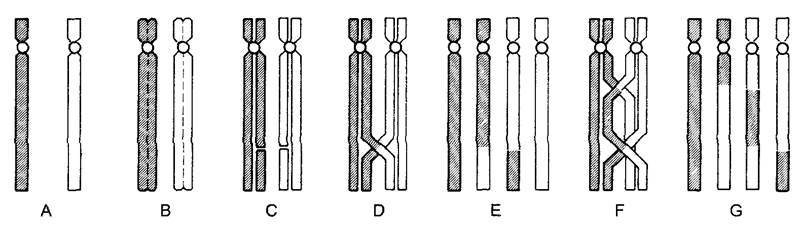
Для клетки диплотена часто является фазой роста, она длится соответственно долго. Росту клетки, в общем, предшествует усиленная транскрипция, и фактически диплотенные хромосомы часто бывают разрыхленными (стрепситена, греч. streptos — бахромчатый, курчавый).
Диакинез — последняя стадия мейоти- ческой профазы. Транскрипционная активность падает дальше, конденсация хромосом становится максимальной; хромосомы еще короче и толще, чем в митотической метафазе. Неразделенные центромеры каждой пары гомологов отделяются максимально далеко друг от друга. Движение друг от друга ограничивается расположенными рядом хиазмами. Однако часто хиазмы теперь бывают сдвинуты в направлении теломер, больше не связанных с ядерной оболочкой, и их число при этом поэтапно уменьшается (терминализация хиазм, рис. 2.40).
Рис. 2.40. Уменьшение числа хроматид от пахитены (А) до метафазы I (Е) (Anemone - lensis, 1000х) (no A. A. Moffett)

Диакинез (и при этом мейотическая профаза в целом) закачивается фрагментацией ядерной оболочки. В метафазе I гомологичные пары (!) располагаются по экватору веретена. Гомологи еще связаны между собой хиазмами, часто будучи свободными только у теломер. У центромер каждой из хромосом находится кинетохор. Какая из двух хромосом отправится к какому полюсу — дело случая. Можно сказать, что на этом этапе происходит межхромосомная рекомбинация.
Число возможных вариантов распределения для материнских и отцовских хромосом в анафазе I и соответственно вариантов комбинаций этих хромосом в дочерней клетке равно 2n.У организма с n = 10 в гаплоидном наборе имеется уже свыше 1 000 различных комбинаций, при n = 23 (например, у человека) — почти 8,4 млн, при n = 50 — больше триллиона (>1015). Шанс, что возникнут гаметы исключительно с отцовским или же материнским генетическим материалом, уже из-за случайного распределения отцовских и материнских хромосом крайне невелик, а учитывая к тому же всегда имеющийся обмен фрагментами хромосом, — практически нулевой. Перемешивание наборов аллелей уже только при мейозе, если даже не учитывать сингамию, крайне эффективно.
В анафазе I хиазмы наконец распадаются, гомологичные хромосомы больше не связаны между собой и мигрируют в веретене друг от друга. Важно, что в противоположность митотической анафазе в дочерние ядра попадают не хроматиды или же дочерние хромосомы, а уже реплицированные хромосомы с еще не разделенными центромерами и неудвоенным кинетохором. Эти хромосомы соответствуют не телофазным, а профазным хромосомам в случае нормального митоза. Дочерние клетки, мейоциты I, имеют, таким образом, в своих ядрах гаплоидный набор хромосом, но пока еще двойное количество ДНК: 2С в противоположность нерепли- цированному гаплоидному геному с количеством ДНК 1С.
При мейозе II количество ДНК уменьшается с 2С до 1С. В интерфазе между первым и вторым мейотическими делениями — интеркинезе — репликация ДНК не происходит, S-фаза выпадает. Соответственно интеркинез часто бывает коротким и может вообще полностью отсутствовать. Удваиваются только кинетохоры. В ходе мейоза II хроматиды, возникшие вовремя премейотической S-фазы и частично измененные при обмене участками (кроссинговере), отделяются друг от друга и попадают в разные дочерние ядра. Внешне, таким образом, мейоз II напоминает гаплоидный митоз. Однако дочерние хроматиды отдельных хромосом не идентичны в отношении состава аллелей. Это связано с тем, что вследствие межхромосомной рекомбинации вовремя пахитены в мейотической профазе в хроматидах чередуются сериями генетические локусы, занятые отцовскими или же материнскими аллелями. Такое бывает там, где между центромерой и уже затронутым местом происходит неравное число кроссинговеров. Эти, часто неидентичные, последовательности теперь вместе с идентичными последовательностями исходных сестринских хроматид отделяются друг от друга (постредукция, см. рис. 2.39). Гаплоидные гаметы содержат только один аллель каждого гена. Таким образом, при последующих митозах все потомки одной хромосомы будут идентичны.
Суммируя сведения о мейозе, можно сказать следующее. Редукция (уменьшение) числа хромосом с 2n до 1 n при мейозе I достигается за счет того, что по дочерним ядрам расходятся не хроматиды, а хромосомы. Уменьшение количества ДНК с 4С до 1С осуществляется за счет двукратного ядерного деления без промежуточной репликации. Это та вторая функция мейоза, которая делает необходимым втрое деление.
2.2.3.8. Кроссинговер
Последовательности ДНК, соответствующие определенным генам, сохраняются в одной хромосоме или же одной хроматиде за счет ковалентных связей между нуклеотидами вдоль двойной спирали ДНК. Поэтому в генетике все гены, которые локализованы на одной определенной хромосоме, обозначаются как сцепленные. Хромосомы — структурное соответствие тому, что в генетике называют группа сцепления. Разделение генов одной группы сцепления происходит при кроссинговере: несестринские хроматиды спаренных гомологичных хромосом обмениваются участками между собой. Данный процесс в пахитене начинается с того, что в двойных спиралях ДНК двух соседних несестринских хроматид в соответствующих местах эндонуклеазы разрывают одно- или двухцепочечкые молекулы ДНК, а после перекреста происходит сшивание (рис. 2.41). Процесс часто осложняется тем, что разрывы отдельных одиночных цепей ДНК происходят не точно друг напротив друга, так что необходимы дополнительный репаративный синтез последовательностей ДНК и удаление излишних концов последовательностей. Эти процессы происходят в рекомбинационных узелках на синаптонемальном комплексе, в которых концентрируются все необходимые ферменты.
Рис. 2.41. Молекулярные процессы при межхромосомной рекомбинации: А—несестринские хроматиды, спаренные в двойных спиралях ДНК по 2 (всего 4) с помощью специфических ферментов разрываются на одиночные тяжи примерно одинаковой величины (стрелки; спиральная структура ДНК не показана); В—перекрест (crossing over) после альтернативного спаривания, переносимые отдельные тяжи (показаны пунктиром) дополнены за счет репаративного синтеза; С—сшивание свободных концов; D—за счет кроссинговера возникает новая комбинация отцовских и материнских генов (рекомбинация)
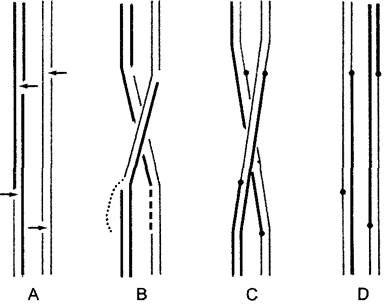
2.2.3.9. Сингамия
При сингамии речь идет о слиянии клеток (синцитозе), точнее, о слиянии двух различающихся в половом отношении гамет. Сначала происходит плазмогамия — возникновение одной двуядерной клетки. Чаще всего за плазмогамией непосредственно следует кариогамия — либо путем слияния ядерных оболочек обоих ядер гамет («предъядер»), либо, наоборот, путем разрушения ядерных оболочек и расположения отцовских и материнских хромосом в общем аппарате веретена, так что сразу происходит первый диплоидный митоз. Однако сингамия и кариогамия могут быть разделенными — и даже сильно — во времени и в пространстве, что, например, имеет место у многих аскомицетов и базидиомицетов. Между обоими частными процессами сингамии вклинивается тогда дикариофаза — соответствующие клетки двуядерны.
В живой природе встречаются различные формы сингамии. В некоторых случаях вообще не образуется каких-нибудь особых гамет, так как любые клетки тела одного партнера по спариванию могут сливаться с такими же клетками другого партнера (соматогамия — например, у водоросли Spirogyra и у высших грибов). В других случаях гаметы представляют собой крайне дифференцированные клетки, а взаимодействие партнеров обеспечивается прямо- таки трудно вообразимыми приспособлениями. Соответствующие детальные сведения будут приведены при рассмотрении отдельных систематических групп в разделе 11.2.
Раздельнополость дает возможность широко комбинировать между собой аллели, возникающие независимо друг от друга у разных организмов одного вида. Наряду с благоприятными или нейтральными комбинациями, возникают также и особенно полезные, что служит материалом для естественного отбора. На этом основывается эволюционное преимущество циклов растений с половым размножением, что особенно заметно тогда, когда имеются обширные геномы — соответственно у всех сложно устроенных многоклеточных организмов.
2.2.4. Рибосомы
Рибосомы — это рибонуклеопротеиновые комплексы, на которых осуществляется биосинтез белков. Отсюда понятно, что особенно богаты рибосомами быстро растущие клетки образовательных тканей.
Синтез белков основывается на переводе (трансляции) полинуклеотидных последовательностей в полипептидные (translation; см. 7.3.1.2). Этот процесс требует высокого уровня энергетического и информационного обеспечения и соответственно наличия крупных и разнообразно взаимосвязанных функциональных единиц. Например, молекулярные массы частиц цитоплазматических рибосом у эукариот составляют порядка 4 МДа (4 МДа = 4 млн Да) (табл. 2.2).
Таблица 2.2. Некоторые сведения о рибосомах
Свойство |
Рибосомы |
|||||
цитоплазмы |
пластид |
Esherichia coli |
||||
Диаметр, нм |
33 |
27 |
27 |
|||
Масса, кДа |
4 200 |
2 500 |
2 500 |
|||
Седиментация |
80S |
70S |
70S |
|||
Доля белка, % от сухой массы |
50 |
47 |
40 |
|||
Субъединицы |
60S |
40S |
50S |
30S |
50S |
30S |
Число рибосомальных белков |
49 |
33 |
30 |
23 |
34 |
21 |
Состав рРНК |
28S |
18S |
23S |
16S |
23S |
16S |
5,8S |
5S |
5S |
||||
5S |
4,5S |
|||||
Рибосомы у прокариот мельче, чем у эукариот. По скорости седиментации (осаждения) в ультрацентрифуге прокариотические рибосомы характеризуются как 70S-, а эукариотические — как 80S- рибосомы. Они различаются не только структурно, но и функционально. Так, трансляция у 70S-pиюосом блокируется антибиотиками хлорамфениколом, стрептомицином, линкомицином и эритромицином, тогда как такие же концентрации этих антибиотиков не оказывают никакого воздействия на SOS-рибосомы; наоборот, циклогексимид подавляет функцию только SOS-рибосом. Рибосомы органелл — пластид и митохондрий — во многом более сходны с бактериальными 70S-рибосомами (рис. 2.42), чем с SOS-рибосомами эукариот.
Рис. 2.42. Структура рибосомы на примере 70 S-рибосомы Escherichia coli.
Большая и малая субъединицы соединены в активную рибосому. Процесс трансляции в месте между субъединицами, показанном стрелкой со звездочкой, нарастающая полипептидная цепь Р выходит у нижнего конца большой субъединицы. Функциональные места на субъединицах: а—синтез полипептида (пептидилтрансферазный центр); b—выход полипептидной цепи и прикрепление к мембране; с—прикрепление иРНК, распознавание кодон-антикодон, d—прикрепление тРНК, е—взаимодействие с факторами элонгации. Рибосомальные белки большой субъединицы обозначены как L1, L2; белки малой субъединицы—S1, S2... (англ, large, small). Рибосомы эукариот (80S-тип) сходны по структуре, но крупнее
Молекулы каждого типа рРНК имеются по одному разу на рибосому, так же, как почти все рибосомные белки. Рибосомы у разных организмов отличаются по строению.
Все рибосомы — прокариотические, рибосомы органелл и эукариотические цитоплазматические рибосомы — состоят из двух субъединиц неравной величины. Субъединицы обычно связаны между собой только при трансляции, точнее вовремя удлинения (elongation) возникающей полипептидной цепи. По мере освобождения готовых полипептидов (termination) рибосомные субъединицы отделяются друг от друга. Малая субъединица может теперь снова связываться с 5’-концом последовательности новой иРНК (initiation) и после прикрепления большой субъединицы осуществлять повторяющуюся последовательность реакций удлинения.
Обе рибосомные субъединицы представляют собой комплекс из многих различных, частично щелочных, рибосомальных белков с различными рРНК.
В последнее время удалось детально (до атомов) выяснить молекулярную архитектуру субъединиц, прежде всего для рибосом бактерий. Взаимодействие иРНК и тРНК происходит примерно там, где «головка» малой субъединицы и «коронка» большой субъединицы располагаются друг против друга (рис. 2.42). Отсюда растущая полипептидная цепь перемещается через большую субъединицу и выходит только у противоположного, тупого конца этой субъединицы. У 80S-рибосом примерно 40 аминокислотных остатков растущей полипептидной цепочки находятся внутри рибосомы: поэтому они защищены от экспериментального воздействия пептидаз или протеиназ.
В трансляции, наряду с иРНК в качестве переносчика информации и рРНК в качестве структурных посредников и связующих партнеров в рибосоме, участвуют также транспортные РНК (тРНК, tRNA). Они доставляют активированные аминокислотные остатки к рибосоме и позволяют специфически встраивать аминокислоты в растущую полипептидную цепочку. При этом они передают информацию, образуя водородные связи между кодонами иРНК и основаниями антикодона на тРНК. Молекулы тРНК — для каждой аминокислоты имеется по крайней мере один их сорт — играют, таким образом, при трансляции роль своеобразного «словаря».
Транспортные тРНК — сравнительно небольшие молекулы, состоящие из всего лишь примерно 80 нуклеотидов («25 кДа). Их последовательность обеспечивает значительное внутримолекулярное спаривание комплементарных оснований, в результате чего возникает характерная для всех тРНК структура «клеверного листа» с 4 лучами и 3 петлями (рис. 2.43, А). Так называемый акцепторный луч с 3'- и 5'- концами не несет петли; к З’-концу присоединяется активированный аминокислотный остаток. Соответствующий этой аминокислоте антикодон, который присоединяется к комплементарному по основаниям триплету иРНК, находится, напротив. Однако на самом деле тРНК имеет не такую двухмерную структуру, а представляет собой α-образную молекулу. Акцепторный конец и петля антикодона находятся на расстоянии примерно 9 нм друг от друга на двух концах «буквы α» (рис. 2.43, В). Оба боковых луча «клеверного листа» в месте изгиба молекулы отогнуты наружу и содержат опознавательные сигналы для того фермента, который высоко специфичен для каждой данной тРНК с соответствующей ей аминокислотой. Надежность этих ферментов — аминоацил- тРНК-синтетаз — гарантирует точность трансляции, чрезвычайно высокую даже для стандартов современной техники, без чего клеткам и организмам было бы невозможно выжить.
Рис. 2.43. Транспортная РНК: А—форма «клеверного листа» с четырьмя лучами и тремя петлями: 1—так называемая![]() - петля (риботимидин-псевдоуридин-цитидин-; этой петлей тРНК рыхло связывается с 5S-рРНК или 5,8S-рРНК); 2—антикодонная петля с антикодоном; 3—вариабельные петли, у различных тРНК бывают различной величины или полностью отсутствуют; 4—ДГУ-петля (дигидро- уридин-). Предварительно активированная аминокислота присоединяется к ССА-последовательности у З'-конца. «Редкие основания» отмечены более жирными линиями; В—пространственная модель, «L-форма»
- петля (риботимидин-псевдоуридин-цитидин-; этой петлей тРНК рыхло связывается с 5S-рРНК или 5,8S-рРНК); 2—антикодонная петля с антикодоном; 3—вариабельные петли, у различных тРНК бывают различной величины или полностью отсутствуют; 4—ДГУ-петля (дигидро- уридин-). Предварительно активированная аминокислота присоединяется к ССА-последовательности у З'-конца. «Редкие основания» отмечены более жирными линиями; В—пространственная модель, «L-форма»
Среди всевозможных рибонуклеиновых кислот клетки по количеству явно преобладают рРНК: они составляют примерно 4/5 всех РНК, а на долю тРНК приходится 1/10. Рибосомальные и транспортные РНК встречаются у всех организмов — от мельчайших бактерий до крупнейших многоклеточных растений и животных, имея в основном сходную структуру и всегда одну и ту же функцию. Их последовательности в ходе эволюции организмов оказались в значительной мере консервативными. Поэтому они считаются особенно надежными свидетелями эволюции и позволяют реконструировать эволюционные события даже очень большой давности1. Например, особое положение среди прокариот и значительная гетерогенность архебактерий были показаны, прежде всего, с помощью сравнения последовательностей рРНК.
1 Точнее, последовательности рРНК позволяют выдвинуть гипотезы об эволюции белоксинтезирующего аппарата, которая идет медленнее эволюции многих других признаков. Судить об эволюции организма (всего генома) по этим данным не всегда корректно. — Примеч. ред.
При трансляции несколько или достаточно много рибосом (моносом) соединяются вместе с помощью длинной одноцепочечной молекулы иРНК и образуют полисому (рис. 2.44, А, В). Располагаясь свободно в цитоплазме, они имеют вид трехмерной спирали. У мембран они, напротив, образуют двухмерные фигуры, преимущественно спирали (см. рис. 2.50, В). Прикрепление к мембранам осуществляется с помощью большой рибосомной субъединицы вблизи места выхода для растущей полипептидной цепи. Последняя часто по мере синтеза проходит через мембрану. Так, например, секреторные белки и лизосомальные ферменты попадают внутрь цистерн ЭР. В других случаях возникающая полипептидная цепь остается (с последовательностью из по крайней мере 20 следующих друг за другом гидрофобных аминокислотных остатков) постоянно закрепленной в самой мембране и так превращается в интегральный мембранный белок (см. 2.2.5.1). Свободные полисомы синтезируют прежде всего растворимые белки для цитоплазматического компартмента клетки. Однако, как это ни удивительно, и многие митохондриальные и пластидные белки, а также все характерные ферменты пероксисом транслируются на свободных полисомах цитоплазмы и только позже пост-трансляционно (post-translational) попадают в определенный целевой компартмент (см. 7.3.1.4).
Рис. 2.44. Рибосомы и полисомы, выделенные из цветочной почки Narcissus pseudonarcissus (препараты R. Junker, электронная микрофотосъемка H. Falk)
А—моносомы, В—полисомы, местами видно встраивание рибосом из двух субъединиц разной величины
2.2.5. Биомембраны
Биомембраны — это тонкие (толщина 6—11 нм), плоские структуры, состоящие из липидов и белков (см. 1.5 2). С одной стороны, они окружают каждую отдельную клетку, а с другой — отделяют друг от друга разнообразные компартменты внутри клетки. Для выполнения этой функции особенно важны два свойства: биомембраны селективно проницаемы (см. 2.2.5.3; 6.1.5) и не имеют свободных краев, а полностью окружают ту или иную структуру. Несмотря на то что они плоские, это не двухмерные, а трехмерные образования. Биомембраны представляют собой вязкие жидкости — нечто вроде тяжелого мазута. Искусственно разорванные, они тут же опять смыкаются — следствие гидрофобного эффекта (см 1.5.1; на этом основывается, в частности, возможность опытов с микроинъекцией на живых клетках).
Мембраны возникают в клетке не заново (de novo), а всегда происходят от уже существовавших мембран — таким образом, они обладают генетической непрерывностью. Биогенез мембран основан на росте в ширину имевшихся ранее мембран за счет встраивания новых молекул и, наконец, отщепления везикул от мембран компартментов путем мембранного потока. Обе важнейшие составляющие биомембран — структурные липиды и мембранные белки — синтезируются прежде всего в ЭР Отсюда они могут попадать через потоки пузырьков в мембраны аппарата Гольджи и вакуолей, а также к клеточной (плазматической) мембране и в наружные мембраны оболочек пластид и митохондрий. Между наружными и внутренними мембранами этих органелл, которые и по своему химическому составу четко отличаются от всех других мембран клетки, прямого обмена нет.
Клетки эукариот характеризуются, в частности, тем, что содержат помимо клеточной мембраны другие мембранные системы и ограниченные мембранами структуры, выполняющие различные функции. О них речь идет в разделе 2 2 6 и боксе 2 3 Однако все клеточные мембраны показывают существенное сходство молекулярного строения и многих других особенностей Они рассмотрены ниже.
2.2.5.1. Молекулярный состав биомембран
Искусственно созданные бимолекулярные слои из структурных липидов (ср рис. 1. 21, 1.22) соответствуют биомембранам по таким параметрам, как толщина, текучесть и полупроницаемость, однако у них не происходит специфического транспорта, не говоря уж об активном мембранном транспорте. У искусственных бимолекулярных липидных слоев наружная и внутренняя стороны идентичны, а у естественных биомембран они, наоборот, различаются. Эти различия объясняются отсутствием или наличием мембранных белков, прежде всего тех, которые отвечают за различное функционирование отдельных видов мембран в клетке. Соотношение масс белков и липидов в нормальном случае составляет порядка 3:2, однако имеются сильные отклонения. В мембранах с преобладанием белков, таких, как внутренние мембраны митохондрий, доля белков может превышать 70%, а в мембранах с преобладанием липидов, например, у мембран хромопластов (см. 2.2.9.2), падает ниже 20%.
Имеется два типа мембранных белков. Периферические (- extrinse) мембранные белки располагаются только на поверхности липидного бислоя и удерживаются электростатическими взаимодействиями с полярными частями мембранных липидов. С неполярными углеводородными цепочками липидов они не контактируют, поэтому легко отделяются от биомембран, например, при повышении концентрации ионов. Некоторые периферические мембранные белки, правда, прочно закреплены в мембранах через ковалентные связи с углеводородными цепочками жирных кислот или с прениловыми липидами. Интегральные (= intrinsic) мембранные белки проходят через полярную внутреннюю часть липидного бислоя. Эти трансмембранные белки можно выделить из мембран только при разрушении мембранного бислоя, например, при использовании детергентов. Такие белковые молекулы отличаются высокогидрофобными поверхностями. Часто здесь мы имеем дело с а-спиралями из 20 — 25 аминокислот с неполярными боковыми цепями, такими, как лейцин и изолейцин, валин или аланин (ср. рис. 1.11). Имеются интегральные мембранные белки, несколько раз пересекающие мембрану, и соответственно в их структуре много а-спиральных доменов: у бактериородопсина, например, их 7, у ионных каналов — до 24. Интегральные мембранные белки закрепляются в двойном липидном слое мембраны за счет гидрофобности, возникают непосредственные взаимодействия белка с неполярными хвостами липидных молекул. Те домены трансмембранных белков, которые с обеих сторон выступают из мембраны, несут гидрофильные группировки на поверхности. Многие мембранные белки гликозилированы, они несут ковалентно связанные остатки сахаров или же цепочки олигосахаридов на наружной стороне мембран.
2.2.5.2. Модель текучей мозаики
Согласно модели текучей мозаики1, типичная биомембрана представляет собой постоянно меняющуюся мозаику трансмембранных белков, которые интегрированы с помощью гидрофобных доменов в жидкокристаллический двойной слой из структурных липидов (рис. 2.45). Несмотря на то что из-за жидкого состояния интегральные мембранные белки могут вращаться в плоскости мембраны и смещаться в сторону (латеральная диффузия) и даже постоянно меняться с липидными молекулами положением в липидной пленке, переворачивание молекулы (fliр-flор-переход) в значительной мере исключено. Таким образом, ни липидная молекула, которая находится в одном слое мембранного бислоя, никак не может попасть в другой одинарный слой, ни гидрофильные домены интегрального мембранного белка по обе стороны трансмембранных доменов не могут поменяться своим положением. Поэтому биомембраны асимметричны, их наружная и внутренняя поверхности различны по составу и свойствам2.
1 В отечественной литературе ее принято называть «моделью липидного озера». — Примеч. ред.
2 Высказанные положения слишком категоричны: переход молекул липидов с одной стороны мембраны на другую вполне возможен, хотя он идет с гораздо меньшей скоростью, чем латеральная диффузия. — Примеч, ред.
Рис. 2.45. Поперечный разрез через клеточную мембрану согласно модели жидкой мозаики (схематично)
Вязко-жидкий двойной липидный слой пронизан интегральными мембранными белками (справа димер), экстраплазматические части которых несут неразветвленные и/или разветвленные гликановые цепи. Гликановые цепи из гликолипидов отходят также от экстраплазматической стороны мембраны наружу. На плазматической стороне нм липиды ни белки не гликолизируются, в неполярные области двойного липидного слоя включены стероидные липиды трансмембранные домены интегральных мембранных белков на своей наружной стороне здесь также гидрофобны. Звездочкой (*) обозначен периферический мембранный белок. Стрелки — плоскость раскола при замораживании-скалывании Треугольники — указатели предпочтительное отложение дающих контраст атомов осмия за счет чего возникает кар тина структуры из трех слоев на поперечном разрезе биомембран в электронном микроскопе (ср рис 2 46 А). Все участвующие молекулы находятся в тепловом движении, постоянно происходит перемена мест в плоскости мембраны и вращение вокруг осей, перпендикулярных плоскостям мембраны. Напротив, опрокидывание белковых или липидных молекул («fliр-flор>) практически исключено
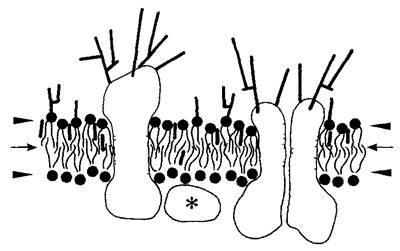
Жидкое состояние клеточных мембран сохраняется при изменениях температуры за счет сдвига химического состава липидов. Разжижающим действием оказывают усиленное накопление стероидных липидов и увеличение числа двойных связей в углеводородных цепях жирных кислот в липидах. У организмов, которые живут в холодной среде, в составе мембранных липидов увеличивается доля ненасыщенных жирных кислот. Так, вместо насыщенной, не имеющей двойных связей стеариновой кислоты для синтеза липидов используются ненасыщенная олеиновая кислота с одной двойной связью, линолевая кислота с двумя двойными связями; наконец, линоленовая кислота — с тремя в 18-углеродном жирнокислотном остатке и арахидоновая кислота — с 4 двойными связями в 20-углеродном жирнокислотном остатке. Ценнейшее льняное масло (с большим числом двойных связей) получают в холодных районах возделывания.
При электронной микроскопии биомембраны на поперечном срезе выглядят как тонкие двойные линии (рис. 2.46, А, В). Интегральные мембранные белки становятся видимыми в препаратах, приготовленных по методу замораживания-скалывания; они выглядят как внутренние мембранные частицы (inner membrane particles, IMP; см. рис. 2.67; 2.85; 2.94, С).
Рис. 2.46. Электронно-микроскопическое изображение биомембран (А—электронная микрофотосъемка Н Falk; В, С—препараты и электронная микрофотосъемка V.Speth): А—клеточная мембрана в виде трех слоев между клеточной стенкой W и цитоплазмой Су водоросли Botrydium granufatum после фиксации глутаральдегидом — OsO4; В—фотография трех слоев нефиксированных мембран Гольджи диктиосомы после замораживания-скалывания (поперечный срез, эмбриональная клетка кончика корня лука); С—вид части клетки меристемы корня лука репчатого на препарате, подвергнутом замораживанию-скалыванию: многочисленные мембраны на поперечном сколе, а также на плоскости с частицами внутренней мембраны, число которых на единицу площади является характерным для каждого соответствующего типа мембран, Су—цитоплазма; D—диктиосома; ER—эндоплазматический ретикулум (эндоплазматическая сеть); М—митохондрия; N—клеточное ядро; V—вакуоли; W—клеточная стенка
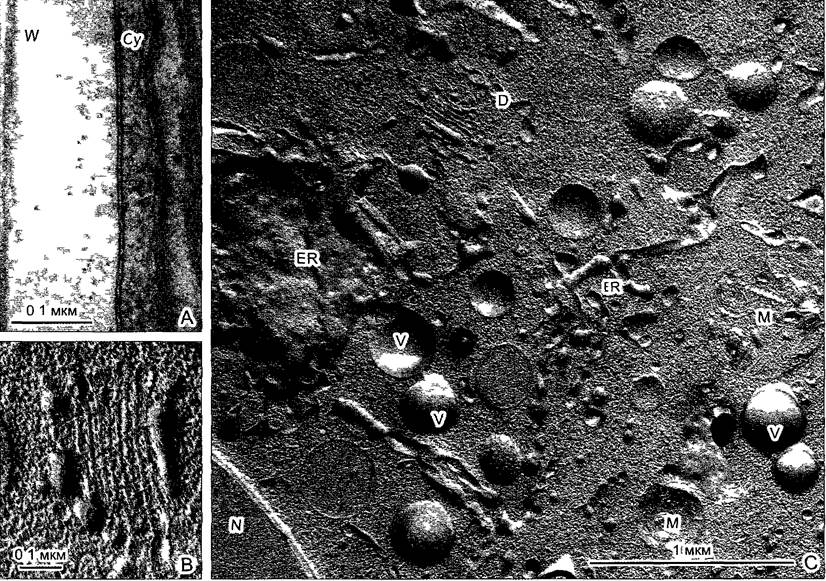
2.2.5.3. Мембраны как разграничивающие структуры
Существование клеток и их компартментов было бы невозможно без барьеров, создаваемых мембранами. Поэтому существенная задача биомембран — предотвращение свободной диффузии веществ между компартментами. Однако, с другой стороны, клетки и метаболически активные комлартменты, будучи открытыми системами, должны участвовать в обмене определенными веществами с окружающей их средой. Для этой цели служат специфические интегральные комплексы, которые распознают и переносят через мембрану определенные ионы или молекулы. Часто при этом необходимо даже накопление определенных ионов или молекул в клетке или же в отдельной ее части. Оно достигается за счет того, что специфические переносчики функционируют как насосы (энергетически обусловленный активный = метаболический транспорт). Исследование проницаемости биомембран показало, что их барьерное действие в значительной мере основывается на наличии двойного липидного слоя, тогда как специфический и особенно активный мембранный транспорт осуществляется интегральными мембранными белками — транслокаторами (пермеазы, carriers). Транс локаторы узнают и связывают переносимые вещества с помощью стерических переходных форм (аналогично специфическому связыванию комплексов фермент-субстрат, см. 6.1.6) и перемещают их при конформационных изменениях из одного компартмента клетки в соседний (см. 6.1.5; рис. 6.5).
Каждый компартмент (compartment) отличается от других компартментов клетки конкретным составом (табл. 2.3) и определенным уровнем ионов, а также характерными значениями pH и окислительно-восстановительного потенциала (бокс 2 3) Если различия (часто очень значительные) в концентрациях у границ компартментов нивелируются (например, при действии ядов, так называемых ионофоров или определенных антибиотиков), следствием бывает гибель клетки. Мембранные потенциалы, играющие важную роль в жизни всех клеток, возникают также из-за различий в ионном составе соседних компартментов. Мембранными потенциалами (порядка 100 мВ) из- за малой толщины двойного липидного слоя (4 нм) обусловлены электрические поля плотностью порядка 100 000 В см-1 Мембранный потенциал возникает, таким образом, на границе, созданной двойным липидным слоем биомембраны.
Таблица 2.3 Ведущие ферменты/характерные соединения клеточных мембран и мембранных структур
Органеллы клетки |
Ведущий фермент/характерное соединение |
Клеточная мембрана |
Целлюлозосинтаза, Nа+/К+-насос |
Цитоплазма |
Нитратредуктаза, 80S-рибосомы |
Клеточное ядро |
Хроматин (линейная ядерная ДНК, гистоны ), ядерные ДНК- и РНК-полимеразы |
Цитоплазма + ядро |
Актин миозин, тубулин |
Пластиды |
Крахмал и амилосинтаза, кольцевая плДНК, рибосомы (70S), нитритредуктаза, в хлоропластах рибулезобисфосфаткарбоксилаза (Рубиско, RubisCO), хлорофизлы, пластохинон, пластидная АТФ-синтаза |
Митохондрии |
Фумараза, сукцинатдегидрогеназа, цитохромоксидаза, убихннон, митохондриальная АТФ-синтаза, кольцевая мтДНК, рибосомы (70S-Tип) |
Шероховатый ЭР |
SRP-рецептор, рибофорины |
Диктиосомы |
Гликозилтрансферазы |
Вакуоли/лизосомы |
Кислая фосфатаза, α-маннозидаза, различные запасные и ядовитые вещества и пигменты (белки, сахара, кислоты, алкалоиды гликозиды, оксазат Са, флавоноиды и др ) |
Олеосомы |
Триацил глицериды |
1 Na+/К+-насос характерен для клеточной мембраны животных, но не высших растений. Здесь правильнее указать Н+-АТФазу — Примеч. ред.
Бок 2 3
Цитоплазма отграничена от внешней среды клеточной мембраной (плазмалеммой), а от клеточного сока — тонопластом. Эти мембраны, таким образом, в каждом случае представляют собой границу между цитоплазмой и не плазматическим пространством То же можно сказать и о всех клеточных мембранах (Е. Schnepf, 1964) каждая биомембрана отграничивает цитоплазму от неплазмы (правило компартментации, теорема Шнепфа) Внутреннее пространство цистерн ЭР и аппарата Гольджи, вакуолей и пузырьков, пероксисом и тилакоидов, а также пространства между двумя мембранами оболочек пластид и тилакоидов не относятся к цитоплазматическому компартменту.
Плазматические компартменты — это цито- и кариоплазма, а также пространства стромы пластид и матрикса митохондрий (пласто- и митоплазма, называемые также соответственно пластидо- и хондриоплазма)1. Они могут характеризоваться, наряду с прочим, содержанием нуклеиновых кислот и рибосом, наличием и оборотом высокоэнергетических соединений (АТФ, АДФ) и слабо щелочной реакцией. Плазматические компартменты, в целом, обладают восстановительными свойствами. Сторона мембраны, граничащая с плазматическим компартментом, заряжена отрицательно. Полисахариды, запасаемые в плазматических «фазах» на основе глюкозы (глюканы) — α-глюканы, в том числе типичные запасные полисахариды (крахмал, гликоген, парамилон, см 14 3, 2.2.9.2). В противоположность этому, не плазматические внутренние пространства клетки не содержат активных нуклеиновых кислот или рибосом (однако часто содержат белки), их значения pH обычно бывают меньше 7, относительно мембранных потенциалов они находятся на плюс-стороне, их среда окислительная; если они содержат глюканы, то говорят не о запасных, а о структурных полисахаридах2 (β-глюканы: целлюлоза, каллоза и т.п.). У мембранных гликопротеидов гликозилированные домены находятся всегда на экстраплазматической стороне мембраны.
1 Термины, приведенные в скобках, мало распространены — Примеч. ред.
2 Исключение составляет сахароза, накапливающаяся в вакуолях. — Примеч. ред.
Из правила компартментации можно вывести, наряду с прочими, такие следствия:
✵ Между одноименными компартментами (плазматический/плазматический или неплазматический/неплазматический) находится четное число мембран (пример: 2 мембраны между цитоплазмой и митоплазмой; 4 мембраны между митоплазмой и пластоплазмой). Соответственно этому также и при прохождении (мысленном) через целую клетку будет, в конце концов, пересечено четное число мембран.
✵ Разъединение одноименных компартментов можно осуществить не через одну единственную мембрану, а через двойную мембрану — через переходную зону разнородных компартментов (пример: цитоплазма/пластоплазма).
✵ Всеобщая асимметрия биомембран становится понятной в свете правила компартментации: когда мембраны расположены между принципиально неодноименными компартментами, следует ожидать, что две их поверхности неодинаковы. На этом основывается разработанное в настоящее время различение аспектов поверхностей биомембран при электронно-микроскопическом изучении препаратов, приготовленных методом замораживания-скалывания (см. рис. А).
Рис. А. Схема строения мембран в препаратах, подвергнутых замораживанию-скалыванию на примере мембран хлоропластов: 2 мембраны оболочки, мембраны тилакоидов (ср. рис. 2.83, D).
Мембраны показаны здесь на поперечном срезе; на препаратах, подвергнутых замораживанию-скалыванию, они также видны расположенными продольно. Внутреннее пространство тилакоидов и пространство между обеими мембранами оболочки не являются плазматическими. При замораживании-скалывании оба одиночных липидных слоя биомембран отделяются друг от друга, так что при электронной микроскопии видны не наружные (верхние), а внутренние плоскости мембран. Последние называют фракционными поверхностями fracture faces (F), а именно прилегающие к плазматической фазе как плазматические поверхности — plasmatic faces PF, а остальные как EF (Е—экстраплазматические поверхности от extrapfasmatic = не плазматические). Трансмембранные белки встречаются как частицы на поверхности слома, в целом гладкой (см. рис. 2.85). По картине расположения частиц EF и PF чаще всего четко различается проявление асимметрии мембран. Наружные поверхности мембран обозначены S (англ, surface — поверхность), точнее, как PS и ESсоответственно
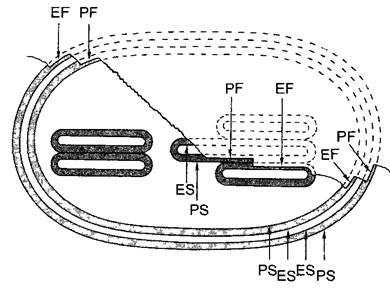
✵ Слияние компартментов при процессах мембранных потоков возможно только между одноименными мембранными структурами. (Примеры плазматического слияния мембранных структур: образование синцитиев; слияние гамет; примеры неплазматического слияния: экзо- и эндоцитоз; временами случающиеся прямые соединения между ЭР и внешней средой или межмембранными пространствами оболочек пластид и митохондрий.)
Из правила компартментации следует новое подразделение эукариотических клеток на компартменты. Исходно на основе наблюдений с помощью светового микроскопа протопласты были разделены на цитоплазму и карио-(нуклео-)плазму. Пластиды и митохондрии при этом рассматривали как части или же включения цитоплазмы. Правда, нуклео- и цитоплазма могут сливаться между собой, как это происходит при каждом нормальном митозе, а ядерная оболочка пронизана ядерными порами (ядерно-цитоплазматический континуум). Напротив, мито- и пластоплазма, обладающие и собственной генетической информацией, не сливаются ни между собой, ни с ядерно-плазматическим континуумом, хотя такие слияния по правилу компартментации представляются возможными. То, что этого все же не бывает, говорит о глубоких различиях видов плазмы в клетке, которые удалось объяснить с позиции теории эндосимбиоза (см 2 4) Отвлеченное разграничение хондрио- и пластоплазмы получает правомерное обоснование.
Биомембраны не всегда являются диффузионными барьерами. Многие липофильные яды наркотики и т п могут растворяться и даже концентрироваться в двойном липидном слое, так что последний не представляет собой никакого препятствия для их диффузии. Могут проходить даже полярные частицы, когда они достаточно малы (<70 Да) Мембрана действует как фильтр со средней шириной пор 0,3 нм. В качестве пор функционируют при этом места кратковременных нарушений в структуре бислоя, как это постоянно происходит при тепловом движении липидных молекул в жидких мембранах. Правда, во многих случаях сравнительно высокая проницаемость для воды объясняется наличием аквапоринов,образующих трансмембранные каналы для молекул воды (см рис 6 25). Через такой канал, когда он открывается за счет фосфорилирования аквапоринов, не могут проходить ни ионы, ни метаболиты, однако проходят до 4 млрд молекул Н2О в секунду.
Особенности проницаемости липидного бислоя в биомембранах описываются теорией липидного фильтра. Согласно этой теории, полярные вещества соразмерно своей величине могут диффундировать через гидрофильные поры мембраны, тогда как неполярные вещества могут непосредственно проходить через мембраны. Однако независимо от параметров величины частиц и липофильности, это пассивное проникновение является неспецифическим: нет структур для узнавания определенных проникающих через мембрану химических веществ. Рисунок 2.47 наглядно показывает поучительный эксперимент, подтверждающий теорию липидного фильтра (см. также рис. 7.37).
Рис. 2.47. Движение ионов через мембрану
Накопление нейтрального красного в вакуоли растительной клетки Нейтральный красный существует в вакуоли как липофильная молекула (А), в кислом же растворе за счет присоединения протона — как цветной катион (В) С—исходная ситуация живая клетка в разбавленном нейтральном растворе, pH 8 (цветная молекула показана как точки, цветные катионы — как штрихи) D—окончательное состояние цветные молекулы проникли в вакуоль (pH 5), в которой они не могут больше оставаться как гидрофильные цветные ионы Равновесие устанавливается только тогда, когда концентрация нейтральных молекул в вакуоли равна таковой во внешнем растворе Однако тогда достигается более чем тысячекратное накопление ионной формы нейтрального красного в вакуоли
2.2.6. Клеточные мембраны и компартменты
Различные мембранные системы клетки, хотя и не связаны непосредственно между собой, однако могут косвенно контактировать друг с другом за счет потока пузырьков, мембранного потока. При текучести биомембран и возникающей за счет этого возможности перемещать даже крупные комплексы мембранных белков в плоскости мембраны пространственное разделение отдельных мембранных структур обеспечивает их функциональное разнообразие. Наличие постоянно открытых каналов между компартментами клетки имело бы следствием диффузию в обоих направлениях, тогда как потоки пузырьков в живой клетке всегда соответствуют одностороннему движению (нагнетающее действие при мембранном потоке).
Поток везикул предполагает строгую упорядоченность и слияние мембранных структур, которое основано на слиянии мембран. Поскольку биомембраны не могут сливаться самопроизвольно, силы отталкивания преодолеваются за счет специализированных белков. За счет таких белков одновременно обеспечивается слияние мембранных компартментов (см. 2.2.6.4; 2.2.6.5).
Большинство внутриклеточных мембран (эндомембран) и наружная мембрана клетки находятся во взаимосвязи благодаря процессам мембранного везикулярного потока. Наконец, эндомембраны относятся к центральной мембранной системе более высокого ранга. Однако к этой системе не относятся внутренние мембраны митохондрий, а также внутренние мембраны оболочки пластид и тилакоиды (они будут обсуждаться дальше; см. 2.2.8.2; 2.2.9.1). Следовательно, растительная клетка содержит не только три постоянно разделенных сорта плазмы (см. бокс 2.3), но и соответственно также три мембранные системы, не связанные мембранным везикулярным потоком, которые также обладают характерными различиями в составе липидов и белков.
Из внутренних мембранных структур клеток растений и грибов уже в XIX столетии были открыты крупные вакуоли, а их мембраны были охарактеризованы более детально при исследовании осмоса. В настоящее время можно выделить их из клетки в интактной форме (см. рис. 2.59, А). Примерно в то же время, когда электронно-микроскопические исследования привели к открытию ЭР с ядерной оболочкой в качестве центрального элемента, диктиосом аппарата Гольджи и пузырьков разного сорта, путем фракционирования клетки удалось охарактеризовать различные мембранные компоненты и их мембраны (см. бокс 2.1). Были открыты многие структурные/функциональные взаимоотношения. Растительные и грибные клетки труднее поддаются анализу, чем лишенные стенок и вакуолей клетки млекопитающих. Например, из растительных тканей трудно получать чистые фракции плазматической мембраны, что в случае животных клеток чаще всего не составляет проблемы. Однако многие основополагающие открытия, которые были сделаны на клетках животных, применимы и к соответствующим системам растительных клеток.
2.2.6.1. Клеточная мембрана
Клеточная, или плазматическая, мембрана (= плазмалемма) из-за большого содержания гликопротеинов толще и плотнее других мембран клетки. Она создает и стабилизирует особый ионный баланс между цитоплазмой и апопластом, в то время как соответствующие транслокаторы, используя АТФ, выводят протоны, ионы Са2+ и Nа+ из клетки, а ионы К+входят в клетку. Клеточная мембрана за счет выпячивания или складок увеличена в точках интенсивного обмена веществами (ср., например, рис. 3.27).
Лишенные стенок протопласты можно легко получить путем лизиса клеточных стенок с помощью пектиназ и целлюлаз (рис. 2.48). При осмотической стабилизации протопласты вполне жизнеспособны. С протопластами можно осуществлять слияние клеток, например, с помощью полиэтиленгликоля или электрического шока (рис. 2.49). Соответственно можно получить также соматические гибриды (цибриды, cybrids), т.е. соединенные клетки от организмов совершенно разного систематического положения, которые в природе никогда не смогли бы появиться.
Рис. 2.48. Протопласты, искусственно полученные путем ферментативного разрушения клеточных стенок (С—препарат U. Matern): А, В—эпидермис запасающих чешуйлуковиц Аlliumсера вскоре после внесения пектиназно-целлюлазной смеси и после выхода округлых протопластов в 0,6 М сорбите (140х). Стрелки на А— плазматические нити, образовавшиеся из плазмодесм; С—протопласт из культуры клеток петрушки (370х). На А—С — крупные центральные вакуоли; D—протопласты клеток дрожжей, Saccharomyces cerevtsiae (800х). По сравнению с клетками высших растений клетки дрожжей очень мелкие; N—клеточное ядро с ядрышком
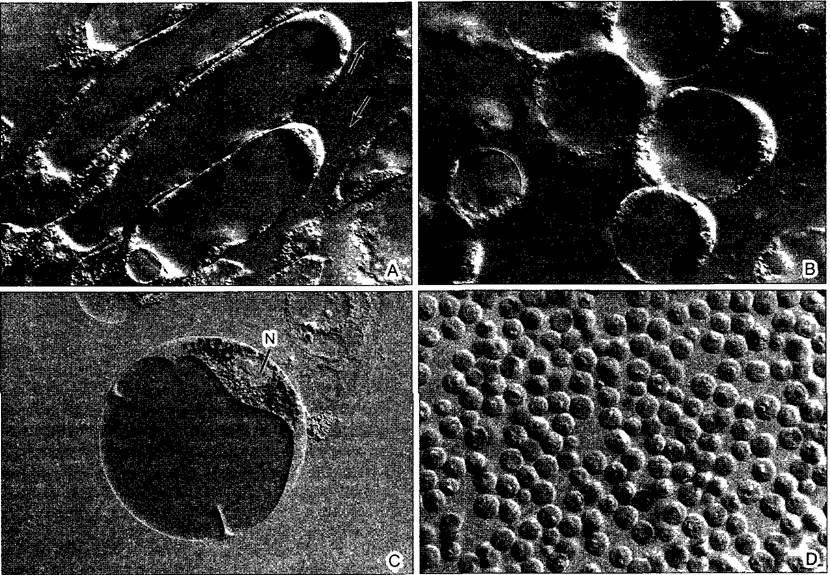
Рис. 2.49. Электрослияние протопластов листостебельного мха Fuñaría hygrometnca (640х) (препараты и электронная микрофотосъемка A Mejia, G Spangenberg, Н -U Коор, М Ворр)
Два протопласта соприкасающиеся с электродом (А), сливаются заснет электрического шока (силовое поле 1 кВ см 3, 70 мкс) (В—Е) Из возникшей таким образом гибридной клетки может за несколько недель вырасти новое растение мха
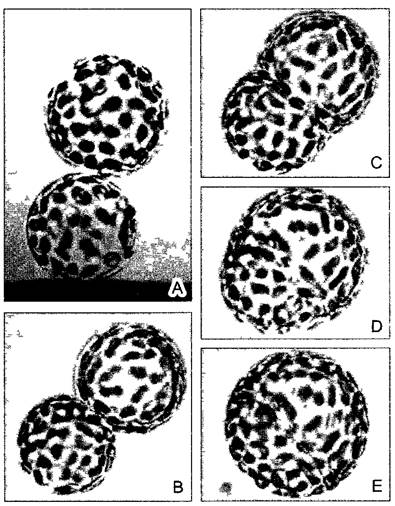
Клеточная мембрана за счет тургора прижата к внутренней стороне клеточной стенки, однако в определенных местах она в результате специфических химических взаимодействий особенно тесно связана со стенкой. С одной стороны, это те места, где образуются микрофибриллы целлюлозы (см. 2.2.7.2). С другой стороны, с помощью антител удалось показать, что интегральные мембранные белки (интегрины) взаимодействуют с компонентами клеточной стенки и могут обеспечивать прочное взаимное соединение (как внеклеточный матрикс в животных клетках).
2.2.6.2. Эндоплазматическая сеть (ЭС), или эндоплазматический ретикулум (ЭР)
Эта мембранная система, часто пронизывающая всю клетку, получила свое название после первых электронно-микроскопических наблюдений тотальных препаратов фибробластов (К. R. Porter, 1946). В этих клетках она выглядела как сеть (лат. reticulum — сеть), которая у исследовавшегося типа клеток была хорошо развита, прежде всего в эндоплазме вблизи ядра, а не в кортикальной (экто-)плазме. Позже было показано, что здесь мы имеем дело с системой плоских двойных мембран («цистерн», рис 2.50), часть из которых соединена с большим количеством рибосом, и что «микросомная фракция», сначала выделенная из клеток печени, состоит из ЭР. Впрочем, уже к концу XIX столетия Ш. Гарнье наблюдал в выделяющих белок клетках желез млекопитающих области цитоплазмы, которые интенсивно окрашивались основными красителями. Из-за явной связи между этим базофильным окрашиванием и синтезом секретируемых белков. Гарнье назвал эти области цитоплазмы эргастоплазмой (греч. еrgaster — рабочий). На электронных микрофотографиях эргастоптазма выглядит как скопление параллельно расположенных цистерн несущего рибосомы шероховатого ЭР. Базофилия обусловлена высокой концентрацией рРНК. В подходящих случаях цистерны ЭР можно наблюдать даже с помощью светового микроскопа и соответственно в живых клетках, где они отличаются быстрыми изменениями формы (рис 2.51). Сетевидная форма этих структур может быть четко видна в поле флуоресцентного микроскопа (рис 2.52).
Рис. 2.50. Несущий рибосомы (шероховатый) эндоплазматический ретикулум (электронная микрофотосъемка А. Н.Falk, В. U. Kristen): А—цистерны на поперечном срезе (стрелки), рядом митохондрии М, диктиосомы D и хлоропласт С; плазмодесмы Р в первичном поровом поле клеточной стенки; клетка листа фасоли обыкновенной, В— плоско срезанные цистерны шероховатого ЭР со спиралевидными поли- сомами в пыльцевой трубке табака Nicotiana tabacum
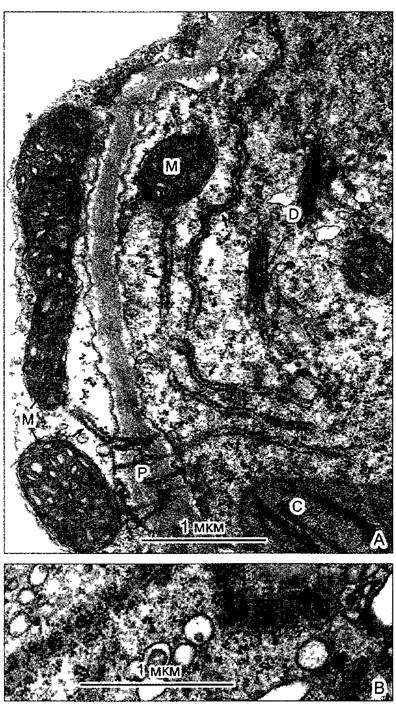
Рис. 2.51. Эндоплазматический ретикулум в живой клетке из культуры тканей табака (940х) (съемка в фазовом контрасте W. Url)
В—снимок сделан через 10,5 с после А. На снимках видны (наряду с ЭР) также олеосомы, митохондрии и (слева внизу) пластиды
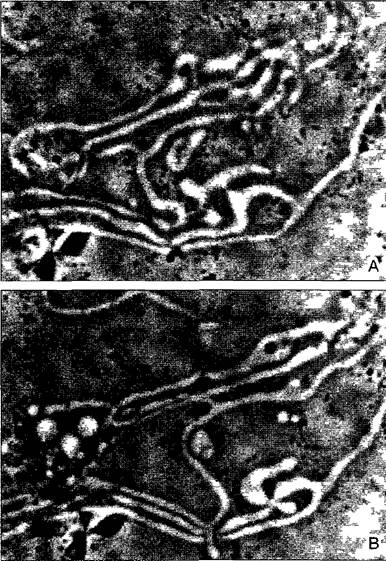
Рис. 2.52. ЭР в эпидермальных клетках лука репчатого после флуоресцентного окрашивания 3,3' дигексилоксакарбоцианиниодидом в нормальном состоянии (в виде цистерн А, 750х) и после обработки холодом (тубулярный В, 870х) (снимки Н. Quader)
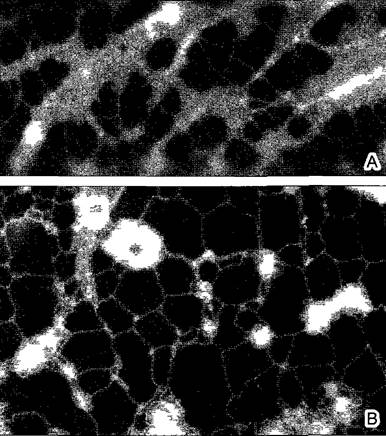
ЭР представлен двумя различными структурными и функциональными формами — в виде шероховатого ЭР(rough ER, rER) и гладкого ЭР(smooth ER, sER) Несущая полисомы шероховатая форма (называемая также гранулярным ЭР) встречается в виде обширных плоских цистерн (см рис 2 50) Напротив, лишенный рибосом гладкий ЭР часто образует сетевидные структуры из разветвленных мембранных трубочек (рис 2.53).
Рис. 2.53. Гладкий ЭР накапливающей масло клетки лопуха Arctium lappa с многочисленными поперечными и продольными разрезами изогнутых и разветвленных цистерн ЭР (электронная микрофотосъемка E.Schnepf). М—митохондрия; W—клеточная стенка
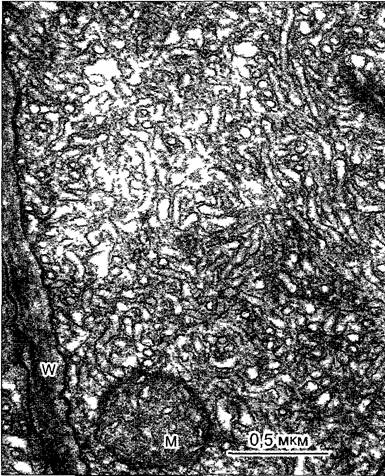
На шероховатом ЭР — место интенсивного синтеза белков Белки, образуемые здесь связанными с мембранами полисомами, — это либо мембранные белки, либо такие белки, которые переносятся в неплазматические структуры (например, вакуоли) или выделяются наружу (секреторные белки = экспортируемые белки, например, белки клеточной стенки или разрушающие стенку экзоферменты паразитических грибов; белки цитоплазмы и ядерного пространства синтезируются не на шероховатом ЭР, а на свободных полисомах цитоплазмы). Мембраны шероховатого ЭР — единственные мембраны, которые имеют рецепторы для рибосом и могут образовывать полисомы на своей плазматической стороне (plasmatic side, PS). О перемещении белков, которые синтезируются на связанных с шероховатым ЭР рибосомах, см. 7.3.1.4.
Функции гладкого ЭР разнообразны. Прежде всего он участвует в синтезе липидов, флавоноидов и терпеноидов (см. 6.16.1; 6.16.2). Образование жирных кислот в растительных клетках (в противоположность животным клеткам) происходит прежде всего в пластидах. Однако преобразование сначала насыщенных жирных кислот в ненасыщенные и встраивание образуемых липидов в мембраны в растительной клетке, как во всех эукариотических клетках, является функцией гладкого ЭР. Встраивание происходит только на обращенной к цитоплазме (Р-)стороне мембран ЭР, так что синтезируемые молекулы липидов могут встраиваться только в плазматический монослой мембраны. Однако эти мембраны содержат особый белок — флиппазу. Она катализирует переброс липидных молекул (flip-flop) из плазматического монослоя в экстраплазматический (иначе он практически невозможен).
2.2.6.3. Диктиосомы и аппарат Гольджи
Аппарат Гольджи — это своеобразная «органелла-железа» клетки. В диктиосомах синтезируются или гликозилируются секреты, которые через секреторные пузырьки (пузырьки Гольджи) выводятся из клетки или откладываются в вакуолях. Диктиосомы — это элементы аппарата Гольджи. Мелкие одноклеточные организмы часто имеют только одну единственную диктиосому, однако в более крупных клетках всегда имеются многочисленные диктиосомы (в некоторых случаях их бывает свыше тысячи): у растений они чаще всего (в противоположность многим клеткам у животных) рассеяны по всей цитоплазме («дисперсный» аппарат Гольджи).
Типичная диктиосома образована стопкой цистерн аппарата Гольджи. Она всегда находится по соседству с цистерной ЭР или оболочкой ядра и ориентирована параллельно им (рис. 2.54, В; 2.56). Обращенную к ЭР сторону диктиосомы называют ее цис-стороной, а противоположную — транс-стороной. С цис-стороны за счет слияния с транспортирующимися туда пузырьками образуются новые цистерны Гольджи, с транс-стороны отделяются пузырьки Гольджи. Во многих случаях краевые зоны дистальных цистерн образуют сетчатую структуру (традс-Гольджи-сеть, trans-Golgi-net, TGN). Между цистернами аппарата Гольджи иногда находятся идущие параллельно нити, функция которых неизвестна. У так называемых гипертрофированных диктиосом отчленяются не отдельные пузырьки, а целые цистерны вздуваются и мигрируют к поверхности клетки (см. рис. 7.55, D).
Рис. 2.54. Диктиосомы (электронная микрофотосъемка: А—U. Kristen; В—J.Lockhausen, U. Kristen): А—продольно и поперечно разрезанные диктиосомы в клетке лигулы полушника Isoetes lacustris; сетчато-трубчатая периферия цистерн Гольджи и многочисленные мелкие пузырьки; В—поперечный разрез диктиосомы в железистой клетке Veronica beccabunga\ цис-сторона снизу, прилегает к шероховатому ЭР; на трансстороне различимы тонкие нити аппарата Гольджи между цистернами; наружные цистерны транс-стороны расширены и продырявлены многочисленными отверстиями (транс-Гольджи-сеть); М—митохондрия
Диктиосомы — образования недолговечные. При необходимости ЭР может образовывать их заново.
Структура диктиосом варьирует у разных организмов, а внутри многоклеточного организма зависит от степени дифференцировки клетки. У некоторых примитивных грибов, а также в клетках сухих семян вместо диктиосом в цитоплазме находятся скопления мелких мембранных пузырьков или трубочек. И если у типичных диктиосом высших растений число цистерн Гольджи колеблется от 43 до 10, то у протистов оно может быть более 30.
В цистернах аппарата Гольджи с помощью специфичных гликозилтра нсфераз образуются олиго- и полисахариды. Специфичные гликозилтрансферазы (например, галлактозилтрансфераза, которая переносит единицы галактозы на нарастающие глюкановые цепочки) — основные ферменты аппарата Гольджи. С их помощью, в частности, синтезируются полисахариды матрикса клеточной стенки (см. 6.17.1.1); для синтеза запасных полисахаридов, таких, как крахмал и гликоген, существуют собственные цитоплазматические (или пластидные, или митохондриальные) ферментные системы (см. 6.17.1.2). В цистернах Гольджи также гликозилируются интегральные мембранные белки — этот процесс начинается уже в просвете шероховатого ЭР, однако завершается только в аппарате Гольджи. Все экспортируемые и интегральные белки плазматической мембраны представляют собой гликопротеины.
Образуемые секреты также бывают самыми разными. Как крайние варианты можно назвать, с одной стороны, оформленные секреты, в которых цистерны или пузырьки Гольджи путем процессов самоорганизации формируются в характерные структуры. Известные примеры: чешуйки клеточной стенки (см. рис. 11.7; 11.74, в), экструзосомы (эджектосомы или трихоцисты) одноклеточных криптофитов и динофитов, взрывообразно выбрасываемые наружу, иногда ядовитые «снаряды» для защиты от врагов или поражения жертвы, а также мастигонемы перистых жгутиков (см. рис. 11.20, А—С; 11.72, Б). С другой стороны, часто выделяются особенно насыщенные водой слизистые полисахариды. Своеобразный случай секреции аппарата Гольджи — активное выделение воды. У всех пресноводных протистов без жесткой клеточной стенки водный баланс нестабилен. поскольку они постоянно поглощают воду путем осмоса, но не могут компенсировать создающееся внутреннее давление противодействующим давлением со стороны жесткого внешнего скелета. Таким организмам необходимы структуры для активного выделения воды. В большинстве случаев это пульсирующие сократительные вакуоли. Увеличиваясь в размере, они механически или осмотически поглощают воду из окружающей цитоплазмы (диастола) и периодически при сокращении выпрыскивают ее наружу через ненадолго открывающийся канал (систола). У одноклеточной водоросли Vacuolaria эту функцию берут на себя многочисленные диктиосомы. Они образуют плотный слой непосредственно вокруг ядерной оболочки — «перинуклеарный» аппарат Гольджи Постоянно в большом числе отчленяющиеся пузырьки Гольджи которые содержат крайне насыщенную водой слизь, быстро сливаются во все более крупные секреторные вакуоли и в таком виде выводятся на ружу (рис 2.55).
Рис. 2 55. Выделение воды через аппарат Гольджи (А В—no R Poisson A Hollande С D—электронная микрофотосъемка Е Schnepf W Koch)
А—С — Vacuolana virescens. Схема образования и экзоцитоза насыщенных водой пузырьков аппарата Гольджи (вакуолей) в следующих друг за другом стадиях комплексный аппарат Гольджи (показан мелкими точками построен из примерно 50 диктиосом) прилегает к ядру (показано крупными точками) римские цифры означают крупные «пульсирующие» вакуоли возникшие путем слияния меньших вакуолей (арабские цифры). За 30 мин выделяется объем воды близкий к объему клетки С— многие диктиосомы аппарата Гольджи становящиеся по мере продвижения вовне (вверху) все более крупными вакуолями Гольджи D—у одноклеточной водоросли Glaucocystis geitlen целые цистерны Гольджи, так же сливаются поглощая воду и ритмично опорожняются наружу в направлении, указанном стрелкой G—аппарат Гольджи М—клеточная мембрана
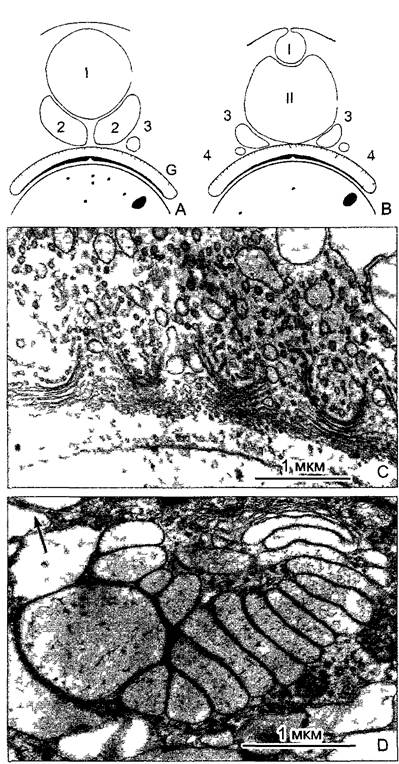
2.2.6.4. Мембранный поток, экзо- и эндоцитоз
В противоположность мембранному транспорту (перемещению веществ через биомембраны), понятие мембранный поток (везикулярный транспорт) подразумевает транспорт целых компарт ментов. Путем мембранного потока мелкие компартменты (везикулы) могут отделяться от более крупных, направленно перемещаться в клетке с помощью цитоскелета и его моторных белков и сливаться с другими компартментами Общая схема подобных процессов (цитозов)1 показана на рис 2.56 (ср рис 7 16) Так, секреторные пузырьки отшнуровываются от транс-сет Гольджи, мигрируют к клеточной мембране, сливаются с ней и выделяют свое содержимое наружу Мембрана пузырька становится частью плазматической мембраны Этот вид клеточной секреции называют экзоцитозом. Путем экзоцитоза макромолекулы и еще значительно более крупные оформленные секреты могут попадать из клетки во внеклеточное пространство, не проходя самостоятельно через клеточную мембрану, которая не открывается даже на короткий срок.
1 Термин «цитоз» в нашей литературе не принят. Обычно уточняют, о каком именно процессе идет речь об эндоцитозе или экзоцитозе — Примеч. ред.
Рис. 2.56. Мембранный поток, экзо- и эндоцитоз (электронная микрофотосъемка Н Falk)
А—белки, синтезированные на шероховатом ЭР, попадают через транзитные пузырьки кдиктиосоме D (1). Там они модифицируются путем гликозилирования или через пузырьки Гольджи транспортируются (2) к клеточной мембране СМ и выводятся из клетки (3), либо упаковываются (4) в первичные лизосомы Поглощенные посредством фагоцитоза более крупные частицы (5) с помощью лизосомных ферментов разлагаются (6) в пищеварительных вакуолях Частицы меньшего размера, например, усваиваемые клеткой макромолекулы, адсорбируются специфическими рецепторами на клеточной мембране и переносятся (8) с мембранных пузырьков CV к эндосомам End, в кислой среде которых они отсоединяются от рецепторов и гидролизуются Рецепторы рециклизуются сначала перемещаются (9) через пузырьки CV к диктиосомам, затем снова к поверхности клетки (10), В—поток пузырьков от шероховатого ЭР (здесь представлена оболочкой ядра N водоросли Botrydium granulatum) к соседним диктиосомам, стрелки перешнуровывание транзитных пузырьков, СМ—клеточная мембрана, CV—мембранные пузырьки, D—диктиосома, End—эндосома, Lys— лизосомы
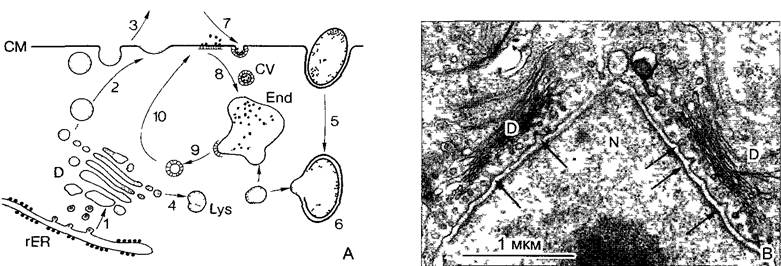
При отчленении секреторных пузырьков диктиосома теряет мембранный материал. Новый материал должен поставляться от ЭР, поскольку в диктиосомах не синтезируются ни липиды, ни белки. Это происходит через транзитные пузырьки (первичные пузырьки) строго определенного размера, так что облик диктиосом, несмотря на постоянные поступление и потерю мембранного материала, остается неизменным. Таким образом, аппарат Гольджи существует как динамическая структура в подвижном равновесии и сохраняет структурную и функциональную полярность: на обращенной к ЭР цис-стороне (образующей стороне) из транзитных пузырьков строятся новые цистерны аппарата Гольджи, на дистальной стороне (транс-стороне, секреторной стороне) мембраны аппарата Гольджи утрачиваются при отчленении секреторных пузырьков. Мембраны аппарата Гольджи мигрируют с заключенными в них предшественниками секретов насквозь через стопку цистерн от цис- к транс-стороне, непосредственно через них или через потоки пузырьков у края диктиосомы. При этом высота цистерн уменьшается, а толщина мембран увеличивается. Связанные с мембранами ферменты проявляют разную активность с проксимальной и дистальной стороны.
Путем поэтапного удлинения олиго- и полисахаридных цепочек увеличивается доля гликанов в первичных секретах, одновременно содержимое первичных цистерн подкисляется. Если последовательности ДНК, РНК и белков полностью определяются исходной матрицей, то последовательность остатков сахаров в олигосахаридных цепочках гликопротеинов устанавливается следующими друг за другом во времени и пространстве этапами биосинтеза, которые можно сравнить с «монтажом вдоль ленты конвейера»1
1 Таким образом, последовательность сахаров в полисахаридах зависит от того, в каких компартментах (содержащих специфичные гли- козилтрансферазы) и в какой последовательности побывает исходным продукт, т е от того на какую «конвейерную ленту» ему посчастли вилось попасть Последовательность сахаров прямо не закодирована в геноме, там содержится лишь информация о «деталях конвейера» но не о том, в каком порядке этот «конвейер» организован — Примеч. ред.
Рис. 2.57. Мембранные пузырьки (coated vesicles, CV) и клатрин (С—препарат и электронная микрофотосъемка D. G. Robinson D—электронная микрофотосъемка О. Ktermayer) А—схема CCV (комплекс клатрина с везикулами), В—3 трисцелиона как компоненты пента- и гексагональной сетчатой структуры Каждый трисцелион состоит из 3 тяжелых цепей (по 180 кДа, 50% α-спирали согнутые петли) и 3 легких (по 35 кДа) вдоль каждого ребра клатриновой решетки проходят 4 тяжелые цепи легкие цепи находятся в углах С—везикулы CVвыделенные из гипокотиля цуккини (культурной формы тыквы Cucurbita pepo) в негативном контрасте D—везикулы CV (стрелки) на диктиосомедесмидиевой водоросли Micrastenas (обратите внимание также на одностороннее размещение рибосом на цистернах ЭР против цис-стороны диктиосом)
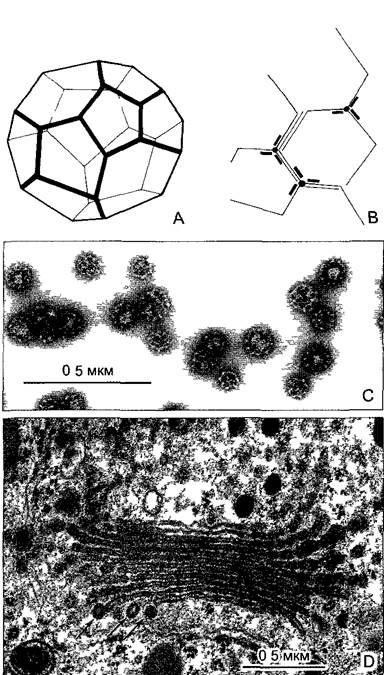
Если на поверхности клетки за счет впячивания клеточной мембраны образуются пузырьки, которые смещаются внутрь клетки, мы имеем дело с эндоцитозом. Формально он соответствует последним этапам экзоцитоза, только с противоположным направлением. При этом, например, макромолекулы, которые у наружной стороны клеточной мембраны связываются специфическими рецепторами, могут доставляться через мембранные пузырьки(coated vesicles, CV) к эндосомам и лизосомам и там перевариваться. Многие одноклеточные организмы и большинство клеток животных могут захватывать также микроскопические частицы пищи путем эндопитоза (фагоцитоз, рис 2 56, А, 5 и 6) Эндоцитоз обнаружен и у растительных клеток, но уже из-за осмотрофности этих клеток и клеточных стенок, которая делает невозможной фаготрофность, его масштаб очень ограничен Мембранные пузырьки часто встречаются также в растительных клетках, особенно вблизи клеточной мембраны и вокруг диктиосом (рис 2.57, D) Они связаны с реутилизацией мембран и рецепторов или служат для внутриклеточного перемещения мембран и веществ (интрацитоз)1
1 Этот термин в отечественной литературе практически не используется — Примеч. ред.
2.2.6.5. Мембранные пузырьки (coated vesicles)
Мембранные пузырьки (рис 2 57) относятся к мельчайшим мембранным компонентам клетки их диаметр порядка 0,1 мкм. Они имеют граничащий с цитоплазмой мембранный скелет — собственно «coat» (англ. — оболочка). По белкам оболочки можно различать два типа мембранных пузырьков: клатриновые (clathrin coated vesicles, CCV) и коатпротеиновые. Клатриновые пузырьки наблюдаются при эндоцитозе и при движении пузырьков между диктиосомами и лизосомами или же вакуолями; коатпротеиновые пузырьки — преимущественно при экзо- и интрацитозе. Оба вида мембранных пузырьков недолговечны и подлежат постоянной смене.
Сетчатая структура в виде пчелиных сот, которую образует вокруг клатриновых пузырьков структурный белок клатрин (греч. klathron — решетка), построена из тримеров клатрина — так называемых трисцелионов (рис. 2.57, В). Построение и разборка регулируются сопутствующими белками: распад, например, происходит при участии специальной АТФазы. Образование клатриновых пузырьков при эндоцитозе начинается с построения структуры в виде сот из клатрина у внутренней стороны клеточной мембраны. В этом процессе участвуют особые белки сборки (assembly proteins), которые родственны аналогичным по функциям белкам в клетках млекопитающих (адаптинам). Области, затрагиваемые этим процессом, называют coated membranes или, в связи с тем, что они погружены в цитоплазму, — coated pits1 (англ, pit — яма). В растительных клетках до 7 % и более поверхности клеточной мембраны может быть занято многоугольниками из клатрина. Образование coated pits и их отшнуровывание в виде клатриновых пузырьков требует энергии: должна быть произведена работа против тургора (для сравнения: локальное надавливание на полностью накачанную велосипедную камеру требует значительного усилия). Соответственно эндоцитоз у растительных клеток наблюдается прежде всего в структурах с низким тургором (корневые волоски, клетки эндосперма, искусственно полученные протопласты). С образующимся клатриновым покровом связан динамин — ГТФаза, которая удовлетворяет потребность в энергии путем расщепления ГТФ.
1 Соответствующая терминология еще недостаточно устоялась, и даже в немецком оригинале дана английская калька. В переводе мы используем тот же прием. — Примеч. ред.
У коатпротеиновых пузырьков (СОР- vesicles) комплекс оболочки образован из нескольких белков, не родственных клатрину, они называются коатомерами. На дрожжевых клетках, служащих удобной моделью для генетического анализа, и на нервных клетках млекопитающих, у которых с помощью электрического импульса можно управлять массовым высвобождением транспортных пузырьков, удалось в значительной мере выяснить решающие этапы транспорта везикул.
Эти этапы включают отпочковывание пузырьков от донорных мембран, локализацию их у акцепторных мембран и слияние с ними. Для образования пузырьков коатомеры из цитоплазмы встраиваются в соответствующие области мембран ЭР или же диктиосом. Это требует активизации небольшого G-белка, который содержит в активном центре ГДФ и обменивает его теперь на ГТФ. Процесс, который инициирует отпочковывание пузырьков, может блокироваться грибным ядом брефельдином. Слияние пузырьков с соответствующими мембранами возможно благодаря двум белковым факторам: АТФазе и растворимому фактору. АТФаза носит название NSF, от NEM- чувствительного фактора (NEM = N-этил-малеимид — соединение, которое блокирует ферменты с SH-группами — в данном случае АТФазу). Для растворимого фактора используется аббревиатура SNAP(англ, soluble NSF associated protein — растворимый белок, ассоциированный с NSF). Локализация пузырьков у клеточной мембраны возможна только после разрыва покрова (coat). Этот процесс сопровождается расщеплением ГТФ в G-белке. Однако здесь необходимы специальные распознающие структуры, исключающие ошибочные направления в транспорте пузырьков. Некоторые из них к настоящему времени удалось охарактеризовать более детально. Они известны под общим названием SNARE (рецепторы для SNAP).
2.2.6.6. Пероксисомы и глиоксисомы
В цитоплазме активных эукариотических клеток находится множество мелких сферических структур (компартментов), которые ограничены только одной мембраной. До появления электронного микроскопа они в целом обозначались как пузырьки, или везикулы. Однако их функции очень варьируют: можно выделить запасные, транспортные и реакционные везикулы. Некоторые примеры мы уже упоминали. Так, мембранный поток при экзо- и эндоцитозе обеспечивается транспортными пузырьками, которые выполняют роль контейнеров. Запасные пузырьки — это, например, алейроновые зерна (см. ниже).
Рис. 2.58. Пероксисома листа шпината, тесно прилегающая к хлоропласту (с гранами) (электронная микрофотосъемка H.Falk).
В цитоплазме многочисленные рибосомы; Ср—хлоропласт; V—вакуоль
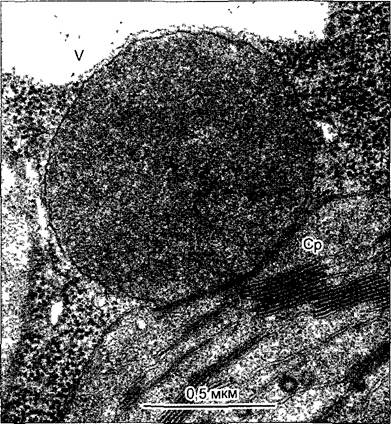
К началу электронно-микроскопической эры все пузырьки размером 0,3 — 1,5 мкм с плотным содержимым обозначали как микротельца. Они выполняют специальные функции при обмене веществ и содержат соответствующие определенные ферменты в высокой концентрации. Функции микротелец зависят от конкретной клетки (ткани). Однако на переднем плане здесь всегда стоят окислительные реакции, чаще всего — распад различных веществ. При этих реакциях возникает клеточный яд — перекись (пероксид) водорода Н2О2, который расщепляется на воду и кислород ферментом каталазой. Каталаза — главный фермент, общий для всех микротелец, которые известны под общим названием пероксисомы.Из растений были выделены пероксисомы фотосинтетически активных клеток (так называемые листовые пероксисомы; рис. 2.58) как органеллы, вовлеченные в процесс фотодыхания (см. 6.5.6). Кроме того, пероксисомы накапливающих масло семян, которые играют решающую роль при мобилизации запасов жиров, относят к глиоксисомам (см. 6.12). В обоих случаях обменные процессы между компаргментами в живой клетке становятся очевидными даже визуально благодаря тесному совместному расположению пероксисом с пластидами и митохондриями (при фотодыхании) или же олеосомами (при мобилизации жиров).
Пероксисомы происходят только из себе подобных, хотя они (в противоположность митохондриям и пластидам) не содержат нуклеиновых кислот. Все характерные ферменты синтезируются на свободных полисомах цитоплазмы и только потом, при отщеплении лидерной последовательности — транспептида, перемещаются в микротельца. Это напоминает соответствующие процессы у митохондрий и пластид (см. 2.2.8.2; 2.2.9).
2.2.6.7. Вакуоли и тонопласт
Заполненные клеточным соком вакуоли, особенно крупная центральная вакуоль закончивших рост клеток, — характерные структуры растительной клетки. Объем всех вакуолей одной клетки, называемый также вакуомом, составляет у клеток в первичных меристематических тканях примерно 20 % объема, а конечный их объем может достигать более 90 % (ср. рис. 2.2, А, С; 2.48, А—С; 2.59). Вакуоли — не плазматические компоненты, их содержимое чаще всего имеет значения pH порядка 5.5. иногда еще ниже (например, у лимона, который имеет характерное немецкое название «saurer Apfel» —«кислое яблоко»)1. От слабо щелочной цитоплазмы вакуоли отграничены тонопластной мембраной, чаще всего ее называют просто «тонопластом».
1 В случае лимона и других цитрусовых считать содержимое соковых мешочков вакуолярным содержимым не совсем верно Соковые мешочки образуются путем автолиза клеток — Примеч. ред.
Рис. 2.59. Вакуоли (А — препарат и съемка J Willenbrink В —съемка в интерференционном контрасте Н Falk С — съемка в фазовом кон трасте W Uri)
А—выделенные из протопластов запасающей паренхимы сахарной свеклы Beta vulgaris ssp altissima (320х) В—в плазмолизированных клетках эпидермиса запасающих чешуй лука репчатого Alttum сера плазматические тяжи вздуты из-за применения плазмолитика (1 М KSCN) (210х) С — клетка мякоти плода снежноягодника Symphortcarpos albus Ядро подвешено в центре крупной вакуоли на плазматических тяжах последние богаты актиновыми филаментами (320х)
При нормальных условиях общая молярная концентрация вакуолярного сока значительно выше, чем у жидкости в клеточных стенках, она практически соответствует чистой, в значительной мере деминерализованной воде. Вакуолярный сок является гипертоническим и поэтому насасывает воду через плазматическую мембрану и тонопласт (осмос, см 6 3 2 1). Возникающее за счет этого гидростатическое давление — тургор — натягивает клеточную стенку и уравновешивается давлением стенки Поскольку вакуолярный сок, будучи жидкостью, несжимаем, на антагонизме тургора и давления стенки основана твердость травянистых, неодревесневших частей растений (Отдаленно аналогичная ситуация имеется у животных с так называемым гидроскелетом, однако там речь идет о межклеточных полостях, которые туго заполнены жидкостью ). Когда клеточные стенки обнаруживают раз ломы или слабые места, как, например, в железистой ткани растении, с помощью тургора могут выдавливаться секреты.
Если внешнюю для клетки среду экспериментально сделать гипертонической по отношению к вакуолярному соку, то вакуоль теряет воду до тех пор, пока общие молярные концентрации всех осмотически активных компонентов сока и внешней среды не выравняются. Из-за уменьшения объема вакуоли давление на клеточную стенку сначала ослабевает, и в конечном счете от нее отстает протопласт происходит плазмолиз (рис. 2.59, В; 2.60). Однако имеются участки стенки, от которых клеточная мембрана не отстает даже при плазмолизе («отрицательные плазмолизные места», например, пояски Каспари в клетках эндодермы; см. 3.2.2.3). В таких местах гликановые цепи интегральных мембранных белков прочно закреплены в клеточной стенке.
Рис. 2.60. Клетки эпидермиса нижней стороны листа Rhoeo discolor (по W. Schumacher): А—в воде; В—начинающийся плазмолиз в 0,5 М KNО3; С—завершившийся плазмолиз, концентрация веществ вакуолярного сока возросла; D—деплазмолиз после помещения в воду
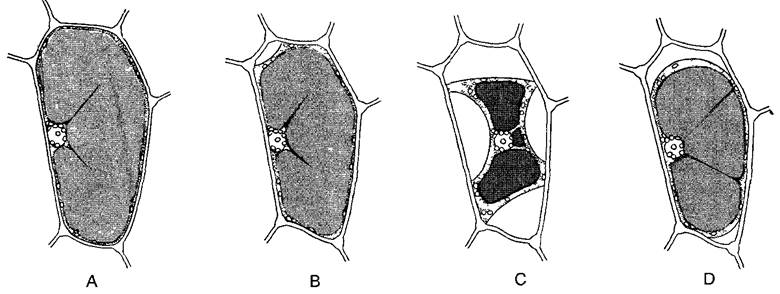
Свыше 120 лет назад В.Пфеффер с помощью плазмолиза установил полупроницаемость мембран живых клеток, а около 1900 г. Э. Овертон на основании соответствующих наблюдений разработал первые представления о химических и молекулярных свойствах биомембран.
Вакуоли часто служат запасающим компартментом. В вакуолярном соке наряду с неорганическими ионами (К+, СI-, Nа+) мы имеем дело, прежде всего, с органическими метаболитами, такими, как сахар и органические кислоты (яблочная, лимонная и щавелевая, аминокислоты). Часто вакуом служит также резервуаром для улавливания временных включений и метаболитов (например, для накопления в вакуолях сахарозы, особенно выраженного у сахарного тростника и сахарной свеклы; ночного накопления яблочной кислоты — соответственно малата у так называемых САМ-растений; см. 6.5.9).
Еще более бросается в глаза постоянное удаление соединений из цитоплазмы, где происходит их синтез и накопление в вакуоли, где они остаются изолированными1. Разнообразие этих веществ огромно.
1Например, цианогенные гликозиды изолированы мембраной вакуоли от соответствующих гликозидаз. — Примеч. ред.
Большинство их происходит от вторичного метаболизма растений (см. 6.16). Значительную часть этих соединений, известных под общим названием «растительные, или природные, вещества»2, используют в фармакологии, пищевой промышленности для получения ароматических, вкусовых или лекарственных веществ. Многие природные вещества содержатся в вакуоли в форме гликозидов, т.е. как соединения с одним или несколькими остатками сахаров. Будучи сравнительно крупными гидрофильными молекулами, они уже не могут покинуть вакуоль.
2 Чисто немецкий оборот речи. — Примеч. Ред.
Основные вещества вакуолей — экскреты (конечные продукты обмена веществ), которые не играют никакой роли в обмене веществ в клетке и были бы вредны для цитоплазмы и ее ферментов, по крайней мере в окончательных своих концентрациях. Некоторые из этих веществ — смертельные яды. Вакуолярные токсины делают особенно ясной важную роль внутриклеточной компартментации: когда эти яды воздействуют снаружи на продуцирующие их растения, они их убивают — клеточная мембрана для них проницаема, а тонопласт нет. Экологическое значение ядовитых/горьких веществ в вакуолях очевидно: они обеспечивают защиту от поедания, так как растительноядные животные избегают такие растения. Наконец, эти отношения отражают также особую ситуацию с клеткой растительных тканей, которая из-за особенностей организации растения не может отдавать свои шлаки в систему типа кровообращения, а должна сама избавляться от них или откладывать их внутри себя (локальное — клеточное — выделение вместо центрального).
Среди токсинов вакуолей необычайным разнообразием выделяется группа алкалоидов (см. 6.16.3). Многие из этих содержащих азот гетероциклов имеют важное фармакологическое значение: алкалоиды спорыньи из гриба Сlaviceps, морфин, кодеин и другие опиаты из опиума — высушенного млечного сока мака снотворного1; кониин из болиголова (Сonium maculatum), которым был отравлен Сократ; атропин, никотин и гиосциамин из различных пасленовых; колхицин из безвременника осеннего и т.д.
1Вряд ли стоит причислять систему млечников к вакуолям. — Примеч. ред.
Фенольные дубильные вещества (таннины) и продукты их окисления — флобафены удаляются из цитоплазмы из-за их губительного денатурирующего действия на белки. После повреждения тканей и в отмерших частях растений (пробке, ядровой древесине) они подавляют рост микробов и грибов.
В вакуолях многих клеток находятся кристаллы нерастворимого оксалата кальция (рис. 2.61). Их образование оберегает растение от вредного воздействия излишнего кальция. Эти кристаллы, имеющие различную форму, образуются внутри вакуоли в предварительно сформированной мембранной камере, а затем могут быть даже окружены слоем, содержащим суберин.
Рис. 2.61. Различные формы кристаллов оксалата кальция (A —D — по D. von Denffer): А, В—рафиды (пучки кристаллических игл, моногидрат) у Impatiens, продольный и поперечный разрез (200х); С—друза, моногидрат (Opuntia, 200х); D—тетрагональный одиночный кристалл в клетке эпидермиса Vanilla (дигидрат, 150х); Е—стилоиды (шиловидные структуры) оксалата в высушенной бурой чешуе лука репчатого Аllium сера (дигидрат; съемка в темном поле 65х)
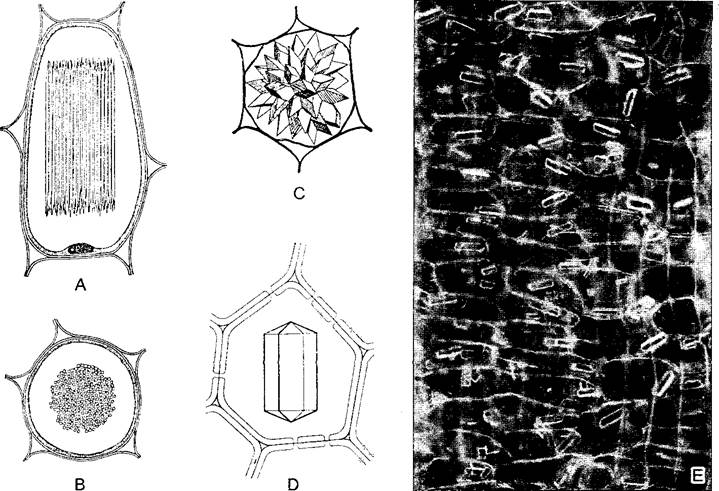
Растворимые в воде пигменты вакуолей (химохромы) служат и для привлечения переносящих пыльцу насекомых и для защиты от ультрафиолетового излучения. О вакуолях как литических структурах см. ниже.
Особенно важная для питания человека форма накопления питательных веществ в вакуолях встречается во многих семенах, особенно бобовых и хлебных злаков Семена из-за малого содержания в них воды и пригодности для транспортировки и хранения представляют особенную ценность. Они составляют примерно 2/3 производимых во всем мире сельскохозяйственных растительных продуктов. При созревании семян в периферических клетках зерен злаков и семядолях бобовых (гороха, фасоли, чечевицы и т.д.) образуются накапливающие белок вакуоли — алейроновые зерна (греч. aleuron — пшеничная мука, рис. 2.62), Запасные белки синтезируются на шероховатом ЭР. Алейроновые зерна возникают либо непосредственно на вздутых цистернах шероховатого ЭР, либо при посредничестве диктиосом через слияние пузырьков Гольджи (рис. 2.63).
Рис. 2.62. Алейрон (А — по Gassner; В — по D von Denffer)
А—поперечный разрез через наружные слои зерновки ржи (135х), В —D — эндосперм Ricinus communis, В—клетка с центральной масляной вакуолью (касторовое масло) и многочисленными алейроновыми зернами, каждое с четырехугольным белковым кристаллоидом и аморфным глобоидом (400х), С, D—отдельное алейроновое зерно — кристаллоид (670х)
Рис. 2.63. Образование и депонирование запасных белков у ячменя (Hordeum vulgare) (по D von Weitstem)
Клеточное ядро К с хроматином С и ядрышком, амилопласт А с крахмалом S, шероховатый ЭРЕ с полирибосомами, диктиосома G с отчленившимися белковыми пузырьками, белковая вакуоль V с аморфным гордеином Н и гранулярным глобулином, М—митохондрии, Р—плазмодесмы, Ро—полирибосомы
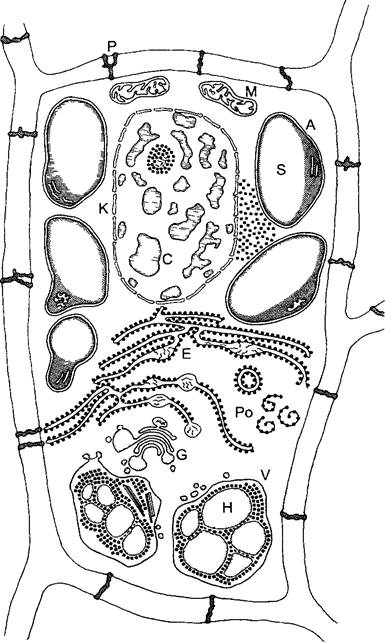
Запасные белки часто представляют собой мультимерные комплексы с большой массой частиц (у бобовых, например, тримерные вицелины с массой 150 — 210 кДа, а также гексамерный легумин с массой свыше 300 кДа) При прорастании семян запасные белки быстро гидролизуются и получающиеся аминокислоты транспортируются в растущий зародыш Алейроновые вакуоли, таким образом, проявляют себя как цитолизосомы — структуры, ответственные за внутриклеточный лизис веществ
Пространства, заполненные вакуолярным соком, вообще часто показывают свойства лизосом — отделенных от цитоплазмы компартментов для внутриклеточного пищеварения. Они содержат кислую фосфатазу и другие литические ферменты, в том числе протеиназы, РНКазы, амилазы и гликозидазы.
Все только что рассмотренные функции вакуома основываются на барьерной функции тонопласта и специфических транспортных процессах в тонопласте. Как только стало возможным препаративное выделение вакуолей (см. рис. 2.59, А), был продемонстрирован целый спектр механизмов перемещения веществ через биомембраны. Благодаря мечению антителами белков внутри тонопласта стало еще яснее, что в одной и той же клетке часто находятся различные вакуолярные структуры
Динамика пространств вакуолярного сока значительна. На ней основывается, например, растяжение растительных органов (см. 7.1.1). Чаще всего образуется
центральная вакуоль за счет слияния мелких провакуолей (англ prevacuolar compartments). В клетках камбия древесных пород (см. 3.1.2) зимой наблюдается обратный процесс: центральная вакуоль делится на многочисленные мелкие вакуоли, которые следующей весной опять сливаются между собой.
Для некоторых случаев хорошо подтверждены принципиально иные пути возникновения вакуолей. Так, свободная от органелл область цитоплазмы может окружаться цистернами ЭР, которые сливаются между собой, образуя сферу. Затем начинается автолиз (самопереваривание) внутреннего пространства, из которого таким путем возникает вакуоль Мембрана тонопласта происходит при этом из расположенной снаружи мембраны цистерн ЭР. Сама вакуоль соответствует в этом случае цитолизосоме.
2.2.7. Клеточные стенки
Стенка растительной и грибной клетки как формообразующий наружный скелет (экзоскелет) противостоит тургору, давление которого на протопласт через стенку составляет примерно 0,5—1 МПа (5 — 10 бар). Таким путем поддерживается механико-осмотическое равновесие содержащих вакуоли клеток. Стенка — продукт отложения живых клеток, который, хотя и отделен от клетки мембраной (плазмалеммой), находится в постоянном взаимодействии с цитоплазмой. Клеточная стенка в этом плане, по крайней мере в естественных условиях, представляет собой интегральный компонент живых клеток. В химическом отношении мы имеем здесь дело с набором многих различных полисахаридов и белков, а в отношении структуры — со сложной структурой из аморфной основы-матрикса — интегрированного туда скелетного материала из фибрилл. Большинство стенок тканевых клеток пронизаны многочисленными плазмодесмами — плазматическими «мостиками» между соседними клетками; при световой микроскопии они едва различимы.
Клеточная стенка относится к особенно характерным компонентам растительных и грибных клеток. При делении осуществляется отложение из клетки первоосновы стенки — клеточной срединной пластинки. Существование клетки, со всех сторон окруженной стенкой, делает невозможным фаготрофное питание. Наоборот, в одетой клеточной стенкой клетке — дерматобласте — значительная часть цитоплазмы находится в состоянии золя. Фактически у водорослей и высших растений ток цитоплазмы — частое явление. Наконец, из-за наличия клеточной стенки в теле растений не происходит перемещения клеток. Правда, нерасчлененные млечные сосуды или клетки волокон могут несколько протискиваться между клетками тканей или даже врастать между ними. Однако миграций клеток, как при онтогенезе многоклеточных животных, у растений никогда не наблюдается. Однажды образовавшиеся клеточные стенки растений лишь изредка снова лизируются. При многолетнем росте деревьев и кустарников значительные части растительного тела состоят из стенок отмерших тканей (древесина, пробка).
2.2.7.1. Развитие и дифференцировка
Развитие растительной клеточной стенки начинается при делении клетки с образования срединной клеточной пластинки путем слияния пузырьков Гольджи в фрагмопласт (см. 2.2.3.6). Клеточная пластинка состоит только из вещества матрикса (основы клеточной стенки), т.е. преимущественно из пектинов с незначительной долей белков. Она сохраняется в дальнейшем как срединная пластинка, так что клеточные стенки в основном трехслойные. Поскольку срединная пластинка не имеет фибриллярного скелета, она особенно легко может разрушиться. Ткань распадается на составляющие ее отдельные клетки (происходит мацерация; от лат. mасегаге — делаться мягким, рыхлым; известный пример: ткани плода яблок при созревании становятся рассыпчатыми).
Непосредственно после клеточного деления в каждой из дочерних клеток начинается образование новых слоев клеточной стенки, которые теперь содержат и скелетный материал (целлюлозу). За счет этого возникает сначала пластичная первичная стенка. Она принимает участие в длительном эмбриональном и более быстром постэмбриональном росте клетки, растягиваясь под действием тургора. Все- таки здесь мы имеем дело с истинным ростом, так как первичная стенка за счет отложения новых слоев становится толще, и ее сухая масса увеличивается. Из исследований в области клеточной физиологии мы знаем, что при росте клетки увеличивается не столько тургор, сколько меняется гибкость (пластичность) первичной стенки, а также синтезируется новый материал, прежде всего веществ матрикса. Увеличивается также доля скелетных фибрилл, в первичной стенке они составляют примерно % сухой массы. Скелетные фибриллы (они состоят у многих зеленых водорослей и всех высших растений из целлюлозы) гибкие, но очень прочные на разрыв. Наконец, клетка сама «зашнуровывает себя в корсет», сначала эластичный, но уже больше пластично не растяжимый. Стабилизируется окончательное состояние первичной клеточной стенки, которое часто сохраняется до отмирания клетки. Клеточную стенку стабильном состоянии называют саккодерма (греч. sakkos — одежда, derma — кожа).
У многоклеточных организмов дифференцировка клеток выражается и в последующих химических изменениях саккодермы или в образовании особых, дополнительных слоев стенки. В этих случаях речь идет о вторичных клеточных стенках. Вторичные слои стенки откладываются у саккодермы. Состав и ультраструктура соответствуют при этом функциям, которым эти слои стенки служат. У наземных растений на переднем плане стоят функции механического укрепления и изоляции от окружающей среды. Особо прочные вторичные стенки (см. 2.2.7.4) характерны для механических тканей, утолщенные — для изолирующих (см. 2.2.7.6).
2.2.7.2. Первичная клеточная стенка
В первичных стенках преобладают различные компоненты матрикса клеточной стенки — пектиновые вещества, гемицеллюлозы и структурные белки (рис. 2.64). Вещества матрикса выделяются через пузырьки Гольджи. Их механическая прочность незначительна; матрикс клеточной стенки — легко набухающие, изотропные гели сложного состава.
Рис. 2.64. Химический состав (сухая масса) первичных клеточных стенок культуры клеток Acer pseudoplatanus (явора) (по данным Р AIbersheim с сотр.)
Гемицеллюлоза ксилоглюкан (21,7%) сопутствует скелетным фибриллам из целлюлозы (23,9%) Арабиногалактаны и рамногалактуронаны соответствуют пектиновым веществам (вместе 36%) HPRG — богатый гидроксипролином гликопротеин (18,9%) Соответствующие процентные значения для клеточных стенок в листьях Arabidopsis thahana равны 28, 14, 42 и 14
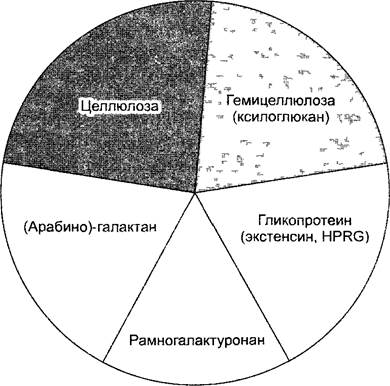
✵ Пектиновые вещества химически ге- терогенны Исходно сильно отрицательно заряженные, кислые полисахариды (галактуронаны и рамноталактуронаны) ранее трактовали как протопектин, их производные после этерификации части карбоксильных групп метиловым спиртом — как пектин В настоящее время к пектиновым веществам относят также содержащие мало кислых карбоксильных групп, но сильно гидрофильные полисахариды с относительно короткими цепями — арабинаны, галактаны, арабиногалактаны В целом они отличаются легкой растворимостью в воде и высокой склонностью к набуханию. В срединной пластинке отдельные молекулы связаны между собой в сеть двухвалентными катионами (Са2+, Мg2+). Если эти ионы удалить (например, щавелевой кислотой или хелатирующими веществами типа EDTA — этилендиаминтетрауксусной кислотой), пектиновые вещества переходят в раствор Свободные карбоксильные группы пектинов делают клеточные стенки эффективными катионообменниками. В некоторых органах растений (особенно часто, например, в семенной кожуре) образуется много пектиновых веществ, которые известны как растительные слизи (например, слизь айвы; гуммиарабик, вишневая камедь)1
1 Гуммиарабик и вишневая камедь образуются в местах механического повреждения, а не в семенной кожуре — Примеч. ред.
• Гемицеллюлозы менее гидрофильны и в целом имеют более крупные молекулы. Чтобы перевести их в раствор, необходимо применение щелочей. Основные представители гемицеллюлоз — глюканы с β (1 → 3)- и β (1 → 4)-связями, а также ксилоглюканы (у злаков замененные ксиланом с присоединенными арабинозными и другими остатками) Ксилоглюканы состоят из β(1 → 4)-связанных единиц глюкозы, из которых большинство несет α(1 → 6)-связанные ксилозные цепи. Гемицеллюлозы одевают целлюлозные фибриллы и таким образом придают прочность клеточным стенкам. В механически прочных вторичных стенках количественная доля гемицеллюлоз особенно высока.
Огромная разнородность полисахаридов матрикса (а именно таких компонентов, которые практически не увеличивают прочность стенки) долгое время представляла собой загадку. В последние годы были обнаружены новые важные функции веществ, входящих в состав клеточной стенки. Как и в теле животного, где гетеросахариды клеточной поверхности относятся к важнейшим распознающим и рецепторным структурам клеток (например, детерминанты групп крови), вещества клеточной стенки растении участвуют в распознавании гамет или же в управлении ростом пыльцевой трубки в ткани пестика. 2 Рост паразитических грибов в ткани растения подавляется антибиотическими защитными веществами — фитоалексинами. Синтез фитоалексинов вызывается элиситорами, наиболее действенные из которых — олигосахариды, высвобождающиеся при лизисе клеточной стенки ферментами гриба или пораженного растения (см. 9.3.4).
2 Физиологически активные вещества этого класса называют олигосахаридами — Примеч. ред.
✵ Преобладающие структурные белки клеточной стенки — гликопротеины с необычайно высокой долей гидроксилированного пролина. Почти все гидрокеипролиновые остатки (более 1/3 аминокислотных остатков!) гликозилированы и несут три или (чаще), тетра-L-арабинозидные цепи. Доля полипептидов у этих богатых гидроксипролином гликопротеинов (HRGPот англ. hydroxyproline rich glycoproteins) составляет едва ли 1/3 молекулярной массы (86 кДа), остальная часть приходится на углеводы. Белки образуют жесткую стержневую структуру длиной 80 нм, которая окружена арабинозидной «оберткой». HRGP обладают сильной тенденцией к ассоциированию, поэтому полагают, что в матриксе клеточной стенки они образуют сеть, придающую прочность. При стрессе, механическом повреждении или поражении паразитами их образование усиливается. У некоторых растений, особенно среди однодольных, структурного белка в клеточных стенках немного. В механически прочных вторичных стенках они чаще всего вообще отсутствуют.
В аминокислотной последовательности HRGP особенно обращает внимание ее гомология с коллагенами — важнейшими структурными белками межклеточного матрикса у животных и человека. Это дает основание выдвинуть гипотезу об общем филогенетическом происхождении генов для этих богатых гидроксипролином внеклеточных структурных белков. У определенных водорослей (например, Chlamydomonas) клеточная стенка состоит почти целиком из высокоупорядоченного слоя HRGP.
К HRGP относится наиболее распространенный структурный белок первичных клеточных стенок — экстензии. Важная подгруппа HRGP — арабиногалактановые белки (AGP). У этих протеогликанов белковая доля составляет чаще всего менее 10% общей массы. Наряду с HRGP часто встречаются еще два класса гликопротеинов клеточной стенки, богатые пролином и глицином, — соответственно PRP и GRP.
Скелет клеточной стенки состоит у всех высших растений из целлюлозы. От 2 000 до более чем 15 000 единиц β-глюкозы образуют длинные неразветвленные цепи (для сравнения: цепи α-D-глюкана запасных полисахаридов крахмала и гликогена спирально закручены и частично разветвленные).
У целлюлозы соседние глюкозные единицы вдоль оси молекулы (и вокруг этой оси) сдвинуты в каждом случае друг относительно друга на 180° и в этом положении удерживаются с обеих сторон гликозидными связями (рис. 2.65). Как раз благодаря этой конструкции пиранозные кольца отдельных мономеров лежат по всей глюкановой цепи примерно в одной плоскости, так что молекулы целлюлозы, длина которых может превышать 8 мкм, имеют форму ленты. Эти молекулы имеют сильную тенденцию к ассоциированию, они легко укладываются друг возле друга по длине с образованием водородных связей, причем сначала они образуют элементарные фибриллы (диаметром около 3 нм), а затем, особенно во вторичных стенках, также значительно более толстые микрофибриллы диаметром 5 — 30 нм (рис. 2.66). В таких скелетных фибриллах, которые также бывают лентовидными, на значительном протяжении имеется упорядоченность в виде кристаллических решеток. Гибкость особенно прочных микрофибрилл вторичных слоев стенки из-за сильно выраженного кристаллического строения ограничена, и при более сильном изгибе они ломаются, как иглы кристаллов. С функциональной точки зрения важно, что скелетные фибриллы имеют высокое сопротивление на разрыв. Компактная целлюлозная нить толщиной 1 мм может выдержать 60 кг (600 Н), т.е. предел прочности на разрыв составляет 80 % от предела прочности стали.
Рис. 2.65. Целлюлоза, фрагмент β-1,4-глюкановой цепи: две единицы целолобиозы (=4 глкжозильных остатка) (водородные связи по бокам основной цепи показаны пунктиром)
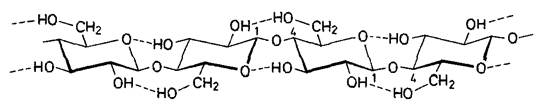
Рис. 2.66. Выделенные целлюлозные фибриллы в негативном контрасте (электронная микрофотосъемка W.W. Franke): А—элементарные фибриллы из слизи айвы; В— микрофибриллы сифонокладовой зеленой водоросли Valoma, разный диаметр отчасти объясняется лентовидной формой этих жестких скелетных фибрилл (треугольники-указатели); при более сильном изгибе они ломаются, как иглы кристаллов (стрелки)

На строго параллельной ориентации целлюлозных молекул в скелетных фибриллах основана необычайно сильная оптическая анизотропия целлюлозы. Она выражается в двойномпреломлении слоев стенки, богатых целлюлозой. Кроме того, из-за кристаллической структуры фибрилл целлюлоза дает также выраженное преломление на рентгеновских диаграммах. По обоим свойствам скелет клеточной стенки диаметрально противоположен ее изотропно-аморфному матриксу.
Биосинтез целлюлозы осуществляется в розетковидных, реже линейных белковых комплексах плазматической мембраны (рис. 2.67). Каждый целлюлозосинтазный (терминальный) комплекс образует несколько целлюлозных цепей, которые непосредственно после их синтеза кристаллизуются в элементарные фибриллы. Более толстые микрофибриллы возникают за счет концентрации на мембране рядом нескольких активных целлюлозосинтазных комплексов.
Рис. 2.67. Целлюлозосинтазные комплексы (замораживание-скалывание препаратов и электронная микрофотосъемка: А—U. Rudolph; В— I.Tsekos, H.-D Reiss):
А—в клеточной мембране листостебельного мха Funarta hygrometnca (протонема). Из 20 видимых на снимке розеток 5 отмечены овалами; В—«линейные» комплексы у красной водоросли Porphyra yezoensis
Синтез целлюлозы и образование фибрилл в естественных условиях строго связаны между собой, однако искусственно могут быть разделены. Красителями, которые особенно прочно соединяются с молекулами целлюлозы (конго красный или кальцифлуор белый — отбеливатель в моющих средствах), кристаллизация подавляется; синтез целлюлозы продолжается дальше, но фибриллы не образуются.
Оболочники — единственные из животных, у которых микрофибриллы образуются из целлюлозы («туницин»). У них в наружных клеточных мембранах клеток эпидермиса обнаружены целлюлозосинтазные комплексы.
С1-атомы отдельных глюкозных единиц расположены вдоль оси молекулы в одном и том же направлении. Молекулы целлюлозы (целлюлоза I) нативных элементарных и микрофибрилл ориентированы в этом плане все одинаково — следствие их одновременного возникновения на целлюлозосинтазных комплексах. Однако параллельная ориентация не соответствует энергетически благоприятному состоянию. При часто применяемом в технике осаждении целлюлозы из растворов (например, в процессе приготовления «медного шелка» из растворов целлюлозы в аммиачном гидроксиде Си2+ — реактиве Швейцера) образуются фибриллы, молекулы которых располагаются антипараллельно. Эта целлюлоза (II) стабильнее, так как она беднее энергией, чем нативная целлюлоза (I).
Целлюлоза — самая распространенная органическая макромолекула в биосфере: ежегодно на Земле синтезируется свыше 1011 т целлюлозы. Хозяйственное значение целлюлозы и ее производных огромно, особенно в текстильной промышленности. Чистую целлюлозу получают, прежде всего, из волосков семян хлопчатника, а также с помощью различных методов из древесины. Для человека целлюлоза не имеет пищевой ценности, а богатая целлюлозой пища содержит много балластного вещества. Многие растительноядные животные, особенно жвачные, обладают особыми приспособлениями для переваривания целлюлозы. Значительную роль играют при этом эндосимбиотические бактерии и простейшие, которые продуцируют ферменты целлюлазы, разрушающие целлюлозу.
В животном царстве (членистоногие), а также у многих грибов и некоторых водорослей встречается внеклеточное скелетное вещество хитин — линейный полимер N-ацетилглюкозамина. Хитиновые фибриллы, несмотря на то что они состоят из других мономеров, имеют структуру, сходную с целлюлозой, но их прочность вследствие интенсивного сцепления соседних молекул выше.
У сифоновых морских водорослей, отличающихся полиэнергидными гигантскими клетками, вместо целлюлозы функцию скелетного вещества выполняют ксиланы или маннаны. Эти полисахариды могут образовывать кристаллические агрегаты, но формирование фибрилл у них выражено меньше, чем у целлюлозы или хитина. У всех более крупных фотосинтезирующих наземных растений целлюлоза — единственное скелетное вещество. Она может образовываться непосредственно из продуктов фотосинтеза. Содержащие азот скелетные вещества (хитин, белки), напротив, предпочтительны у гетеротрофных организмов, у которых азот не является лимитирующим элементом.
Преимущественно кристаллические целлюлозные или хитиновые фибриллы практически не могут поглощать воду. Напротив, аморфные гидрофильные вещества матрикса в зависимости от наличия воды разбухают или высыхают. Без воды они сморщиваются в плотную массу, а при наличии воды становятся студнями, сухая масса которых составляет менее 3 % от сырой массы. (Это, как известно, используется при приготовлении питательных сред, а также желе.) Гигроскопические движения клеточных стенок или тканей (см. 8 4) почти нацело основываются, с одной стороны, на неизменности длины скелетных фибрилл, а с другой — на способности к разбуханию веществ матрикса. Особенно это бросается в глаза каждый раз, когда скелет и матрикс не проникают друг в друга, как в первичных стенках, а разделены, например, это имеет место у знаменитых гаптер спор хвоща (см. рис. 11.141, Р, J). Их гигроскопические движения основываются на том, что один внутренний слой построен из целлюлозы, а другой — из способного к разбуханию арабиноглюкана.
Согласно молекулярным структурным моделям первичной стенки (рис. 2.68), поверх целлюлозных фибрилл имеется покров из особенно устойчивых ксила- нов или же ксилоглюканов, отдельные фибриллы сплетаются в прочный скелет. В ячейках этой сети пектиновые вещества образуют вторую, уплотняющую матрикс сеть. Тогда как средняя ширина ячейки (пористость) нативной первичной стенки находится в пределах 5—10 нм (максимальное значение 20 нм; могут проходить глобулярные белки примерно до 50 кДа), после удаления пектинов экстрагированием стенка проницаема для частиц до 40 нм в диаметре.
Рис. 2.68. Упрощенная схема молекулярного строения первичной клеточной стенки (по С. Brett, К.Waldron, из LTaiz, Е.Zeiger, с изменениями).
Из многих компонентов стенки здесь показаны только целлюлозные микрофибриллы, прикрепленные к ним водородными связями и соединяющие их в сеть ксилоглюкановые цепочки (гемицеллюлоза, показаны темно-серым), пектины (соединенные в сеть ионами Са2+, показаны точками) и белки клеточной стенки
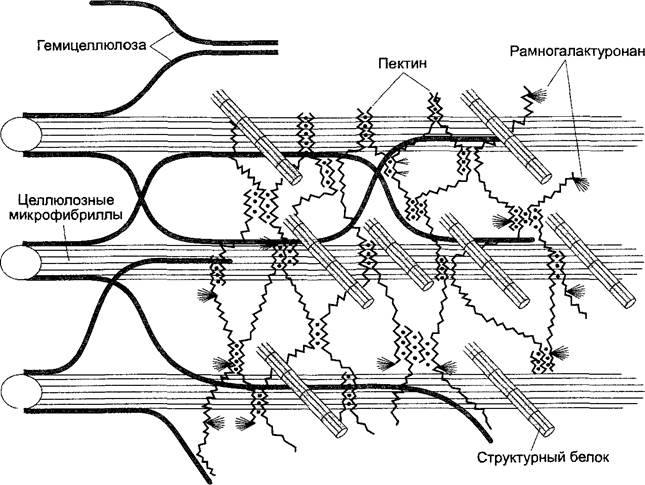
При утолщении первичной клеточной стенки последовательно откладываемые ее слои постепенно пластично растягиваются все сильнее. Одновременно со стороны клетки выделяются новые слои стенки. Каждый отдельный слой стенки при этом все время отодвигается дальше наружу и за счет растяжения постепенно утоньшается, а сеть скелета стенки при этом разрыхляется. Растущая клетка управляет направлением хода скелетных фибрилл в только что образованных слоях стенки. Поскольку каждая скелетная фибрилла при возникновении зажимается между плазматической мембраной и уже имеющимися слоями стенки, целлюлозосинтазные комплексы за счет своей синтетической активности в жидкой плазматической мембране должны перемещаться. Это движение управляется, очевидно, кортикальными микротрубочками, расположенными непосредственно под мембраной, как по направляющим рельсам (см. рис. 2.72). У многих растущих клеток ориентация скелетных фибрилл в следующих друг за другом слоях первичной стенки каждый раз поворачивается под одним определенным постоянным углом, причем за день она обычно проходит полный оборот — впечатляющее проявление циркадной ритмики (см. 7.7.2.3).
Пластичность клеточных стенок контролируется ростовыми веществами — фитогормонами (см. 7.6.1.4). Она является решающей для растяжения стенки. Пластичность основывается на уменьшении поперечного переплетения скелетных фибрилл, так что они получают возможность двигаться друг относительно друга.
Первичные клеточные стенки содержат различные ферменты, которые способствуют такому разрыхлению. Глюканазы могут разлагать глкжаны матрикса. Водородные связи между целлюлозными фибриллами и ксилоглюканами временно размыкаются экспанзинами. Другие ферменты могут удлинять ксилоглюкановые цепи путем встраивания новых мономеров1.
1 Эстеразыизменяют степень этерификации пектинов: сильно метилированные пектины образуют менее прочную сеть, а деметилированные адсорбируют Са2+, и сеть становится более прочной. — Примеч. ред.
Различные компоненты клеточной стенки непосредственно взаимосвязаны с цитоскелетом через интегральные белки клеточной мембраны. Эти связующие белки характеризуются специфической последовательностью -аrg-gly-asn- (RGD). Если связь цитоскелета с экзоскелетом клетки нарушается при избытке пептидов с этой последовательностью, соответствующие клетки становятся неспособными к регулярным делениям и правильному размещению в ткани.
Окончательная форма растительных и грибных клеток зависит от того, растет первичная клеточная стенка изометрично или анизометрично. Клетки, сильно растущие только в одном направлении, показывают верхушечный рост. В этом случае секреция веществ матрикса, которая осуществляется путем экзоцитоза пузырьков Гольджи, ограничена растущей верхушкой клетки, где цитоплазма особенно богата актиновыми филаментами. Клетки с верхушечным ростом могут внедряться между пространственно фиксированными структурами, например, между частицами почвы в случае корневых волосков и грибных гиф или между соседними клетками у клеток волокон, млечных сосудов и пыльцевых трубок (интрузивный рост).
2.2.7.3. Плазмодесмы и поровые поля
Плазмодесмы — это плазматические соединения между соседними клетками через разделяющие их клеточные стенки. Они объединяют отдельные клетки тканей в один симпластический континуум.
Часто плазмодесмы встречаются группами, которые называются первичные поровые поля, так как они могут превращаться в замыкающие пленки пор (см. 2.2.7.5). В их области клеточные стенки часто тоньше (рис. 2.69, С). Каждая плазмодесма окружена в клеточной стенке покровом из каллозы. Поскольку каллозу (см. 2.2.7.6) легко можно выявить с помощью флуоресцентной микроскопии, расположение плазмодеем, несмотря на их малый диаметр (30 — 60 нм), можно точно установить даже с помощью светового микроскопа (рис. 2.69, А). На электронно-микроскопических изображениях они выглядят как простые или разветвленные трубки (рис. 2.69, Э —в; 2.71), которые окаймлены клеточной мембраной. Клеточные мембраны соединенных клеток переходят здесь одна в другую. Через каждую пдазмодесму проходит центральный тяж — десмотрубочка (рис. 2.69, Е; 2.70). Он соответствует локальной модификации ЭР, однако (вопреки вводящему в заблуждение названию) не является трубчатой структурой, а представляет собой компактный тяж из структурных белков, который в обеих граничащих клетках контактирует с цистернами ЭР. Пространство в виде полого цилиндра между десмотрубочкой и клеточной мембраной относится к мембранным структурам цитоплазмы. Оно должно было бы по своим размерам быть проходимым даже для крупных белковых молекул, и в особых случаях это действительно происходит: например, растительные вирусы распространяются в ткани через плазмодесмы. Однако в обычных условиях проницаемость ограничена частицами с молекулярными массами менее 1 кДа (диаметр 2 нм), так как между глобулярными белками клеточной мембраны и соответствующими белками десмотрубочки растянуты соединительные белки, разделяющие плазматический полый цилиндр на множество микроканалов. Последние могут быть расширены благодаря особым двигательным белкам, которые являются посредниками специфического и направленного транспорта (см 7 4 4 1, рис 7 30)
Рис. 2.69. Плазмодесмы и первичные поровые поля при световой и электронной микроскопии (А—съемка в световом микроскопе I Dorr, В von Cleve, С—съемка в темном поле, D—G — электронная микрофотосъемка R Kollmann, С Glockmann)
А—в паренхиме побега тыквы Cucurbita pepo каллоза видна благодаря обработке флуоресцентным анилиновым синим (220х) В—в утолщенных клеточных стенках эндосперма Royena villosa, контрастировано пропиткой йодистым серебром (770х), С—клеточные стенки в перегородке стручочка лунника Lunaria rediviva, кажущиеся прорывы в стенке представляют собой тонкие места которые соответствуют первичным поровым полям (300х), D—контактирующие с шероховатым ЭР плазмодесмы в стенке W между клетками каллуса Vicia faba, Е—разрезанные поперек плазмодесмы первичного порового поля у Metasequoia glyptostroboides, каждая плазмодесма отграничена трехслойной клеточной мембраной от светлой каллозной оболочки в клеточной стенке с центральной десмотрубочкой, F, G—модификации первичных плазмодесм между клетками Страсбургера в хвое Metasequoia gfyptostroboides, ранняя и конечная стадии развития
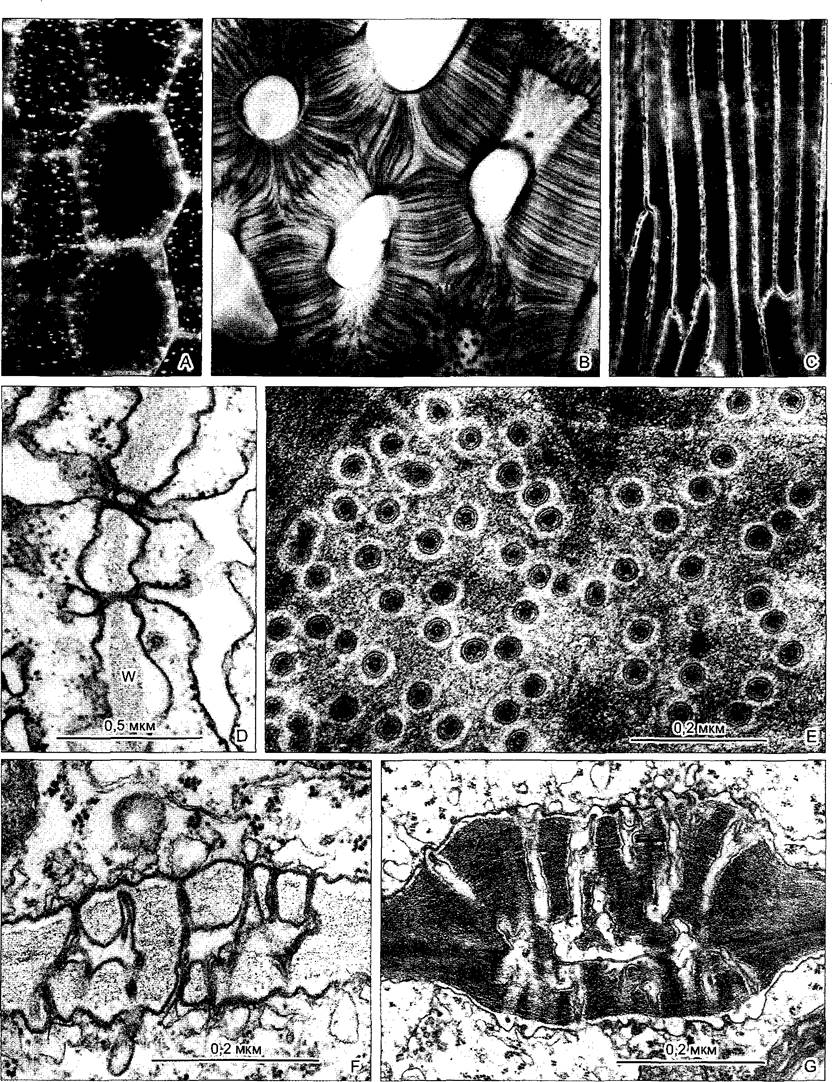
Многие плазмодесмы закладываются уже при клеточном делении как выемки в клеточной пластинке (первичные плазмодесмы). Однако и позже плазмодесмы постоянно образуются заново (вторичные плазмодесмы), так что удельное число плазмодесм на единицу площади даже в растущих клетках часто остается более или менее постоянным, хотя поверхность стенки при постэмбриональном росте клетки часто увеличивается более чем в 100 раз по сравнению с исходной. При прививках или поражении паразитами (например, Cuscuta, см рис 4 38, 4 39, А, 11 281, D) между клетками особей, даже относящихся к разным расам или видам, образуются плазмодесмы. Вторичные плазмодесмы особенно часто бывают разветвленными. Схема образования вторичных плазмодесм показана на рис 2.71
Рис. 2.70. Модель ультраструктуры плазмодесмы слева — продольный справа — поперечный разрез (по W J Lukas)
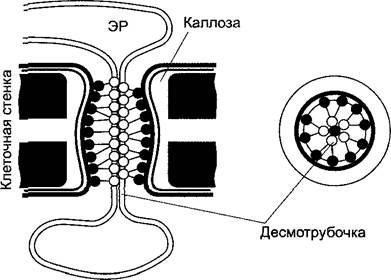
Рис. 2.71. Возникновение вторичных плазмодесм (по R. Коllmann, С. Glockmann)
А—элементы ЭР двух соседних клеток приблизились к клеточной мембране, клеточная стенка (показана черным) в этом месте лизируется В—элементы ЭР обеих клеток сливаются, пузырьки из аппарата Гольджи поставляют новый материал стенки, С—вновь синтезированная стенка пронизана вторичными плазмодесмами, часть которых разветвленные («срединные узелки» в области срединной пластинки)
На 100 мкм2 поверхности стенки в паренхиме приходится 5 — 50 плазмодесм. Когда соседние клетки тесно кооперируются между собой, например, клетки-спутницы и элементы ситовидных трубок во флоэме (см 3 2 4 1) или клетки мезофилла и обкладки у С4-растений (см 6 5 8), достигается значительно большая плотность плазмодесм, в меристемах — до 1200 на 100 мкм2 и более. У физиологически изолированных клеток, например, замыкающих клеток устьиц (см 3 2 2 1), они, напротив, особенно редки
Если между клетками должен быть массовый поток, плазмодесмы вторично сильно расширяются Наиболее известный пример — ситовидные поры в ситовидных пластинках проводящих пучков флоэмы (см 3 2 4 1) Диаметр этих пор в клеточной стенке в предельных случаях может достигать 15 мкм, часто же встречаются значения в интервале 0,5 — 3 мкм Исследования с флуорохромами показали, что ситовидные пластинки не препятствуют массовому току веществ в проводящих путях флоэмы Тем не менее плазмодесмы могут запираться при участии убиквитина или даже полностью исчезать Если, например, одна клетка в ткани отмирает, ее плазмодесмы за счет очень быстрого утолщения их каллозной оболочки плотно закрываются и замыкаются, а соседние клетки могут незатронутыми жить дальше Однако исходно имевшиеся плазмодесмы даже между живыми клетками или группами клеток могут полностью исчезать, когда такие «симпластические домены» должны быть изолированы от своих соседей в ходе морфогенетических процессов Вопреки прежним представлениям плазмодесмы в любом случае не статические, а в высшей степени динамичные образования, плотность и пропускная способность которых могут быстро меняться,
приспосабливаясь к особым локальным потребностям
В животных тканях плазмодесмы не встречаются. Однако и у них соседние клетки могут быть физиологически связаны через плотные щелевые контакты — особые участки плазматических мембран со многими каналами (коннексонами), каждый с 6 белковыми молекулами (коннексин). Плазмодесмы и коннексоны — аналоги, т е построены по-разному, однако имеют сходные функции — обмен ионами и сигнальными молекулами между клетками. Интересно, что путем иммунофлуоресценции в плазмодесмах можно выявить белки, которые серотогически родственны коннексинам.
2.2.7.4. Вторичные стенки клеток волокон и древесины
У водных растений вес вегетативного тела компенсируется выталкивающей силой воды. Растения, которые во время роста поднимаются из воды в воздушную среду, напротив, должны уметь сами нести свой вес (исключение лазящие растения, см табл 4.1). У крупных наземных растений для данной функции образуются особые механические ткани (см 3 2 3). В них находятся клетки двух типов клетки волокон для проведения веществ и сильно одревесневшие клетки, когда надо противостоять внешнему давлению (например, склереиды, трахеиды, трахеи) с жесткими стенками В так называемой физиологической анатомии растений (С. Швенденер, Г. Габерландт) все механические ткани растения объединяют механическую систему, а клетки этих тканей соответственно называют механическими клетками.
Массивные вторичные слоистые утолщения стенок клеток волокон и некоторых растительных волосков (например, у хлопчатника) состоят преимущественно из плотно упакованных микрофибрилл целлюлозы. Доля этих отложений стенки в сухой массе может достигать 90 %. Волокна клетки (и некоторые толстостенные клетки волосков) отражают на высоком пространственном и структурном уровне типичные свойства скелетных микрофибрилл: они не разрываются даже при сильных нагрузках на растяжение, но гибкие. На этих свойствах веществ растительных волокон основано их огромное хозяйственное значение.
Поскольку вторичные слои клеток только после завершения роста растяжением первичной клеточной стенки могут откладываться изнутри в той мере, в какой из-за них утолщается стенка, сужается просвет клетки. Пространство для живого протопласта в конце концов часто сокращается до менее 5 % от исходного объема, и клетка отмирает. Функционально далее имеет значение только сама стенка.
Целлюлозные микрофибриллы располагаются всегда параллельно клеточной мембране, однако в задаваемой таким путем плоскости возможны различные варианты упорядочения (текстуры; от лат. texturа — ткань, сплетение) (рис. 2.72; 2.73). Первичные стенки чаще всего показывают беспорядочную текстуру (правда, часто с предпочтительным направлением), слои вторичных стенок отличаются параллельной текстурой. У вытянутых в длину клеток, прежде всего у волокон, волокнистая, спиральная или трубчатая текстура может становиться разной в зависимости от ориентации микрофибрилл относительно продольной оси. Трубчатая и волокнистая текстуры — пограничные случаи по отношению к спиральной текстуре. Направление текстуры соответствует направлению основного механического воздействия.
Стенки клеток волокон чаще всего показывают спиральную текстуру с большим шагом спирали, которая в противоположность более редкой строго продольной (волокнистой) текстуре может пружинить при воздействии перемещений воздуха. Направление спиралей при такой текстуре различно. Фибриллы вторичной стенки волокон конопли и джута правовращающие, а волокна льна и крапивы — левовращающие. В растительных волосках с утолщенными стенками направление вращения может многократно меняться: на нескольких сантиметрах волосков у хлопчатника — до 150 раз.
Рис. 2.72. Параллельное и беспорядочное расположение целлюлозных микрофибрилл (электронная микрофотосъемка D.G Robinson).
Клеточная стенка водоросли Oocystis solitaria состоит из многих наложенных друг на друга слоев А—при нормальных условиях скелетные фибриллы в каждом слое параллельны, от слоя к слою смена направления на 90° (крестообразное расположение); В—колхицин, под влиянием которого кортикальные микротрубочки на внутренней стороне клеточной мембраны разрушаются, вызывает беспорядочное расположение фибрилл

Рис. 2.73. Расположение целлюлозных микрофибрилл в клеточных стенках
А—беспорядочное расположение типично для первичной стенки изодиаметрических клеток. Вторичные слои стенки, напротив, показывают параллельное расположение; В—волокнистое расположение (текстура), С—спиральное расположение (текстура) — наиболее частая форма, D—трубчатое расположение (текстура)
Понятно, что трубчатая текстура у клеток волокон не встречается. Она получила свое название от млечных трубок многих растений (см. 3.2 5.1), для стенок которых она типична Млечные трубки испытывают внутреннее давление, и, хотя это давление жидкости изотропно, давление на стенки в поперечном направлении больше, чем в продольном. (В технике давно известно, что при избыточном давлении в трубах происходят продольные разрывы.)
Отложение вторичных слоев стенки осуществляется по частям. Возникают слои, которые часто представляют собой дневной прирост и в свою очередь образуют пакеты слоев. Их называют слоями вторичной стенки. Общая схема строения и названия слоев приведены на рис. 2.74. За саккодермой следует первый, относительно тонкий слой вторичной стенки — это переходный слой S1 мелкой спиральной текстурой. За ним внутрь клетки следует толстый слой S2, который может состоять более чем из 50 пластин. Его функции различны. Плотно упакованные скелетные микрофибриллы показывают здесь спиральную или волокнистую текстуру. К просвету клетки дальше будет примыкать как последнее отложение тонкий слой S3 (третичная стенка), также отличающаяся текстурой. В свою очередь слой S3 может быть еще покрыт сильно отличающимся в плане структуры и химического состава изотропно-гомогенным «бородавчатым слоем», который обязан своим названием зернистой поверхности.
Рис. 2.74. Вторичное утолщение стенки на примере трахеиды у хвойных (А, В — по I.W Bailey)
А—поперечный разрез (800х), В—слои клеточной стенки: М—срединная пластинка, Р—первичная стенка (саккодерма); S1—переходный слой; S2—собственно вторичная стенка, построенная из многих слоев, S3—третичная стенка, С—спиральные трахеиды у тыквы с характерными утолщениями, которые принадлежат слоям вторичной клеточной клетки S2 (ср. рис 3.24, Е), слева — клетки паренхимы
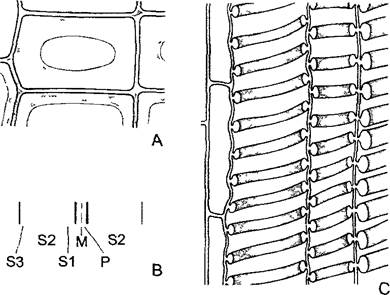
В успешно противостоящих давлению клеточных стенках скелетные фибриллы упакованы в материалы с жесткой формой, т.е. инкрустированы. Такие инкрустированные клеточные стенки содержат в качестве инкрустирующего материала наряду с минеральными веществами (силикаты: злаки, осоки, хвощи; карбонат кальция: известковые водоросли, волоски многих тыквенных и бурачниковых) лигнин. Инкрустацию лигнином называют также одревеснением клеточной стенки (от лат. lignum — древесина). Лигнины — имеется три различные его формы у однодольных, лиственных и хвойных пород — возникают при одревеснении клеточной стенки путем полимеризации из фенольных соединений (монолигнолов; см. 6.17.2; рис. 6.132 — 6.134), которые в свою очередь экзоцитируются как растворимые глюкозиды через пузырьки Гольджи. Растущие во всех направлениях гигантские молекулы лигнина внедряются в микрофибриллярный скелет клеточных стенок. Лигнин оптически изотропный. Поскольку молекулы лигнина вторично соединены друг с другом в более крупные единицы и могут распространяться через (часто особенно сильно лигнифицированные) срединные пластинки, лигниновая масса ствола дерева соответствует, по крайней мере гипотетически, одной-единственной гигантской полимерной молекуле, масса которой исчисляется в тоннах. Исходный матрикс клеточной стенки при лигнификации заменяется (вытесняется) компактным лигниновым полимером. Одревесневшие клеточные стенки в типичном случае состоят примерно на 2/з из целлюлозы и стойких гемицеллюлоз (преимущественно ксиланов; от греч. xylon — древесина), на 1/з из лигнина.
Целлюлозные фибриллы оказываются наконец так плотно упакованными в лигнин, что больше не могут перемещаться друг относительно друга, а их ограниченная способность к разбуханию утрачивается полностью. В первичных стенках целлюлоза легко разрыхляется концентрированным раствором хлорида цинка, так что
может впитывать йод и при этом окрашиваться в темно-фиолетовый цвет, однако в одревесневших стенках эта реакция с хлор-цинк-йодом не происходит. Замечательная прочность таких стенок и далее одревесневшей ткани, прежде всего самой древесины, основывается на этом взаимном проникновении гибких скелетных фибрилл и плотного, жесткого наполнителя лигнина. Технические аналоги этого способа построения материала — армированные пластмассы, плотно склеенный картон или древесно-стружечные плиты (ДСП).
Наглядный пример различной роли скелета и инкрустирующих материалов для придания прочности дает реакционная древесина горизонтально растущих ветвей. У хвойных нижняя сторона таких ветвей усиливается настолько, что выдерживает деформацию сжатия: клеточные стенки в этих тканях особенно сильно лигнифицированы. Лиственные деревья, напротив, образуют древесину, выдерживающую деформацию натяжения; на верхней стороне ветвей такая древесина содержит много клеток с толстыми вторичными слоями вторичной стенки из чистой целлюлозы; такие волокнистые клетки обозначают как G-клетки («G» от gelatine — желатина, по внешнему виду при микроскопировании).
Способность выдерживать давление проявляется и в системах проведения воды на большое расстояние: в одревесневшей части (ксилеме) проводящих пучков и древесине многолетних осей побегов или корнях. Проводящие воду элементы ксилемы (трахеиды и трахеи, см. 3.2.4.2) происходят из живых клеток, но в функционирующем состоянии представляют собой мертвые трубки, упроченные путем лигнификации. Благодаря лигнификации ксилемные пучки и древесина — часто важнейшие несущие структуры в теле наземных растений.
2.2.7.5. Поры
Лигнификация делает клетки не только жесткими, но и менее проницаемыми. Если в неодревесневшие первичные стенки могут проникать частицы диаметром до 5 нм, то в одревесневших стенках сильно снижена даже проницаемость для воды. Это также имеет значение для проведения воды в корнях, стеблях и листьях: за счет
одревеснения затрудняются поступление или выход воды. Там, где все же нужно перемещение воды (или вообще обмен веществами), закладываются в стенках поровые каналы, — каналы, видимые при световой микроскопии. Рис. 2.75 показывает типичные поровые структуры во вторично утолщенных клеточных стенках. Поровые каналы в соседних клетках соответствуют друг другу, они встречаются на первичных поровых полях. Области первичных стенок, богатые плазмодесмами, функционируют при этом как замыкающие структуры поры.
Окаймленные поры (англ, bordered pits) характерны для сосудов, проводящих воду. У них вторичные слои стенки вокруг порового канала (porus) приподняты над замыкающей пленкой, так что возникает воронковидный «двор». Трахеиды хвойных отличаются особенно крупными, округлыми окаймленными порами. Через них течет поднимающаяся по стволу вода. Замыкающие структуры утолщены в середине в торус (лат. torus — подушка), который подвижно подвешен на радиальных крепежных нитях из целлюлозы. Вода может протекать между нитями из одной трахеиды в следующую. При воздушной эмболии окаймленная пора действует как замыкающий вентиль: торус прижимается к поровому каналу со стороны, откуда действует давление, и замыкает его (см. рис. 2.75, С).
Рис. 2.75. Поры (А—по W. Halbsguth; В—по Rothert, Reinke; F—съемка в световом микроскопе H.Falk; Н—сканирующая электронная микроскопия A. Resch):
А—фрагмент каменистого эндосперма пальмы «слоновая нога» (Phytelephas); сильно утолщенные клеточные стенки (М — срединная пластинка) служат здесь как депо для запасных полисахаридов; клетки связаны плазмодесмами, особенно поровыми каналами ТК (230х); В—каменистая клетка (склереида) из скорлупы грецкого ореха (Juglans) с разветвленными поровыми каналами; каналы, которые, по-видимому, пронизывают не все слои вторичной стенки, косо выходят из плоскости среза (670х); С—F—окаймленные лоры хвойных: С—схематично, слева общий вид, в середине продольный срез; справа то же, замыкающее действие при одностороннем давлении; D, Е —окаймленные поры сосны Pinus sylvestris,общий вид в фазовом контрасте и в поляризационном микроскопе (целлюлозные фибриллы окружают черную пору; общая концентрическая структура в поляризованном свете формирует так называемый «сферитный крест» — ср. также рис. 2.90, В) (ЗЗОх); F—окаймленные поры у сосны горной Pínus mugo, продольный разрез: образование окаймления путем подъема вторичных стенок, различимы пора и замыкающая пленка с торусом (утолщенной центральной частью пленки поры) (600х); G, Н—окаймленные поры у лиственных пород: G—со щелевидной порой (по форме напоминает «кошачьи глаза») в стенках сосудов дуба Quercus robur, справа также на поперечном срезе стенки (стрелка; 530х); Н—сосуд с порами ивы Salix (1 000х)

2.2.7.6. Модификации вторичных стенок
К важнейшим условиям для жизни растений (и активной жизни вообще) относится обеспечение водой (см. 6.3; 13.5). Большинство наземных растений обладает специальными приспособлениями, чтобы избежать высыхания на воздухе. Особенно важны при этом липофильные слои вторичных стенок у тех клеток, которые расположены на поверхности тела (эпидермальные клетки) или вблизи поверхности (клетки пробки). В противоположность механическим вторичным стенкам, которые служат для прочности и всегда содержат много целлюлозы, утолщенные слои вторичных стенок состоят из водонепроницаемого гидрофобного материала и не содержат в типичном случае целлюлозы. Непроницаемость для воды достигается не за счет инкрустации целлюлозных слоев стенки, а за счет отложения (аккрустации) липофильных веществ (аккрусты) на образовавшуюся раньше саккодерму, которая служит основой для аккрустации и обеспечивает необходимую механическую прочность. В эпидермисе таким веществом является кутин (лат. cutis — кожа, поверхность), у клеток пробки — это химически родственный суберин (лат.
súber — пробка; см. 6.17.3). Кутин и суберин образуют полимерный матрикс, в который дополнительно включаются особые гидрофобные компоненты — различные воска.
Опробковевшая клеточная стенка состоит из расположенного внутри сакко- дермы суберинового слоя (рис. 2.76). Со стороны просвета клетки он часто покрыт еще одним тонким слоем, который снова содержит целлюлозу (третичная стенка), однако функционально решающую роль играет субериновый слой как аккрустирующее вторичное отложение стенки. Он сам практически непроницаем для воды за счет воска, который образует в субериновом слое параллельные пластины толщиной 3 нм (рис. 2.77, А). Палочковидные молекулы воска ориентированы перпендикулярно плоскости ламелл. После удаления воска (он состоит преимущественно из смеси сложных эфиров жирных кислот с восковыми спиртами) остается нерастворимый, аморфно-изотропный полимерный матрикс — собственно суберин. Он представляет собой трехмерный сплетенный в сеть конденсат из имеющих длинные цепочки жирных кислот, жирных спиртов и родственных соединений. Матрикс отличается высокой гидрофобностью, но проницаем для воды. В субериновом слое он служит как стабильный носитель тонких восковых пленок, которые, в свою очередь, блокируют поступление гидрофильных веществ. Например, такие пленки на два порядка менее проницаемы для ионов, чем макромолекулярный суберин. Способ построения ламелл вторичной стенки (как вообще у изолирующих слоев, в том числе в технике) гарантирует очень действенный барьер даже при дефектах отдельных слоев.
Молекулярные компоненты суберина и пластин воска выделяются опробковевшими клетками не через пузырьки Гольджи, а путем диффузии Место их образования — гладкий ЭР. Формирование суберинового слоя может осуществляться весьма быстро — например, при поранении за несколько часов.
Рис. 2.76. Модель ультраструктуры опробковевшей клеточной стенки
Липофильный субериновый слой не содержит целлюлозы В третичной стенке снова появляются скелетные фибриллы
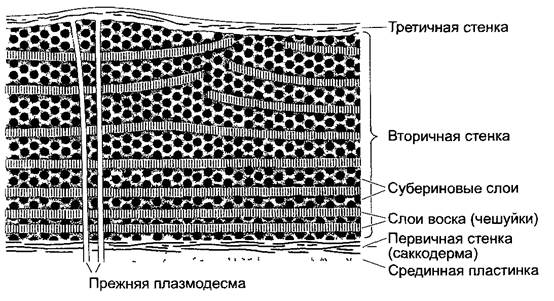
Кутикула в принципе построена сходно с субериновым слоем опробковевших клеток (см. 3.2.2.1). Она также представляет собой свободный от целлюлозы липофильный слой стенки с восковыми пленками, имеющими параллельные поверхности, в полимерном матриксе из кутана, а весь комплекс откладывается на первичную клеточную стенку (рис. 2.77, В). Правда, аккрустация осуществляется здесь на наружной стороне саккодермы. Молекулярные компоненты, таким образом, секретируются клетками эпидермиса через первичную стенку наружу. В этом процессе участвуют мелкие основные белки — переносчики липидов в матриксе стенки. Так возникает единое для всех эпидермальных клеток образование — кутикула.
Рис. 2.77. Ламеллярное строение аккрустированных слоев клеточной стенки (поперечные разрезы), восковые слои не контрастированы полимерный матрикс (суберин, кутин) темный (электронная микрофотосъемка А Н Falk В J Wattendorff)
А—клеточная стенка из раневой перидермы картофеля, стенки двух соседних клеток пробки с ламеллированными субериновыми слоями, В—отделенная кутикула Agave americana
Воска кутикулы имеют более длинные углеводные цепочки, соответственно обладающие еще большей гидрофобностью (чисто С- атомов колеблется у них между 25 и 33 — тогда как у восков пробки — от 18 до 28).
Для растений сухих местообитаний особенно характерны кристаллы воска на поверхности кутикулы (эпикутикулярный воск, ср рис 3 11) За счет них кутикула становится неувлажняемой Часто кутиновые массы откладываются во внешних слоях первичной стенки эпидермальных клеток, под собственно кутикулой В таких кутикулярных слоях встречаются кутин и сопровождающие воска как инкрустирующие вещества Однако эти гидрофобные вещества стенки плохо перемешиваются с гидрофильными компонентами первичной стенки, что выражается малой упорядоченностью на ультраструктурном уровне Восковые пленки часто прерываются и больше не располагаются параллельно поверхности, а дополнительная защита от транспирации даже у толстых кутикулярных слоев лишь умеренная Соответствующих явлений у клеток пробки не бывает В многослойной пробковой ткани сильное утолщение может достигаться путем образования новых слоев пробковых клеток, тогда как кутикула на граничащих с воздухом внешних поверхностях эпидермиса часто остается ограниченной и поэтому в основном однослойной.
Поверхность тела членистоногих также несет кутикулу. Сильно развитые внутренние слои кутикулы насекомых (эндо- и экзокутикула), образующие содержащий хитин наружный скелет обеспечивают прежде всего механическую прочность, тогда как внешняя аккрустированная эпикутикула из-за большого содержания в ней воска является отличной защитой от транспирации Эпикутикула показывает, как в химическом, так и в ультраструктурном плане, много параллелей с растительной кутикулой — яркий пример конвергентной эволюции у животных и растений.
Микроскопически мелкие споры и пыльцевые зерна также обычно имеют аккрустированные клеточные стенки — спородермы (см. рис. 11.174; 11Л 76). В качестве аккрустируюших веществ здесь встречаются особенно стойкие спорополленины. Их функция состоит, правда, не в удержании воды (это было бы при крайне высоком соотношении поверхность/объем иллюзорным, а эти клетки выживают даже при полном высыхании1). Здесь речь скорее о защитных слоях, которые могут, в том числе, поглощать вредное ультрафиолетовое излучение. Спородермы полностью отличаются не только функционально, но по химии, ультраструктуре и развитию от кутиновых стенок эпидермиса и субериновых слоев клеток пробки. Они важны для систематики и реконструкции эволюции растительности (спорово-пыльцевой анализ).
1 Не всегда споры и пыльцевые зерна остаются жизнеспособными при высыхании, поэтому в ряде случаев водоудерживающая функция спорополленина очевидна. — Примеч. ред.
Материалом для утолщения особого рода является каллоза — глюкан с одной-тремя гликозидными связями, имеющий спиралевидную молекулу, он всегда встречается в очень компактной форме без примесей других веществ. С помощью каллозы могут замыкаться плазмодесмы и ситовидные поры (см. 2.2.7.3); только что образовавшиеся пыльцевые зерна при образовании спородермы отграничены друг от друга толстыми слоями каллозы; а в быстро растущих пыльцевых трубках продвигающийся вперед вместе с апикальной частью протопласт вегетативной клетки отделяется от остающейся базальной части трубки опять же каллозной пробкой. Каллоза может быстро синтезироваться в больших количествах на плазматической мембране и так же быстро разлагаться. Часто она играет роль защитного соединения на клеточном уровне.
2.2.8. Митохондрии
На рис. 2.78 дана обобщенная схема структуры митохондрий.
Рис. 2.78. Схема строения митохондрии (по Н.Ziegler).
Внутренняя и наружная мембраны различаются не только по внешнему виду и составу ферментов, но и по липидному составу (кардиолипин/холестерин, ср. рис. 2.100). Внутренняя мембрана образует путем выпячивания кристы, на стороне которых, обращенной к матриксу митохондрии, локализованы АТФ-синтазные комплексы
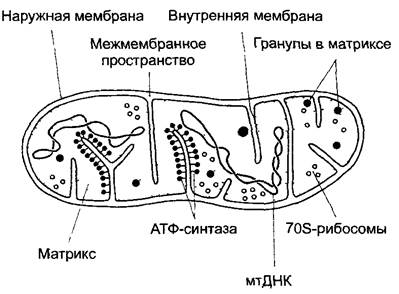
• Двойная оболочка из разных мембран, между которыми находится неплазматический компартмент — межмембранное пространство. Внутренняя мембрана митохондрий образует характерные впячивания (кристы), которые обычно сужаются у основания, а внутри митохондрии расширяются и слабо вздуваются (рис. 2.79). В некоторых случаях кристы образуют пространственную сетчатую структуру.
Рис. 2.79. Электронно-микроскопическое изображение митохондрий (электронная микрофотосъемка Н Falk)
А—в листе шпината видны многочисленные срезы крист, неплазматическая внутренняя часть которых соединена с межмембранным пространством двойной мембранной оболочки, эти связи здесь не видны, так как находятся вне плоскости среза На В, наоборот, они четко различимы. Митохондриальные рибосомы, как и рибосомы в хлоропластах Р, явно мельче, чем рибосомы цитоплазмы
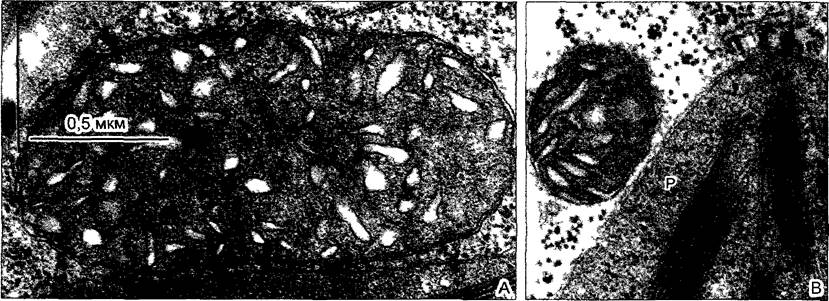
• Грибовидные тела, видимые при электронной микроскопии, на внутренней стороне внутренней мембраны митохондрии соответствуют компонентам митохондриального АТФ-синтазного комплекса (рис. 2.80). Они состоят из палочковидной базальной части — F0-комплекса, который проходит через внутреннюю митохондриальную мембрану как протонный канал, и F1-комплекса в виде головки, который представляет собой собственно АТФ-синтазный комплекс. Во время синтеза АТФ весь комплекс вращается вокруг своей продольной оси, перпендикулярной плоскости мембраны.
Рис. 2.80. АТФ-синтазные комплексы мембран крист (электронная микрофотосъемка Н Falk)
Эти комплексы четко видны на негативно контрастированием препарате митохондрии, выделенной из ткани картофеля как светлые «грибовидные тела», или F1-частицы. Они связаны тонкими перемычками (F0, здесь неразличимы) с мембранами. По молекулярному строению комплексы сходны с АТФ-синтазой хлоропластов (ср рис 6 63)
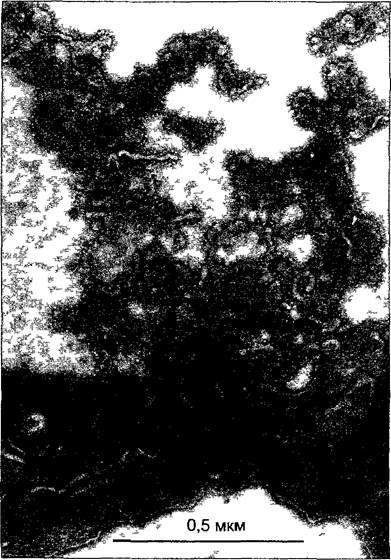
• Матрикс с 70S-рибосомами и (почти всегда) кольцевой митохондриальной ДНК (мтДНК). В большинстве случаев в органелле имеется несколько (часто много) колец ДНК. Они концентрируются в рыхлых частях митохондриального матрикса и аналогичны нуклеоиду бактерий Гистоны и нуклеосомы отсутствуют.
✵ Иногда встречаются плотные матриксные гранулы, в которых, в частности, накапливаются ионы кальция и магния
2.2.8.1. Структурные изменения и размножение
На тонких срезах (см. рис. 2.79) и после выделения митохондрии обычно выглядят как округлые или эллиптические тельца диаметром примерно 1 мкм. В постэмбриональных, живых клетках, напротив, чаще всего наблюдаются нитевидно удлиненные и даже разветвленные митохондрии (рис. 2.81), облик которых часто претерпевает быстрые изменения. У дрожжей и некоторых водорослей на определенных стадиях развития или при особых внешних условиях многочисленные митохондрии одной клетки сливаются в одну единственную сетевидную гигантскую митохондрию, которая после снова распадается на мелкие отдельные митохондрии. Также и у высших растений нередко бывает слияние и распадение митохондрий.
Рис. 2.81. Митохондрии (снимок в интерференционном контрасте W Url)
В живой клетке митохондрии способны к быстрому изменению формы. Чаще всего они встречаются как структуры в форме нитей или трубок, как здесь в верхнем (внутреннем) эпидермисе запасающих чешуй луковицы Allium сера. Наряду с многочисленными митохондриями в виде «спагетти» видны также короткие митохондрии, как и округлые олеосомы и несколько лейкопластов с включениями типа крахмала (например, рядом со звездочкой*); слева наверху нечетко видно ядро (670х)
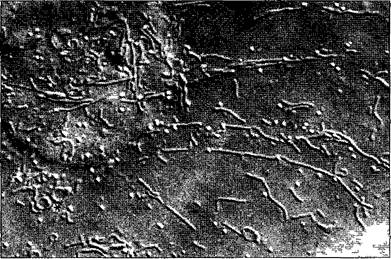
Митохондрии могут возникать только из себе подобных. Их размножение происходит прежде всего в клетках образующей ткани (меристемы). Оно основано на перешнуровке тела органеллы после образования септы в межмембранном пространстве (рис. 2.82). При этом за счет множества молекул мтДНК в митохондрии ни одна дочерняя митохондрия не останется без генетической информации. При быстром размножении клеток синтез ферментов в митохондрии сначала часто бывает неполным, так что возникающие промитохондрии не обладают дыхательной активностью. Также и при дальнейшем развитии синтез ферментов может значительно варьировать.
Рис. 2.82. Деление митохондрии (нуклеотиды показаны точками)
У дрожжей есть также свободные от ДНК митохондрии, однако клетки в целом все-таки остаются способными к размножению. Дрожжи — факультативные анаэробы, они могут жить без кислорода и обходиться без дыхания и митохондрий — редкое исключение среди эукариот. Поэтому мутационные изменения мтДНК, имеющие следствием дефекты в отношении дыхания митохондрии, с самого начала не являются смертельными (летальными). Так называемые мутанты «peilte colonie» пивных дрожжей Saccharomyces cerevisiaeспонтанно встречаются с частотой 1 — 2 %; с помощью таких мутагенов, как акрифлавин или этидий- бромид, частота появления мутаций может быть повышена до почти 100%. «Petites» дефективны в отношении дыхания, они растут в аэробных условиях значительно медленнее, чем дикий тип дрожжей; их колонии на твердом глюкозном агаре остаются, таким образом, меньше, откуда и название1. У мутантов petites мтДНК либо изменена (р — мутанты), либо полностью отсутствует (р0), определенные белки и компоненты мультиферментных дыхательных комплексов больше не могут образовываться.
1 Petites — маленькие (франц.) — Примеч. пер.
У грибов и растении мтДНК, несмотря на примерно одинаковый генный состав, обладает очень разными молекулярными массами и длинами1 (от 20 до более 800 мкм) Эти различия обусловлены разницей в наличии некодирующих последовательностей (см 7 2 13) У многих растений митохондрии вследствие внутримолекулярных процессов рекомбинации содержат мтДНК разного размера, причем наряду с комплектными копиями встречаются и некомплектные (см рис 7 7)
1 В больших митохондриальных геномах обнаружены рамки считывания для белков с неизвестными свойствами, так что нельзя считать генный состав «примерно одинаковым» — Примеч. ред.
2.2.8.2. Мембраны и компартментация митохондрий
Митохондрии — это прежде всего органеллы клеточного дыхания, их важнейшая функция — предоставление химической энергии в форме АТФ (см 6 10 3).
АТФ синтезируется из АДФ и фосфата в ходе реакции окислительного фосфорилирования с использованием энергии АТФ-синтазные комплексы (место синтеза АТФ) находятся на внутренней мембране митохондрий Необходимая энергия возникает при происходящем здесь транспорте электронов от богатых энергией дыхательных субстратов к кислороду (дыхательная цепь, см 6 10 3 3). В результате транспорта электронов возникает протонный градиент на внутренней мембране митохондрии, в межмембранном пространстве падает значение pH. Одновременно на мембране образуется мембранный потенциал внутренняя сторона приобретает отрицательный, а внешняя — положительный заряд Протонный градиент и мембранный потенциал разряжаются при вращении АТФ-синтазного комплекса с образованием АТФ. Можно сказать, что богатые энергией промежуточные стадии при обмене веществ могут встречаться не только как богатые энергией молекулы, но и также в форме ионных градиентов. Это центральное положение хемиосмотической теории П. Митчелла относится и к фотофосфорилированию в хлоропластах (см 6 4 9, 6 10 3 3). Теория Митчетла объясняет значение компартментации для клеточной энергетики.
Электроны для транспортной дыхательной цепи берутся от окисления органических кислот в нитратном цикле или цикле Кребса (см 6 10 3 2, рис 6 94). Почти все ферменты для этого цикла локализованы в матриксе митохондрии.
Помимо клеточного дыхания, митохондрии в растительных клетках участвуют и в ряде других обменных процессов — в фотодыхании (см 6 5 6) и запрограммированной смерти клеток (апоптозе) (см 7 3 2).
Интегральные белки наружной и внутренней мембран митохондрий сильно различаются. Различается также их липидный состав Внешняя мембрана содержит широко распространенный в эукариотных мембранах холестерин, внутренняя мембрана от него свободна, но в ней высокое содержание кардиолипина — фосфолипида, который помимо этого содержится в мембранах бактерий (см рис 2 100). Объяснение этого своеобразного явления дает теория эндосимбиоза (см 2 4).
Проницаемость наружной мембраны митохондрий высокая Она содержит трубковидные комплексы интегральных мембранных белков (поринов), которые пропускают гидрофильные частицы до 1 кДа (для сравнения АТФ имеет молекулярную массу 0,5 кДа). Внутренняя мембрана оболочки, напротив, непроницаема даже для протонов — иначе было бы невозможным накопление заряда для обеспечения энергией АТФ-синтаз. Чтобы привести в соответствие эту малую проницаемость с потребностями обмена веществ, внутренняя мембрана митохондрий снабжена многочисленными специфическими транслокаторами. Они обеспечивают, например, обмен АТФ и АДФ (аденилатный транслокатор), фосфата, а также органических кислот.
Иначе организован белковый импорт — мембранный транспорт из цитоплазмы в митохондрии. Белки и даже некоторые РНК не могут сами синтезироваться в митохондрии. Кодируемые ядром митохондриальные белки синтезируются в цитоптазме как неактивные предшественники, которые на своем N-конце несут транзитный пептид. Он служит «почтовым индексом», обеспечивая посттрансляционное прикрепление предшественника к интегральным транслокаторным комплексам оболочки митохондрии (одному во внешней и двум разным во внутренней мембране) и последующее прохождение полипептидов. Сама транслокация локализована там, где временно соприкасаются внутренняя и наружная мембраны митохондрии. Когда белок достигает места выполнения своей функции, транзитный пептид отщепляется и вслед за этим устанавливаются окончательные конформация и активность белка (см 7 3 14)
2.2.9. Пластиды
В одном и том же растении пластиды встречаются в разных формах. Под микроскопом это проявляется уже внешне в разной пигментации. Так, пропластиды образовательной ткани и лейкопласты основной и запасающей тканей бесцветны, фотосинтетически активные, содержащие хлорофилл хлоропласта зеленые, геронтопласты1 осенней листвы и хромопласты в цветках и плодах окрашены каротиноидами в цвета от желтого до красного Все формы пластид могут переходить друг в друга, только геронтопласты представляют собой конечный этап необратимого развития Как и митохондрии, пластиды отграничены от цитоплазмы оболочкой из двух мембран (plastid envelope), причем наружная мембрана пластид так же значительно более проницаема, чем внутренняя, которая соответственно снабжена многими специфическими транслокаторами Внутренняя мембрана пластид, кроме того, является преимущественным местом синтеза липидов в растительных клетках.
1 Этот термин в отечественной литературе не используется — Примеч. ред.
Пластиды размножаются исключительно путем деления. Как и у бактерий, при этом происходит перешнуровка органеллы с помощью центральной сократительной кольцевой зоны Она содержит белок FtsZ, который и у бактерий выполняет сходную функцию, а по структуре и последовательности является гомологом тубулина (см 2 3 1)
Путем специфического флуоресцентного мечения пластид с помощью GFP (см 2 11) удалось показать, что пластиды в живых клетках образуют тонкие придатки («стромулы», «stromuies») и через них могут вступать в непосредственный контакт друг с другом, так что образуется пластидный континуум.
Пластиды обладают генетической непрерывностью за счет собственной генетической информации в форме пластидной ДНК (птДНК = хлДНК, ptDNA = ctDNA, см рис. 2 86, 7 5, см 7 2 12). Однако, как и у митохондрий, собственная ДНК пластид не может полностью кодировать все специфичные для пластиды белки. Гены для более 90% этих белков локализованы в ядре, а пблипептиды- предшественники, синтезируемые на свободных полисомах, должны транслоцироваться через оболочку пластиды к местам назначения. Это происходит так же, как и у митохондрий, с помощью N-концевых транзитных (лидерных) пептидов при помощи соответствующих транслокаторных комплексов на внутренней и наружной пластидной мембране (см рис 7 18). Несмотря на одинаковую функцию, белки этих комплексов лишь в незначительной степени сходны с соответствующими белками митохондрий. В хлоропластах требуются дополнительные структуры для целенаправленного перемещения и встраивания белков в тилакоиды. Как было выявлено, в них действуют четыре разные системы, тогда как в оболочке пластиды — лишь одна транслокационная система.
Наличие у пластид собственной наследственной информации было открыто еще в первом десятилетии прошлого столетия Э. Бауром и К. Корренсом на основании исключительно материнского наследования дефектов зеленой окраски у львиного зева и мирабилис (Mirabilis) (см 10 1 2 5). У этих растений при сингамии через мужские зародышевые клетки пластиды в зиготу не поступают (У других растений, например, у пеларгоний и энотеры, на против, пластиды наследуются бипарентально от обоих родителей). В 1929 г после подробных исследований на гибридах энотеры О. Реннер предложил для совокупности пластидных наследственных факторов термин пластом. Однако только в 60-х гг XX в ученые смогли выделить птДНК и наконец охарактеризовать ее более детально как кольцевую двойную спираль. В 1986 г. двум исследовательским группам из Японии удалось полностью секвенировать птДНК табака (см. рис. 7.5) и печеночника Маrschantia, в дальнейшем были секвенированы птДНК многих других растений (см. 7.2.1.2).
2.2.9.1. Форма и ультраструктура хлоропластов
Хлоропласты — характерные органеллы всех фотоавтотрофных эукариот. В результате световых реакций фотосинтеза (см. 6.4) они преобразуют лучистую энергию Солнца в химическую энергию и закладывают таким образом энергетическую основу для существования всех органотрофных (гетеротрофных) жизненных форм. Одновременно ассимилируются углерод, водород и фосфор, восстанавливаются нитрат и сульфат, а также из воды высвобождается кислород. Кислород в атмосфере Земли — необходимый фактор для аэробного получения энергии из органических источников питания и создания озонового слоя в верхней части атмосферы Земли — образуется почти исключительно в результате фотосинтеза.
Находящиеся внутри типичных хлоропластов мембраны (рис. 2.83) — мембраны тилакоидов — содержат различные каротиноиды и связанные с белками хлорофиллы. В противоположность кристам митохондрий, тилакоиды не находятся в непосредственной связи с внутренней мембраной оболочки хлоропласта. В тилакоидах протекают световые реакции фотосинтеза. Тилакоиды часто соприкасаются друг с другом, образуя стопки (граны), в промежуточных областях — строме — тилакоиды, наоборот, одиночные (рис. 2.84). Молекулярное строение тилакоидной мембраны отражает ее функции. Большое содержание белков (рис. 2.85; см. рис. 6.57) и асимметричная организация: расположение или же ориентация белковых комплексов — морфологическое выражение хода световых реакций. АТФ образуется в пластидных АТФ-синтазных комплексах, которые по своему строению в значительной мере соответствуют АТФ-синтазам митохондрий и локализованы на обращенных к строме мембранах тилакоидов.
Строма представляет собой плазматическую фазу органеллы. В ней можно выявить «пластоскелет» из FtsХ, который стабилизирует форму хлоропласта (см. рис. 2.83, С). Строма содержит наряду с ферментами для темновых реакций фотосинтеза (см. 6.5) также зерна крахмала и другие запасные структуры, такие, как плас- тоглобулы — в качестве запаса липидов, — белковые кристаллы при определенных обстоятельствах (например, кристаллы белка фитоферритина, накапливающего железо). В строме находятся также нуклеоиды, в числе от нескольких до многих, рыхлые области со скоплениями молекул птДНК — носителей пластома (рис. 2.86; см. 7.2.1.2), а также 70Б-рибосомы.
Рис. 2.83. Хлоропласты в поле светового и электронного микроскопа (С—электронная микрофотосъемка J Kiessling, R Reski, D—электронная микрофотосъемка Н Falk)
А, В—гранулярные хлоропласты в живых клетках листочка мха FontinaUs antipyretica (1230х) А—деление хлоропласта путем перешнуровывания посередине (стрелки), В —флуоресценция хлорофилла в гранах, С—пластоскелет в хлоропластах листостебельного мха Physcomitrella patens (регенерирующий протопласт, живой, FtsZ1, флуоресцирующий за счет GFP см 2 1 1) (2050х), D—гранальная структура хлоропласта при электронной микроскопии Многочисленные тилакоиды различимы как плоские двойные мембраны в гранах (некоторые из них обозначены как G) они сложены друг с другом в плотные стопки, между гранами одиночные стромальные тилакоиды Черные стрелки — пластоглобулы рыхлые области стромы (*) содержат птДНК («нуклеоиды»), белые стрелки — двойная внешняя оболочка пластиды V— вакуоль
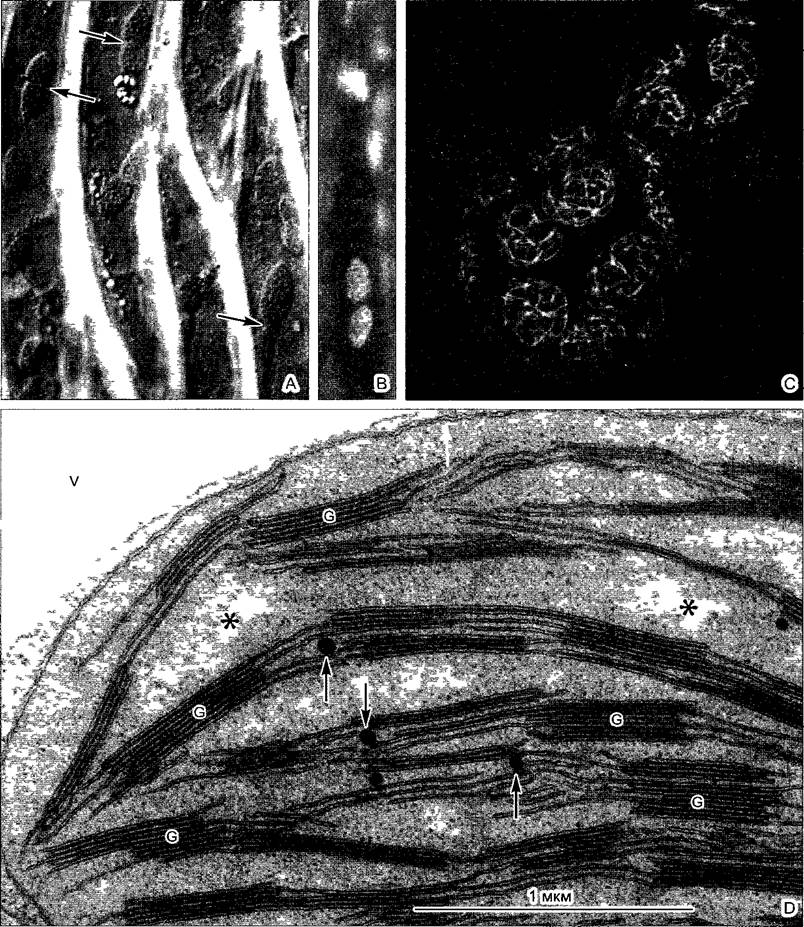
Рис. 2.84. Сгруппированные в граны и одиночные тилакоиды не являются отдельными компартментами, а представляют собой пространственный континуум с многочисленными мембранными наложениями (по w. wehrmeyer)
Рис. 2.85. Мембраны тилакоидов несут белковые комплексы, которые участвуют в световых реакциях фотосинтеза (ср рис 6 57) (препарат и электронная микрофотосъемка L А Staehein)
На препарате, подвергнутом замораживанию- скалыванию (хлоропласт гороха), эти комплексы четко выступают как мембранные частицы (обозначения плоскостей мембран ср с рис А, бокс 2 3) G, S—области гран и стромы соответственно, функциональные различия этих областей тилакоидов отражены также в распределении белковых частиц

Рис. 2.86. Нуклеоиды пластид (А — флуоресцентная фотография Н Dorle В — электронная микрофотосъемка Н Falk С —препарат и электронное изображение Р Hansmann)
А—хлоропласты в клетках листьев Elodea canadensis после флуоресцентного окрашивания птДНК DAPI (ДАФИ = 4'-5-диамидино-2- фенилиндолом), каждый хлоропласт содержит несколько нуклеоидов каждый нуклеоид — несколько кольцевых молекул птДНК (1000х), В—5 нуклеоидов видны как рыхлые области в строме хлоропласта фасоли, С—нуклеоиды, выделенные из хлоропластов шпината птДНК образует петли вокруг рыхлых белковых скелетных элементов
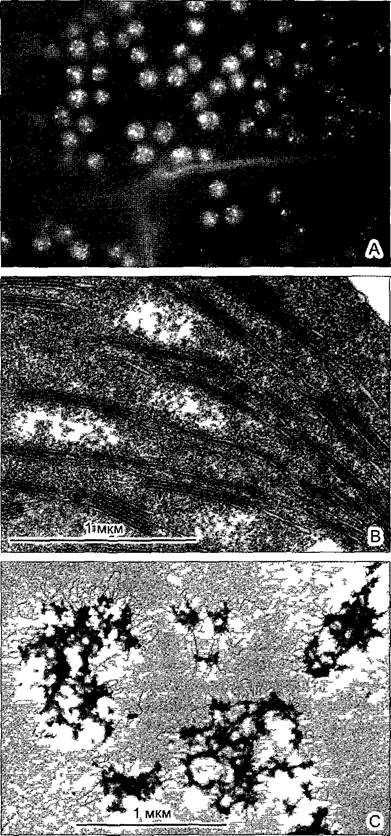
Структурная организация хлоропластов часто более или менее варьирует, особенно у водорослей. Это относится, прежде всего, к внешней форме органеллы. В листьях высших растений хлоропласты линзовидные; их диаметр 4—10 мкм; в клетке они находятся в виде типичных зерен от нескольких до очень многих. У некоторых зеленых водорослей встречаются особенно крупные мегапласты, порой своеобразной формы и часто в единственном числе в клетке (рис. 2.87). Хлоропласты многих водорослей и антоцеротовых мхов содержат резко отграниченные уплотнения стромы, которые часто окружены зернами крахмала; в них заходят лишь отдельные тилакоиды или тилакоиды не заходят вообще. Эти области стромы — пиреноиды (греч. ругеа — ядро, косточка) — отличаются особенно высокой концентрацией ключевого фермента фиксации СO2 — рибулезобисфосфаткарбоксилазы-оксигеназы (РБФК, RubisСО — предположительно наиболее частого ферментного белка вообще). РБФК представляет собой комплекс из 8 больших и 8 малых субъединиц; его доля в строме, в общем, очень высока: в зеленых тканях листьев часто свыше 60 % всех растворимых белков (о функции см. в разделе 6.5.1).
Рис. 2.87. Мегапласты в клетках зигнемовой водоросли Spirogyra (вверху, 380х) и десми- диевой водоросли Micrasterias denticulata (внизу, 260х) (съемка в световом микроскопе UМеndI). Стрелки — пиреноиды

Не все хлоропласты имеют гранальную организацию тилакоидов. У лишенных гран «гомогенных» хлоропластов тилакоиды либо совсем не образуют группировок (это относится к пластидам всех красных водорослей), либо, наоборот, через всю пластиду проходят пластины (ламеллы) из примыкающих друг к другу двух или трех тилакоидов (рис. 2.88).
Рис. 2.88. Гомогенный хлоропласт водоросли Tribonema viride (ср рис 11 72, Е) (электронная микрофотосъемка Н Falk).
Тилакоиды, сгруппированные по три, проходят через всю пластиду, стромальных тилакоидов не образуется. Области, содержащие птДНК, находятся по периферии всей органеллы (стрелки)

Пластиды красных водорослей, кроме расположенных поодиночке тилакоидов, отличаются еще особой формой комплексов белковых пигментов, которые служат как антенны для улавливания световых лучей при фотосинтезе. Если белковые комплексы зеленых растений становятся видны только при рассмотрении тилакоидов с поверхности (см. рис. 2.85), то светособирающие комплексы красных водорослей, построенные из фикобилипротеинов — фикобнлисомы, выступают над поверхностью тилакоидов (рис. 2.89; см. также 6 53, В). Соответствующие светособирающие комплексы есть также на фотосинтетических мембранах цианобактерий, относящихся к прокариотам.
Рис. 2.89. Фикобилисомы цианобактерии Rhomidíum persictnum (А) и красной водоросли Rhodelta vtoiacea (В), справа — в плоскости, слева — в профиль (электронная микрофотосъемка W Wehrmeyer): С—молекулярная модель состоящих из дисков полукруглых фикобилисом красных водорослей с центральной частью из аллофикоциа- нина АР и отходящих от нее лучей фикоцианина PC и фикоэритроцианина РЕС. О роли фикобилисом при фотосинтезе ср. рис 6.53; CS—карбоксисома (ср. рис. 2.94, А); N—содержащая ДНК строма пластиды; W—клеточная стенка
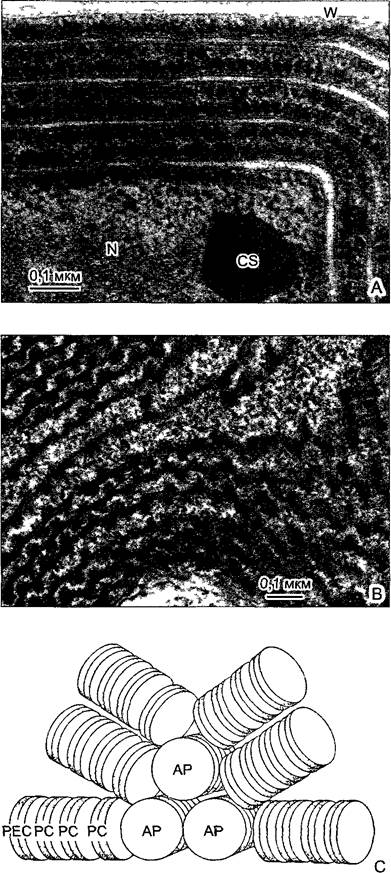
Хлоропласты не только красных водорослей (из-за наличия фикобилинов они окрашены в цвета от красного до лилового: «родопласты»), но и представителей многих других групп водорослей содержат так много дополнительных, т.е. содержащихся наряду с хлорофиллом, пигментов, что выглядят не зелеными (например, «феопласты» бурых водорослей или желтые пластиды динофлагеллят и многих золотистых водорослей). Как обобщающее понятие для всех пигментированных пластид иногда употребляется термин «хроматофор»(носитель пигмента).
Окрашенный особыми каротиноидами темно-красный глазок — стигма — многих жгутиковых соответствует плотному скоплению пигментированных пластоглобул (см. рис. 1; 11.74, А; 11.94, А). Это скопление липидных капель либо локализовано в хлоропластах, либо расположено вне пластид — по-видимому, в цитоплазме. Возможно, однако, что во втором случае мы также имеем дело с пластидами, которые в ходе эволюции сильно модифицировались.
2.2.9.2. Другие формы пластид. Крахмал
У высших растений структурная и функциональная вариабельность пластид значительно выше, чем митохондрий. При этом встречающаяся в какой-либо определенной клетке форма пластид прежде всего отражает функцию этой клетки, т. е. в конечном счете является следствием дифференцировки ткани. Например, сравнительно мелкие, часто делящиеся пропластиды отражают высокую частоту деления меристематических клеток.
Лейкопласты типичны для прекративших деление клеток, в которых уже не происходит фотосинтез и отсутствуют оптические сигналы для животных. Однако они могут брать на себя запасающую функцию: «элайопласты» содержат масло в многочисленных пластоглобулах; «протеинопласты» — крупные белковые кристаллы; обильное накопление крахмала — функция непигментированных амилопластов в соответствующих запасающих тканях зерновок злаков, клубней картофеля и т.п.
Крахмал — запасной полисахарид зеленых растений и многих водорослей. Это важнейший продукт питания для человечества: пшеница, рис, кукуруза на 60% удовлетворяют мировые потребности в пище. У гетеротрофных организмов (грибов, бактерий, животных) крахмалу соответствует гликоген, который в рыхлой форме откладывается в цитоплазме. Химически крахмал, как и гликоген, представляет собой гомополимер из единиц «-глюкозы (см. рис. 1.20; 6.130; 6.131). Если спиральные гликановые цепочки неразветвленные, то мы имеем дело с амилозой; амилопектин, наоборот, имеет разветвленные цепочки. (Молекула гликогена разветвлена еще сильнее.) Амилоза и амилопектин откладываются в форме очень плотных, двояко преломляющих свет крахмальных зерен внутри пластид или (у некоторых водорослей) в непосредственной близости от них в цитоплазме Форма и размер крахмальных зерен в запасающей ткани, в целом, видоспецифичны (рис 2 90)
Рис. 2.90. Крахмальные зерна (С—препарат Н. С. Bartscherer, электронная микрофотосъемка Fa Kontron JEOL-EM JSM-840, D — F — no D von Denffer)
А В—картофельный крахмал (330х), на А четко видна слоистость, которая обусловлена ритмическими изменениями условий синтеза крахмальные зерна растут, в общем, от одного центра образования (у картофельного крахмала он расположен эксцентрично) путем послойного отложения нового материала, В—в поляризационном микроскопе крахмальные зерна выявляются как двояко преломляющие структуры причем из-за концентрического строения появляются характерные сферитные кресты С —ячменный крахмал после обработки амилазой этот фермент разлагает крахмал, в получающихся из за распада кратерах видно слоистое строение DE—собранные вместе крахмальные зерна овса, F—гантелевидное крахмальное зерно в амилопласте из млечника молочая блестящего Euphorbia splendens
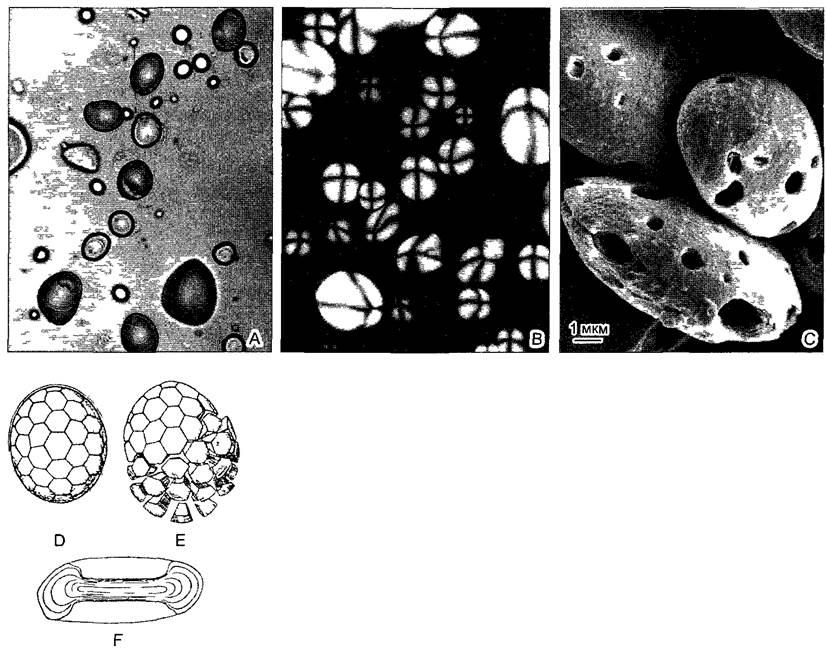
Молекулярная структура крахмального зерна, несмотря на многочисленные исследования, еще далеко не выяснена Поразительное двойное преломление света основывается, очевидно, на кристаллических слоях, образующихся по мере роста, в которых боковые цепи рас положенных пучком молекул амилопектинов ориентированы радиально Радиальная ориентация глюкановых цепей, с одной стороны, является результатом синтеза глюкана, который происходит исключительно на ответствен ной за это поверхности растущего крахмаль ного зерна, с другой стороны обеспечивает при необходимости быстрый распад и мобилизацию крахмала
У многих (не у всех’) цветковых растений последние этапы образования тилакоидов зависят от света. Пластиды этих растений при недостатке света превращаются в этиопласты —специфические формы биогенеза хлоропластов. В этиопластах компоненты мембран тилакоидов или их предшественников накапливаются в форме проламеллярных тел (рис 2.91). Этиопласты окрашены каротиноидами в бледно-желтый цвет. Именно в этот цвет окрашены прорастающие побеги картофеля, хранящегося в темноте, травяной покров под лежащей на нем доской (этиоляция. франц étioler — бледнеть, чахнуть). Если же зеленые части растений попадают в темноту надолго, то после распада сначала стромальных, а потом также финальных тилакоидов возникают проламел- лярные тела, хлоропласты становятся этио- пластами.
Рис. 2.91. Этиопласт(ы) в молодой клетке листа фасоли Phaseolus vulgaris (электронная микрофотосъемка М Wrischer).
Из паракристаллического проламеллярного тела выходят отдельные тилакоиды. Пластидные рибосомы заметно меньше, чем цитоплазматические рибосомы; в строме несколько нуклеоидов
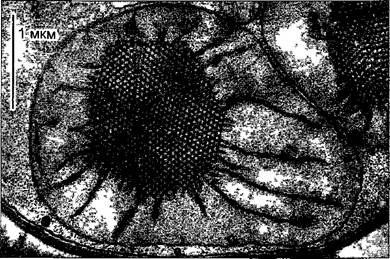
Подразделение пластид на лейко-, хлоро- и хромопласты, предложенное свыше 100 лет назад одним из первых авторов этой книги А.Ф В Шимпером, основывалось исключительно на пигментации как простом признаке, применимом даже на микроскопическом уровне. Под понятием «хромопласты» тогда объединяли все пластиды, которые, хотя не содержат хлорофилл и поэтому не осуществляют и фотосинтез, но накапливают каротиноиды, что придает им желтый, оранжевый или красный цвет. (Каротиноиды — это неполярные тетратерпены с линейными молекулами и протяженной п-электронной системой, на которой основывается способность к поглощению синего или зеленого света, см. рис. 6.50.) Увеличение доли каротиноидов подтверждается на пластидах осенней листвы — стареющих хлоропластах, однако особенно заметно на пластидах многих лепестков и плодов, которые посылают оптические сигналы для привлечения животных (перенос пыльцы — зоофилия; перенос семян — зоохория). Позже оказалось, что пластиды осенней листвы — их теперь называют геронтопластами (от греч geron — старик) — имеют мало общего с собственно хромопластами (табл. 2.4): их сходство так же мало, как сходство клеток стареющих листьев, в которых происходит интенсивный распад веществ, с клетками свежих лепестков или плодов.
Таблица 2.4 Хромопласты и геронтопласты
Свойство |
Хромопласты |
Геронтопласты |
Наличие |
Цветки, плоды |
Осенняя листва |
Функция |
Привлечение животных |
- |
Возникновение |
Из пластид различного типа, путем преобразования или синтеза |
Путем распада |
Размножение (деление) |
+ |
- |
Тип ультраструктуры |
Округлый, трубчатый, мембранозный, кристаллический |
Исключительно округлый |
Синтез каротиноидов de novo |
+ |
- |
Статус клетки |
Не стареющая, анаболичная |
Стареющая, катаболичная |
У хромопластов можно различать различные типы строения на ультраструктурном уровне в зависимости от внутренних структур, в которых накапливаются (рис. 2.92) липофильные каротиноиды (каротины и ксантофиллы; см. рис. 6.50).
✵ Чаще всего встречаются шаровидные хромопласты с многочисленными пластоглобулами, в которых концентрируются молекулы пигментов.
✵ Трубчатые хромопластысодержат паракристаллические пучки нитей диаметром 20 нм, которые на поперечных срезах при электронной микроскопии выглядят как трубки (tubuli). Однако на самом деле речь идет о нитевидных жидких кристаллах неполярных пигментов, которые одеты чехлом из амфиполярных структурных липидов и структурного белка с молекулярной массой 32 кДа — фибрилл и на. Трубчатые хромопласты обладают сильным двойным преломлением света и могут принимать причудливые очертания.
Рис. 2.92. Хромопласты (А—по H.Mohr, P. Schopfer; Е—препарат D. Kühnen): А—типы ультраструктуры; развитие часто идет из молодых хлоропластов; В, С— трубчатые хромопласты в продольном и поперечном сечении (соответственно плод шиповника и лепесток impatiens noli-tangere), D—мембранозный хромопласт Narcissus pseudcnarcissus, срез; Е—выделенные кристаллические хромопласты из корня моркови в поляризованном свете (750х); пластинчатые кристаллы β-каротина обладают дихроизмом, т.е. поглощение света зависит от направления световых колебаний (тензора)
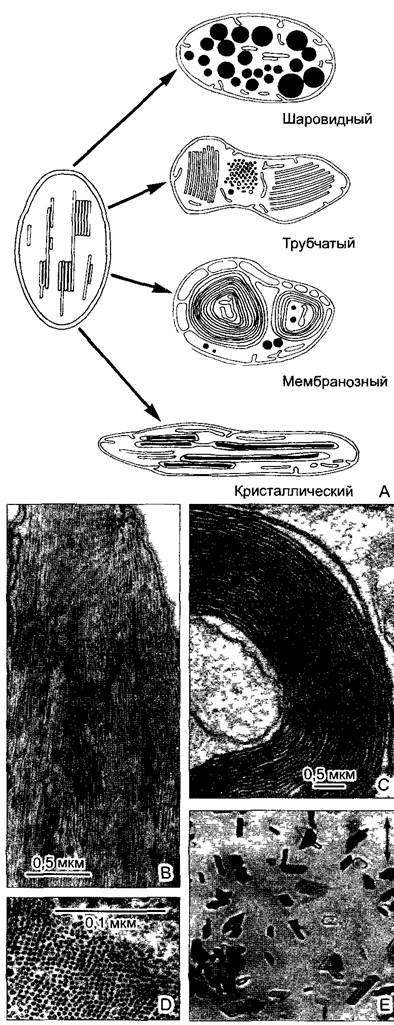
✵ Это относится также к кристаллическим хромопластам, в которых, а именно внутри плоских мембранных мешков, выкристаллизовывается β-каротин.
✵ Наименее распространены мембранозные хромопласты. У них молекулы пигментов встроены в мембраны, которые образуются из внутренней мембраны оболочки и в конце концов существуют в виде концентрической системы из многих вложенных друг в друга мембранных цистерн. Эти мембраны содержат лишь очень мало белка, они являются примером биомембран с доминированием липидов.
Внутренние структуры хромопластов образуются путем молекулярных процессов самоорганизации в зависимости от имеющихся в распоряжении типов молекул.
Хромопласты, которые особенно часто возникают из хлоропластов, в том числе молодых (незрелые томаты, плоды стручкового перца, шиповника и т.д. зеленые), могут, как и хлоропласты, размножаться путем деления в форме перешнуровки. При этом уменьшается число нуклеоидов на органеллу, часто до одного- единственного. Одновременно пластидные рибосомы разрушаются и птДНК инактивируется путем компактизации. Специфичные для хромопластов белки, такие, как фибриллин трубчатых хромопластов, всегда кодируются ядром.