БОТАНИКА ТОМ 1 - КЛЕТОЧНАЯ БИОЛОГИЯ. АНАТОМИЯ. МОРФОЛОГИЯ - 2007
1. МОЛЕКУЛЯРНЫЕ ОСНОВЫ— СТРОИТЕЛЬНЫЕ «КИРПИЧИКИ» КЛЕТОК
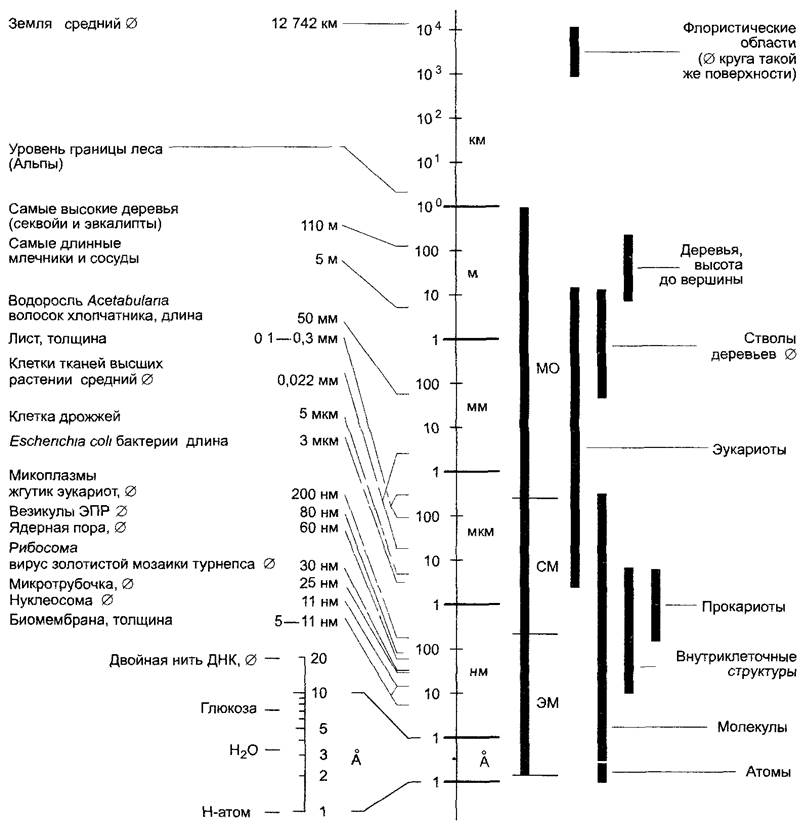
Ботаника рассматривает живые системы различного размера — от простирающихся на тысячи километров флористических областей и экосистем до невидимого мира молекул, шкала измерений которого составляет миллионные доли миллиметра (нанометры), т е эти различия составляют более 15 порядков (рис 1.1). В учебнике мы рассмотрим материал по возрастающей шкале — от молекул к экосистемам.
Рис. 1.1. Шкала относительных размеров (по Р Sitte)
От диаметра атома водорода (Н) до диаметра Земли шкала размерных величин охватывает область в 17 порядков от 10-10м (1 А) до 107(10000 км) Невооруженным глазом видны объекты макроскопических размеров (МО), к ней примыкает область размеров объектов для световой микроскопии (СМ) и, наконец, область, доступная только электронному микроскопу (ЭМ) Размерная шкала логарифмическая, она не имеет нулевой точки, каждое деление шкалы представляет десятикратное увеличение предыдущего значения и десятую часть от последующего Таким образом, в едином масштабе можно показать большие численные различия, и такая шкала может представлять размеры от атомарных до космических Единицей длины СИ является метр (м), употребляемые приставки уменьшают каждую единицу на три размерных порядка милли- (тысячная доля, 10-3, сокращенно — м), микро- (миллионная доля, 10-6 — мк), нано- (миллиардная доля, 10-9 — н) или увеличивают единицу измерения — кило- (тысяча, 103 — к), 1 нм = 10 Змкм = 10 6мм = 10-9м = 10 12км. Единица ангстрем (1 А = 0,1 нм) не относится к системе единиц СИ, но часто употребляется, так как очень удобна при описании размеров атомов и молекул диаметр атома водорода равен 1 А, диаметр двойной нити ДНК равен 20 А, расстояние между ядрами атомов в ковалентной химической связи около 1 А
Каждая живая клетка содержит множество разных молекул Бактериальная клетка, масса которой составляет всего тысячную часть растительной клетки, состоит примерно из 6 000 типов молекул, а в растительной клетке их примерно в десять раз больше.
Как правило, около 70 % массы цитоплазмы составляет вода. Вакуолизированные клетки растений и грибов содержат еще большую долю воды. В состав клеток входит также около 2 % неорганических ионов и 8 % низкомолекулярных веществ. Низкомолекулярными называют органические соединения с молекулярной массой ниже 1 000 Да (= 1 кДа, 1 103 Да), в исключительных случаях до 4 000 Да Дальтон (Да) — это единица атомной массы, 1 Да = 1,66 10-24 г, соответственно 1/12 массы атома 12С. Молекулярная массарассчитывается как сумма масс всех атомов, составляющих молекулу. Атомные и молекулярные массы — относительные величины, которые не следует путать с молярной массой(выражается в граммах на моль). Количество вещества 1 моль (единица измерения моль) соответствует числу частиц, содержащихся в 12 г изотопа углерода 12С (число Авогадро NА= 6,0220 1023 частиц). При таком определении моля значения относительных атомных и молекулярных масс и молярных масс в численном выражении идентичны. Вещество с молекулярной массой 18 Да (например, Н2O) обладает и молярной массой 18 г моль1. Большинство низкомолекулярных веществ являются метаболитами, молекулами, которые подвергаются постоянной перестройке в процессе клеточного обмена веществ (метаболизма) (см. гл. 6).
Оставшаяся пятая часть массы клетки приходится на макромолекулы. К ним относятся нуклеиновые кислоты, белки и полисахариды. Здесь речь идет о молекулах с массой более 4 000 Да (4 кДа). Макромолекулы часто служат структурным целям, например, структурные белки, структурные полисахариды, а также некоторые нуклеиновые кислоты. Многие белки — биокатализаторы; их называют также ферментами, или энзимами. Большинство нуклеиновых кислот нужны для хранения и переноса информации, а многочисленные полисахариды используются как запас энергии и углерода.
Биологически важные макромолекулы являются полимерами, т. е. они возникают путем образования ковалентных связей между мономерами, обычно с выделением воды. Этот процесс называется полимеризацией. Если макромолекула образована только одним типом мономеров-кирпичиков, как, например, целлюлоза, состоящая из β-D-глюкозы, говорят о гомополимерах; при двух и более разнородных мономерах, составляющих макромолекулу, говорят о гетерополимерах. Белки и нуклеиновые кислоты являются примером гетерополимеров. Образованные путем реакций конденсации полимеры могут легко вновь распадаться на мономеры путем химического или ферментативного гидролиза. Распад запасного крахмала во время прорастания зерновки злаков основан на гидролизе и катализируется амилазами (см. 6.17.1.2). Распад белков идет гидролитически с помощью протеаз. Особое место среди гетерополимеров занимает типичный для растений структурный полимер лигнин (составная часть древесины). Он образуется из нескольких типов мономеров путем свободнорадикальной полимеризации. Лигнин чрезвычайно стабилен благодаря разнообразию связей в его молекуле между мономерами, он не гидролизуется и даже с помощью ферментов разрушается крайне трудно (см. 6.17.2).
Метаболиты и разнообразные реакции обмена веществ обсуждаются в гл. 6 (физиология обмена веществ). Ниже приводится краткий обзор структуры биологически важных макромолекул, а также липидов. Липиды, хотя и не являются макромолекулами, встречаются в клетках как структурные элементы, прежде всего, как составные части биологических мембран. Но в первую очередь следует обсудить и понять особые свойства воды, универсального биологического растворителя.
1.1. Структура и свойства воды
В клетках вода служит растворителем. Вода — полярная среда, ее молекулы являются сильными электрическими диполями (рис. 1.2, А, В). Это обусловлено большой электроотрицательностью кислорода по сравнению с водородом (табл. 1.1), вследствие чего происходит сдвиг обобществленных атомами кислорода и водорода электронов в сторону кислорода, и ковалентная связь поляризуется. Кислород вносит в молекулу воды частичный отрицательный заряд (δ-), водород — частичный положительный заряд (δ+). В электрическом поле ионов диполи воды выстраиваются определенным образом, образуя гидратную оболочку (рис. 1.2, С). Такая экранизация электрических зарядов анионов и катионов препятствует их объединению ионной связью; они остаются в растворе. Гидратные оболочки образуются также у молекул, имеющих поляризованные связи (например, С—О- или С—N- связи). По этой причине вода — прекрасный растворитель для заряженных и полярных веществ.
Таблица 1.1. Электроотрицательность биологически важных элементов (электроотрицательность фтора принята за 100 %)
Элемент |
Относительная электроотрицательность, % |
Кислород (О) |
85 |
Азот (N) |
75 |
Углерод (С) |
65 |
Сера(S) |
65 |
Водород (Н) |
55 |
Фосфор (Р) |
55 |
Рис. 1.2. Структура и свойства воды (по A. L. Lehninger, D. L. Nelson, М. М. Сох)
А — шаростержневая модель молекулы воды; В — полусферическая модель молекулы воды (точки — свободные электроны атома кислорода); С — расположение молекул воды, окружающих анионы и катионы с образованием гидратных оболочек; D — сталкиваясь, молекулы воды образуют между собой легко перестраивающиеся водородные связи, Е — кристаллическая структура льда каждый атом кислорода окружен четырьмя атомами водорода, при таянии разрушается только 15% водородных связей; F — наиболее часто встречающиеся водородные связи между структурными элементами биомолекул
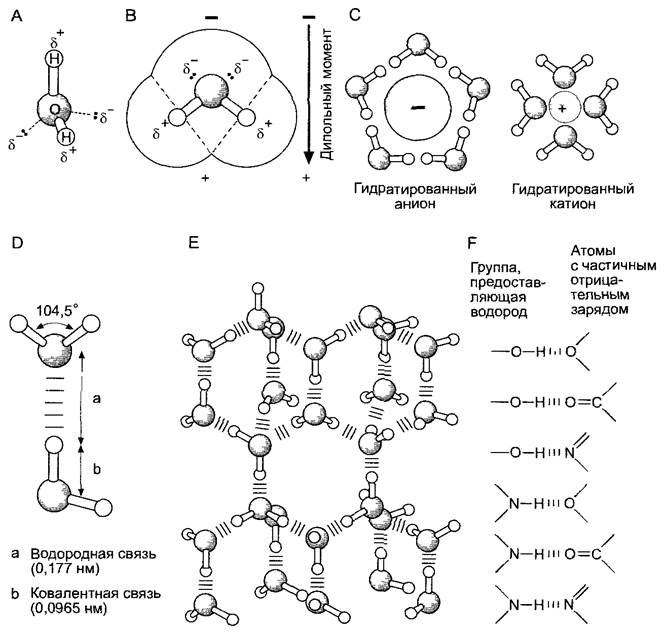
В жидкой фазе между молекулами воды образуются водородные связи (мостики): противоположные частичные заряды атомов Н и О создают электростатическое притяжение (рис. 1.2, D, Е). Образование таких водородных связей придает воде уникальные свойства, например, сравнительно высокие значения поверхностного натяжения, теплоты испарения и плотности. Силы когезии (сцепления) между молекулами воды имеют большое значение для транспорта воды в растении (см. 6.3.5). В кристаллах льда каждый атом кислорода окружен четырьмя атомами водорода (рис. 1.2, Е), в жидкой воде при комнатной температуре атом кислорода находится в контакте еще с тремя-четырьмя атомами водорода (в среднем 3,4).
Водородные связи не только образуются у воды, но и легко возникают между атомами водорода, которые связаны с каким-либо другим электроотрицательным атомом (как правило, с азотом или кислородом) другой или той же самой молекулы. Примеры часто встречающихся водородных связей можно видеть на рис. 1.2, F. Стабилизация структуры нуклеиновых кислот и белков также осуществляется благодаря водородным связям (см. рис. 1.6; 1.10; 1.14). Молекулы целлюлозы при образовании межмолекулярных водородных связей объединяются в пучки (микрофибриллы) и таким путем способствуют увеличению механической прочности стенок растительных клеток (см. 2.2.7; 6.17.1.1).
Вещества, имеющие достаточно много полярных групп, благодаря чему они способны в водной фазе включаться в сеть водородных мостиков и потому растворимы в воде, называют гидрофильными (от греч. philia— симпатия). Гидрофильность повышается, если в дополнение к полярным группам имеются и ионизирующиеся группы, такие как карбоксильная (—СООН —» — СОО- + Н+) или аминогруппа (—NH2 + Н+ —» —NH3+), стимулирующие образование моЩных гидратных оболочек.
Соединения, не растворимые в воде, называют гидрофобными (от греч. hydrophobia — боязнь воды). Для них характерна высокая доля неполярных связей или же наличие только таких связей. При неполярных ковалентных связях оба партнера имеют сходную электроотрицательность, так что на атомах, образующих связь, не возникает частичного электрического заряда. Такие группы не образуют водородных мостиков. Обычные примеры неполярных связей — углерод-водородные и углерод-углеродные. Именно поэтому чистые углеводороды, такие как бензол или каротиноиды, очень плохо растворяются в воде, но растворяются в неполярных органических растворителях вроде масел и потому называются липофильными (от греч. lipos — жир, масло. Примеч. ред.).
У сложных молекул растворимость зависит от количественного соотношения полярных и неполярных связей. Вот почему имеются все переходы между крайне гидрофобными соединениями (например, углеводородами) и крайне гидрофильными веществами (например, полианионами вроде полигалактуронанов с большим числом кислотных групп), которые могут связывать воду в количестве, в 100 раз большем, чем их собственная масса.