БОТАНИКА ТОМ 1 - КЛЕТОЧНАЯ БИОЛОГИЯ. АНАТОМИЯ. МОРФОЛОГИЯ - 2007
1. МОЛЕКУЛЯРНЫЕ ОСНОВЫ— СТРОИТЕЛЬНЫЕ «КИРПИЧИКИ» КЛЕТОК
1.3. Белки
Белки, причем самые разнообразные (иногда их называют протеинами, от греч. protos — первый), находятся во всех клетках. Очень многие из них являются ферментами, которые осуществляют метаболизм (обмен веществ) в качестве специфических биокатализаторов (см. 6.1.6) или служат катализаторами для правильного свертывания новообразованных молекул белка в третичную и четвертичную структуры. Эти белки-помощники разделяют на два класса — шапероны и шаперонины (франц. chaperon — компаньонка) (см. 7.3.1.2; 7.3.1.4). Структурные белки не обладают ферментативной активностью, но характеризуются высокой стабильностью и способностью образовывать очень крупные, высокоупорядоченные комплексы, в том числе нитевидные или трубчатые структуры — филаменты и микротрубочки. Структурные белки и ферменты располагаются не только внутри клеток, но и снаружи. Наконец, рецепторные белки служат для специфического узнавания сигнальных веществ, таких как гормоны, феромоны, элиситоры, или специфических поверхностных структур, в частности, на яйцеклетке при оплодотворении. Присоединение лигандов при высокоспецифичном распознавании, запускает внутри клетки каскад реакций вторичных мессенджеров, что приводит к клеточному ответу. Транслокационные белки входят в состав мембран, они специализированы так, что узнают и пропускают через мембраны определенные молекулы или ионы. Сократительные белки (моторные протеины) являются молекулярными «силовыми машинами>, они переводят химическую энергию в механическую работу. Запасные белки в больших количествах накапливаются в семенах, а также и в вегетативных запасающих органах и в меньшем количестве — в большинстве типов клеток. Благодаря протеолизу из запасных белков высвобождаются аминокислоты, необходимые для синтеза новых других белков (см. 6.17.4)1.
1 Часто белки выполняют не одну, а несколько функций. Так, структурные белки микротрубочек (тубулины) участвуют в транспорте молекул внутри клетки. Белки филаментов обладают АТФазной каталитической активностью и т.д. — Примеч. ред.
1.3.1. Аминокислоты, входящие в состав белков
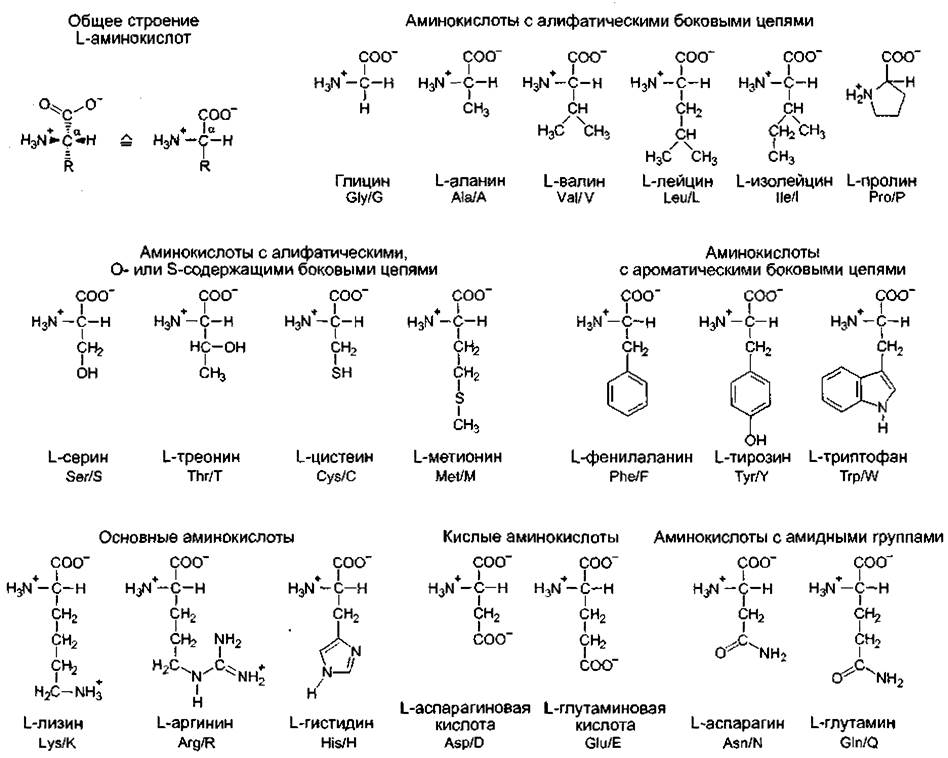
Белки являются полипептидами — гетерополимерными макромолекулами, состоящими из линейно связанных между собой α-аминокарбоновых кислот, упрощенно называемых аминокислотами. На рис. 1.11 показаны 20 аминокислот, входящих в состав белков, они сгруппированы по ряду характерных признаков.
Общий для всех аминокислот план строения, показанный сверху слева на рис. 1.11, характеризуется тем, что Сα-атом соединен с карбоксильной группой, аминогруппой, атомом водорода и остатком — радикалом R, отличающимся у разных аминокислот. В простейшем случае, у аминокислоты глицина R- Н. Эта аминокислота в отличие от всех остальных оптически не активна, так как Сα-атом замещен симметрично. Прочие 19 аминокислот проявляют оптическую активность и относятся к L-ряду. Принадлежность к L-ряду можно определить по расположению заместителей в структурных формулах, изображенных по Эмилю Фишеру (так называемая фишеровская проекция): если наверху записать наиболее окисленный С- атом (в данном случае — карбоксильная группа), а вертикально разместить самую длинную углеродную цепочку, но рассматриваемое соединение принадлежит к L- ряду, если определяющая группа (здесь аминогруппа —NH2) располагается слева (лат. laeve —- слева)1. Если эта группа стоит справа, значит, перед нами D-форма (лат. dexter — правый). Сα проявляет S-конфигурапию согласно Cahn-Ingold-Prelog-номенклатуре (за исключением цистеина: R и глицина). R-, или S-конфигурация асимметрично замещенного С-атома устанавливается на основании правил старшинства для четырех разных радикалов и является системой классификации совершенно независимой от D- или L-номенклатуры.
1 В оригинале дано «laevis, links», что неверно. Laevis означает гладкий, тогда как прилагательное laeva существовало только в женском роде, восходя к несохранившемуся laevus — левый. — Примеч. ред.
Рис. 1.11. Двадцать протеиногенных аминокислот.
Пространственное расположение заместителей у Сα-атома всех аминокислот одинаково, за исключением глицина, который замещен симметрично, остальные аминокислоты принадлежат к L-ряду относительно положения аминогруппы. Для упрощения под общепринятыми названиями аминокислот приведены трехбуквенное и однобуквенное обозначения, применяющиеся в данных об аминокислотной последовательности полипептидов
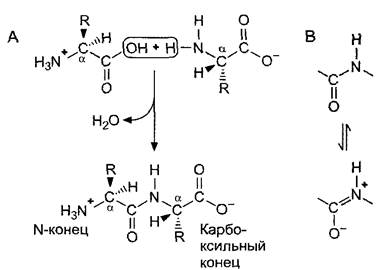
Отдельные аминокислоты линейно связаны в белках пептидными связями между карбоксильной группой одной и аминогруппой следующей аминокислоты. Образование пептидной связи соответствует образованию амида кислоты и может формально (!) рассматриваться как реакция конденсации с выделением воды (рис. 1.12). Фактически синтез полипептидов (см. 7.3.1.2), идущий в клеточных рибосомах, значительно сложнее. Пептидные связи можно расщеплять гидролитически. Переваривание белков соответствует их гидролизу.
Рис. 1.12. Образование пептидной связи: А—образование пептидной связи можно считать (формально!) реакцией конденсации с выделением воды. Пептидные связи с Сα-атома- ми образуют скелет молекулы, от которого наружу отходят боковые радикалы (R). Из-за того, что пептидная связь частично обладает свойствами двойных связей (В), пептидная связь жесткая и планарная, а соседние связи с Сα-атомами могут свободно поворачиваться
У всех белков принимающие участие в образовании пептидных связей атомы и Сα-атомы связаны в однообразно структурированный линейный каркас. Многообразие структур и свойств белков определяется последовательностью аминокислот (т.е. боковых радикалов R) и вытекающих из этого структурных особенностей. Как показано на рис. 1.11, боковые заместители отличаются величиной, полярностью, а у основных и кислых аминокислот также наличием способных к диссоциации групп. В пределах физиологических значений pH — от 4 (клеточные стенки, вакуоли) и 7 (цитоплазма) до 8,5 (строма хлоропластов на свету) — для белков, как правило, характерны электрические заряды. Значение pH, при котором на белках не обнаруживают электрического заряда (т.е. положительные и отрицательные заряды взаимно компенсируются) называют изоэлектрической точкой. В изоэлектрической точке белки особенно легко осаждаются, так как имеют слабые гидратные оболочки (см. 1.1).
1.3.2. Строение белков
1.3.2.1. Первичная структура
Линейная последовательность аминокислот в белках составляет их первичную структуру. Аминокислотная последовательность читается, начиная с аминокислоты, имеющей при Сα-атоме свободную NН2-группу (N-конец), и заканчивая аминокислотой, несущей свободную карбоксильную группу (карбоксильный конец, С-конец). Направление чтения соответствует направлению синтеза молекулы.
Число возможных последовательностей аминокислот невероятно велико. Так, если в последовательности некоторого белка находится п аминокислот, а в каждом положении находится одна из 20 аминокислот, то число возможных вариантов их сочетаний 20n. Даже для небольшого белка всего из 100 аминокислот число возможных последовательностей 20100 = 1,26 • 10130. В природе встречается, как полагают, 1010— 1020 разных белков; одно растение синтезирует примерно 20 000 — 60 000 различных белков. Для сравнения: число молекул воды в Мировом океане оказывается где-то только 4 • 1046.
Для каждого белка типична своя последовательность аминокислот, однако для понимания его функций одного этого недостаточно. Правда, на основании сходства последовательностей можно идентифицировать родственные белки и даже делать выводы о родственных отношениях организмов, сравнивая последовательности многих белков (или генов) (молекулярная систематика; см. 11.1.3.1).
Например, цитохром с встречается как важный переносчик электронов у прокариот и в митохондриях всех эукариот. Речь идет о белке примерно из 110 аминокислот и одной ковалентно связанной группы гема. Его аминокислотная последовательность (рис. 1.13) известна более чем для 100 организмов. Сравнение показывает, что в определенных позициях даже у не родственных организмов всегда находится одна и та же аминокислота, в других всегда обнаруживают сходные аминокислоты, тогда как есть такие позиции, где могут встречаться самые разные аминокислоты. Высококонсервативные аминокислоты часто имеют важное значение для структуры и/или функции белка. Число идентичных или сходных аминокислот, расположенных в одинаковых позициях, выражают при сравнении последовательностей в процентах. Если совпадения последовательностей явно (!) превышают случайное (около 5 %, к тому же у негомологичных белков наличие даже коротких участков с полным совпадением в высшей степени маловероятно), то сравниваемые последовательности считают гомологичными, т.е. и филогенетически родственными. Все до сих пор секвенированные белки можно распределить на менее чем 150 друг другу негомологичных семейств. При этом каждое из них содержит и много белков с неодинаковыми функциями. Эволюция белков (и, следовательно, генов) очевидно шла на удлинение немногих исходных последовательностей.
Рис. 1.13. Сравнение последовательностей цитохрома с (составлено S.Rensing).
Десять выбранных последовательностей аминокислот (однобуквенный код) самых разных организмов расположены так, что соответствующие позиции стоят одна над другой по вертикали. Полное совпадение отмечено темной тонировкой, позиции сходных аминокислотных остатков (например, i/L/V: изолейцин/лейцин/валин) отмечены серым. Представлены цитохромы с человека (Homo sapiens, Hom_sa), дрозофилы (Drosophila meianogaster, Dro_me), аскомицетов — Saccharomyces cerevisiae (Sac_ce) и Neurospora crassa {Neu_cr),покрытосеменных растений — тыквы (Cucurbita maxima, Cuc_ma), фасоли (Phaseolus aureus, Pha_au), пшеницы (Triticum aestivum, Tri_ae); дерева гинкго (Ginkgo biloba, Gin_bi), зеленой водоросли Chlamydomonas reinhardtii (Chl_re), а также бактерии Rhodospirillum rubrum (Rho_ru) как представителя прокариот

Большинство белков содержат от 100 до 800 аминокислот, хотя встречаются и более короткие, и более длинные полипептидные цепи. Если аминокислот меньше 30, то говорят об олигопептидах или просто о пептидах. По молекулярной массе белка можно приблизительно вычислить число слагающих его аминокислот, и наоборот. Средняя молекулярная масса аминокислотного остатка в полипептидной цепи принята за 111 Да. Полипептиды из 100 — 800 аминокислот обладают поэтому молекулярной массой около 11—88 кДа. Полипептидные цепи массой более 100 кДа (>900 аминокислот) встречаются редко. Интересный пример: растительная протонная АТФаза — белок, важный для энергизации плазмалеммы, который «выкачивает» из клетки (см. рис. 6.4; 6.5) ионы водорода при гидролизе АТФ. Этот фермент является полипептидной цепью из около 950 аминокислот (молекулярная масса около 105 кДа).
1.3.2.2. Пространственная структура
Пространственное расположение полипептидной цепи определяется ее первичной структурой. Правда, закономерности, согласно которым белковая молекула складывается определенным образом в структуры высшего порядка, еще не до конца понятны. Небольшие участки полипептидной цепи из 5 — 20 аминокислот образуют локальные вторичные структуры, устойчивые за счет водородных связей между С=О- и NН-группами между удаленными в первичной последовательности аминокислотами. Из-за того, что пептидную связь можно рассматривать отчасти как двойную, она более плоская и жесткая, а связи с соседними Сα-атомами могут свободно поворачиваться (см. рис. 1.12). Цепи из чередующихся пептидных связей и Сα-атомов могут поэтому принимать несколько пространственных конформаций. Наиболее обычные элементы вторичной структуры — правозакрученная α-спираль и β-складчатый слой (англ. β-sheet); кроме них встречаются β-петли (англ, β-turns) и случайные витки (англ, random coils). Случайными витками, как правило, связаны между собой α-спирали и/или β-складчатые слои.
В α-спирали водородные связи образуются между С=O-группой одной аминокислоты и NH-группой каждой четвертой из следующих аминокислот продолжающейся последовательности (рис. 1.14). Благодаря этому и возникает правозакрученная спираль, полный виток которой содержит 3,6 аминокислоты. Остатки аминокислот, не принимающие участия в образовании скелета из полипептидных связей и Сα-атомов, отходят от спирали наружу. Обычно в α-спиральных вторичных структурах встречаются аминокислоты аланин, глутаминовая кислота, лейцин и метионин, реже аспарагин, тирозин, глицин и особенно редко пролин.
Рис. 1.14. Вторичные структуры полипептидов (по Р.Кагlson): А—α-спираль; В—антипараллельный и параллельный β-складчатый слои: в параллельном β-слое С=O- и NН-элементы пептидных связей располагаются напротив точно такого же элемента, а в антипараллельном β-слое С=О-группа стоит против NН-группы (и наоборот). Сα-атомы обозначены черными точками, R — боковые радикалы аминокислот; пунктир — водородные связи. При изображении третичных структур (см. рис. 1.15) для лучшей наглядности вторичные структурные элементы принято показывать схематически и без аминокислотных остатков R. При этом складчатые слои обычно изображают стрелками в направлении от N-конца к С-концу, а спирали — цилиндрами или же винтовыми лентами
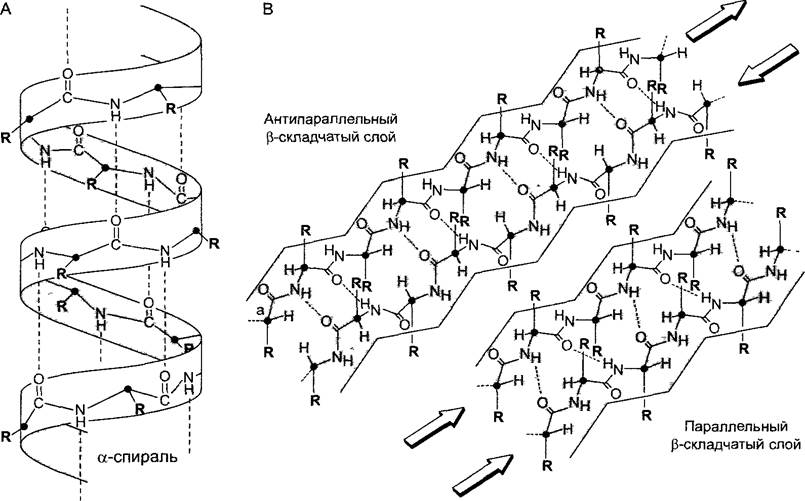
Складчатый слой β образуется в результате установления водородных связей между функциональными группами С=O— и NH— в пептидных связях разных протяженных участков одной полипептидной молекулы, т.е. между так называемыми р-нитя- ми (англ. β-strands). β-Нити могут располагаться параллельно или антипараллельно, т. е. лежащие рядом β-нити тянутся либо параллельно — обе от N-конца к С-концу, либо в противоположных направлениях — одна от N-конца к С-концу, а вторая от С-конца к N-концу (рис. 1.14). Аминокислотные остатки располагаются в β-нитях, чередуясь то сверху, то снизу от плоскости каркаса нити. Обычно в β-слоях встречаются аланин, изолейцин, а также ароматические аминокислоты, реже кислые и основные аминокислоты. Соседние элементы вторичных структур, в особенности p-нити, связаны часто посредством β-петель из 4 — 8 аминокислот, стабилизированных, как правило, также за счет водородных связей. В области β-петли полипептидная цепь резко изгибается, поэтому говорят также о петлях-шпильках (англ, hairpinturns). Именно поэтому β-петли способствуют образованию компактных белковых структур. В β-петлях обычно находятся аминокислоты пролин и глицин, а также аспарагин и аспарагиновая кислота.
Процесс укладки белковой молекулы заканчивается образованием компактной трехмерной третичной структуры — ансамбля из элементов вторичных структур полипептидной цепи. Небольшие белки, содержащие до 200 аминокислот, образуют единственный домен. Молекулы с большим числом аминокислот могут структурироваться в два и более доменов, каждый из которых укладывается независимо от других. Часто в этом процессе принимают участие вспомогательные белки — уже упомянутые шапероны (Chaperone) и шаперонины (Chaperonine) (см. 7.3.1.2; 7.3.1.4). Стабилизация третичной структуры часто протекает за счет:
✵ образования дополнительных водородных связей;
✵ образования дисульфидных связей;
✵ установления неполярных взаимодействий, в особенности внутри молекулы;
✵ других сложных модификаций, таких, например, как гликозилирование;
✵ изомеризации Х-Рго-пептидных связей, которые в противоположность остальным пептидным связям, всегда являющимся трансизомерами (см. рис. 1.12), могут встречаться в виде как цис-, так и трансизомеров (X — любая аминокислота, Pro —пролин).
В отличие от образования водородных связей и неполярных взаимодействий, процессы модификации белка катализируются ферментами.
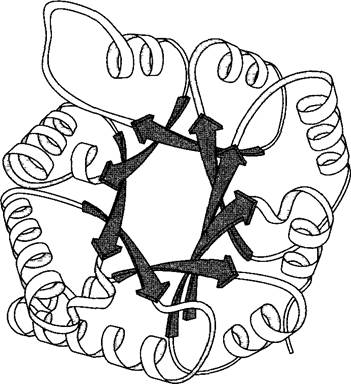
С помощью рентгеноструктурного анализа или метода ядерно-магнитного резонанса (ЯМР-спектроскопии) удалось выяснить пространственную структуру многих, даже сложных белков вплоть до расположения отдельных атомов (рис. 1.15). При этом оказалось, что число типов трехмерной третичной структуры белков ограничено, и соответственно можно выделить ограниченное число семейств белков: их насчитывается чуть больше 1 100. Внутри одного структурного семейства могут встречаться белки, аминокислотные последовательности которых не гомологичны.
Рис. 1.15. Третичная структура триозофосфат- изомеразы пекарских дрожжей (Saccharomyces cerevisiae). Схема мономера фермента (по L.Stryer).
В клетке фермент находится в активной форме в виде димера. Представлена только конформация каркаса аминокислотной цепи (ср. с рис. 1.14). Структура состоит из 8 параллельных ß-петель (см. рис. 1.14) (тонированные стрелки в центре молекулы белка) и 8 расположенных на периферии α-спиралей, связанных между собой с помощью этих петель
В зависимости от доли разных элементов вторичных структур образуются глобулярные либо фибриллярные белки. Первая структура характерна для ферментов, вторая встречается у многих структурных белков. Многие белки несут непептидные простетические группы (греч. prostetos — добавленный). В зависимости от типа дополнительной простетической группы различают глико-, липо-, хромо-, фосфо- или металлопротеины. Выше упомянутый цитохром с является хромопротеином: в него в качестве простетической группы включен гем.
Трехмерная структура белка сочетает стабильность с динамичностью. Так, очень маленькие, как правило, активные центры фермента влияют на общую конформацию молекул. Значительная часть третичной структуры служит для того, чтобы с высокой точностью осуществлять образование и стабилизацию структуры активного центра. Для многих белков характерны функциональные конформационные изменения. Так, например, у рецепторов и ферментов конформация меняется после их связывания с лигандами. При этом говорят о индуцированном соответствии (англ, induced fit) конформации активного центра белка и его субстрата. Изменения конформации происходят также у моторных белков в ходе их цикла работы (например, миозин, динеин, кинезин; см. 2.2.2.2) или транслокаторов (белков-переносчиков) по мере транспорта (см. 6.1.5; 6.2.3). Обратимые химические модификации определенных аминокислот, такие, например, как фосфорилирование, воздействуют на активность белка обычно через конформационные изменения. То же касается и присоединения аллостерических регуляторов к ферментам (см. 6.1.7). Таким образом, структура и функция белков находятся под влиянием разнообразных регуляторных процессов. По способу действия белки можно охарактеризовать как молекулярные машины клеток.
Структура и функция большинства белков зависят от состояния внутриклеточной среды (в том числе от значения pH, ионной силы). Растворимые белки сильно гидратированы, что обусловлено наличием полярных и заряженных аминокислотных остатков на их поверхности (см. 1.1). Зато аминокислоты, находящиеся внутри молекулы белка, стабилизируют ее конформацию благодаря неполярным взаимодействиям.
Резкие изменения значений pH или нагревание приводят к денатурации белка. При этом разрушается его третичная структура, а при известных условиях и вторичная структура. Благодаря взаимодействию разных белков между собой, например, вследствие оголения неполярных остатков при денатурации, происходит процесс агрегации и в конце концов коагуляция (преципитация) белка. Обычно такое состояние необратимо и его называют необратимой денатурацией.
1.3.2.3. Белковые комплексы
Многие белки могут выполнять свои функции только в соединении с молекулами того же или других белков. Такие белковые комплексы рассматривают как четвертичные структуры, а составляющие их субъединицы называют протомерами (от греч. meros — часть). Если имеется только один сорт субъединиц, говорят об гомоолигомерном белковом комплексе; гетероолигомерные белковые комплексы состоят из двух или нескольких разных субъединиц. Четвертичные структуры удерживаются вместе не с помощью ковалентных связей, а за счет других взаимодействий (водородных и ионных связей, гидрофобных взаимодействий). У структурных белков четвертичные структуры могут достигать значительных размеров: микротрубочки и нити актина (актиновые филаменты) достигают в длину нескольких микрометров, в то время как их глобулярные протомеры (тубулин, актин) имеют диаметр всего 4 нм.
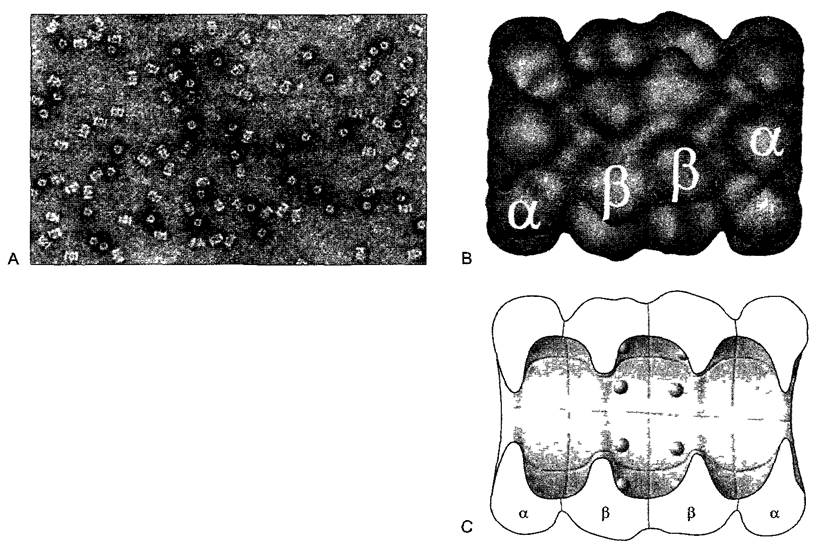
В качестве примера белкового комплекса на рис. 1.16 показана протеасома. Протеасомы имеются у всех организмов, их функция — разрушение регуляторных и неправильно сложенных белков. Таким образом, они служат для «оборота белков» (англ, protein turnover), т.е. постоянного обновления белков клетки путем разрушения и новых синтезов (см. 7.3.1). Протеасома обладает трубчатой четвертичной структурой (рис. 1.16), причем активные центры разных составляющих ее протеаз расположены на внутренней стороне трубки. В результате расщепляются только те полипептиды, которые проникают внутрь протеасомы. Другие примеры белковых комплексов — шаперонины, к которым относится состоящий из 14 идентичных протомеров Hsp60-шаперонин пластид (см. 7.3.1.4, рис. 7.18).
Рис. 1.16. 205-протеасома как пример мультимерного ферментного комплекса (А, В — оригиналы H.Zuhl, С — по Н.Zuhl, с любезного разрешения) А—вид комплекса при высоко разрешающей электронной микроскопии; В—реконструированное по нескольким электронно-микроскопическим препаратам изображение протеасомы, в котором различимы субъединицы; С—схематический продольный срез через 20S-протеасому. Этот мультимерный, трубковидный протеазный комплекс состоит из 4 колец по 7 субъединиц в каждом, внутри β-субъединиц располагаются активные центры. Узкие отверстия трубчатых камер (диаметр <2 нм) пропускают только развернутые белковые молекулы Распознавание расщепляемого белка, маркированного убиквитином, происходит с помощью дополнительных белков на правом или левом концах 20в-комплекса (здесь не показаны), благодаря чему возникает 26S-комплекс (S — единицы седиментации, см. бокс 2.1)
Мультиферментный комплекс образуется, когда в единую четвертичную структуру объединены разные ферменты. Некоторые из этих комплексов, способные катализировать целую цепь последовательных реакций, обладают крайне высокими молекулярными массами — свыше 7 106 Да, например, состоящий почти из 100 протомеров комплекс пируватдегидрогеназы (см. 6.10.3.1). Часто белки-катализаторы бывают связаны с регуляторными субъединицами. Вообще, протомеры четвертичных структур могут взаимно влиять друг на друга, например, в том смысле, что переход одного протомера из неактивной в активную конформацию содействует соответствующей активации всех остальных протомеров (кооперативность, см. 6.1.7).
Нуклеиновые кислоты, как правило, ассоциированы с белковыми комплексами. Так, ДНК хромосом клеточных ядер по большей части объединена в комплекс с октамерными гистонными комплексами в нуклеосомы (см рис. 2.21), а рибосомальные РНК объединяются с множеством разных белков в рибосомы (см. 2.2.4). Наконец, многие вирусы также являются рибонуклеопротеиновыми частицами (рис. 1.17).
Рис. 1.17. Вирусная частица вируса золотистой мозаики турнепса (TYMV = Turnip Yellow Mosaic Virus) в негативном контрасте (ЭМ-фото. P.Klengler, Siemens AG)
Капсид — белковая оболочка вируса, построенная из 32 капсомеров, окружает РНК-содержащий центр. Каждый капсомер состоит в свою очередь из 5 или 6 глобулярных белковых молекул в качестве протомеров четвертичной структуры
