БОТАНИКА ТОМ 1 - КЛЕТОЧНАЯ БИОЛОГИЯ. АНАТОМИЯ. МОРФОЛОГИЯ - 2007
1. МОЛЕКУЛЯРНЫЕ ОСНОВЫ— СТРОИТЕЛЬНЫЕ «КИРПИЧИКИ» КЛЕТОК
1.4. Полисахариды
Наряду с нуклеиновыми кислотами и белками полисахариды составляют третью большую группу важнейших биополимеров. Полисахариды (гликаны) образуются благодаря связыванию моносахаридов, а именно гексоз и/или пентоз, в неразветвленные или разветвленные цепи-макромолекулы. Полисахариды, состоящие только из одного сорта строительных блоков- мономеров, называют гомогликанами, а из двух и более сортов мономеров — гетерогликанами. Структурные полисахариды располагаются снаружи клеток. Они принимают участие в построении клеточных стенок растений. Как внутри, так и снаружи клеток откладываются запасные полисахариды, служащие резервом веществ и энергии.
1.4.1. Моносахариды, строительные блоки (звенья цепей) полисахаридов
Моносахариды обладают несколькими гидроксильными группами, а также одной карбонильной функциональной группой, входящей либо в альдегидную группу (альдозы), либо в кетогруппу (кетозы). По числу С-атомов (n) различают триозы (n-=3, например, глицериновый альдегид), тетрозы (n =4. например, эритроза), пентозы (n = 5, например, рибоза, рибулоза, ксилулоза), гексозы (n - 6, например, глюкоза, фруктоза, галактоза) или гептозы (n-=7, например, седогептулоза) (рис. 1.18). Принадлежность сахара к D- или L-ряду определяется на основе положения гидроксильной группы у асимметрично замещенного С-атома с самым большим номером (вспомните проекцию Фишера!) (см. 1.3.1). У растений встречаются преимущественно моносхариды D- ряда. L-caxapa попадаются в полисахаридах случайно.
Рис. 1.18. Структурные формулы и внутримолекулярная реакция образования полуацеталей моносахаридов: А—линейные формулы в проекции Фишера ряда альдоз и кетоз с n = 4 (тетроза), n = 5 (пентоза), n= 6 (гексоза) углеродных атомов. Положение ОН-группы при «самом нижнем» асимметрично замещенном С-атоме является признаком, по которому сахара относят к D- или L-ряду. Все представленные моносахариды относятся к D-ряду; В — альдегиды реагируют с гидроксильными группами с образованием полуацеталей. Этот процесс происходит в кислой среде и, как показано на примерах D-фруктозы (С) и D-глюкозы (D), может протекать у моносахаридов внутримолекулярно, в особенности у гексоз и альдопентоз. При этом образуются пиранозные или фуранозные замкнутые формы сахаров, названия которых происходят от пиран и фуран. В водном растворе над линейной формой преобладают и находятся между собой в равновесии две изомерные формы, отличающиеся местом гидроксильной группы в полуацетале. Эти изомеры называют аномерами. Различают α- и β-аномеры; Е — моносахариды пиранозного ряда, встречающиеся обычно в качестве мономеров в полисахаридах (с принятыми сокращениями названий). Галактуроновая кислота встречается, например, в пектинах, N-ацетил-β-D-глюкозамин — в хитине, а N-ацетил-β-D-мурамовая кислота — в пептидогликане бактерий. Использованные в С, D, Е проекции Хаворта наглядны, однако не передают фактической конформации молекулы. Так, в растворе β-D-глюкопиранозы преобладает конформация кресла(F)
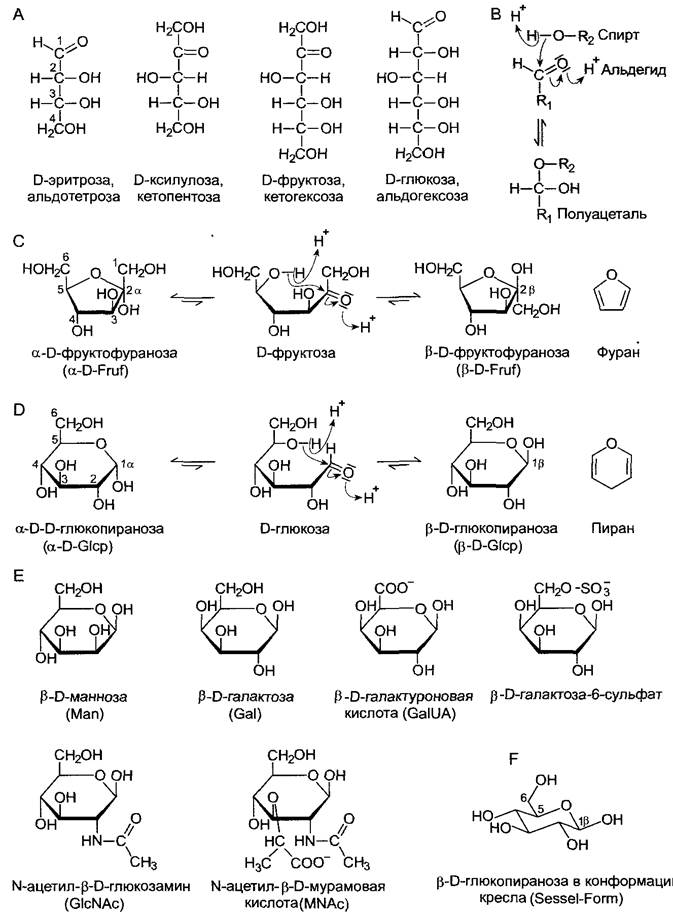
Карбонильная группа обусловливает характерные для моносахаридов реакции. В кислой среде карбонильные группы могут реагировать с гидроксильными, образуя полуацетали.Этот процесс у пентоз и гексоз протекает внутримолекулярно с образованием кольцевых структур двух типов — фуранозных и пиранозных, которые изображены на рис. 1.18 согласно представлениям N. Haworth (так называемая проекция Хаворта). Эта форма представления выбрана здесь ради ее наглядности, однако она не передает фактической пространственной структуры молекулы сахара. Как правило, пиранозные кольца существуют в конформации кресла (рис. 1.18, F). Гидроксильные группы, которые в формулах Хаворта располагаются с нижней стороны плоскости колец, в проекции Фишера смотрят направо. Благодаря двум возможным положениям карбонильной группы при образовании полуацеталей для каждой фуранозной или пиранозной формы имеется два структурных изомера, отличающиеся положением ОН-группы. Их называют аномерами (α- или β-аномеры). В растворе они преобладают над линейной формой и находятся в равновесии между собой.
1.4.2. Образование гликозидов
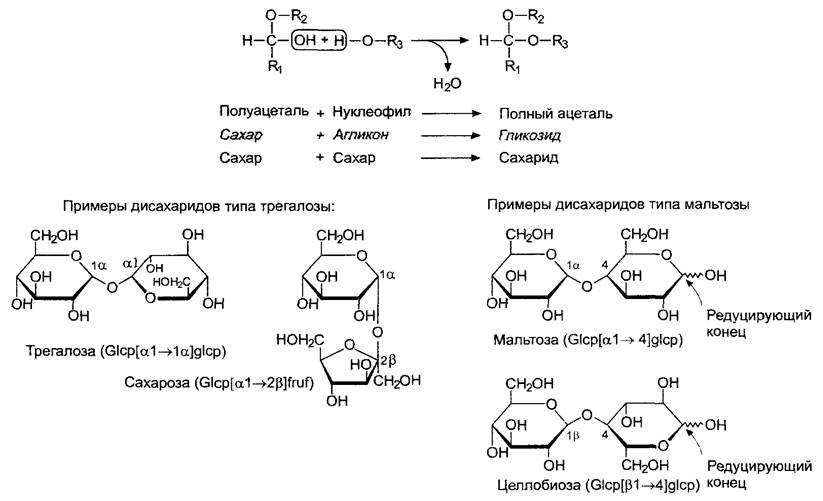
Полуацетали могут реагировать с алифатическими или ароматическими гидроксильными группами, аминами и гидроксильными группами кислот, например, с карбоксильными группами или фосфорной кислотой, с выделением воды и образованием полных ацеталей (рис. 1.19). Возникающая при этом связь называется гликозидной связью. Различают соответственно О-гликозидные и N-гликозидные связи. Если партнер по реакции не является углеводом (агликон), то получившиеся соединения называют гликозидами. Если гликозидной связью связаны два углевода, то говорят о сахаридах, чтобы подчеркнуть, что соединение состоит исключительно из моносахаридов. Эти реакции обратимы. Гликозидные связи в кислой среде могут расщепляться гидролитически. Ферменты, гидролизующие гликозидные связи, называются гликозидазами.
Многие природные низкомолекулярные вещества растительного происхождения (см. 6.16), накапливающиеся в вакуолях, являются гликозидами. Как правило, гликозиды более растворимы в воде, чем исходные агликоны. Гликолипиды — это О-гликозиды и важные компоненты мембран (см. 1.5.2). У растений особенно часто встречаются галактолипиды,типичные для мембран пластид. Многие интегральные мембранные белки и белки, секретируемые клетками наружу, а также и некоторые внутриклеточные белки являются гликопротеинами; в них встречаются как О-гликозидные связи (с радикалами некоторых аминокислот: серина, треонина и тирозина), так и N-гликозидные связи (с радикалом аспарагина).
Если два моносахарида объединяются в дисахарид, в этом могут принимать участие или обе полуацетальные группы, или же полуацеталь одного сахара, которая реагирует с алифатической гидроксильной группой другого сахара. В первом случае образуются д и сахариды типа трегалозы без свободной полуацетальной группы, во втором случае — дисахариды типа мальтозы, еще сохранившие полуацетальную группу (рис. 1.19). Полуацеталь — мягкий восстанавливающий агент. Он восстанавливает Сu2+ в щелочном растворе винной кислоты до Сu+, выпадающей в осадок в виде Сu2O (проба Фелинга). Свободная подуаиетальная группа сахарида называется поэтому и его редуцирующим концом. Следовательно, сахар типа трегалозы, как сама трегалоза или сахароза, не имеет редуцирующего конца. В зависимости от числа связанных моносахаридов образуются ди-, три, тетра- и т.д. -сахариды (n= 2, 3, 4...), которые называют олигосахаридами при n < 30 и полисахаридами, когда n = 30 и более. Так как при связывании сахаров возможны многочисленные изомеры, нужно точно указать тип гликозидной связи, т.е. указать принимающие участие в образовании связи С-атомов и тип номера, а также тип кольцевой структуры (фуранозной или пиранозной), так как некоторые сахара, например рибоза, существуют как в фуранозной, так и в пиранозной формах. На рис. 1.18 и 1.19 приведены примеры номенклатуры сахаридов.
Рис. 1.19. Образование гликозидных связей.
Гликозидные связи возникают при реакции полуацетальной группы сахара с нуклеофильными группами второй молекулы, которая может быть либо агликоном, либо также сахаром. Последний может принимать участие в реакции своей полуацетальной группой или же одной из других гидроксильных групп. В первом случае образуются дисахариды трегалозного типа, во втором — мальтозного типа. По сокращенной записи названия моносахаридов и способа гликозидной связи (в скобках) можно понять и характер структуры. Так как в растворе у сахаридов мальтозного типа и моносахаридов у редуцирующего (восстанавливающего) конца α- и β-аномерные формы находятся в равновесии с разомкнутыми формами, положение ОН-группы оказывается неопределенным
1.4.3. Запасные и структурные полисахариды
Полисахариды (см. 6.17.1) служат растениям структурообразующими веществами (структурные полисахариды) и расположены тогда снаружи клеток, либо используются растениями как резервные вещества (запасные полисахариды), т.е. являются накопителями восстановленного углерода. Запасные полисахариды накапливаются преимущественно внутри клеток; правда, в плодах и семенах иногда встречаются и внеклеточные запасные углеводы в форме слизистых веществ. Полисахариды подразделяют на группы по типу составляющих их мономеров. Глюканы состоят либо исключительно (гомогликаны), либо преимущественно (гетерогликаны) из глюкозы, фруктаны — соответственно из фруктозы, галактаны — из галактозы и т. п. Если два моносахарида имеются приблизительно в равных (сравнимых) соотношениях, это также отражается в названии. Так, глюкоманнанысодержат значительные доли глюкозы и маннозы. Арабиногалактаны состоят преимущественно из арабинозы и галактозы Перечень разных полисахаридов дан в табл. 1.3, важнейшие структуры показаны на рис 1.20. Наряду с неразветвленными полисахаридами важны и разветвленные, например, амилопектин и гликоген.
Рис. 1.20. Примеры полисахаридов (о функциях см. табл, 1.3).
Молекулы имеют разную величину. Так, число мономеров n у амилозы составляет 200—1000, у амилолектина и целлюлозы 2 000—10 000, у галактуронана до 200 и у инулина или флеина только 30—40. Число т мономерных единиц между двумя разветвлениями амилопектина равно 23—25. Гликоген построен так же, но здесь m всего 12—14. Таким образом, гликоген разветвлен сильнее амилолектина
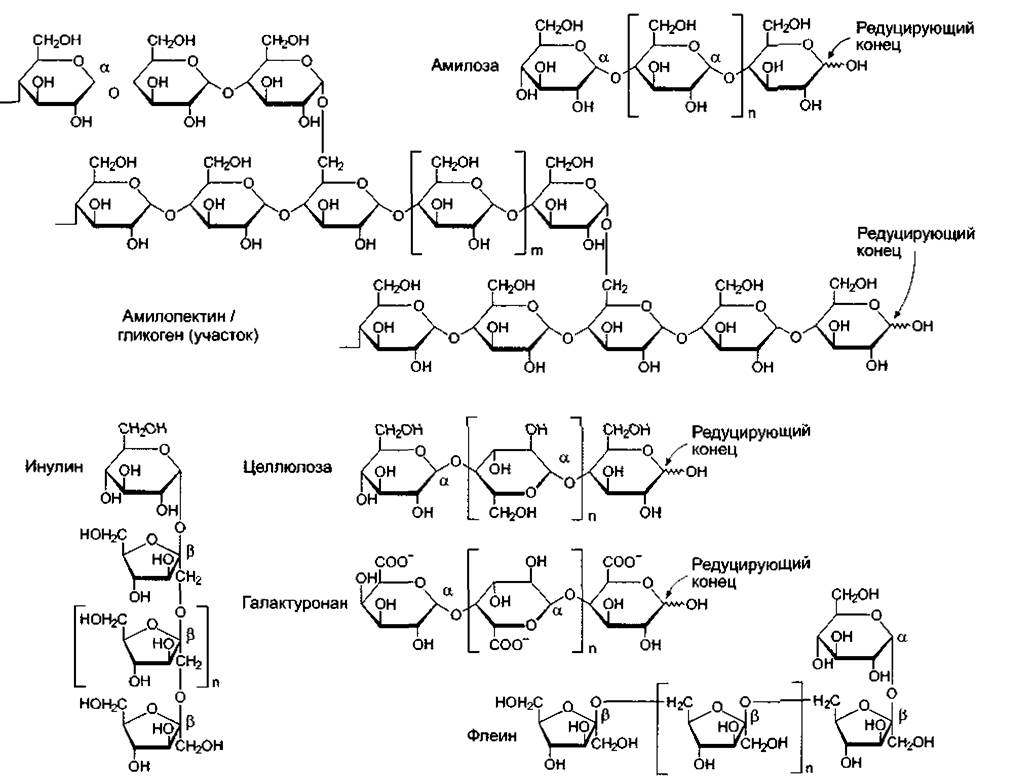
Таблица 13 Часто встречающиеся запасные и структурные полисахариды
Полисахарид |
Моносахаридный (е) блок(и) |
Гликозидная(ые) связь(и) |
Функция |
Амилоза |
α-D-глюкоза |
α1 —> 4 |
Компонент крахмала (10 — 30%, резервное вещество) |
Амилопектин |
α-D-глюкоза |
α1 —> 4 + α1—> 6 |
Компонент крахмала (70 — 90%, резервное вещество, степень ветвления 1 25) |
Гликоген |
α-D-глюкоза |
α1 —> 4 + α1 —> 6 |
Резервное вещество бактерий и грибов, ветвление 1 14 |
Инулин |
β-D-фруктоза + 1 Mol α-D-глюкозы |
β2 —> 1 α1 —> 2β |
Фруктан, резервное вещество, например у Аsteraceae |
Флеин |
β-D-фруктоза + 1 Mol α-D-глюкозы |
β2 —> 6 α1—>2β |
Фруктан, резервное вещество, например у Роасеае |
Целлюлоза |
β-D-глюкоза |
β1 —>4 |
Структурное вещество клеточных стенок растений |
Галактуронан |
α-D-галактуроновая кислота |
α1—>4 |
Структурное вещество клеточных стенок растений и составная часть пектина |
Ксилоглюкан |
β-D-глюкоза + α-D-ксилоза |
β1 —>4 α1—> 6 |
Структурное вещество клеточных стенок и составная часть гемицеллюлоз, глюкан с боковыми ксилозными цепями в связи а1 —> 6 |
Хитин |
N-ацетил-β-D-глюкозамин |
β1 —>4 |
Структурное вещество клеточных стенок многих грибов и ряда водорослей |
Каллоза |
β-D-глюкоза |
β1 —> 3 |
Закупоривание пор ситовидных трубок, плазмодесм, пыльцевых трубок, скопление в местах проникновения гиф грибов или в ранах |
Агароза |
β-D-галактоза, 3,6-дегидро-L-галактоза |
α1 —> 3 + β1 —> 4 |
Структурное вещество клеточных стенок красных водорослей |
Муреин |
N-aцетил-β-D-глюкозамин + N-ацетил-β-D-мурамовая кислота |
β1 —>4 |
Структурное вещество клеточных стенок бактерий, чередование обоих мономеров |