БОТАНИКА ТОМ 2 - ФИЗИОЛОГИЯ РАСТЕНИЙ - 2007
6. ФИЗИОЛОГИЯ ОБМЕНА ВЕЩЕСТВ
6.10. Выработка энергии в результате расщепления углеводов
В связи с тем, что АТФ, синтезированная в результате фотофосфорилирования, а у хемоавтотрофов соответственно в результате транспорта электронов при окислении неорганического субстрата, как правило, используется для восстановления СO2 (ассимиляция углекислого газа), АТФ, используемая для прочих рабочих процессов клеток автотрофов, должна быть получена иным путем (см. рис. 6.2). Фотоавтотрофы поэтому должны были приобрести способность к синтезу АТФ в темноте. Все клетки гетеротрофных и автотрофных организмов в качестве исходного вещества для синтеза своих органических клеточных компонентов и в качестве поставщиков энергии используют исключительно восстановленные углеродные соединения, которые в итоге являются продуктом фотосинтеза или хемосинтеза.
Выработка энергии в результате расщепления восстановленных углеродных соединений (диссимиляция) постоянно происходит за счет окислительно-восстановительных реакций, т.е. посредством переноса электронов от донора к акцептору. В зависимости от конечного акцептора электронов в поставляющих энергию реакциях расщепления (катаболических реакциях) различают два основных типа диссимиляции: в первом случае конечным акцептором электронов служит кислород (аэробная диссимиляция, или клеточное дыхание; см. рис. 6.2), во втором случае — органическая молекула, которая самостоятельно возникает в результате расщепления (анаэробная диссимиляция, или брожение). В процессе брожения происходит не чистое окисление субстрата, а, напротив, внутренняя реакция окисления-восстановления, т. е. перенос электронов внутри субстрата или обмен ими между продуктами расщепления субстрата.
Организмы, которые совсем не могут использовать кислород, облигатные анаэробы (облигатно использующие реакции брожения), встречаются очень редко и ограничиваются небольшим числом бактерий и беспозвоночных, живущих, например, в органическом иле водоемов и кишечнике животных. Факультативными анаэробами, вырабатывающими энергию с помощью брожения в условиях недостатка кислорода, является большинство живых клеток. Однако продуктивность анаэробной диссимиляции (и степень чувствительности к недостатку кислорода), а также биохимические пути брожения различаются. Большинство дрожжей, например, могут существовать в анаэробных условиях, используя брожение, но размножаются только в аэробных условиях, т. е. при использовании процесса дыхания. Переключение с аэробного на анаэробный катаболизм облегчается тем, что оба биохимических пути идентичны на многих этапах, в аэробном расщеплении участвуют соединения, образованные в результате анаэробного.
В качестве субстрата для брожения выступают, как правило, гексозы, в основном глюкоза. Специализированные бактерии могут сбраживать также пентозы, аминокислоты и жирные кислоты. При дыхании также в основном используется глюкоза в качестве субстрата. Общий биохимический путь глюкозного брожения и глюкозного дыхания ведет к образованию пирувата и называется гликолизом (см. 6.10.1). Он протекает в цитоплазме клеток.
Глюкоза поступает в распоряжение растения непосредственно из цикла Кальвина (см. 6.5, рис. 6.70) или в результате расщепления транспортных и запасных углеводов (см. рис. 6.72, а также 6.17.1.2), что позволяет обеспечивать глюкозой фотосинтетически неактивные клетки и ткани. В дополнение к этому растения способны к преобразованию запасных липидов в углеводы (см. 6.12). Наконец, для синтеза АТФ могут служить также реакции расщепления углеродных остатков аминокислот (например, расщепление запасных белков).
Глюкоза образуется в результате расщепления сахарозы с помощью инвертаз и расщепления крахмала с помощью амилаз и мальтаз (см. 6.17.1.2). Глюкозо-1-фосфат появляется непосредственно в результате расщепления сахарозы сахарозосинтазой или при фосфоролитическом расщеплении крахмала (см. рис. 6.72, а также
6.17.1.2). Глюкоза с помощью АТФ и фосфоглкжомутазы с промежуточным участием гексокиназы и образованием глюкозо- 1-фосфата преобразуется в глюкозо-6-фосфат, который находится в состоянии равновесия с фруктозо-6-фосфатом, начальным метаболитом гликолиза (рис. 6.92, гексозофосфатизомеразная реакция).
Фруктозо-6-фосфат после преобразования во фруктозо-1,6-бисфосфат с помощью альдолазы расщепляется на одну молекулу 3-фосфоглицеринового альдегида и одну молекулу дигидроксиацетонфосфата, которые находятся в равновесии друг с другом в реакции, катализируемой триозофосфатизомеразой. Реакции гликолиза,
вырабатывающие энергию, протекают с образованием пирувата из 3-фосфорогли- церинового альдегида. Последовательность реакций, представленная на рис. 6.92, протекает два раза, используя одну молекулу гексозы (одну на оба триозофосфата), и производит 2 АТФ с каждого триозофосфата, т. е. всего 4 АТФ на одну гексозу. Кроме того, необходимо учитывать, что для синтеза фруктозо-1,6-бисфосфата из глюкозы используются 2 молекулы АТФ. Чистый выход гликолиза составляет таким образом 2 АТФ на одну молекулу глюкозы.
Реакции преобразования фруктозо-1,6- бисфосфата в 3-фосфоглицерат аналогичны реакциям цикла Кальвина, но протекают в противоположном направлении (см. рис. 6.70). Принимающие в этом участие изоферменты несколько различаются своим молекулярным строением; глицеральдегидфосфатдегидрогеназа хлоропластов НАДФ-зависима, а изоформа, участвующая в гликолизе, зависит от НАД.
Синтез АТФ в процессе гликолиза происходит в результате субстратного фосфорилирования. Обе синтетические реакции проходят с выделением энергии. Свободная молярная стандартная энтальпия гидролиза фосфоенолпирувата до пирувата и неорганического фосфата составляет ∆G0' = 5= -61,9 кДж • моль-1 (см. рис. 6.3). Катализируемая пируваткиназой реакция, в которой на АДФ переносится фосфатный остаток с образованием АТФ (∆G0' = +30,5 кДж • моль-1), протекает в итоге с выделением энергии (∆G0' = -31,4 кДж'моль-1) и практически необратима. В стандартных условиях около 50 % энергии фосфоенольной связи запасается в форме АТФ.
Также достаточно большой для синтеза АТФ является свободная молярная стандартная энтальпия гидролиза 1,3-дифосфоглицерата до 3-фосфоглицерата и фосфата (∆G0' = -49,4 кДж • моль-1; см. табл. 6.3). Фосфоглицераткиназная реакция соответственно тоже идет с выделением энергии (∆G0' = -49,4 + 30,5 кДж • моль-1 = -18,9 кДж • моль-1), удаление 1,3-дифосфоглицерата смещает равновесие и «запускает» слабо эндергоническое окисление 3-фосфоглицеринового альдегида в процессе глицеральдегидфосфатдегидрогеназной реакции (∆G0' = + 6,3 кДж • моль-1). Таким образом, общая реакция окисления 3-фосфоглицеринового альдегида до 3-фосфоглицерата идет с выделением энергии (∆G0' = -18,9 + 6,3 кДж • моль-1 = -12,6 кДж • моль-1).
Рис. 6.92. Гликолитическое расщепление глюкозы до пирувата и (на сером фоне) реакции брожения для вторичного окисления синтезированных в процессе гликолиза НАДН + Н+ в условиях недостатка кислорода. Реакции внутри обведенного прямоугольника протекают дважды, так как из одной молекулы глюкозы в качестве продукта альдолазной реакции появляется две молекулы триозофосфата
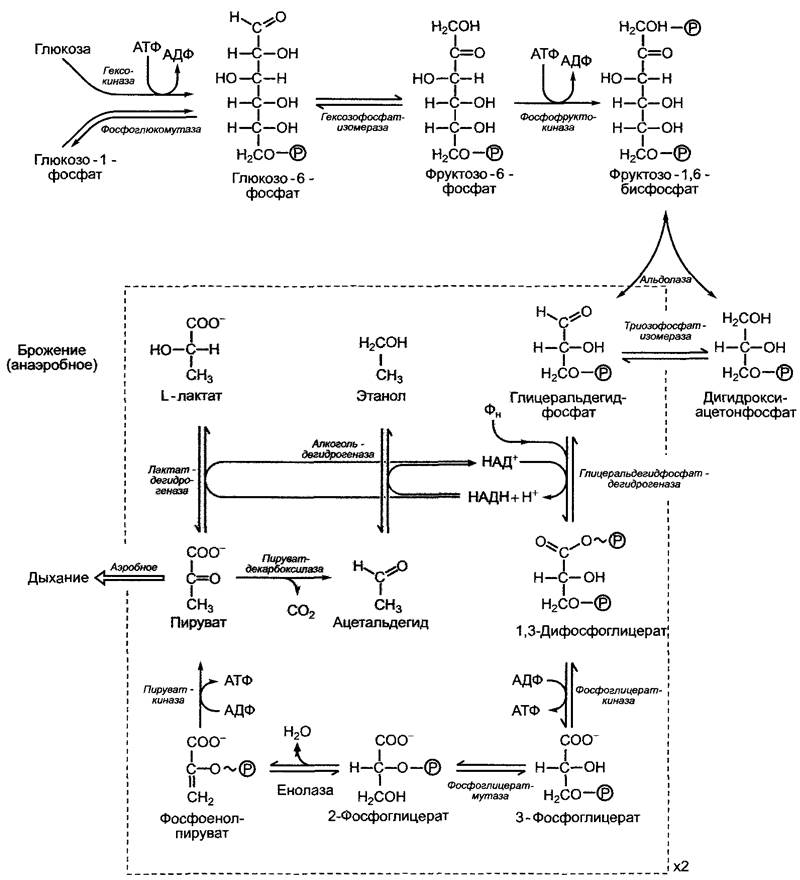
В присутствии кислорода пируват в итоге окисляется до СO2, при этом вторично окисляется синтезированный в процессе
гликолиза НАДН. При недостатке кислорода эти процессы сильно ограничены. Многие клетки способны вторично окислять НАДН, электроны при этом переносятся на метаболиты гликолиза, на пиру- ват или образованный из него ацетальдегид. В первом случае появляется молочная кислота (молочнокислое брожение, см.
6.10.2.2), во втором — этанол (спиртовое брожение, см. 6.10.2.1). В каждом случае брожение обеспечивает нормальное течение гликолиза, а, следовательно, и снабжение клеток АТФ посредством субстратного фосфорилирования в условиях недостатка кислорода (см. рис. 6.92).
Этанол в качестве конечного продукта анаэробного расщепления глюкозы образуется у дрожжей, используемых в промышленности, а также в процессе приготовления пульке (южноамериканского напитка из перебродившей в результате деятельности бактерии Zymomonas mobilis пасоки агавы, которую получают из стеблей в пору цветения, из одного стебля за 4 — 5 мес, что составляет до 1 000 л содержимого флоэмы). Многие другие организмы и ткани различных высших растений (семена многих видов, например, риса, гороха; корни при затоплении, например, риса, кукурузы) содержат этанол в условиях недостатка кислорода. Этанол в больших количествах является клеточным ядом и вследствие своей способности проникать сквозь мембраны не может обезвреживаться с помощью компартментации, поэтому он постоянно синтезируется только теми организмами, которые живут в водной среде и способны выделять спирт наружу.
Общее уравнение спиртового брожения выглядит так:
С6Н12O6 —>2С2Н5ОН + 2СO2;
∆G0' = -234 кДж • моль-1.
Для сравнения, при полном расщеплении глюкозы до СO2 ∆G0' = -2 877 кДж • моль-1. Спиртовое брожение поэтому является в энергетическом отношении очень неэф
фективным процессом, при котором перерабатываются большие объемы субстрата и получается еще один богатый энергией субстрат (этанол). Продуцируемый хлебопекарными дрожжами в процессе спиртового брожения СO2 используется при выпечке дрожжевого теста как разрыхлитель.
Последовательность реакций превращения пирувата в этанол представлена на рис. 6.92. При необратимом декарбоксилировании пирувата в ацетальдегид в качестве коэнзима используется тиаминпирофосфат. Выход АТФ в результате спиртового брожения составляет, как и при гликолизе, исходя из глюкозы, 2 молекулы АТФ из одной молекулы глюкозы. Запасенная энергия в стандартных условиях составляет, таким образом, 2 • 30,5 кДж моль-1/ /234 кДж • моль-1 = 0,26 (26 %). В клетке, где вещества находятся не в стандартных условиях, выход энергии значительно выше.
Используя методы генной инженерии, удалось так изменить бактерию Zymomonas mobilis, что она начала сбраживать до этанола не только глюкозу, фруктозу или сахарозу, но даже ксилозу. Таким образом, стало возможно подвергать технической переработке опилки из древесины — побочный продукт, получаемый при обработке дерева, который состоит из целлюлозы, пентозсодержащей гемицеллюлозы и лигнина (см. 6.17.2).
6.10.2.2. Молочнокислое брожение и другие виды брожения
В результате чистого молочнокислого брожения из глюкозы образуется только молочная кислота (гомоферментация); С6Н12O6 —> 2 лактат- + 2Н+; ∆G0' = -197 кДж • моль-1. Это анаэробное расщепление (кроме того, что оно наблюдается в мышцах животных) происходит, например, у бактерий Streptococcus lactis (используется в качестве закваски в масло- и сыроделии; является также причиной спонтанного скисания молока) и Lactobacillus delbrückii (используется в промышленном синтезе молочной кислоты). Молочнокислое брожение встречается также у высших растений (например, картофеля) и различных видов зеленых водорослей (например, Chlorella, Scenedesmus). В процессе молочнокислого брожения пируват восстанавливается непосредственно до L-молочной кислоты (L-лактата), реакция катализируется лактатдегидрогеназой (см. рис. 6.92). Посредством L-лактата восстанавливается необходимая для гликолиза НАД+. Реакция вдет с выделением энергии (∆G0' = -25 кДж • моль-1) и в условиях клетки необратима.
Количество полученной в результате молочнокислого брожения АТФ такое же, как в спиртовом брожении. Выход энергии в стандартных условиях составляет 31 %, в клетке он, вероятно, все-таки намного выше.
В процессе смешанного молочнокислого брожения (гетероферментация) наряду с молочной кислотой в эквимолярных количествах образуются этанол и СO2. Они обнаружены, например, у определенных видов Lactobacillus.
Существует также еще несколько видов брожения, которые названы в соответствии со своими конечными продуктами, например, пропионовокислое, муравьинокислое, маслянокислое, янтарнокислое. Они протекают согласно механизмам, которые в своей основе сходны с механизмами спиртового и молочнокислого брожения. Хотя традиционное «уксуснокислое брожение» не называют брожением как таковым, поскольку оно протекает с потреблением кислорода:
С2Н5ОН + O2 —> СН3 СООН + Н2O;
∆G0' = -753 кДж • моль-1.
Эта реакция проводится видами Acetobacter, которые используются в приготовления винного уксуса.
В аэробных условиях энергия химических связей молекулы пирувата переводится в форму АТФ и используется клеткой. Необходимый для гликолиза НАД+ регенерирует из НАДН + Н+. У эукариот эти процессы протекают в митохондриях (см. 2.2.8), в которые пируват импортируется из цитоплазмы посредством транслокатора внутренней мембраны митохондрий в обмен на ионы гидроксила. Образованный в процессе гликолиза НАДН (в отличие от митохондрий животных) в митохондриях растений окисляется на их внутренней мембране (см. рис. 6.97). Внутренняя мембрана митохондрий, как и внутренняя мембрана хлоропластов, практически непроницаема для пиридиннуклеотидов.
Превращение пирувата при окислительном расщеплении в митохондриях протекает в 3 этапа:
1. Образование ацетилкоэнзима А из пирувата (см. 6.10.3.1).
2. Превращение ацетилкоэнзима А в цитратном цикле с образованием СO2 и восстановителей (цикл Кребса, см. 6.10.3.2).
3. Транспорт электронов в дыхательной цепи с вторичным окислением восстановителей и использованием энергии окислительно-восстановительных реакций для синтеза АТФ (см. 6.10.3.3).
6.10.3.1. Образование ацетилкоэнзима А из пирувата
Синтезированный в процессе гликолиза пируват в митохондриях сначала подвергается окислительному декарбоксилированию. Образованный в процессе реакции ацетат высвобождается в виде ацетилкоэнзима А (ацетил-КоА, рис. 6.93). Это окислительное превращение осуществляется в результате сложной последовательности биохимических реакций, в которых участвуют 3 различных фермента и 5 разных коэнзимов, образующие пируватдегидрогеназный комплекс (подробности см. в учебниках по биохимии). Реакция сильно экзергоничная (∆G0' = -33,5 кДж моль-1). Оба предоставляемых субстратом электрона идут на восстановление НАД+ до НАДН+ + Н+.
Рис. 6.93. Пируватдегидрогеназная реакция (А); структура коэнзима А (ацетилкоэнзим А) (В)
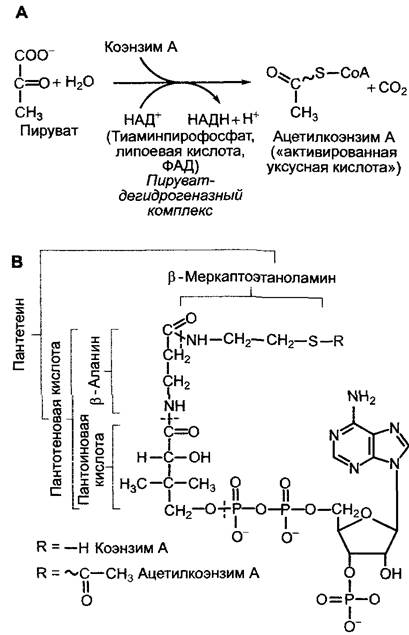
Ацетильный остаток в ацетил-КоА представляет собой «активированную уксусную кислоту», которая не только может подвергаться катаболической переработке в цитратном цикле (рис. 6.94), но и служит основным структурным элементом для многочисленных синтетических реакций. До ацетил-КоА расщепляются не только сахар, но и жирные кислоты, и различные аминокислоты, поэтому он играет ключевую роль в обмене веществ.
Рис. 6.94. Последовательность реакций пируватдегидрогеназы и цитратного цикла (цикл Кребса). В результате цитратного цикла связывается одно С2-соединение (ацетат) и освобождается 2 молекулы СО2, хотя это не те связанные С-атомы, которые высвобождаются в том же обороте цикла (см серую маркировку атомов)
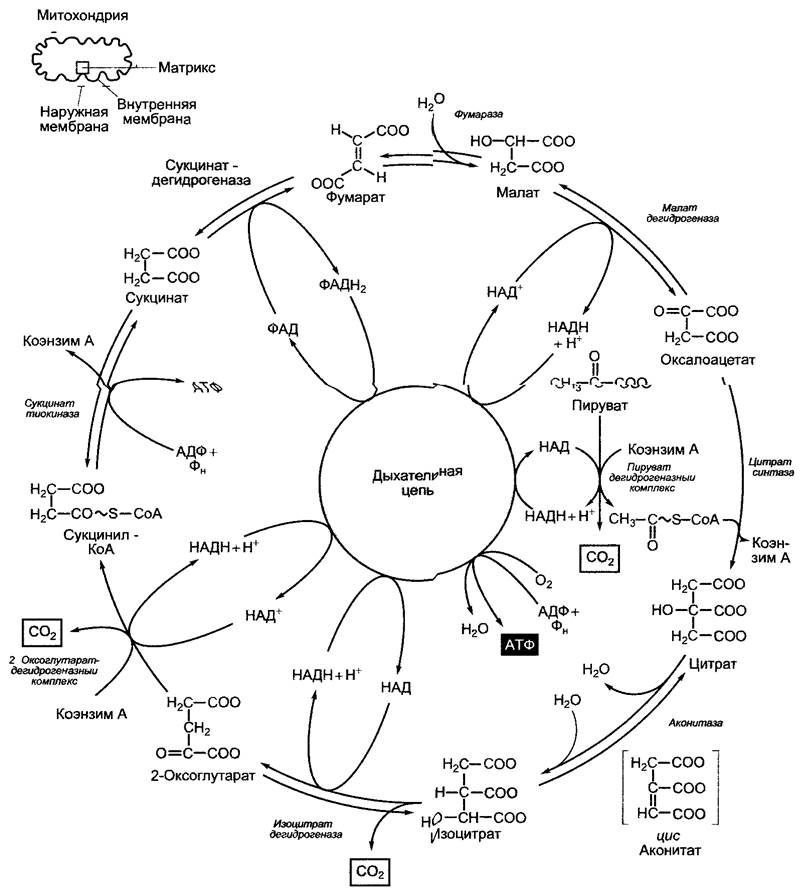
6.10.3.2. Цитратный цикл (цикл Кребса)
В нитратном цикле ацетильный остаток ацетил-КоА окисляется до двух молекул СO2; полученные при этом 8 электронов идут на восстановление 3 НАД+ до НАДН+ + Н+ и 1 ФАД до ФАДН2 (рис. 6.94).
Цитратный цикл называется иначе циклом Кребса — Мартиуса (в честь главных первооткрывателей), он не нуждается в кислороде. Как это обычно свойственно циклическим процессам, цитратный цикл завершается реакциями регенерации оксалоацетата — акцепторной молекулы ацетильной группы.
Обе реакции, в результате которых высвобождается СO2, являются реакциями окислительного декарбоксилирования, каждая из них ведет к переносу пары электронов на НАД+. Окислительное декарбоксилирование 2-оксоглутарата, катализируемое 2-оксоглутаратдегидрогеназным комплексом, протекает аналогично реакциям в пируватдегидрогеназном комплексе. Наряду с коэнзимом А и НАД+ в ней принимают участие в качестве других коэнзимов также тиаминпирофосфат, липоевая кислота и ФАД. Богатая энергией тиоэфирная связь продукта реакции сукцинил-КоА используется в синтезе АТФ (у млекопитающих — ГТФ) (тиокиназная реакция, субстратное фосфорилирование).
Две другие пары электронов высвобождаются в процессе окисления сукцината и малата. В то время как НАД+ служит акцептором электронов для малатдегидрогеназы, сукцинатдегидрогеназа использует в качестве акцептора электронов ковалентно связанный флавинадениндинуклеотид (ФАД, рис. 6.95).
6.10.3.3. Дыхательная цепь в митохондриях
Итак, 10 электронов, полученных при окислении пирувата до 3 молекул СО2, переносятся в ходе пируватдегидрогеназной реакции и нитратного цикла на четыре НАД+ и один ФАД. Восстановленные коэнзимы, четыре НАДН + Н+ и один ФАДН2, передают свои электроны дыхательной цепи, локализованной на внутренней мембране митохондрии, где они в конце концов переносятся на кислород с образованием Н2О. Энергия этого экзергоничного переноса используется для создания трансмембранного протонного градиента на внутренней мембране митохондрии. Полученная таким образом протон-движущая сила используется для синтеза АТФ (окислительное фосфорилирование, фосфорилирование в дыхательной цепи).
Существует определенное сходство между дыхательной цепью в митохондриях и электрон-транспортной цепью фотосинтеза. У цианобактерий обе цепи локализованы на одной мембране, и в качестве общего модуля используют цитохром- комплекс, а также пластохинон — в качестве донора и цитохром с — в каче-
стве акцептора электронов цитохром -b6/f комплекса. В качестве специфичных для дыхательной цепи комплексов выступают исключительно НАДН-дегидрогеназный комплекс и цитохром - а /а 3 - комплекс. Электроны переносятся от образованного в цитратном цикле НАДН через НАДН-дегидрогеназу, пластохинон, цитохром-b6/f- комплекс и цитохром с на цитохром-a/a3- комплекс, с которого они переходят на молекулярный кислород с образованием воды «Реликтовой» данная ситуация является в хлоропластах — в мембранах тила- коидов, где НАДН-дегидрогеназный комплекс составляет часть дыхательной цепи. Его функции неизвестны.
Рис. 6.95. Окислительно-восстановительные системы дыхательной цепи, которые служат в качестве переносчиков по схеме 2 электрона/ 2 иона водорода. ФАД является составной частью сукцинатде- гидрогеназы (ковалентно связанной), ФМН — составной частью НАДН-дегидрогеназы (комплекс I), а убихинон — переносчик электронов, диффундирующий между комплексами I и Ill (см. рис. 6.96). Убихинон, как и пластохинон (см. рис. 6.56), несет один прениловый остаток, который в большинстве случаев у микроорганизмов состоит из 6, а у высших растений — из 10 изопреновых единиц (см. 6.12.6). Липофильный прениловый остаток закрепляет молекулу в мембране митохондрий
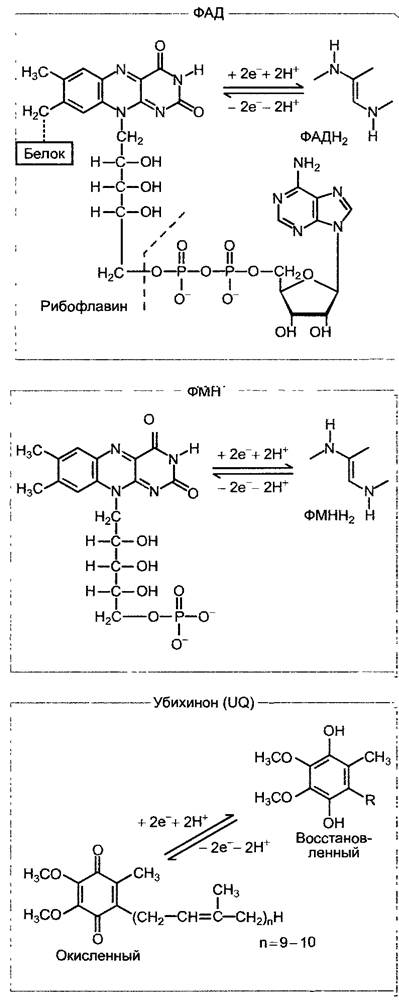
В дыхательной цепи митохондрий вместо компонентов, используемых цианобактериями наряду с фотосинтетической транспортной цепью электронов (вместо пластохинона, цитохром-b6/f-комплекса, цитохрома с), работает последовательность убихинон (= коэнзим Q) —> цитохром-b/с1- комплекс —> цитохром с; при этом пластохинон и убихинон (см. рис. 6.56; 6.95) эквивалентны в отношении функциональных групп, а цитохромный b/с1-комплекс по строению и функциям гомологичен цитохром - b6/f- комплексу (цитохром f относится к с-типу цитохромов, см. 6.4.6). Общая цепь транспорта электронов от НАДН-дегидрогеназы до цитохром-a/a3-комплекса (он называется еще цитохромоксидазой, или терминальной оксидазой) также образует на внутренней мембране митохондрий структурное единство с определенным молярным соотношением отдельных соединений и использует около 400 — 500 нм2 поверхности. В одной митохондрии могут располагаться до 20000 таких транспортных цепей электронов.
Структурно-функциональный принцип работы дыхательной цепи похож на таковой транспортной цепи электронов при фотосинтезе. Звенья дыхательной цепи являются оксидоредуктазами, чье последовательное расположение в дыхательной цепи — следствие их окислительно-восстановительного потенциала (табл. 6.22; рис. 6.96). От окислительно-восстановительной системы с отрицательным стандартным потенциалом (НАДН + Н+/НАД+, Е0′ = -0,32 В) электроны переходят на систему с положительным стандартным потенциалом (1/2О2/Н2О Е0'= +0,82 В); реакция соответственно сильно эндергоничная (∆G0' = -221 кДж • моль-1) и поэтому протекает самопроизвольно.
Таблица 6.22. Стандартные окислительно- восстановительные потенциалы окислительновосстановительной системы в дыхательной цепи1
Окислительно-восстановительная пара |
Е0' (В) |
НАД+ + 2Н+ + 2е-⇄ НАДН + Н+ |
-0,32 |
ФМН + 2Н+ + 2е-⇄ ФМНН2 |
-0,22 |
ФАД + 2Н+ + 2е- ⇄ ФАДН2 |
-0,22 |
UQ + 2Н+ + e- ⇄ UQH2 |
+0,03 |
Цитохром b (Fe3+) + е-⇄цитохром b (Fe2+) |
+0,05 |
UQH+ + Н+ + е-⇄ UQH2 |
+0,19 |
Цитохром С1(Fe3+) ⇄ цитохром c1(Fe2+) |
+0,23 |
Цитохром с (Fe3+) ⇄ цитохром с (Fe2+) |
+0,24 |
Цитохром а (Fe3+) ⇄ цитохром a (Fe2+) |
+0,28 |
Цитохром а3 (Fe3+) ⇄ цитохром а3(Fe2+) |
+0,35 |
O2 + 4Н+ + 4е- ⇄ 2Н2O |
+0,82 |
1 Приведенный в таблице список компонентов дыхательной цепи не полный. В ЗТЦ дыхания входят также FеS-центр Риске и низкопотенциальная форма цитохрома b. — Примеч. ред.
Расположение компонентов дыхательной цепи на внутренней мембране митохондрий схематически показано на рис. 6.96. В состав трех трансмембранных комплексов, НАДН-дегидрогеназы (комплекса I), цитохром-b/с1-комплекса (комплекса III) и цитохром-a/a3-комплекса (комплекса IV) входят многочисленные полипептиды и связанные с ними окислительно-восстановительные системы: флавины, железосерные центры и цитохромы, принципиальное строение которых уже известно по фотосинтезу (см. рис. 6.95). Нумерация комплексов основана на традиционной номенклатуре выделенных комплексов, чье строение ранее еще не было известно, и представляет собой принятую тогда терминологию. Особенностью комплекса IV являются медно-серный центр и медно-цитохромный-a3-центр. Последний связывает молекулярный кислород (O2) и, вероятно, переносит на него последовательно 4 электрона с образованием 2 молекул воды. Вместо кислорода медно-цитохром- ный-a3-центр может также связывать монооксид углерода (СО), азид (N-3) или цианид (CN-), и так прочно, что эти вещества действуют как ингибиторы дыхания и поэтому высокотоксичны.
В качестве окислительно-восстановительных переносчиков электронов между трансмембранными комплексами работают растворимые компоненты, а именно локализованные во внутренней мембране митохондрий между комплексами I и III молекулы убихинона (UQ, англ. ubiquinone). Как пластохинон в световой реакции, уби- хинон является переносчиком двух электронов и двух ионов водорода. Цитохром с, растворимый переносчик одного электрона, диффундирует в межмембранном пространстве между комплексами III и IV, завершая, таким образом, электрон-транспортную цепь.
Многие детали, особенно связанная с транспортом электронов транслокация ионов водорода из матрикса в межмембранное пространство, которая происходит в трех трансмембранных комплексах, еще не совсем понятны. Представленные на рис. 6.96 стехиометрические величины — это фактическое состояние процесса, однако точных данных в этой области нет. На основании вполне вероятного Q-цикла в цитохром-b/c1-комплексе (см. соответствующую реакцию в цитохром-b6/f-комплексе; см. рис. 6.60) считают, что на каждую НАДН + Н+, следовательно, на каждые 2 перенесенных на кислород электрона, транспортируются 10 ионов водорода, 4 посредством НАДН-дегидрогеназного комплекса, 4 с помощью цитохром-b/c1-комплекса и 2 с помощью цитохромного а/а3 комплекса.
Рис. 6.96. Схема митохондриальной дыхательной цепи, синтеза и экспорта АТФ. АТФ-синтаза состоит из трансмембранного F0-стержня (ингибируется олигомицином) и фактора 1 (F1-головки), в котором происходит синтез АТФ. Строение и механизм действия митохондриальной Fо/F1-АТФ-синтазы почти целиком соответствуют таковым СFо/СF1-АТФ-синтазы хлоропластов (см. рис. 6.63). Цит. — цитохром; ∆ЕМ — мембранный потенциал; F0 —олигомицинчувствительный фактор; (FеS)n — несколько железо-серных центров; Q — Q — цикл (см. рис. 6.60); UQ — убихинон; UQН2 — убигидрохинон
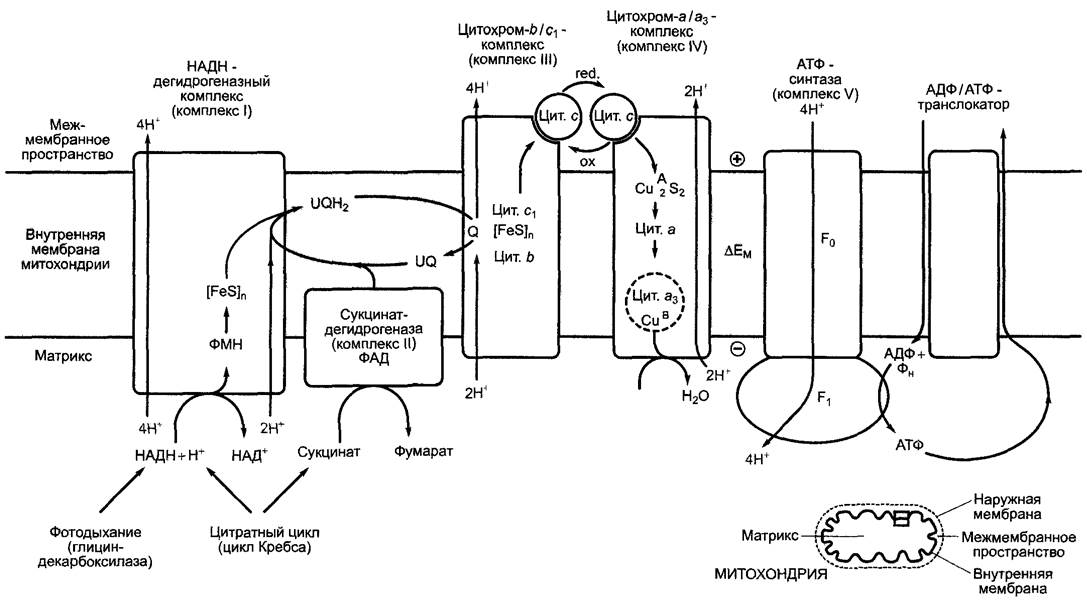
Фермент нитратного цикла сукцинат- дегидрогеназа представляет собой периферический мембранный белок и локализуется на внутренней мембране митохондрии со стороны матрикса. Он переносит 2 полученных от сукцината электрона непосредственно на убихинон, здесь в качестве коэнзима задействован ФАД. Сукцинат- дегидрогеназу называют также комплексом II дыхательной цепи. Вследствие того, что комплекс I не участвует в этой реакции, с каждой парой электронов в процессе окисления сукцината через внутреннюю мембрану митохондрии переносится только 6 ионов водорода. Обсуждается возможность того, что не только сукцинатдегидрогена- за, но и другие ферменты цитратного цикла могут находиться в интактной органелле в связанном состоянии с внутренней мембраной митохондрии и образовывать друг с другом функциональное единство («метаболой»), которое, вероятно, делает возможным передачу субстрата (англ, metabolite channeling) от одних компонентов другим. При выделении органеллы, это взаимодействие нарушается, поэтому после центрифугирования гомогената для выделения сукцинатдегидрогеназы все ферменты цитратного цикла остаются в растворенном состоянии в качестве отдельных компонентов, в то время как сукцинатдегидрогеназа обнаруживается в осадке вместе с митохондриальной мембраной. Вполне можно допустить, что в живых клетках намного больше метаболических путей организованы в «метаболоны».
Митохондриальный синтез АТФ осуществляется и локализованной во внутренней мембране митохондрии АТФ-синтазой, которая по строению и функциям очень напоминает СF0/СF1АТФ-синтазу хлоропластов (см. рис. 6.63). Движущей силой синтеза АТФ из АДФ + Фн является сила движения протонов (см. уравнение
6.19). Протон-движущую силу можно рассматривать как результат взаимодействия градиента концентраций ионов H+, возникающего при работе электрон-транспортной цепи, и электрического потенциала, возникающего из-за затрудненного транспорта анионов через мембрану. В итоге со стороны матрикса митохондрий (или стромы хлоропластов) уменьшается концентрация Н+ и возникает отрицательный заряд, а со стороны межмембранного пространства (или внутритилакоидного пространства хлоропластов) накапливаются высокая концентрация Н+ и положительный заряд. Вклад концентрационного градиента и разности электрических потенциалов в протон-движущую силу на мембране хлоропластов и митохондрий неодинаков. Так, движение зарядов через мембрану тилакоидов приводит к тому, что по обеим сторонам мембраны возникает огромная разность концентраций ионов водорода, однако возникновения значительного электрического потенциала при этом не наблюдается. Итак, синтез АТФ в хлоропластах «запускается» концентрационным градиентом ионов водорода. Таким образом, это основной вклад в создание движущей силы протонов в хлоропластах. Блокирование в митохондриях возникновения градиента протонов быстро приводит к появлению электрической разности потенциалов на внутренней мембране митохондрии (∆ЕМ = -200 мВ, отрицательный заряд со стороны матрикса), в то время как разность концентраций ионов водорода остается маленькой (значение pH в межмембранном пространстве только на 0,2 единицы, чем в матриксе). Итак, синтез АТФ в митохондриях «запускается» в основном благодаря вкладу электрического потенциала в протон-движущую силу (см. уравнение 6.19).
В отличие от хлоропластов, которые отдают синтезированную на свету АТФ на собственные нужды1 (в основном, на фиксацию СO2), митохондрии экспортируют АТФ в цитоплазму. За это отвечает расположенный во внутренней мембране транслокатор, который транспортирует АТФ в цитоплазму в порядке строгого обмена на АДФ (АДФ/АТФ-транслокатор).Используемый в стехиометрических количествах неорганический фосфат поставляется через фосфат/ОН-антипортер. Наружная мембрана митохондрии, как и пластидная, характеризуется наличием поринов, трансмембранных белков, образующих относительно большие поры, сквозь которые беспрепятственно могут диффундировать низкомолекулярные соединения и даже небольшие молекулы белков (предельная граница размеров около 10 кДа). Следовательно, наружная мембрана оболочки этой органеллы не является барьером для обмена метаболитами.
1 Несмотря на отсутствие прямого транспорта АТФ из хлоропластов в цитоплазму существуют механизмы челночного переноса энергии с образованием АТФ в цитоплазме. — Примеч. ред.
Рис. 6.97. Альтернативный путь окисления убигидрохинона (UQН2) альтернативной оксидазой. Этот путь используется в основном в случае сильного повышения концентрации НАДН + Н+ в цитоплазме или матриксе митохондрий. Энергия выделяется в виде тепла. АТФ не синтезируется. В данной ситуации в цитохром-b/ c1-комплексе, возможно, окисляется только небольшая часть убигидрохинона (пунктирная стрелка)
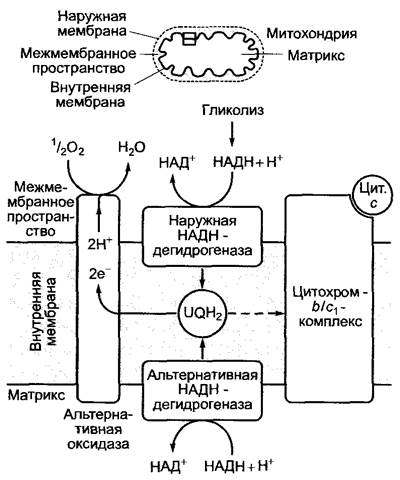
Митохондриальная дыхательная цепь растений иная, чем у животных (рис. 6.97). Так, в отличие от животной НАДН + Н+, полученный в растительном гликолизе, окисляется на наружной стороне внутренней мембраны митохондрии под воздействием наружной НАДН-дегидрогеназы. Оба электрона переносятся непосредственно на убихинон, минуя комплекс I. Эта реакция имеет значение в том случае, когда цитоплазматическая концентрация НАДН очень высока, т. е. она менее важна для синтеза АТФ, но предоставляет окисленный НАД+ для метаболических реакций в цитоплазме. Похожую функцию, вероятно, выполняет расположенная на внутренней мембране митохондрии со стороны матрикса альтернативная НАДН-дегидрогеназа; она окисляет НАДН + Н+ и переносит электроны на убихинон, при этом не происходит транспорт ионов водорода. В этой ситуации (повышенное содержание НАДН и, как следствие, очень большое значение отношения НАДН/НАД) окисляется убигидрохинон (UQH2) под действием альтернативной оксидазы,которая переносит электроны и Н+-ионы от UQH2 на кислород с образованием воды. Энергия высвобождается в виде тепла, АТФ не синтезируется. Сначала фермент активируется высокой концентрацией пирувата в матриксе (признак недостатка, окисленного НАД+, см. рис. 6.9). Альтернативная оксидаза не ингибируется цианидом, азидом или СО (ингибитором является, например, салицилгидроксамовая кислота). Это цианидустойчивое дыхание переводит энергию НАДН + Н+ в тепло без образования АТФ. У Arum, maculatum и ароидных термогенез (образование тепла) при участии альтернативной оксидазы способствует лучшему улетучиванию веществ, привлекающих опылителей, у Symplocarpus foetidus термогенез предохраняет цветы от холода, в плодах во время созревания он способствует более быстрому расщеплению органических кислот и углеводов (респи- рационный климактерий, см. 7.6.5.2).
Выход энергии при окислении глюкозы в процессе дыхания:
С6Н12О6 + 6 O2 + 6 Н2O —> 6 СO2 + 12 Н2O (∆G0' = -2 877 кДж • моль4).
Энергия, запасенная в форме АТФ, составляет 31,8% от изменения свободной молярной стандартной энтальпии реакции окисления глюкозы при pH 7 (G0'). Доля запасенной энергии определяется следующим образом.
Гликолиз:
✵ чистый выход (субстратное фосфорилирование) —> 2 АТФ;
✵ окисление 2 НАДН + H+ наружной НАДН-дегидрогеназой —> 12Н+ —> 3 АТФ1;
1 Выход АТФ здесь завышен, поскольку наружная НАДН-дегидрогеназа не дает вклада в протонный градиент, при ее работе запасается 2, а не 3 молекулы АТФ. — Примеч. ред.
✵ 2 молекулы пирувата на дыхание.
Дыхание:
✵ окисление 2 молекул пирувата до СO2 в нитратном цикле (цикл Кребса) дает
8 НАДН + Н+ —> 80 Н+ —> 20 АТФ,
2 ФАДН2 —> 12 Н+ —> 3 АТФ и в результате сукцинаттиокиназной реакции (окислительное субстратное фосфорилирование) —> 2 АТФ.
В целом в благоприятных условиях, когда все без исключения ионы водорода полностью задействованы в синтезе АТФ (что собственно невозможно в условиях живой клетки, так как Н+-ионы диффундируют сквозь наружную мембрану в цитоплазму)2, синтезируется до 30 молекул АТФ на одну молекулу глюкозы, что соответствует 30 • ∆G0′ (АДФ + Фн/АТФ, ∆G0′ = +30,5 кДж • моль-1), итого 915 кДж • моль-1 сохраненной в форме АТФ свободной энтальпии, что и составляет 31,8% от 2 877 кДж • моль-1 глюкозы высвободившейся свободной энтальпии (разница теряется в виде тепла). Если принять во внимание реальные условия внутри клетки, которые не соответствуют стандартным, выход энергии, вероятно, составит более высокое значение (∆G0 для синтеза АТФ в клетке, предположительно, составляет около 50 кДж моль-1).
2 Кроме того, работают альтернативные дегидрогеназы и цианидустойчивое дыхание, что снижает выход АТФ. — Примеч. ред.
Некоторые метанобразующие архебактерии способны из бедного энергией субстрата, СO2, синтезировать посредством слабоэкзергонической восстановительной реакции метан:
СO2 + 4O2 —> 2 Н2O + СН4.
В превращении участвуют 7 ферментов и 3 коэнзима, среди них коэнзим F430 с тетрапиррольной системой, содержащей никель, и коэнзим М (НS-СН2-СН2-SO3), чья тиоловая группа принимает метальный остаток (метил-КоМ) и под воздействием коэнзима F430 выделяется в виде метана (СН4, метил-КоА-редуктазная реакция). Возникший в процессе реакции преобразования градиент ионов водорода используется в синтезе АТФ. Из одной молекулы СO2 при этом получается менее одной молекулы АТФ, которой тем не менее достаточно для обеспечения бактериям выживания на местах с бедным энергией субстратом.
6.10.3.4. Связь цикла Кребса с другими метаболическими путями
В цикле Кребса ацетат окисляется до СO2 и происходит перенос электронов на НАД+ или ФАД. Кроме того, нитратный цикл (цикл Кребса) поставляет промежуточные продукты для биосинтеза других метаболитов. Отток этих метаболитов, вероятно, быстро приведет к остановке цикла, если пополняющие реакции (анаплеротические реакции) не компенсируют эти потери. Наконец, цитратный цикл связывает синтезирующие (анаболические) и расщепляющие (катаболические) пути обмена веществ, он амфиболичен.
Некоторые важные взаимодействия нитратного цикла с другими метаболическими путями представлены на рис. 6.98.
Рис. 6.98. Некоторые основные связи цитратного цикла (цикла Кребса) с другими метаболическими путями: (1) — фосфоенолпируваткарбоксилаза; (2) — малатдегидрогеназа; (3) — НАД-маликэнзим; (4) — глутаматдегидрогеназа; (5) — ФЕП-карбоксикиназа; (6) — глутаматсинтаза; (7) — глутаминсинтетаза
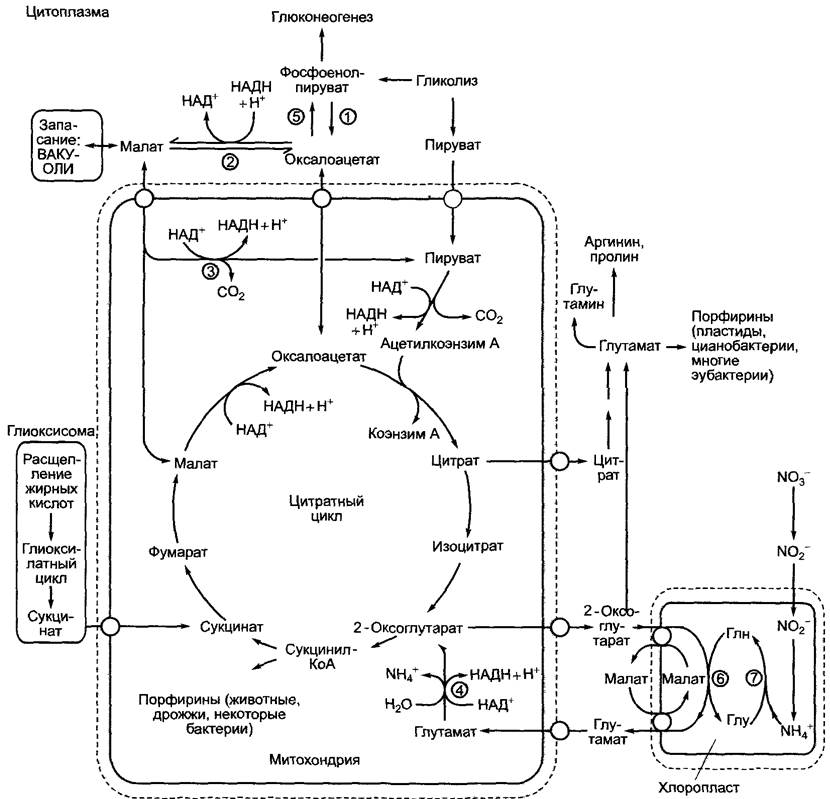
Наряду с пластидным синтезом глутамата (см. 6.6, 6.13) существует еще цитоплазматический синтез этой аминокислоты. Углерод частично поставляется от 2-оксоглутарата нитратного цикла, преобладающая же его часть — от цитрата, который превращается в 2-оксоглутарат под действием цитоплазматического изофермента аконитазы и НАД-изоцитратдегидрогеназы. Глутамат является предшественником глутамина, аргинина и пролина (см. 6.13.1), а также в отличие от животного глутамата служит отправной точкой для биосинтеза тетрапиррола (у растений пластидного — см. 6.15). Для пополнения цикла Кребса углеродными соединениями митохондрии импортируют оксалоацетат, который возникает в результате цитоплазматической фосфоенолпируваткарбоксилазной реакции или из малата (малатдегидрогеназа). В добавление к этому митохондрии снабжены малаттранслокатором и поглощают малат из цитоплазмы. Этот малат может служить для повышения его уровня в цит-
ратном цикле либо превращаться в пиру- ват с образованием НАДН в результате реакции декарбоксилирования, катализируемой находящимся в матриксе малик- энзимом. Эти реакции (рис. 6.98) представляют собой механизм распределения восстановительных эквивалентов (НАДН + Н+) между цитоплазмой и митохондриями. Третьим важным субстратом митохондриального дыхания наряду с пируватом и манатом является глутамат. Он представляет собой главный продукт ассимиляции нитратов в хлоропластах и имеется в достаточном количестве в фотосинтезирующих клетках. Часть глутамата после импорта в митохондрии разлагается ферментом глутаматдегидрогеназой до 2-оксоглутарата (который отправляется в нитратный цикл) и NH+4, при этом образуется НАДН + Н+ (см. рис. 6.98).
Цитратный цикл играет важную роль в преобразовании жиров в углеводы. Это происходит при прорастании запасающих жиры семян (см. 6.12), а также в процессах старения (например, при осеннем старении листьев), когда нерастворимые в воде мембранные липиды (особенно в процессе старения хлоропластов) преобразуются в транспортные углеводы, которые накапливаются в запасающих тканях. В этой последовательности биохимических реакций, которая далее рассматривается более подробно, жирные кислоты расщепляются до ацетата с последующим синтезом сукцината. Эти реакции протекают в глиоксисомах (см. 6.12). Сукцинат диффундирует в митохондрии и преобразуется в цитратном цикле в оксалоацетат. Последний при помощи транслокатора транспортируется в цитоплазму и превращается в фосфоенолпируват под действием фосфоенолпируват- карбоксилазы (эта реакция была представлена в разделе 6.5.8, рис. 6.79). Начинаясь с фосфоенолпирувата, обратимые реакции гликолиза (см. рис. 6.92) протекают вплоть до образования фруктозо-1,6-бисфосфата (глюконеогенез). В необратимой фруктозо-
1,6-бисфосфатфосфатазной реакции он преобразуется во фруктозо-6-фосфат (∆G0' = -17 кДж • моль-1). Начиная с появления данного метаболита становится возможным синтез структурных и запасных углеводов (см. 6.17.1), а также других содержащих сахар соединений (гликолипидов, гликопротеинов). В равновесии с фруктозо-6-фосфатом находится глюкозо-6- фосфат (гексозоизомеразная реакция — см. рис. 6.72), исходный метаболит для окислительного пентозофосфатного пути (см.
6.10.3.5), который наряду с пентозофосфатами предоставляет также НАДФН + Н+ для других метаболических путей в цитоплазме.
Различные дыхательные субстраты для полного превращения в СO2 нуждаются (в зависимости от их молекулярного строения) в разных количествах кислорода. Объемное отношение производимого СO2 к потребленному O2 называется дыхательным коэффициентом (ДК = \/СO2: VO2).
Так как по закону Авогадро один моль занимает объем 22,4 л при нормальных условиях, значение ДК при растеплении однородного субстрата легко высчитать теоретически; с другой стороны, выводы касательно дыхательного субстрата, основанные на значении ДК, должны делаться с определенной осторожностью. Согласно общему уравнению глюкозного дыхания (см. 6.10.3.3), значение ДК при использовании углеводов равно 1. При расщеплении богатых водородом молекул, таких, как жиры и белки, ДК меньше 1 (у жиров около 0,7; у белков около 0,8):
Дыхание с использованием пальмитиновой кислоты;
С16Н32O2 + 23 O2 —> 16 СO2 + 16 Н2O,
ДК = 16/23 = 0,7.
Проростки, использующие для дыхания жиры, имеют соответственно ДК = 0,7. Когда жиры преобразуются в углеводы, например, в определенную фазу прорастания запасающих жиры семян или весной в запасающих жиры стволах деревьев, ДК меньше 1, так как используется много кислорода и производится мало СO2. И наоборот, для реакций преобразования углеводов в жиры характерен ДК больше 1 (например, у гуся во время откорма ДК = 1,38).
6.10.3.5. Окислительный пентозофосфатный путь
Окислительный пентозофосфатный путь осуществляется в цитоплазме и хлоропластах. При этом в хлоропластах протекает ряд реакций, обратных реакциям цикла Кальвина, поэтому цикл Кальвина иногда называют восстановительным пентозофосфатным циклом (см. 6.5.3). Окислительный пентозофосфатный путь тоже можно назвать циклом. Одна молекула глюкозы при шестикратном обращении в этом цикле расщепляется до 6 молекул СO2. Как правило, однако, целью этой последовательности биохимических превращений является не расщепление глюкозы, а получение НАДФН + Н+ для анаболических реакций (в хлоропласты, например, для синтеза жиров в темноте, см. 6.11.1), а также синтез специфических сахарофосфатов для других синтетических путей (например, ри- бозо-5-фосфата для синтеза нуклеиновых кислот). На пентозофосфатном пути в равновесных концентрациях находятся С3-, С4-, С5-, С6- и С7-сахара, как это видно на рис. 6.99.
Рис. 6.99. Окислительный пентозофосфатный путь. Структурные формулы, которые здесь не даны, можно увидеть на рис. 6.70. Серым цветом выделены три реакции, которые характерны для окислительного пентозофосфатного пути в хлоропластах, все остальные реакции представляют собой обратимые реакции, или реакции цикла Кальвина (восстановительный пентозофосфатный цикл): (1) — рибулозофосфатизомераза; (2) — рибулозофос- фатэпимераза; (3) — транскетолаза; (4) — триозофосфатизомераза; (5) — альдолаза; (6) —фруктозо-1,6-бисфосфатфосфатаза; (7) — гексозофосфатизомераза
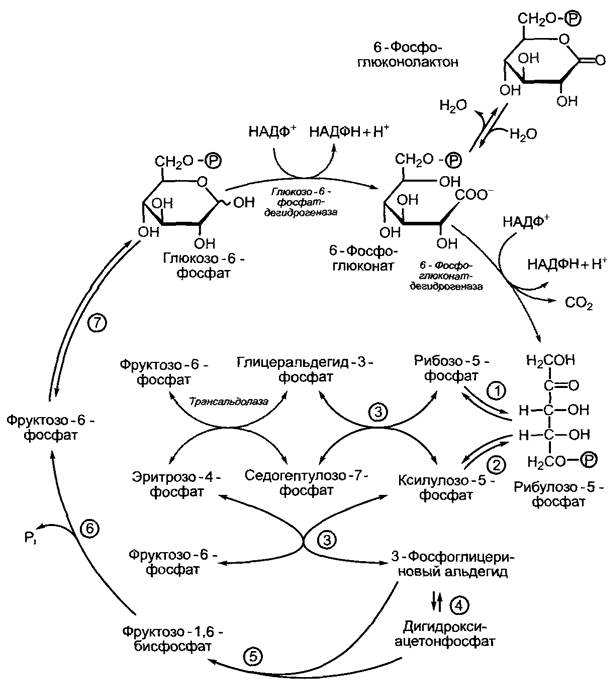
Характерными ферментами окислительного пентозофосфатного пути, отсутствующими в восстановительном пентозофосфатном цикле, являются глюкозо-6-фос- фатдегидрогеназа, 6-фосфоглкжонатдегид- рогеназа, которые катализируют необратимые реакции, и трансальдолаза, которая переносит трехуглеродный скелет (от С1 до С3-атома гептозы) с седогептулозо-7-фосфата на глицеринальдегид-3-фосфат с образованием фруктозо-6-фосфата. Второй продукт реакции — эритрозо-4-фосфат.
Окислительный и восстановительный пентозофосфатные пути в хлоропластах не пересекаются во времени (очень существенный момент!). Это осуществляется, во-первых, благодаря активации светом некоторых ключевых ферментов цикла Кальвина (см. 6.5.5), а во-вторых, вследствие того, что глюкозо-6-фосфатдегидрогеназа инактивируется на свету и активируется в темноте. Фруктозо-1,6-бисфосфат- фосфатаза также активна на свету, поэтому циклическое течение окислительного
пентозофосфатного цикла в хлоропластах невозможно (см. рис. 6.99). Обратимость транскетолазных и трансальдолазных реакций позволяет на свету обеспечить синтез нуклеиновых кислот рибозо-5-фосфатом без образования НАДФН + Н+.
6.10.3.6. Зависимость дыхания от внешних факторов
Интенсивность дыхания в значительной степени зависит от вида растения, а внутри вида — от органа, фазы развития и физиологического статуса растения (табл. 6.23). На интенсивность дыхания влияют также внешние факторы. В качестве важнейшего внешнего фактора выступает температура. Как ферментативный процесс, зависимость интенсивности дыхания от температуры имеет вид кривой с оптимумом (рис. 6.100). Положение характерных значений на этой кривой (минимум, оптимум, максимум) зависит от вида растения, а внутри вида — от условий существования каждого растения (закалки, изнеженности). Граница минимальной температуры, при которой еще можно зарегистрировать дыхание, проходит в большинстве случаев в районе -10 °С. Морозоустойчивые ткани (например, адаптированные к холоду иглы хвойных) дышат при температуре ниже -20 °С, в то время как дыхание чувствительных к холоду тропических растений может почти прекратиться уже при 0 и 5 °С.
Рис. 6.100. График зависимости дыхания и фотосинтеза от температуры. Температурный оптимум![]() и максимум
и максимум![]() дыхания, как правило, выше оптимума и максимума общего фотосинтеза (серым цветом показана чистая продуктивность фотосинтеза). Температурные минимумы для фотосинтеза и дыхания фактически совпадают
дыхания, как правило, выше оптимума и максимума общего фотосинтеза (серым цветом показана чистая продуктивность фотосинтеза). Температурные минимумы для фотосинтеза и дыхания фактически совпадают
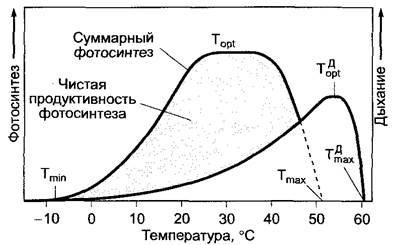
На поднимающейся части температурной кривой (например, между 15 и 25 °С) значение Q10(уравнение 6.48, см. 6.5.11,3) составляет в основном около 2.
Верхняя граница температуры для дыхания обычно выше, чем для фотосинтеза. Синтез АТФ, естественно, отстает от интенсивного дыхания при высоких температурах. Возможно, в такой ситуации прекращается транспорт электронов и окислительное фосфорилирование либо усиливается процесс цианидустойчивого дыхания (см. 6.10.3.3).
Таблица 6.23. Темновое дыхание взрослых листьев летом при 20°С относительно массы сухого вещества (mcуx.в-ва)
Группа растений |
Выделение СO2, мг • г-1• mсух.в-ва • ч-1 |
Группа растений |
Выделение СО2, мг • г' • mсух.в-ва • ч-1 |
Травянистые культурные растения |
3-8 |
Вечнозеленые лиственные |
|
деревья: |
|||
Травянистые дикорастущие растения: |
световые листья |
- 0,7 |
|
светолюбивые травы |
5-8 |
теневые листья |
- 0,3 |
теневыносливые травы |
2-5 |
Вечнозеленые хвойные деревья: |
|
Зеленые лиственные деревья: |
|||
световые листья |
3-4 |
адаптированная к свету хвоя |
-1 |
теневые листья |
1-2 |
теневая хвоя |
-0,2 |
Имеется ряд доказательств того, что адаптация растений к изменяющимся температурным условиям происходит за счет повышения концентраций, соответствующих этим условиям изоферментов, т. е. клетка обладает набором ферментов, приспособленных к различным температурным режимам.
Количество вырабатываемого растениями в процессе дыхания тепла обычно можно измерить только в особых экспериментальных условиях (например, у прорастающих семян в термососуде). Так как гомойотермных растений (т.е. растений, удерживающих температуру на определенном постоянном уровне) не существует, они не имеют специальных приспособлений для терморегуляции. Только в исключительных случаях можно наблюдать нагревание отдельных частей растения при дыхании (початок Агиm italicum на +17 °С, цветки Victoria regia на +10 °С, цветки Cucurbita на +5 °С выше температуры окружающей среды). Биологическое значение образования тепла у соцветий аройника заключается в привлечении опылителей. При очень быстром расщеплении ранее запасенного в початке крахмала, которое запускается окислительным фосфорилированием, вырабатывается тепло, способствующее усиленному распространению пахучих веществ. В качестве регулятора («калоригена») в початке Araceae Sauromatum guttatum выступает салициловая кислота. (В початках Агиm содержится 1 — 6 мкг • г-1 сырого веса салициловой кислоты, в производящих тепло мужских початках Dioon eduie — 100 мкг-г1.) Восприимчивость початка к салициловой кислоте повышается по мере его созревания и контролируется фотопериодически (см. 7.7.2.2). Внутри влажных растительных остатков, которые хранятся в уплотненном состоянии (например, в копне сена), в результате дыхательной деятельности определенных термофильных бактерий и грибов температура может подняться выше 70 °С; задействованные таким образом экзотермические преобразования могут привести к самовозгоранию. Температура листьев растений, пораженных грибом- возбудителем корневой гнили, в среднем на 3 — 5 °С выше температуры листьев здоровых растений. Это может быть использовано для дистанционной диагностики (англ, «remote sensing») больных растений.
Значительное влияние на интенсивность дыхания оказывает водоснабжение растения. У растений, живущих под водой или на переувлажненных почвах, дыхание ограничивается недостатком кислорода из- за его небольшой растворимости в воде (1 л морской воды при аэрации содержит только 7,8 мг кислорода; при фотосинтезе у водных растений появляются пузырьки кислорода). Недостаток кислорода в среде может быть компенсирован, например, доставкой кислорода по системе межклетников от тех частей растения (см. 3.2.1, рис. 3.7; т. 1), которые находятся в атмосфере и к тому же интенсивно высвобождают кислород в процессе фотосинтеза (многие болотные растения). Для снабжения растения O2 могут развиваться некоторые специальные органы (воздушные корни, дыхательные корни, см, бокс 4.5). Сильно развитая система межклетников у водных и болотных растений (см. рис. 3.8; т. 1), во-первых, облегчает доставку кислорода, а во-вторых, запасает фотосинтетический кислород, используемый в дыхании.
По межклетникам корневищ, через черешки листьев и их поверхность и, наконец, через устьица в атмосферу может выделяться метан из ила водоемов (например, у Nuphar luteum). В целом система межклетников несомненно облегчает транспорт газов. Около 25 % глобальной эмиссии метана в тропосферу обусловлено наличием рисовых полей (3 — 5 • 1014 г метана в год). Меристема с повышенной метаболической активностью и еще пока слабо развитая система межклетников должны отчасти приводить к реакциям брожения, продукты которых могут играть роль в закладке и дальнейшем развитии системы межклетников.
Некоторые части ряда растений (прежде всего, корневища) могут длительное время существовать без кислорода (аноксия). Например, корневища Schoenoplectus lacustris живут без кислорода более 90 дней, к тому же в это время у них развиваются новые отростки. Потребность в энергии при этом покрывается за счет реакций брожения. В конце периода аноксии органам может грозить опасность в том случае, когда при поступлении новых порций кислорода возникают кислородные радикалы. С ними можно бороться при помощи антиоксидантов, например, аскорбиновой кислоты или глютатиона.
При засухе значение водного потенциала ниже критического уровня резко сокращает дыхание. Пойкилогидрические виды (см. 13.5.2) или стадии развития (например, семена и споры), которым снижение дыхания не причиняет вреда, дышат в воздушно-сухом состоянии (содержание воды около 10 % сырого веса) крайне слабо и используют при этом минимальное количество веществ. Это является предпосылкой для пережидания периода покоя у семян, спор, пыльцы и целых сухих растений (например, лишайников, некоторых водорослей, мхов, папоротников).
Высокие концентрации диоксида углерода также ограничивают процесс дыхания. С одной стороны, они обнаруживаются в одревесневших частях стволов, с другой — в семенах со слабо проницаемой для СO2 семенной кожурой.
Свет сказывается на дыхании по-разному. Как это видно по фотодыханию (см. 6.5.6), которое не является настоящим дыханием, предварительное освещение фотосинтетически активных растений активирует дыхание в последующей темновой фазе в результате усиленного синтеза субстратов дыхания. Допустима, но не совсем понятна конкуренция дыхания и фотосинтеза за различные коэнзимы. Так, митохондриальное дыхание фотосинтезирующих клеток подавляется на свету (эффект Кока). Далее на дыхание специфическое активирующее действие оказывает коротковолновая (синяя) часть спектра. Наконец, свет может изменять интенсивность дыхания посредством фитохромной системы (см. 7.7.2.4), т.е. при помощи влияния на развитие растения.