БОТАНИКА ТОМ 2 - ФИЗИОЛОГИЯ РАСТЕНИЙ - 2007
6. ФИЗИОЛОГИЯ ОБМЕНА ВЕЩЕСТВ
6.17. Основные типичные для растений полимеры
Наряду с низкомолекулярными первичными и вторичными метаболитами растения синтезируют полимерные органические соединения. Некоторые из них встречаются во всех живых клетках и поэтому не являются типичными для растений, другие же отсутствуют в организме животных (либо очень редко встречаются в виде исключения). Основными типичными для растений полимерами являются структурные и запасные полисахариды, лигнин, кутин и суберин, а также несколько классов запасных белков. Типичным для растений полимерам, поскольку они имеют значение для растения в целом (основные полимеры), посвящены следующие разделы.
Основные структуры углеводов представлены в разделе 1.4 (см. рис. 1.18—1.20). Полимерные гликаны (полисахариды) служат структурными либо запасными веществами.
6.17.1.1. Структурные полисахариды
Растительные клеточные стенки (первичные и вторичные) содержат ряд структурных полисахаридов (также структурных белков). Их количество все время меняется (см. 1.4.3, рис. 2.64). Во вторичных клеточных стенках доминирует целлюлоза (до 90 % органического вещества), в первичных клеточных стенках она придает им прочность, однако здесь ее мало (5 —10 %). Целлюлоза является составной частью клеточных стенок оомицетов. Она обнаружена в покровах оболочников (эти животные синтезируют ее самостоятельно). Некоторые бактерии также могут вырабатывать целлюлозу.
Молекулы целлюлозы состоят из многочисленных (более 15 000) линейных β-D-глюкопиранозных единиц, соединенных между собой (β1—>4)-гликозидной связью. Данные единицы в результате образования внутримолекулярных водородных связей объединяются в псевдокристаллические агрегаты, элементарные фибриллы и микрофибриллы (рис. 2.65; 2.68). Биосинтез целлюлозы происходит направленно при участии целлюлозосинтазы, интегрального мембранного белка плазмалеммы. При этом происходит олигомеризация нескольких синтаз в единый розеточный комплекс (см. рис. 2.67, А) и каждая может перенести глюкозные единицы, которые поставляются из цитоплазмы УДФ-глюкозой (рис. 6.130), на молекулу целлюлозы, удлиняя, таким образом, цепь. Эта молекула целлюлозы выносится синтазой на апопластическую сторону мембраны. Предполагают, что каждый мономер целлюлозосинтазы в розеточном комплексе синтезирует одну молекулу целлюлозы, т.е. один розеточный комплекс параллельно образует несколько молекул целлюлозы, которые связываются в фибриллы. Функционирующие целлюлозосинтазные комплексы должны «скользить» вдоль микротрубочек кортикального цитоскелета по цитоплазматической стороне. Таким образом, вероятно, расположение кортикальных микротрубочек определяет (и контролирует) направление целлюлозных фибрилл в клеточной стенке. Намного меньше известно о биосинтезе остальных полисахаридов клеточной стенки (гемицеллюлозы, пектина, см. 22.1.2).
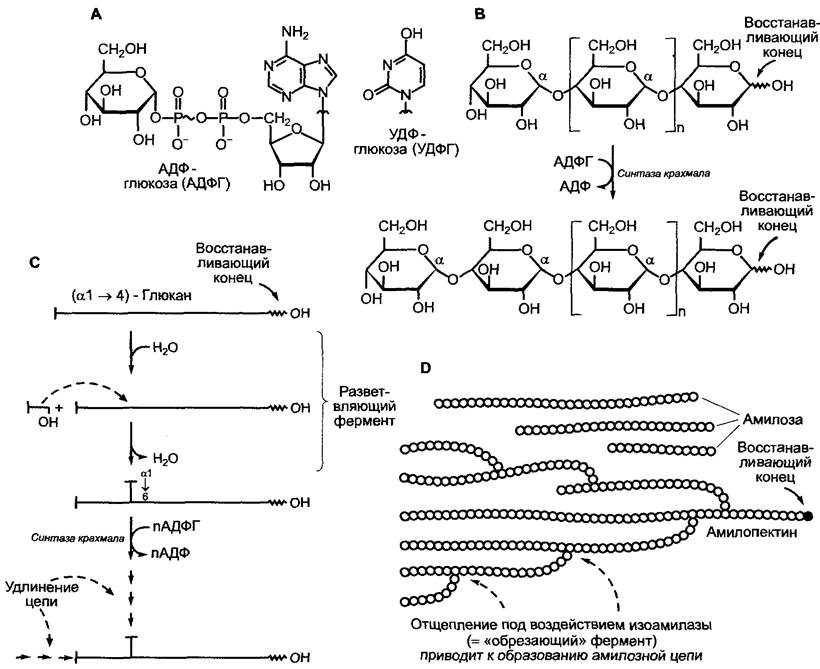
Рис. 6.130. Биосинтез крахмала: А — структура активированной глюкозы, которая представлена в виде кислотного гликозида между D-глюкопиранозой (здесь α-аномером) и остатком фосфорной кислоты нуклеозидцифосфата. АДФ- глюкоза служит субстратом для биосинтеза крахмала, УДФ-глкжоза — для биосинтеза сахарозы и целлюлозы; В — крахмалсинтазная реакция; С — амилопектин синтезируется при помощи совместного действия синтазы крахмала (удлинение цепи) и разветвляющего фермента, трансгликозидазы; D — схематическое строение крахмала. Амилоза синтезируется из амилопектина в результате реакции «обрезки» (изоамилазной реакции). Представленные амилозные цепочки являются отрезками внутренней части молекулы, поэтому восстанавливающие концы не изображены
Хитин, главный структурный компонент клеточной стенки многих грибов, является линейным полимером N-ацетил- глюкозаминных единиц, соединенных между собой (β1 —> 4)-гликозидной связью (структура — см. рис. 1.18, Е); донор N-ацетилглюкозаминных единиц — УДФ-N-ацетил глюкозамин (UDP-GlcNAc). Пептидогликан бактериальной клеточной стенки (см. 2.3.3, рис. 2.98) можно формально представить, как замещенный хитин.
6.17.1.2. Запасные полисахариды
Если не принимать во внимание некоторые исключения (например, сахарный тростник, сахарную свеклу, которые запасают сахарозу в вакуолях, а также бобовые
и губоцветные, которые запасают сахара семейства раффиноз, в основном стахиозу), растения депонируют запасные углеводы в форме нерастворимых в воде полисахаридов преимущественно в форме крахмала в амилопластах (см. рис. 2.90). Оба компонента крахмала амилоза и амилопектин (см. рис. 1.20) представляют собой гомо- гликаны, которые в качестве единственного структурного элемента содержат α-D- глюкопиранозу. В неразветвленной амилозе, имеющей склонность к образованию спирали, в макромолекуле находится 200 — 1000 молекул глюкозы, связанных (α1 —> 4)- гликозидными связями, амилопектин дополнительно содержит (α1 —> 6)-ответвления (приблизительно 1 на 25 (α1 —> 4)-гликозидных связей), со своими 2000 — 10000 мономерами он намного больше амилозы. На включении молекул йода в спираль амилозы основана специфическая цветная реакция на наличие крахмала раствором йода/йодида калия (окрашивание в синий цвет). Похожим на амилопектин строением обладает гликоген, основной запасной углевод бактерий, водорослей и грибов, однако его степень разветвления больше, чем амилопектина (приблизительно 1:14).
При синтезе крахмала сначала синтезируется амилопектин. В этом принимают участие фермент синтаза крахмала и фермент, отвечающий за разветвление (Q-фермент). Синтаза крахмала переносит от АДФ- глюкозы на невосстанавливающий конец (α1 —> 4)-глюкановой цепи α-О-глюкопиранозу, в результате образуется (α1—>4)-гликозидная связь. Разветвляющий фермент является трансгликозидазой, которая отщепляет от невосстанавливающего конца (α1 —> 4)-глюкановой цепи олигомер из 5 — 7 молекул глюкозы и снова присоединяет его внутри цепи (α1 —> 6)-гликозидной связью. Благодаря совместной деятельности двух ферментов появляется растущая восстанавливающим концом наружу разветвленная молекула амилопектина (см. рис. 6.130). Амилоза образуется из амилопектина в результате отщепления изоамилазой (α1 —> 6)-ответвления. Данный фермент называют также «обрезающим» ферментом. Отношение содержания амилозы к амилопектину (≈ 10 — 30 % : 70 —90 %) определяется генетически, следовательно, его можно модифицировать как путем селекции, так и методами генной инженерии.
Широко распространенные, растворимые резервные полисахариды, которые запасаются в вакуолях, называются фруктанами. Эти гете- рогликаны наряду с β-D-фруктофуранозой содержат одну молекулу α-D-глюкопиранозы на молекулу и встречаются, например, у представителей семейства Аstегасеае (инулин и инулиноподобные фруктаны, см. рис. 1.20), а также у Роасеае и других однодольных (флеин и флеиноподобные фруктаны, см. рис. 1.20). Предполагают, что фруктаны синтезируются в вакуолях из сахарозы.
Сахароза транспортируется в вакуоли, а накопившаяся в процессе синтеза глюкоза поступает обратно в цитоплазму, где снова используется в синтезе сахарозы.
Мобилизация крахмала происходит посредством либо фосфоролиза, либо гидролиза (рис. 6.131). Фосфорилаза крахмала отщепляет глюкозо-1-фосфат от (α1 —> 4)-глюкановой цепи, в результате чего в гликозидную связь ее невосстанавливающего конца внедряется фосфат. Амилоза может разложиться полностью,
амилопектин — только до точек разветвления, с образованием «предельных декстринов».
Рис. 6.131. Фосфоролитическое и гидролитическое расщепление крахмала. Как ассимиляционный, так и резервный крахмал расщепляется в результате совместного воздействия фосфорилазы крахмала, амилаз и изоамилазы. Фосфоролитическое расщепление благоприятнее с точки зрения энергетических затрат, так как энергия гликозидной связи сохраняется в фосфорилированном сахаре глюкозо-1-фосфате (Г-1-Ф). Гидролитическое расщепление резервного крахмала преобладает в эндосперме зерновок злаков
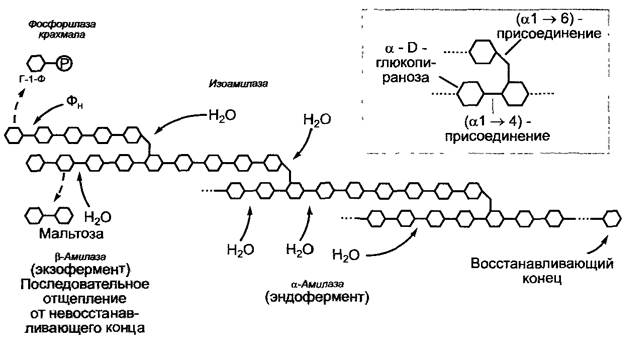
Гидролитическое расщепление крахмала катализируется амилазами. Альфа-амилазы являются эндоамилазами, которые воздействуют на молекулы амилозы и амилопектина изнутри и могут расщепить крахмал до дисахаридов мальтозы (см. рис. 1.19) или изомальтозы — Glср((α1 —> 6) glср — в обход (α1 —> 6)-гликозидных связей. В отличие от этих повсеместно распространенных амилаз β-амилазы найдены только у растений. Экзоамилазы отщепляют от невосстанавливающего конца цепи мальтозу и могут разложить амилозу полностью, а амилопектин — до «предельных декстринов». (α —> 6)-Гликозидные связи предельных декстринов расщепляются изоамилазами, дисахариды мальтоза и изомальтоза — мальтазами. Таким образом, гидролитически крахмал полностью расщепляется до глюкозы. Гидролитическое расщепление менее благоприятно в отношении энергетических затрат, чем фосфоролитическое, так как энергия гликозидных связей в таком случае просто теряется, тогда как в глюкозо-1-фосфате, напротив, сохраняется.
Во многих тканях крахмал расщепляется как фосфоролитически, так и гидролитически; это также относится к ночному расщеплению ассимиляционного крахмала. Преимущественно гидролитическое расщепление крахмала происходит в эндосперме во время прорастания крахмалистых зерновок злаковых. Здесь образование α-амилаз происходит в алейроновом слое по гормональному сигналу (гиббереллин — см. рис. 7.55) зародыша.
Лигнин вместе с целлюлозой входит в состав древесины. В природе это наиболее важное после целлюлозы органическое вещество (биосферный синтез составляет около 2 • 10т в год, для сравнения — целлюлозы 2 • 1011 т). В процессе одревеснения происходит полимеризация лигнина в целлюлозном каркасе вторичных стенок. Лигнин, целлюлоза и другие компоненты клеточных стенок связываются при этом ковалентными связями. Полимеризация лигнина — свободнорадикальная реакция, в которой ферменты регулируют образование радикалов, но не их последующую реакцию. Поэтому лигнин обладает стохастическим составом и представляет собой огромный прочный на сжатие во всех направлениях полимер, который в сочетании с устойчивой к растяжению целлюлозой придает древесине исключительную прочность (сходную «архитектуру» имеет железобетон).
Мономерные компоненты лигнина — фенилпропаны, коричные спирты (рис. 6.132), полученные из представителей семейства коричных кислот (см. рис. 6.115) в результате восстановления карбоксильной группы. Восстановление начинается с активации предшественников — пара-кумаровой, феруловой и синаповой кислот до сложных тиоэфиров кофермента А (см. рис. 6.117). Последние в результате отщепления коэнзима А циннамоил-КоА-редуктазой превращаются в коричные альдегиды, которые затем восстанавливаются циннамалкогольдегидрогеназой (ЦАД) до коричных спиртов; восстановителем для обоих ферментов служит НАДФН + Н+. Специфичность к субстрату ЦАД, возможно, определяет соотношение мономеров в лигнине различных видов. Фермент покрытосеменных восстанавливает все три циннамаль- легида, тогда как для ЦАД голосеменных плохим субстратом является синаповый альдегид. Лигнин птеридофитов и голосеменных отличается преобладанием конифериловых и малой частью двух других спиртов, в лигнине двудольных конифериловые и синаповые спирты содержатся в почти равных количествах, а кумаровый спирт встречается в виде следов. В состав лигнина однодольных (прежде всего, злаков) наряду с двумя другими компонентами входит также большое количество пара-кумарового спирта, поэтому характерное для этих компонентов содержание метоксильных групп (—ОСН3) является важным параметром для определения происхождения лигнина.
Различные ткани одного растения, например, перидерма и древесина или летняя (поздняя) и весенняя (ранняя) древесина, также могут содержать лигнин с разным составом. Так, например, в поздней древесине дуба содержание метоксила выше, чем в ранней.
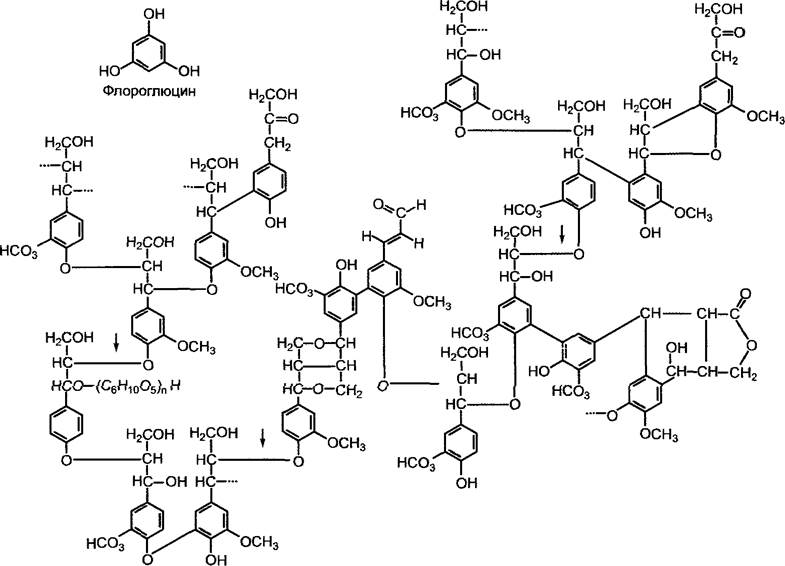
Дегидрирующая свободнорадикальная полимеризация лигнина протекает вне клеток. Предшественники коричных спиртов, которые могут спонтанно полимеризоваться в виде водорастворимых β-глюкозидов — глюкокумарового спирта, кониферина и сирингина (см. рис. 6.132), выделяются в область клеточной стенки, где в результате воздействия β-глюкозидазы высвобождаются спирты. Образование радикалов осуществляется пероксидазой клеточной стенки, которая в качестве косубстрата использует Н2О2 (рис. 6.133). Синтезированный лигнин, схематическая структура которого представлена на рис. 6.134, содержит компоненты, объединенные в полимер различными связями. Это отражает многочисленные резонансные структуры полученных радикалов (см. рис. 6.133). Разбросанные в лигнине в случайном порядке карбонильные остатки (на рис. 6.134) являются причиной окрашивания лигнина в красный цвет флороглюцином/соляной кислотой (синтез полуацеталей карбонильных остатков и фенольных гидроксильных групп).
Рис. 6.132. Активирование и восстановление коричных кислот, которые являются предшественниками лигнина. Коричные спирты выделяются из клетки в виде β-D-глюкопиранозидов
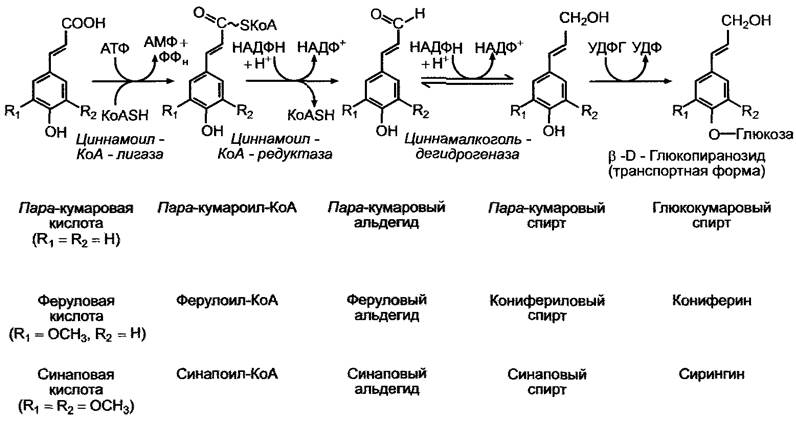
Рис. 6.133. Образование радикалов у предшественников лигнина при окислении коричных спиртов (например, конифериловый спирт) связанными с клеточной стенкой пероксидазами. Неспаренные электроны представлены в виде точек
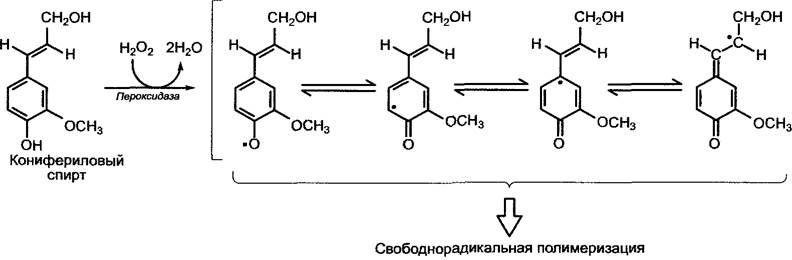
Рис. 6.134. Схема строения лигнина еловых пород по Фройденбергу. Показаны возможные варианты соединения мономерных компонентов. Молекулу следует представить в трехмерном варианте. Арил-эфирная связь между β-С-атомом боковой цепи и ароматическим кольцом соседней (стрелки) является уязвимым местом в процессе деполимеризации лигнина при поражении грибами. Гистохимическое подтверждение наличия лигнина при помощи кислого флороглюцина основано на формировании полуацеталей (см. рис. 1.18) при реакции с карбонильными группами в лигнине
Лигнификация клеточной стенки проходит в три этапа:
✵ отложение лигнина в углах клетки и в серединной пластинке после окончания накопления пектина в первичной стенке (см. 2.2.7.4);
✵ медленное одревеснение S2-слоя вторичной стенки (см. рис. 2.74, В);
✵ основная лигнификация после формирования целлюлозных микрофибрилл SЗ-слоя.
Состав лигнина в этих трех зонах различен.
Расщепление лигнина происходит прежде всего в результате деятельности грибов, вызывающих так называемую «белую гниль», и является в целом аэробным, энергоемким процессом, который протекает очень медленно. В нем принимают участие, помимо всего прочего, лигнолитическая оксигеназа («лигниназа»), O2- и Н2O2-зависимый гем-содержащий фермент пероксидазной природы, который прежде всего производит окислительное расщепление С—С-связей, а также деполимеризующий фермент, который в основном расщепляет ароматические эфирные связи (рис. 6.134). Низкая скорость этого процесса (гниение древесных стволов в лесу!) подтверждает то, что лигнин вследствие случайности своего состава, многообразия связей и наличия ароматического (бедного энергией и потому очень стабильного) ядра представляет собой эффективный структурный барьер, препятствующий проникновению микроорганизмов.
Кутин и суберин — родственные структуры, которые представляют собой липофильные сополимеры. Непроницаемые для газов и воды, они также создают барьеры, предохраняющие растение от проникновения микроорганизмов. Биосинтетически они происходят от жирных кислот — пальмитиновой и стеариновой.
Кутин наряду с гликанами клеточной стенки является основным компонентом растительной кутикулы, которая снаружи изолирована восковым слоем. Воска представляют собой сложные моноэфиры длинноцепочечных жирных кислот и также длинноцепочечных моногидроксиалканов, которым свойственно формирование слоев, но не полимеризация. Кутин, напротив, является сложным полиэфиром многократно гидроксилированных жирных кислот с высоким содержанием 10,16-дигидроксистеариновой и 9,10,16-тригидро- ксистеариновой кислоты, а также фенольных тел в качестве побочных компонентов.
Жирнокислые компоненты суберина ведут свое начало от стеариновой кислоты. Они синтезируются из очень длинноцепочечных жирных кислот (до С30), очень длинноцепочечных гидроксиалканов (до С20) и дикарбоновых кислот. Все названные вещества образуют друг с другом сложные эфиры, в особенности с алифатическими гидроксильными группами коричных спиртов (в основном пара-кумарового спирта). Фенилпропаны объединяются друг с другом подобно тому, как это происходит в лигнине, т. е. суберин представляет собой основную часть лигнана, чьи свободные алифатические гидроксильные группы этерифицируются очень длинноцепочечными ацильными компонентами с образованием сложных эфиров. Суберин наряду с лигнином присутствует в поясках Каспари эндодермы корня (см. 6.3.3) и вместе с восками входит в качестве основного компонента в состав клеточной стенки опробковевших клеток (см. 3.2.2.2).
Белки, также, как и углеводы и липиды, являются важными запасными веществами растений. Запасные белки в основном содержатся в эндосперме семян (например, в алейроновом слое зерновки злаков) либо в запасающих семядолях (например, у бобовых), а также в вегетативных запасающих органах (например, в корнях, клубнях) и запасающих тканях стебля (например, флоэмной паренхиме, камбии). По составу аминокислот и структуре запасные белки в большинстве случаев существенно отличаются от ферментных и структурных, много различных молекулярных форм встречается даже внутри одного вида. Кратко охарактеризуем некоторые из них.
Запасные белки зерновых на основе их растворимости разделяют на проламины (растворимы в 60 —80%-м спирте) и глютелины (растворимы в спиртах или кислотах); однако по своему происхождению эти группы родственные (в настоящее время они объединены под общим названием проламины) и представляют собой смесь различных, частично соединенных друг с другом дисульфидными мостиками субъединиц. Биосинтез субъединиц, как и, вероятно, их агрегация, протекают в эндоплазматическом ретикулуме. Таким образом, предназначенное для запасания протеиновое тело отшнуровывается от гранулярного ЭР в виде наполненной белком и заключенной в мембрану везикулы.
К проламинам относятся глиадин и глютенин пшеницы и ржи; их присутствие в муке определяет хлебопекарные свойства этих зерновых.
Большинство запасных белков других видов растений относятся к глобулинам. Они (в отличие от альбуминов) нерастворимы в дистиллированной воде, но растворяются в разбавленных солевых растворах, из которых могут быть выделены растворами с более высокой концентрацией соли (например, полунасыщенным раствором сульфата аммония). К глобулинам относятся легумины и вицилины, основные запасные белки бобовых. Легумины — гексамерные комплексы; их мономеры представляют собой гетеромеры из α- и β-цепи в каждом, которые ковалентно соединены между собой дисульфидными мостиками. Вицилины — тримеры, их мономеры состоят из одной-единственной пептидной цепи с аминокислотной последовательностью, похожей на таковую в ле- гумине. В отличие от легуминов вицилины гли- козилированы. Биосинтез глобулинов проходит в ЭР, запасные белки оттуда доставляются в запасающие вакуоли по аппарату Гольджи (здесь при необходимости протекают реакции гликозилирования). Наконец, запасающие белок вакуоли фрагментируются на окруженные мембранами протеиновые тела. Семена бобовых содержат до 40 % запасных белков от массы сухого вещества.
Аминокислотный состав запасных белков в большинстве случаев не оптимален для пищи человека. Так, запасные белки бобовых содержат очень мало метионина, в проламинах зерновых в основном отсутствует лизин, в них также мало триптофана и треонина. Потребление исключительно растительной пищи с высоким содержанием «зерновых культур» может привести, особенно у детей, к сильному истощению, так как человеческий организм не в состоянии синтезировать вышеназванные аминокислоты самостоятельно. При помощи методов генной инженерии удалось привести аминокислотный состав запасающих белки семян в относительное соответствие с человеческими потребностями.
Мобилизация запасных белков, например, при прорастании семян, происходит посредством гидролиза с участием различных протеиназ. Эндопептидазы гидролизуют пептидные связи внутри белковой молекулы, экзопептидазы действуют с концов: карбоксипептидазы — с карбоксильного конца, аминопептидазы — с аминного. В расщеплении дисульфидных мостиков, по меньшей мере у зерновых, вероятно, принимает участие восстановленный тиоредоксин.
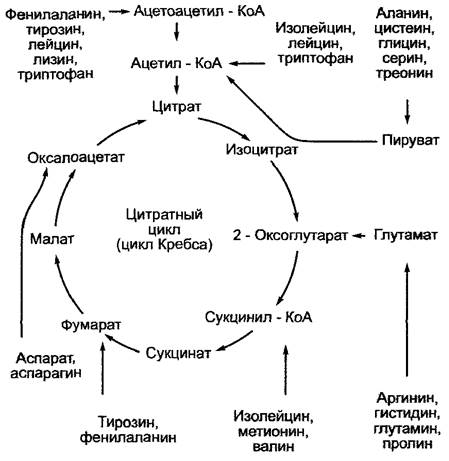
Продукты гидролиза белков — аминокислоты — либо используются в синтезе белков (например, служат для покрытия потребности в ферментах при прорастании семян), либо подвергаются дальнейшему расщеплению, если они не нужны для синтеза белка (например, такие аминокислоты, которые с точки зрения структур представлены в запасных белках в больших количествах, чем в среднем требует белковый синтез). В итоге они превращаются трансаминазами в 2-кетокислоты. Аминный азот переносится на другие 2-кетокислоты, например, на 2-кетоглутаровую кислоту с образованием глутамата (см. 6.6.1). Полученные 2-кетокислоты в большинстве случаев в несколько контролируемых ферментами этапов становятся промежуточными продуктами гликолитического расщепления, или нитратного цикла (цикла Кребса). Разумеется, катаболизм отдельных аминокислот бактерий изучен намного лучше такового растений (рис. 6.135).
Рис. 6.135. Точки вхождения углеродных скелетов аминокислот в реакции синтеза пирувата и цитратного цикла (цикл Кребса), которые были обнаружены в результате опытов на бактериях
Некоторые запасные белки, особенно в семенах, дополнительно служат защитой от поедания животными. Сюда причисляют лектины. Это связывающие сахара белки или гликопротеины, которые часто в больших количествах содержатся в семенах, прежде всего бобовых. Лектины специфично связываются с определенными сахарными остатками, даже в гликопротеинах или полисахаридах. По этой причине и происходит характерная, используемая для подтверждения их наличия, агглютинация эритроцитов. Старое название лектинов — фитогемагглютинины. Лектины связываются в кишечнике с поверхностными гликопротеинами и вызывают функциональные нарушения в пищеварительном тракте. Примерами лектинов являются хорошо изученные конканавалин А бобового Canavalia ensiformis и трифолин Trifolium repens, которому, как и другим поверхностным лектинам корней бобовых, приписывают роль участников специфического связывания микориз в процессе установления клубенькового симбиоза.
Следующими запасными белками с защитным действием являются ингибиторы протеиназ, которые встречаются в запасающих органах многих растений, а также в важнейших продуктах питания (например, в семенах бобовых, картофеле). Они прежде всего ингибируют протеиназы животного или бактериального происхождения и, скорее всего, играют определенную роль в защите растения от растительноядных животных и патогенных микроорганизмов. Поэтому картофель и семена бобовых пригодны в пищу только в приготовленном виде (тепловая денатурация белков). Наряду с основными белками, причисляемыми к фракции запасных белков, многие растения также синтезируют при необходимости (например, при поедании животными) индуцированные ингибиторы протеиназ (см. 9.4.1). К токсичным запасным белкам относят рицинRicinus communis и ингибиторы амилаз видов Phaseolus. Рицин инактивирует 60S-субъединицы эукариотических рибосом.