БОТАНИКА ТОМ 2 - ФИЗИОЛОГИЯ РАСТЕНИЙ - 2007
7. ФИЗИОЛОГИЯ РАЗВИТИЯ
7.3. Клеточные основы развития
7.3.1. Обмен веществ и распределение белков внутри клетки
На пути реализации наследственной информации после успешной транскрипции информация, содержащаяся в мРНК, используется для образования белков. Этот процесс происходит на рибосомах и называется трансляцией. Генетический код здесь (см. 7.3.1.1) переписывается в коллинеарную последовательность аминокислот. Свертывание белков и при необходимости модификация белков — два процесса, которые могут проходить уже во время синтеза белков (котрансляционно) или после окончания синтеза белков (посттрансляционно), заканчивают образование функционального белка (см. 7.3.1.2). Обеспеченность клетки белками является результатом регулируемого сочетания синтеза и распада белков (см. 7.3.1.3).
Синтез белков происходит у эукариот в цитоплазме, в пластидах (если есть) и митохондриях. Образующиеся в пластидах или в митохондриях белки остаются в соответствующих органеллах, напротив, синтезированные в цитоплазме белки направляются в различные компартменты или экскретируются из клетки. Правильное распределение белков внутри клетки является решающим для осуществления и сохранения компартментации у эукариот (см. 7.3.1.4).
Из многочисленных встречающихся в природе аминокислот для синтеза белков во время трансляции используются, как правило, лишь 20 так называемых протеиногенных аминокислот (см. рис. 1.11). Их последовательность в белке определена, согласно сказанному выше, последовательностью оснований в ДНК или соответственно мРНК.
Выраженное четырьмя «знаками» («буквы кода») информационное содержание ДНК или соответственно мРНК должно быть переведено при синтезе белков в максимум 20 «знаков» также информативного «текста» полипептида. Конечно, для кодирования 20 аминокислот использовать 4 «знака» нуклеиновых кислот можно только в комбинации. Если бы дуплет оснований из 4 различных оснований представлял собой «кодовое слово» генетического кода, т. е. соответствовал определенной аминокислоте, можно было бы закодировать максимум 42 = 16 различных аминокислот. Если три следующих друг за другом нуклеотида (триплет) являются кодовым словом, то могут быть закодированы 43 = 64 различные аминокислоты. Показано, что генетический код действительно состоит из последовательных не перекрывающихся триплетов оснований — кодонов, которые соответствуют отдельным аминокислотам (табл. 7.3). Генетический код всеобщий (т. е. он действителен для вирусов, бактерий, растений, животных и человека), но не универсальный и потому называется стандартным кодом. Исключения (табл. 7.4) рассматриваются далее. Кодоны приводятся в направлении 5' —> 3', в соответствии с направлением движения мРНК при трансляции.
Таблица 7.3. Стандартный генетический код
UUU |
Phe |
UCU |
Ser |
UAU |
Tyr |
UGU |
Cys |
UUC |
Phe |
UCC |
Ser |
UAC |
Туг |
UGC |
Cys |
UUA |
Leu |
UCA |
Ser |
UAA |
Стоп |
UGA |
Стоп |
UUG |
Leu |
UCG |
Ser |
UAG |
Стоп |
UGG |
Trp |
CUU |
Leu |
CCU |
Pro |
CAU |
His |
CGU |
Arg |
CUC |
Leu |
CCC |
Pro |
CAC |
His |
CGC |
Arg |
CUA |
Leu |
CCA |
Pro |
CAA |
GIn |
CGA |
Arg |
CUG |
Leu |
CCG |
Pro |
CAG |
GIn |
CGG |
Arg |
AUU |
lIe |
ACU |
Thr |
AAU |
Asn |
AGU |
Ser |
AUC |
IIe |
ACC |
Thr |
AAC |
Asn |
AGC |
Ser |
AUA |
IIe |
АСА |
Thr |
AAA |
Lys |
AGA |
Arg |
AUG |
Met |
ACG |
Thr |
AAG |
Lys |
AGG |
Arg |
GUU |
Val |
GCU |
Ala |
GAU |
Asp |
GGU |
Gly |
GUC |
Val |
GCC |
Ala |
GAC |
Asp |
GGC |
Gly |
GUA |
Val |
GCA |
Ala |
GAA |
Glu |
GGA |
Gly |
GUG |
Val |
GCG |
Ala |
GAG |
Glu |
GGG |
Gly |
Триплеты даны в 5' —> З'-направлении (по трехбуквенному коду аминокислот, рис. 1.11). Полужирный шрифт: стоп-кодоны или соответственно метиониновый кодон, который в подходящем окружении (см. рис.
7.11) обозначает точку начала трансляции.
В то время как для триптофана и метионина существует только один соответствующий кодон, остальные аминокислоты представлены 2 — 6 кодонами. Генетический код является вырожденным. Вырожденность касается в первую очередь основания в третьем положении кодона. Этот факт соответственно дает эволюционное преимущество, так как не каждая точечная мутация (замена одного основания другим) ведет к изменению последовательности аминокислот соответствующего белка. Обращает на себя внимание тот факт, что многократно кодируемые аминокислоты чаще можно найти в белках и что UC-содержащие триплеты кодируют гидрофобные, тогда как AG-содержащие, напротив, — гидрофильные аминокислоты; поэтому первые можно найти в левой/верхней стороне, последние — в правой/нижней стороне таблицы кодонов (см. табл. 7.3). Наконец, семейства триплетов оснований (общее первое основание) определяют аминокислоты, которые демонстрируют сходство по биосинтезу и тем самым по их структуре. Соответствие кодонов аминокислотам, таким образом, не случайно; это позволяет сделать вывод о коэволюции кодонов и аминокислот. В качестве молекулярного механизма обсуждают структурную комплементарность определенных рибонуклеиновых кислот определенным молекулам аминокислот в «мире РНК».
Наряду с кодонами, определяющими последовательность аминокислот, код содержит также «знаки препинания»: одновременно кодирующий метионин инициаторный кодон 5'-AUG-3', а также три стоп-кодона: 5'-UAA-3', 5'-UAG-3' и5'-UGА-З', которые обозначаются как «охра», «амбер» и «опал»1; они маркируют точку старта или соответственно конец транслируемой области мРНК.
1 Эти названия даны по оттенку глаз плодовой мушки Drosophila melanogaster, у которой в результате мутаций в белках, отвечающих за цвет глаза, появляются соответствующие стоп-кодоны, прерывающие трансляцию. — Примеч. ред.
Таблица 7.4. Некоторые отклонения от стандартного генетического кода
Кодон 5' —> 3 |
В стандартном коде обозначает |
также Кодирует |
Организм |
Хондриом: UGA |
Стоп |
Триптофан |
Грибы |
AUA |
Изолейцин |
Метионин |
Saccharomyces cerevisiae |
CGG |
Аргинин |
Триптофан |
Tea mays |
Пластидный геном: AUA |
Изолейцин |
Старт |
Heterocapsa triquetra (динофлагелляты) |
UUG |
Лейцин |
Старт |
Heterocapsa triquetra (динофлагелляты) |
Прокариотические геномы: UGA |
Стоп |
Триптофан |
Mycoplasma spec. |
Ядерные геномы: CUG |
Лейцин |
Серин |
Candida cylindracea |
UAA, UAG |
Стоп |
Глутамин |
Некоторые простейшие, Acetabularia |
UGA |
Стоп |
Селеноцистеин |
В зависимости от контекста последовательности у некоторых про- и эукариот (например, Chlamydomonas) |
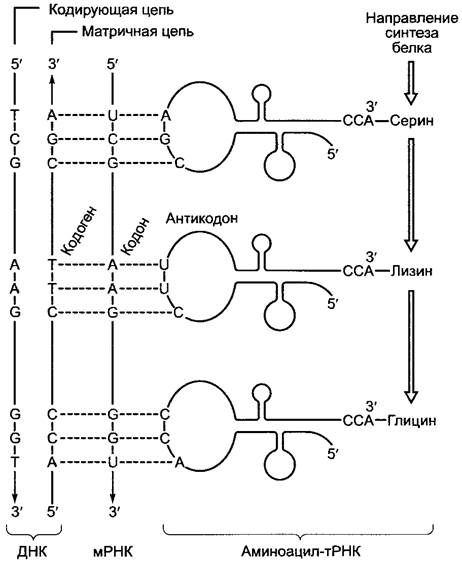
Рис. 7.13. Кодирование аминокислотной информации на ДНК, мРНК и тРНК. Кодоны мРНК имеют последовательность оснований, идентичную соответствующим триплетам кодирующей ДНК-цепи (однако в мРНК вместо Т стоит U). Комплементарные триплеты матричной цепи, используемой для синтеза мРНК, называются кодогенами; они имеют последовательность оснований, в принципе идентичную антикодонам тРНК (снова вместо Т стоит U в РНК). Правда, в антикодонах иногда находятся редкие основания, которые возникают в результате вторичной модификации первоначальных оснований, и наконец появляются нестандартные пары оснований (см. текст)
Со временем были открыты отклонения от стандартного триплетного кода (см. табл. 7.4). Обращает на себя внимание тот факт, что у большинства прокариот и эукариот стоп-кодон 5'-UGА-3' кодирует селеноцистеин, двадцать первую протеиногенную аминокислоту, которая до сих пор была обнаружена у растений только в полипептидной цепи глутатионпероксидазы у Сhlamydomonas reinhardtii. Это «перекодирование» зависит от конформации «шпильки» в мРНК, возникающей благодаря внутреннему спариванию оснований, которая находится у прокариот в З'-направлении непосредственно после UGА-триплета, а у эукариот — в З'-нетранслируемой области мРНК.
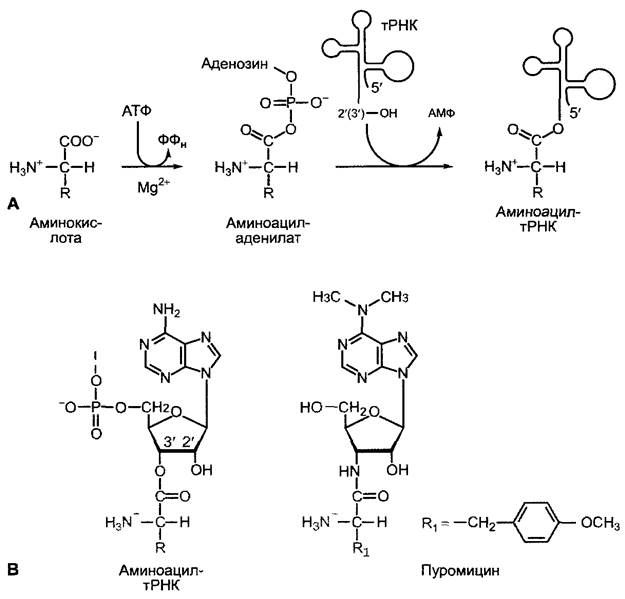
В качестве промежуточных молекул, которые позволяют, в конце концов, перевести последовательность триплетов мРНК в последовательность аминокислот, служат содержащие 74 — 94 нуклеотида тРНК (см. рис. 1.10, А; 7.13); из них у бактерий насчитывается 30—45 различных типов, у эукариот — до 50. Каждая тРНК несет в антикодоновой петле (см. рис. 1.10, А) комплементарный кодону триплет, антикодон, который на рибосоме вступает в комплементарное взаимодействие с кодоном и доставляет, таким образом, определяемую кодоном аминокислоту к аппарату синтеза белка. Все тРНК характеризуются последовательностью оснований 5'- ССА-3' на выступающем З'-конце и несут в «нагруженной» форме соответственно всегда только одну характерную аминокислоту со своей карбоксильной группой в эфирной связи с 2'- или З'-гидроксильной группой концевой рибозы. «Загрузка» тРНК катализируется аминоацил-тРНК-синтетазами (рис. 7.14), среди которых есть фермент для каждой аминокислоты. Благодаря многочисленным контактам между соответствующей синтетазой, аминокислотой и акцепторной тРНК, которая включает антикодон и многие другие структурные элементы тРНК (в том числе редкие основания!; см. рис. 1.10, А, В), обеспечивается процесс, где лишь подходящие друг другу тРНК и аминокислоты реагируют с образованием аминоацил-тРНК. Аминоацил- тРНК-синтетазы обладают дополнительно в качестве корректирующей функции (англ, proofreading function) эстеразной активностью, которая гидролитически удаляет неправильные аминоацильные остатки. Эстеразная активность против соответствующей данной тРНК аминокислоты значительно слабее. Эксперименты показали, что частота ошибок при трансляции у Escherichia coli составляет примерно 1 на 104 встроенных аминокислот. Так как различных тРНК существует больше, чем протеиногенных аминокислот, для многих аминокислот существует несколько изоакцептирующих тРНК.
Рис. 7.14. Аминоацил-тРНК: А — синтез аминоацил-тРНК. Аминокислота сначала активируется АТФ с образованием аминоацил- аденилата; аминоацил-тРНК-синтетазы класса II переносят активированную аминокислоту с высвобождением АМФ на З’-ОН-группу рибозы на З’-конце тРНК; энзимы класса I переносят ее на 2'-ОН- группу; В — З’-конец аминоацил-тРНК, образование которой катализируется аминоацил-тРНК-син- тетазой класса II; пуромицин — структурный аналог З'-конца тРНК, нагруженной тирозином или фенилаланином; амидная связь пуромицина не расщепляется пептидилтрансферазой, так что попадание пуромицина в акцепторный сайт рибосомы ведет к прерыванию синтеза белка
Синтез редких оснований тРНК, которые могут составлять до 10% оснований тРНК и встречаются прежде всего в спаренных петельных участках (см. рис. 1.10, А), происходит путем постгранскрипционной модификации прежде всего в цитоплазме и включает метилирование, восстановление или прикрепление диметилаллилового остатка на адениновый остаток с помощью цитоплазматической диметилаллилтрансферазы. В последнем случае в З'-позиции рядом с антикодоном возникает, как правило, в качестве составной части тРНК N6(∆2-изопентенил)-аденин (IPA) — соединение, которое в свободной форме действует как цитокинин и регулирует развитие растений (см. 7.6.2).
Селеноцистеиновая тРНК образуется путем вторичной модификации, причем с тРНК сначала связывается серин, который с помощью фермента селеноцистеинсинтазы на тРНК превращается в селеноцистеин: донором селена является селенофосфат. Путем вторичной модификации у бактерий из метиониновой тРНК возникает также N-формилметиониновая тРНК, которая используется вместо метионина в качестве первой аминокислоты при инициации трансляции на старт-кодоне 5'-AUG-3'.
Обусловленный образованием петли конформационный изгиб антикодона ведет к тому, что первое основание антикодона и третье основание кодона мРНК вступают в не совсем точное образование пар оснований (см. рис. 7.13). Из-за этого возможно также образование других, отличных от обычных пар оснований (G с С или соответственно А с U; см. рис. 1.6). Это обозначается как «качание» (англ. wobble)1. Например, возможны пары G-U (2 водородных мостика). Производное гуанина инозин (I) в этом месте антикодона может образовывать пары даже с 3 основаниями (A, U, С) (2 водородных мостика). В редких случаях даже в средней позиции антикодонового триплета появляются редкие основания (например, псевдоуридин,![]() , который образует пару с А; см. рис. 1.10). Благодаря «качанию» сокращается число тРНК, которое требуется для декодирования всех триплетов. Митохондриальные тРНК часто могут образовывать пары со всеми 4 типами оснований в третьей позиции кодона. Благодаря этому «суперкачанию» необходимое число тРНК в митохондриях заметно уменьшается.
, который образует пару с А; см. рис. 1.10). Благодаря «качанию» сокращается число тРНК, которое требуется для декодирования всех триплетов. Митохондриальные тРНК часто могут образовывать пары со всеми 4 типами оснований в третьей позиции кодона. Благодаря этому «суперкачанию» необходимое число тРНК в митохондриях заметно уменьшается.
1 Термин «wobble» кроме смысла «качание», «колебание» несет оттенок ненадежности, шаткости, непредвиденной случайности. — Примеч. ред.
7.3.1.2. Биосинтез белков
Процесс биосинтеза белка можно разделить на:
✵ фазу инициации,
✵ фазу элонгации,
✵ фазу терминации.
Далее ограничимся описанием процесса биосинтеза белков на 80S-рибосомах (см. 2.2.4) эукариот, попутно обращая внимание на значительные различия с прокариотической трансляцией на 70S-рибосомах.
Фаза инициации трансляции начинается на 5'-кэпе мРНК (см. рис. 7.12)1 с образования преинициаторного комплекса, состоящего из малой (40S) субъединицы рибосомы, ишшиаторной тРНК, нагруженной метионином (которая отлична от метиониновой тРНК, которая узнает кодон 5'-AUG-3', находящийся внутри открытой рамки считывания), и других белков, факторов инициации. В инициации трансляции у растений также участвуют поли(А)-хвост на З'-конце мРНК, а также поли(А)-связывающий белок; чем длиннее поли(А)-остаток, тем чаще происходит инициация трансляции. Образовавшийся комплекс инициации сканирует мРНК в направлении 5' —> 3' в поисках инициаторного кодона. Он отличается от «внутренних» метиониновых кодонов своим окружением в последовательности (последовательность Козака, см. рис. 7.11). Как только комплекс инициации достигает этой позиции, большая (60S) субъединица рибосомы связывается, и синтез белка начинается.
1 Подчеркнем, что для инициации трансляции у эукариот нужен свободный 5'-конец мРНК, модифицированный в кэп. При этом рибосома синтезирует один закодированный ближе к 5'-концу белок. Даже если бы мРНК несла информацию о двух белках, эукариотическая рибосома не смогла бы транслировать обе рамки считывания. Это свойство влияет на структуру эукариотного генома: под одним промотором находится только один ген, а считываемые мРНК всегда моноцистронны. — Примеч. ред.
В отличие от этого, инициация трансляции у прокариот начинается с образования комплекса инициации на месте связывания рибосом, находящемся в 3 — 10 основаниях в 5'-направлении перед старт- кодоном (последовательность Шайна — Дальгарно:5'-AGGAGGU-3' или варианты этой последовательности)1 Также у прокариот используется собственная инициаторная тРНК, однако она несет не метионин, а N-формилметионин.
1 Важно, что для инициации трансляции у прокариот не нужен модифицированный 5'- конец мРНК, прокариотический синтез белка начинается из середины, что позволяет одной РНК кодировать несколько белков Полицист ронные мРНК в свою очередь позволяют собрать несколько генов в один оперон — Примеч. ред.
Фаза элонгации протекает у про- и эукариот очень похоже (рис 7.15) и требует других белков — факторов элонгации. Со связыванием 60S-субъединицы на рибосоме возникают 2 сайта связывания тРНК Р(пептидильный)-сайт, который сначала занят инициаторной тРНК, и А(акцепторный)-сайт, к которому присоединяется вторая, комплементарная к следующему за старт-кодоном триплету, аминоацил-тРНК Кодон-антикодоновое взаимодействие происходит на 40S-субъединице, синтез пептида на 60S-субъединице с помощью рибозима пептидилтрансферазы (функция 28S- или соответственно у прокариот 23S- рРНК). При высвобождении тРНК карбоксильная группа первой аминокислоты реагирует с аминогруппой второй аминокислоты, еще связанной с тРНК. Следовательно, белок имеет свободную аминогруппу в начале последовательности аминокислот (или соответственно у прокариот N-формиламиногруппу) Поэтому начало полипептида также называется N-конец, а завершающая часть — последовательности полипептида со свободной карбоксильной группой — карбоксильный конец, или C-конец. После окончания пептидилтрансферазной реакции первая тРНК диссоциирует с рибосомой, следующая тРНК перемещается со связанным дипептидом на Р- сайт, причем мРНК, соединенная с антикодоном, также перемещается (транслокация). На освободившемся А-сайте теперь представлен следующий триплет, и к нему присоединяется соответствующая аминоацил-тРНК; с этого начинается очередная пептидилтрансферазная реакция и т.д. Элонгация аминокислотной цепи протекает у эукариот со скоростью ~25 аминокислот в секунду, а у бактерий — ~50 аминокислот в секунду. Из-за величины рибосомы N-конец возникшей цепи белка покидает рибосому только тогда, когда имеется -35 — 40 скрепленных друг с другом аминокислот.
Рис. 7.15. Схема трансляции на рибосоме. Представлено начало синтеза полипептида на 80S-рибосоме. Инициаторный кодон (светло-серый) распознается по последовательности его окружения (последовательность Козака, см рис 7 11) и образует нуклеотидные пары с антикодоном инициаторной тРНКМЕТ мРНК считывает триплет за триплетом в направлении 5 —> 3. Две пептидные связи уже образованы, соответствующие тРНК покинули рибосому. Третья тРНК со связанной пептидной цепью занимает Р-сайт (пептидный сайт), четвертая аминоацил-тРНК, в показанном примере нагруженная тирозином связалась с А-сайтом (акцепторный сайт) и полностью осуществила образование пары антикодона и кодона протекает пептидилтрансферазная реакция. Пептидная цепь изображена без учета стерической конформации (см рис 112)
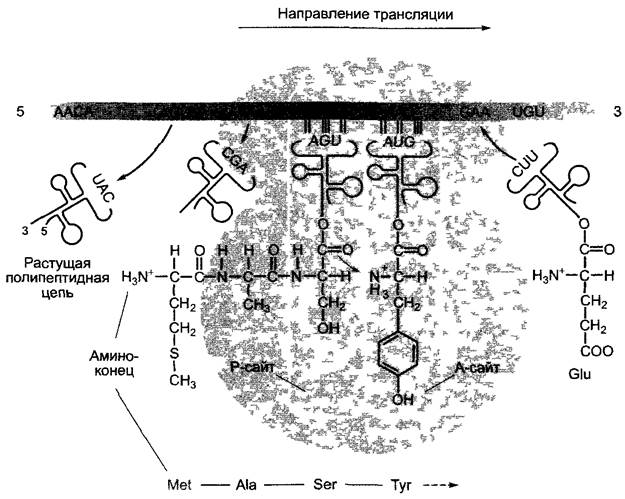
Когда рибосома достигает стоп-кодона, А-сайт занимается одним из трех факторов терминации (в зависимости от синтезируемого пептида), полипептид высвобождается при отделении от тРНК на Р- сайте, из-за чего комплекс трансляции распадается. У эукариот фазы инициации, элонгации и терминации трансляции энергозависимы, в качестве источника энергии служит ГТФ. У прокариот в ГТФ нуждаются инициация и элонгация, но не терминация.
Трансляция, как и транскрипция, регулируется. Экспрессия кодируемых ядром генов находится преимущественно под контролем транскрипции, реже — под контролем трансляции. Трансляционный контроль должен играть роль, например, при недостатке кислорода или повреждении. Напротив, у пластидных генов контроль трансляции является важным механизмом регуляции экспрессии (см. рис. 7.6). Здесь участвуют кодируемые ядром РНК-связывающие белки и расположенные в 5'-направлении перед транслируемой областью участки последовательности на мРНК, с которыми связываются эти регуляторные белки.
Трансляцию можно блокировать различными ингибиторами. Антибиотик пуромицин (см. рис. 7.14) из-за своего структурного сходства с фенилаланиновой или тирозиновой тРНК конкурирует за сайты их связывания на рибосоме и вызывает обрыв образовавшихся белковых цепей, которые высвобождаются в виде пептидилпуромицина. Хлорамфениколподавляет пептидил-трансферазную активность 50S-субъединицы 70S-рибосомы, но не 60S-субъединицы 80S-рибосомы, и поэтому подавляет трансляцию только у бактерий, пластид и митохондрий, но не трансляцию в цитоплазме. Циклогексимид, напротив, ингибирует пептидил- трансферазу 60S-субъединицы, но не 50S-субъединицы, и тем самым подавляет цитоплазматический синтез белка.
Высвобождаемая рибосомой полипептидная цепь еще биологически не активна и переводится в активную форму только благодаря дальнейшим процессам. Сюда всегда относятся свертывание белка, часто — химические модификации и протеолитический процессинг, а также, в редких случаях, сплайсинг белков.
Хотя окончательная (нативная) конформация белка определяется его аминокислотной последовательностью, только малые белки свертываются спонтанно (но долго) in vitro. В клетке большинство белков могут перейти в свою нативную конформацию только при помощи вспомогательных белков, помощников свертывания, или шаперонов (см. 1.3.2.2). Малые белки с молекулярной массой до ~60 кДа, которые в свернутом состоянии образуют только один-единственный домен, свертываются с помощью шаперонинов, т.е. высокомолекулярных комплексов, которые встречаются у про- и эукариот, а также в пластидах и митохондриях. Шаперонины заключают отдельные полипептидные цепи в свою центральную полость и освобождают их только после окончания процесса свертывания (см. рис. 7.18). Процесс свертывания нуждается в АТФ. В пластидах и митохондриях в свертывании белка участвует шаперонин Hsp60, высокомолекулярный цилиндрический комплекс из 14 субъединиц HSP60-белка, которые расположены друг над другом в 2 кольца по 7 субъединиц. HSP60 является белком теплового шока1; цифра 60 показывает молекулярную массу (в кДа) отдельной субъединицы комплекса. Он усиленно образуется после теплового шока (быстрое повышение температуры свыше 32 °С), чтобы снова правильно свернуть термически денатурированные белки.
1 Обозначение HSP происходит от англ. Heat Shoke Protien — белок теплового шока. В русских публикациях используют также сокращение БТШ, но в переводе мы следуем международному стандарту. — Примеч. ред.
Более крупные белки и белки, состоящие из нескольких доменов, которые свертываются независимо друг от друга, используют в качестве помощников свертывания шапероны. Самый распространенный шаперон также является белком теплового шока, HSP70. Он связывается в мономерной форме с гидрофобными сегментами развернутых или лишь частично свернутых белков. Предполагают, что от АТФ зависит только отделение полипептидной цепи от шаперона, а собственно свертывание происходит самопроизвольно. Шапероны связывают полипептидные цепи уже во время их синтеза, т.е. котрансляционно. Они препятствуют, таким образом, агрегации белков, которые синтезируются на полисомах (см. 2.2.4), т.е. на соседних рибосомах, которые «идут» вдоль той же молекулы мРНК на расстоянии лишь примерно 80 нуклеотидов. Шапероны и шаперонины часто кооперируются в клетке. Так, при импорте белков в пластиды и митохондрии (см. 7.3.1.4) полипептидные цепи защищены от преждевременного свертывания путем связывания с цитоплазматическими шаперонами HSP70. После транспортировки через мембраны органелл они «принимаются» пластидными или соответственно митохондриальными изоформами HSP70 и для окончательного свертывания передаются шаперонам НSР60-типа, находящимся в строме или соответственно в матриксе (см. рис. 7.18).
Процессинг белков путем химических модификаций и/или протеолиза может происходить также ко- или соответственно посттрансляционно. Примеры представлены в разделе 7.3.1.4, химические модификации для регуляции энзиматической активности упоминались ранее (см. 6.1.7.2, рис. 6.12; 6.69; 6.71).
Только недавно было обнаружено, что в редких случаях белки переводятся в окончательную форму путем сплайсинга (см. 7.2.2.2). При этом из белка-предшественника вырезаются внутренняя последовательность (интеин, нем. interne Proteinsequenz) и внешние участки (экстеины, нем. externe Proteinabschnitte)1и соединяются в зрелый белок. Часто этот процесс является автокаталитическим, т.е. выполняется самим предшественником белка. Интересен пример субъединицы с молекулярной массой 69 кДа вакуолярной АТФазы дрожжей V типа, транслоцирующей ионы водорода (см. рис. 6.5): при автокаталитическом сплайсинге из предшественника с мол. массой 119 кДа удаляется интеин (50 кДа), который в свою очередь проявляет ферментативную активность. Он работает как специфичная эндонуклеаза, распознающая определенные последовательности при интеграции интеинкодирующей ДНК в геном. Интеин и его ДНК представляют собой, таким образом, мобильный генетический элемент (см. 7.2.1.1).
1 На самом деле эти названия заимствованы из англоязычной литературы. — Примеч. ред.
Количество белка в клетке определяется не только скоростью его синтеза, но и скоростью распада. Многие факты говорят о том, что распад белка также является контролируемым клеточным процессом. В клетках эукариот (и архебактерий) находится протеаза с молекулярной массой 600 — 900 кДа, протеасома (см. 1.3.2.3; рис. 1.16), которая встречается у эукариот в цитоплазме и клеточном ядре и неспецифично разлагает белки до коротких пептидов (~6 — 9 аминокислот). Правда, гидролизуются только те белки, которые перед этим маркируются ковалентным присоединением нескольких (4 и более) молекул убиквитина и тем самым намечаются для распада. Убиквитин — это белок из 76 аминокислот, распространенный среди всех эукариот1. Специфичные ферменты ковалентно переносят убиквитин в АТФ-зависимой реакции на остаток лизина белкового субстрата (ход реакции схематично представлен на рис. 7.44). Убиквитинирование может протекать индуцированно, т.е. зависеть от состояния белка (например, фосфорилированный/дефосфорилированный; кроме того, неправильно свернутые белки быстро убиквитинируются), или конститутивно. Тогда N-концевая аминокислота совместно с внутренними остатками лизина (эти структурные элементы, собранные вместе, называются также N- дегроном) определяют биологический период полураспада белка. Например, белки с аргинином или лизином в качестве N- концевой аминокислоты подвергаются быстрому распаду с помощью протеасомы.
1 Название белка восходит к лат. ubiquis — распространенный повсюду, повсеместный. В немецком тексте ubiquitäres. — Примеч. ред.
Наряду с системой убиквитин — протеасома большое значение имеет АТФ-зави- симый гидролиз белков с помощью СIр- протеаз, названных так, поскольку первыми из этого класса протеаз были открыты казеинразлагающие протеазы Escherichia coli (англ. caseinolytic protease). СIр-протеазы встречаются у растений в цитоплазме, клеточном ядре, в пластидах и митохондриях, а также у бактерий и животных.
О распаде белков в митохондриях и пластидах известно пока мало. У растений в гидролизе собственных белков клетки могли бы участвовать также вакуолярные протеазы, присутствующие часто в больших количествах. Об этих процессах также известно мало. Однако вакуолярные протеазы имеют, как полагают, защитные функции, так как они высвобождаются при поражении патогеном из разрушенной клетки и повреждают внедрившийся микроорганизм (см. 9.3.4).
7.3.1.4. Сортировка белков в клетке: биогенез клеточных органелл
Образовавшиеся в митохондриях или пластидах белки остаются в соответствующей органелле, в то время как кодируемые ядром и соответственно синтезируемые в цитоплазме белки либо выделяются, либо должны попасть в определенные компартменты в клетке, чтобы выполнять свою функцию. Следовательно, правильное распределение кодируемых ядром белков является решающим процессом для биогенеза клеточных органелл и для поддержания компартментации (рис. 7.16).
Информация о месте в клетке, куда должен попасть белок, содержится в самом белке, т.е. в итоге, в последовательности нуклеотидов его гена. Сигналами о локализации белкового продукта в клетке служат участки полипептида на N- или С- конце или внутри аминокислотной цепи, которые вступают во взаимодействие со специфичными рецепторами. При этом прежде всего важны конформация и доступность, а не сама аминокислотная последовательность топогенного сигнала1. Это объясняет, почему во многих случаях нельзя обнаружить топогенный сигнал только на основе аминокислотной последовательности или соответственно почему белки, которые имеют в клетке один и тот же целевой компартмент, могут обладать совершенно различными аминокислотными последовательностями в области их топогенных сигналов.
1 В традиции отечественной науки пока еще нет устоявшейся терминологии, поэтому мы оставили исходное немецкое понятие topogenes Signal. В англоязычной литературе встречается также localization «локализующий» или targeting — «нацеливающий» (на определенный компартмент) сигнал. — Примеч. ред.
Рис. 7.16. Схема важнейших процессов распределения кодируемых ядром белков в клетке. Процессы подробно рассмотрены в тексте. С или N обозначают С- или соответственно N-конец белка. NLS — от англ. nuclear localization signal; PTS — от peroxisomal targeting signal; SRP — от signal recognition particle
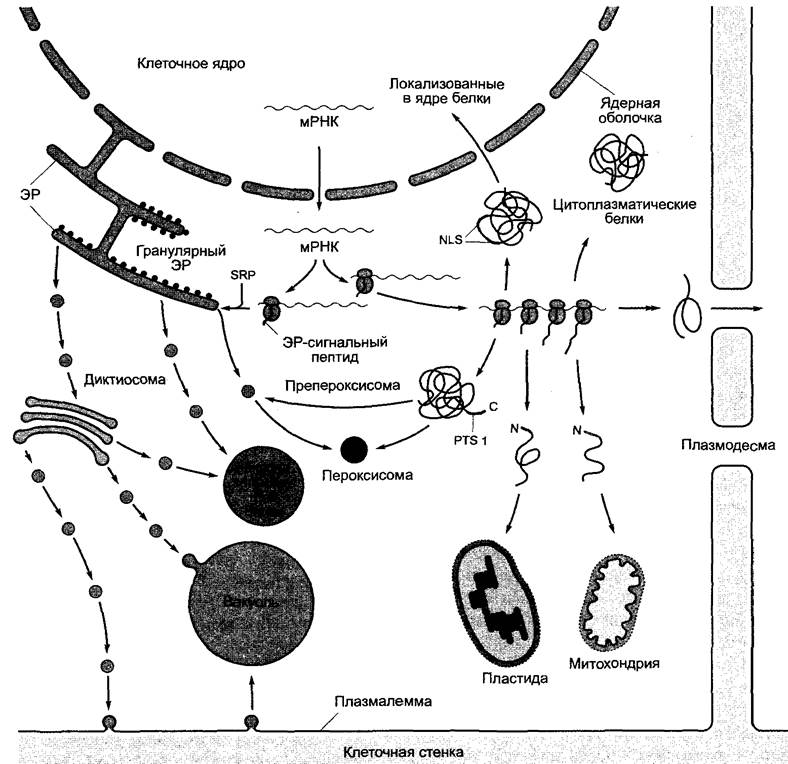
Трансляция всех ядерных мРНК начинается только в цитоплазме. Белки, трансляция которых закончилась на эндоплазматическом ретикулуме (ЭР), обладают N- концевым сигнальным пептидом, составляющим 16 — 30 аминокислот и имеющим в центре от 4 до 12 гидрофобных аминокислот. Как только такой сигнальный пептид покинул рибосому (когда растущая пептидная цепь насчитывает в длину около 70 аминокислот), с ним связывается рибонук- леопротеиновый комплекс SRP (англ, signal recognition particle) и останавливает трансляцию. Комплекс из SRP, рибосомы, возникшей полипептидной цепи и мРНК связывается теперь с SRP-рецептором на поверхности мембраны ЭР, где при отделении SRP и гидролизе ГТФ начало белковой цепи передается на транслокационный комплекс (транслокон) и продолжается элонгация полипептида, причем полипептидная цепь одновременно (котрансляционно) через гидрофильную пору транслокационного комплекса направляется в просвет ЭР. Процесс протекает с отщеплением сигнальной последовательности. Так же котрансляционно свертываются уже белковые домены, при необходимости образуются дисульфидные мостики и олигогликановые цепи связываются с определенными аспарагиновыми остатками с образованием N-гликозидов. Мембранные белки ЭР образуются таким же образом. Однако трансмембранные домены — аминокислотные области, имеющие около 20 гидрофобных остатков, которые имеют структуру α-спирали (или иногда β-слоя), освобождаются из транслокона в мембрану и закрепляют белок в мембране ЭР. Детали хорошо изученных процессов синтеза белка на ЭР не представлены здесь из соображений экономии места.
Синтезированные на ЭР белки транспортируются мембранным (пузырьковым) потоком (см. рис. 7.16) с помощью диктиосом к плазмалемме или вакуолям, или соответственно остаются в ЭР. Если нет других топогенных структур, то передаваемый в просвет ЭР белок выделяется через аппарат Гольджи. Мембранные белки без других топогенных структур оседают тем же путем в плазматической мембране. Для всех остальных целевых компартментов были идентифицированы дополнительные топо- генные сигналы. Так, белки, которые остаются в ЭР, характеризуются С-концевым сигналом удерживания — аминокислотной последовательностью -Lys-Asp-Glu- Leu(COOH) или похожей последовательностью. Белки, предназначенные для вакуолей или соответственно тонопласта, также несут сигнальные последовательности. Это обычно N-концевые последовательности длиной 12—16 аминокислот, почти всегда содержащие мотив -Asn-Pro-Ile- Arg-. Напротив, белки, которые откладываются в запасающих вакуолях (типичных для семян), несут С-концевые или, реже, внутренние мотивы с топогенными сигналами. Во всех известных случаях вакуолярные сигнальные последовательности протеолитически расщепляются в целевом компартменте. Например, токсичный рицин у Ricinus communis в результате удаления внутренней сигнальной последовательности распадается на 2 полипептида, которые в конце концов снова ковалентно связываются друг с другом через дисульфидные мостики и дают А- или соответственно В-цепь зрелогорицина. Образование вакуолей, запасающих белки, происходит лишь частично через пузырьки аппарата Гольджи; наряду с этим пузырьки, содержащие запасные белки, непосредственно отшнуровываются от ЭР.
Если к началу трансляции не образуется ЭР-сигнальный пептид, синтез белка в цитоплазме продолжается с образованием полисом, и образовавшаяся полипептидная цепь отправляется в цитоплазму. Дальнейшее внутриклеточное распределение этих белков, которые транспортируются в пластиды, митохондрии, пероксисомы (или соответственно глиоксисомы) либо в клеточное ядро или при необходимости покидают клетку через плазмодесмы, происходит в свою очередь с помощью разнообразных топогенных сигналов, расшифровка которых в последнее время идет быстрыми темпами. Если они отсутствуют, то белок остается в цитоплазме клетки, в которой он образовался. Далее кратко представим только типичные процессы, в частных случаях возможны многочисленные варианты.
Биогенез пероксисом особенно хорошо исследован у пекарских дрожжей. Принципы формирования пероксисом и глиоксисом высших растений должны быть похожими. Пероксисомы возникают путем посттрансляционного импорта уже полностью свернутых белков в препероксисомы, которые отшнуровываются в виде пузырьков от ЭР и вследствие увеличения содержания белков увеличиваются в объеме. Белки, предназначенные для импорта в эти органеллы, обладают двумя типами аминокислотных последовательностей: PTS1 (С-концевая) или PTS2 (N-концевая) (англ. peroxisomal targeting sequence). PTS2 состоит из девяти, PTS1 — только из трех аминокислот. В типичном случае речь идет о трипептиде -Ser-Lys-Leu-(COOH), который после транспорта не расщепляется. Детали механизма импорта, для которого предполагают наличие большой поры, или эндоцитозоподобный процесс, еще неизвестны. В любом случае даже адсорбированные на пероксисомных белках коллоидные частицы золота диаметром до 9 нм импортируются в клетку вместе с белком.
Во время прорастания у запасающих жиры семян сначала образуется большое количество глиоксисом (мобилизация запасающих липидов, см. 6.12), которые с началом фотосинтеза исчезают и заменяются пероксисомами (фотодыхание, см. 6.5.6). Было показано, что во время этого перехода происходит перестройка глиоксисом в пероксисомы. Так, с помощью специфических антител были обнаружены органеллы, которые содержали как типичные глиоксисомальные, так и пероксисомальные ферменты (ферменты, наличие которых характерно для определенного компартмента). Так как глиоксисомы и пероксисомы имеют многочисленные общие ферменты (например, каталазу и ферменты β-окисления жирных кислот), перестройка глиоксисом в пероксисомы особенно экономична, однако пока непонятно, как именно это происходит.
В уже свернутом состоянии транспортируются также белки, предназначенные для клеточного ядра (например, гистоны, транскрипционные факторы, белки клеточного цикла). В цитоплазме внутренняя сигнальная последовательность из 10 — 38, часто основных, аминокислот (NLS, англ. nuclear localization signal — сигнал ящерной локализации), которая может быть простой или состоять из двух частей, связывается NLS-рецептором — импортином α (рис. 7.17). С импортином α связывается импортин β, который в свою очередь вступает во взаимодействие с белками ядерных пор (структура — см. 2.2.3.4, рис. 2.26) и тем самым направляет импортируемый белок к ядерным порам. Здесь при гидролизе АТФ комплекс белок- импортин - α+β проходит в ядерный матрикс, где и распадается. Импортины α и β транспортируются обратно в цитоплазму для нового использования. Прохождение комплекса им- портин-белок через ядерную пору совершается при участии ГДФ-формы ГТФ-связывающего белка Ran (Ran-ГДФ); в обратном транспорте импортинов α и β в цитоплазму участвуют ГТФ-формы Ran (Ran- ГТФ) (Ran, англ. Ras nuclear, так как речь идет о первом локализованном в ядре Ras- белке; от англ. rat adenosarkoma — опухолевая ткань крысы, в которой был открыт первый ГТФ-связывающий белок этого семейства).
Рис. 7.17. Упрощенная схема импортинзависимого транспорта белков из цитоплазмы через ядерные поры в клеточное ядро. Импорт-комплекс связывается с комплексом ядерных пор (см. рис. 2.26) и проходит при участии АТФ и белка Ran, связанного с ГТФ через ядерную пору. Импортины экспортируются с помощью белка Ran в ГТФ-форме снова в цитоплазму.
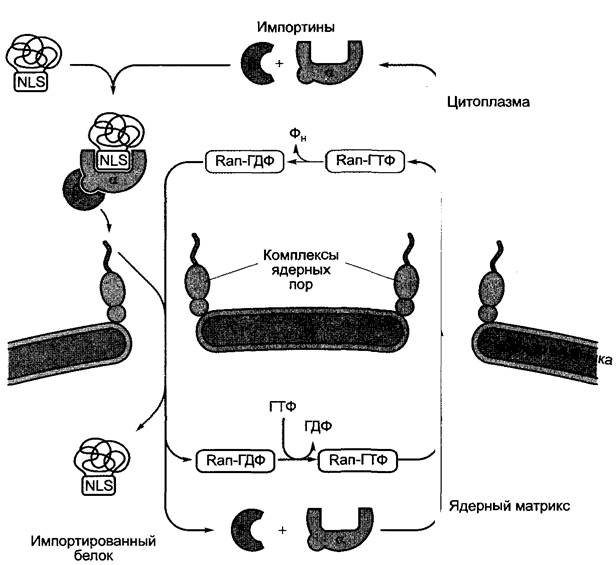
Путем модификации (например, фосфорилирования) NLS-несущего белка может измениться его узнавание NLS-рецептором. Это один из механизмов регуляции ядерного импорта определенных транскрипционных факторов, фосфорилированное состояние которых изменяется под влиянием сигналов, например, из окружающей среды. Рецептор красного света фитохром (см. 7.7.2.4) в неактивном состоянии локализован в цитоплазме, а при освещении, которое ведет к изменению фосфорилированности белка, перемещается в клеточное ядро (см. рис. 7.86).
Импорт белков в митохондрии и пластиды также очень хорошо известен. Далее ограничимся описанием импорта белков в хлоропласт, обращая внимание на различия транспорта белков в митохондрии. Рассмотрим только основной транспортный путь (рис. 7.18).
Рис. 7.18. Схема импорта белков в хлоропласты. В местах контакта внутренняя и внешняя мембраны пластиды вступают во взаимодействие через белковые компоненты упрощенно представленного здесь транслокационного аппарата (ТОС-комплекс, TIC-комплекс). Белки импортируются в развернутом состоянии, если они обладают N-концевой сигнальной последовательностью, транзитным пептидом. Фосфорилированный транзитный пептид сначала связывается при дефосфорилировании ТОС86-белком (мол. масса 86 кДа) и затем переносится на образованную ТОС75 транслокационную пору. Дальнейшие объяснения см. в тексте
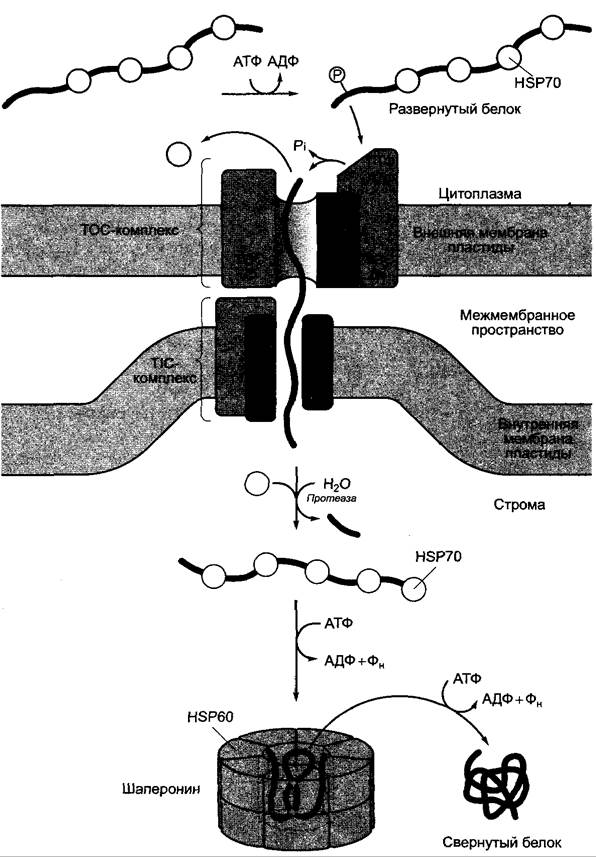
Белки, предназначенные для импорта в хлоропластах, несут на N-конце транзитный пептид, а импортируемые в митохондрии — участок, названный лидернойпоследовательностью, который после импорта протеолитически расщепляется. Митохондриальные лидерные последовательности длиной 15 — 35 аминокислот всегда положительно заряжены и образуют амфипатическую α-спираль: гидрофобные остатки находятся на одной, гидрофильные остатки — на противоположной стороне спирали. Напротив, пластидные транзитные пептиды длиннее (30 — 100 аминокислот; транзитный пептид EPSP-синтазы, например, состоит из 77 аминокислот). Они содержат много полярных аминокислот, однако ни одной (или лишь немногочисленные) положительно заряженной аминокислоты, и не образуют амфипатической α-спирали. В отличие от митохондриальных лидерных последовательностей они, напротив, фосфорилируются по сериновым и/ или треониновым остаткам. На этих характерных отличиях основывается правильная сортировка белков в хлоропластах или соответственно митохондриях. Процесс транслокации в обоих случаях происходит посттрансляционно и протекает очень похоже: импортируемые белки в обоих случаях развернуты, т. е. имеют сравнительно мало характерных структурных особенностей.
При импорте белка в матрикс или соответственно строму органеллы должны быть преодолены две мембраны. Транспорт происходит в местах контакта. Здесь можно обнаружить рецепторы сигнальных последовательностей и транслокационные комплексы. Различают транслокон внешней оболочки хлоропластов (ТОС, англ. translocon of the outer chloroplastmembrane) и внутренней оболочки хлоропластов (TIC, англ. translocon of the inner chloroplast membrane). Аналогично у митохондрий существует ТОМ- и TIM-система, белки которой, однако, не гомологичны ТОС и TIC.
Согласно современным представлениям, развернутая конформация белков, которые нужно импортировать, поддерживается цитоплазматическими шаперонами (см. 7.3.1.2), в первую очередь HSP70. После связывания сигнальной последовательности с рецепторным белком (у хлоропластов это белок ТОС-комплекса с мол. массой 86 кДа) в АТФ- и ГТФ- зависимой реакции происходит протягивание полипептидной цепи через транслокационный аппарат. У хлоропластов в импорте белков участвует также ТОС75, образующий пору, через которую могут проходить также и ионы. Перед транслокацией транзитный пептид дефосфорилируется. На стромальной стороне сигнальная последовательность протеолитически расщепляется и с помощью пластидной изоформы НSР70 и шаперонина Нsр60 (см. 7.3.1.2) свертывается зрелый биологически активный белок. Весь процесс импорта белка стромы из цитоплазмы требует энергии: как в цитоплазме, так в межмембранном пространстве и в строме должна присутствовать АТФ (см. рис. 7.18). При митохондриальном импорте белков требуется, кроме того, разность электрического потенциала на внутренней мембране митохондрий.1
1 В последнее время обнаружены хлоропластные белки, которые импортируются только в том случае, когда мембрана тилакоидов обладает высокой разностью потенциалов (∆μн+). — Примеч. ред.
Некоторые белки хлоропластов, например, пластоцианин (см. 6.4.4), которые локализованы в просвете тилакоидов, должны транспортироваться из цитоплазмы через три мембраны. Предшественник пластоцианина обладает удвоенной N-концевой сигнальной последовательностью: транзитный пептид, включающий 38 аминокислот, который расщепляется в строме, и присоединенный к нему второй сигнальный пептид длиной 28 аминокислот, который после отщепления транзитного пептида освобождается и участвует в транспорте через мембрану тилакоидов. У некоторых белков транспорт через мембрану тилакоидов зависит от градиента pH между стромой и люменом тилакоидов.
7.3.2. Клеточный цикл и контроль клеточного цикла
В основе развития растения лежат клеточное деление, клеточный рост и клеточная дифференцировка. Характерная для животных дополнительная клеточная миграция не играет роли у растений и подчиненное значение имеет у них апоптоз, важный для развития животного. Под апоптозом понимают регулируемое отмирание и следующую за ним смерть клеток в процессе развития органов, как, например, при образовании пальцев. Начинающийся апоптоз можно узнать по фрагментированию ДНК между нуклеосомами (см. 2.2.3.1), например, с помощью гель-электрофорезного разделения возникших фрагментов. Фрагментирование ДНК наблюдали при старении плодолистиков. Под старением плодолистиков понимают возрастные изменения, связанные с их отмиранием (см. 7.6.2.3); они происходят у многих растений при отсутствии оплодотворения. Апоптозоподобные процессы у растений чаще называются запрограммированной гибелью клеток. К этому феномену относится образование воздухоносных тканей (аэренхимы, см. рис. 3.8) путем распада клеток коровой паренхимы, как это происходит прежде всего при недостатке кислорода (например, у кукурузы, см. 7.6.5.2). Кроме того, у покрытосеменных это гибель трех из четырех дочерних клеток, получающихся из материнской клетки зародышевого мешка в результате мейоза; четвертая клетка зародышевого мешка образует женский гаметофит (см. 11.2). Как запрограммированную гибель клеток, кроме того, можно воспринимать отмирание суспензора во время эмбриогенеза (см. рис. 3.1), а также отмирание определенных клеток (например, склеренхимных клеток, трахей, трахеид) в ходе дифференцировки клеток. Наконец, так называемая реакция гиперчувствительности, сопровождающаяся гибелью клеток при патогенном поражении, также запрограммирована: она вызывается продуктами гена авирулентности патогена1 в специфичной реакции при взаимодействии с рецепторами растительных клеток (см. 9.3.1; 9.3.4; рис. 9.17).
1 Речь идет об элиситорах, выделяемых патогеном. — Примеч. ред.
Дифференцировка клеток происходит после окончания клеточных делений. Дифференцированные клетки больше не делятся, однако могут в подходящих условиях (например, при повреждении ткани или в экспериментальных условиях культуры in vitro на подходящих питательных средах, см. 7.1, рис. 7.1) «реэмбрионализироваться»1, т. е. снова начать клеточные деления. Поэтому контроль клеточного цикла, т.е. регулируемая смена митозов и интерфаз (см. 2.2.3.5; рис. 2.30), имеет важное значение в развитии. Как упоминалось ранее, митоз обозначается как М-фаза клеточного цикла. Она заканчивается клеточным делением. Промежуток между двумя митозами, интерфаза, является собственно фазой активности генов. Репликация генетического материала (см. 1.2.3, рис. 1.7, 1.9) происходит в S-фазе. S- и М-фазы отделены друг от друга двумя промежутками, G1 и G2-фазой; геном транскрипционно активен на протяжении всей интерфазы, т. е. даже во время репликации ДНК.
1 «Reemboryonalisieren» не термин, а образный оборот немецкой речи, означающий «как бы возврат клеток к эмбриональному состоянию». — Примеч. ред.
Отдельные периоды клеточного цикла (см. рис. 2.30; 7.19) могут заметно различаться по продолжительности. Так, у кукурузы клеточный цикл в клетках покоящегося центра меристемы корня длится в среднем 170 ч (на G1-фазу приходится из них 135 ч), в то время как инициальные клетки корневого чехлика делятся в среднем один раз за 14 ч, причем G1-фаза отсутствует; репликация ДНК начинается непосредственно после окончания клеточного деления. В апикальных меристемах побега клеточный цикл длится от 20 (Silene coeli-rosa) до 288 ч (Sinapis alba), в меристеме цветка — от 10 (Silene) до 47 ч (Ranunculus), у инициальных клеток в камбии Tsuga canadensis — от 10 до 28 дней, у Pinus — около 1 дня.
Рис. 7.19. Регуляция клеточного цикла растения: А — протекание клеточного цикла в решающей степени контролируется киназами клеточного цикла (Cdk, cyclin-dependent kinase, у Arabidopsis thaliana — Cdc2a и Cdc2b) и их активаторами — циклинами, появляющимися специфично по стадиям (в растениях три типа циклинов: А, В и D; у Arabidopsrs thaliana:СусА2, СусВ1 и В2, CycD1, D2 и D3). Фитогормоны влияют на процесс клеточного деления в контрольных точках (серые треугольники); дальнейшие объяснения в тексте; В — образование и распад комплекса из Cdc2-KHHa3bi и G2 —> M- специфичного циклина В-типа, контролирующего переход от G2-фазы к митозу. Активный комплекс (MPF — от maturation promoting factor) образуется после ассоциации обоих белков, сопровождающейся гиперфосфорилированием и частичным дефосфорилированием Cdc2 до монофосфорилированной формы. MPF индуцирует начало митоза: он фосфорилирует гистон Н1 (начало конденсации хроматина, см. 7.2.2.2) и индуцирует фосфорилированием ламины распад ядерной оболочки. Монофосфорилированная Cdc2 индуцирует одновременно убиквитинирование и тем самым — протеолитический распад своего ассоциированного циклина. Синтез и распад циклина определяют, таким образом, количество MPF, которое вовремя G2—>M-перехода обладает характерной динамикой
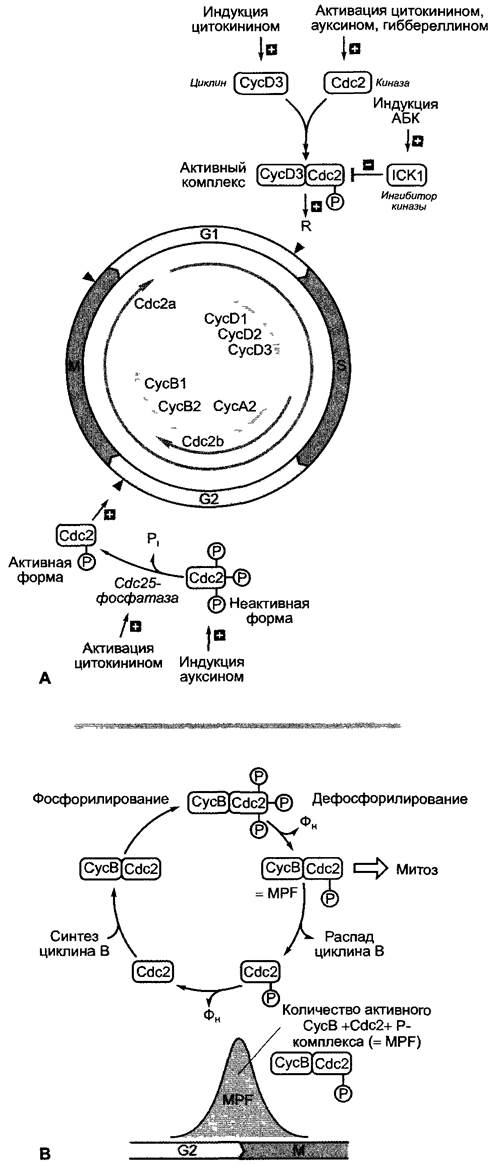
Основные этапы регуляции включаются соответственно незадолго перед решающими переходами между отдельными этапами клеточного цикла (рис. 7.19):
✵ перед G1 —> S-переходом (ключевая точка R, у дрожжей также называется START); здесь происходит регуляция начала репликации и тем самым вступление в новый цикл клеточного деления; остановка клеточного цикла в G1-фазе предшествует началу дифференцировки клеток;
✵ перед G2 —> M-переходом; здесь регулируется начало митоза; при неполной репликации ядерного генома или соответственно при повреждении ДНК клеточный цикл останавливается в этой точке;
✵ перед M —> G1-переходом; здесь происходит собственно деление клетки; при нарушении расположения хромосом в веретене деления клеточный цикл останавливается в метафазе (см. 2.2.3.5).
Молекулярные процессы контроля клеточного цикла были исследованы в первую очередь на клетках млекопитающих и дрожжах. У высших растений (и, предположительно, у всех эукариот) эти процессы, по-видимому, протекают подобным образом. Ключевую роль играют циклинзависимые протеинкиназы(Cdk, англ. cyclin- dependent kinase). Пекарские дрожжи обладают одной-единственной киназой (Cdc2, англ. cell division cycle mutant), названной по мутантам дрожжей, которые позволили идентифицировать ген. У высших растений, однако, циклинзависимые протеинкиназы представлены несколькими похожими белками (у Arabidopsis thaliana, например, их два: Cdc2a и Cdc2b; см. рис. 7.19). Циклины — это белки, появляющиеся в клеточном цикле на специфичных стадиях. Их синтез и распад строго контролируются системой убиквитин/протеасома (см. 7.3.1.3). Циклины являются активаторами Cdk. Предполагают, что отдельные переходы в клеточном цикле контролируются различными комбинациями циклинов с циклинзависимыми киназами, которые путем фосфорилирования регулируют активность различных групп целевых белков, важных для соответствующих переходов (например, транскрипционные факторы, гистоны, белки ядерной оболочки). Вызывающий клеточное деление фактор MPF (англ. maturation promoting factor), например, был выявлен как комплекс Сdс2-киназы с G2 —> M-циклином В. Наряду с ассоциацией с циклинами киназы регулируются в свою очередь путем фосфорилирования; в гиперфосфорилированной форме они неактивны, но могут активироваться специфичными фосфатазами, например Cdc25. Cdk-киназы снижают активность при ассоциации с ингибиторными белками (ICK, inhibitor of cyclin-dependent kinase), так что существует множество действенных механизмов регуляции активности киназ клеточного цикла. Всего у дрожжей до сих пор было найдено более 50 различных Cdc-генов.
В регуляцию клеточного цикла вмешиваются внешние факторы: так, у дрожжей G1 —> S-переход контролируется в точке START наличием питательных веществ, размером клетки и феромонами; ключевая точка в животных клетках регулируется факторами роста. В последнее время выяснено, что у высших растений в регуляции контроля клеточного цикла участвуют фитогормоны (см. рис. 7.19). Стимулирующие клеточное деление цитокинины индуцируют образование G1 —> S-циклина CycD3 и участвуют в активации киназ клеточного цикла при G2 —> M-переходе. Их образование находится под контролем ауксинов (см. 7.6.1). Абсцизовая кислота (см. 7.6.4) индуцирует образование ингибитора киназ ICK1 и ингибирует, таким образом, G1 —> S- переход.
В особых случаях последовательность реакций может быть прервана в любом месте митотического цикла (рис. 7.20): удвоение ДНК без последующего разделения хромосом ведет к политении; также во многих семенах, например, после фазы репликации ДНК (S-фаза) в G2-фазе может включиться также период покоя. Однако если внутри сохранившейся ядерной оболочки происходит удвоение хромосом без видимого их проявления, но не происходит деление ядра, то возникают эндополиплоидные клетки (см. рис. 2.31). В клетках, обладающих только одной пластидой (многие водоросли, мох Аntheros, см. 11.2) или даже одной митоходрией (водоросль Мikromonas), эти органеллы делятся строго синхронно с клеточным ядром. За счет чего достигается эта согласованность, пока неизвестно.
Рис. 7.20. Процессы, входящие в клеточный цикл, и их возможные отклонения
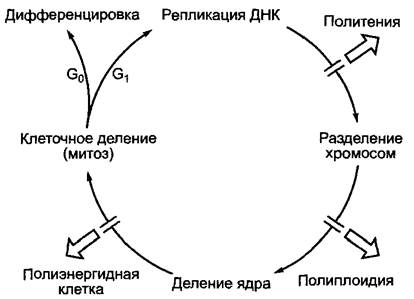
Правда, в полиэнергидных клетках многих водорослей и грибов, а также в многоядерном эндосперме (см. рис. 2.33) происходят многократные репликации ДНК, деления хромосом и ядра, но клеточное деление подавлено. При последующем образовании клеточной стенки в многоядерном эндосперме (например, у Наemanthus katharinae) клеточные стенки возникают между такими ядрами, которые не являются сестринскими, и между ними поэтому нет веретена деления. Следовательно, здесь образование клеточной стенки утратило свою обычную связь с делением ядра. Клеточные деления, при которых одна из дочерних клеток не получает ядра, у растений, как правило, не происходят; безъядерные клетки, например, зрелые членики ситовидных трубок, теряют свое ядро после деления.
О физиологических аспектах митоза известно очень мало. Часто клеточные деления происходят ритмично; частично, по-видимому, они управляются суточной периодичностью (корни лука, образование зооспор у водорослей), однако в течение 24 ч могут также пройти и несколько периодов. У многих водорослей митозы происходят преимущественно ночью: Spirogyra, например, делится обычно около полуночи. У многоядерных клеток деления ядра часто начинаются синхронно, чему, вероятно, способствует цитоплазма, или идут вперед волнообразно от одного конца клетки к другому (см. 11.2, зародышевый мешок). Как и другие физиологические процессы, клеточное деление совершается лишь внутри определенных видоспецифичных границ температур, часто с ярко выраженным оптимумом (у гороха, например, между 0 и 45 °С, оптимум при 28 — 30 °С). Проростки могут быть приспособлены к более низким температурам, чем более старые растения.
Эмбриональные клетки (например, апикальные клетки или инициальные клетки меристем, см. 3.1.1) образуют дочерние клетки, которые либо делятся дальше, либо при утрате способности к делению начинают непосредственно дифференцировку путем роста растяжением. Вступающие в процесс дифференцировки клетки покидают клеточный цикл в G1-фазе (см. рис. 7.19; 7.20) и переходят в неактивно е, в отношении деления, состояние (G0-фаза). Этот переход находится в том числе и под гормональным контролем; многие детали, однако, еще непонятны.
В подходящих условиях уже дифференцированные клетки могут заново вступить в клеточный цикл (G0 —> G1). Этому способствуют, среди прочего, фитогормоны, что используют при регенерации растений из клеточных культур (см. рис. 7.1; 7.6.2). Образуются полноценные растения со всеми видовыми признаками, что доказывает тотипотентность растительных клеток. Часто при регенерации растения из клетки in vitro сначала образуется соматический зародыш, похожий на зиготический зародыш, чьи верхушечные меристемы дифференцируются затем в побег и корень (пример: Daucus carota, см. рис. 7.1). Эти процессы регенерации имеют экономическое значение: их применяют для размножения некоторых декоративных растений, например, орхидей, которые сложно вырастить из семян. В промышленных масштабах орхидеи производят методом микроклонального размножения в культуре in vitro из механически изолированных клеток мезофилла листа или из меристематической ткани. Регенерация растений из культур клеток или соответственно тканей представляет собой важный этап при создании трансгенных растений (см. бокс 7.3).
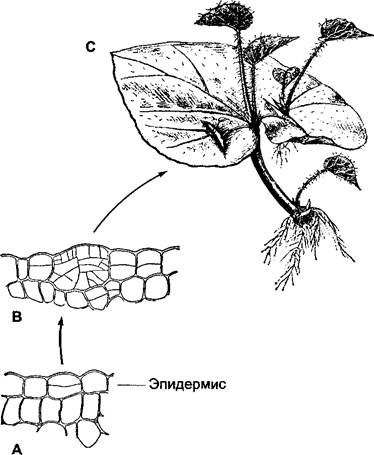
После повреждения из отделенных листьев бегоний корни развиваются не только на нижнем (базальном) конце листового черешка, но и в основании листовой пластинки. Особенно легко на нижнем краю разреза отделенных листовых жилок образуются адвентивные почки, из которых снова могут получиться целые растения бегонии. Эти адвентивные побеги возникают из одной-единственной клетки эпидермиса, снова ставшей эмбриональной (рис. 7.21), в то время как адвентивные корни образуются из делящихся клеток вблизи флоэмы проводящего пучка.
Рис. 7.21. Регенерация побегов и корней на листовых черенках Begonia : А, В — образование адвентивного побега из клетки эпидермиса (фрагменты поперечного среза листа, 150х): А — клетка эпидермиса поделилась однократно; В — из клетки эпидермиса получилась многоклеточная вторичная меристема, дающая сначала адвентивную почку, а и из нее в свою очередь — побег (С)
Образование вторичных меристем (например, пробкового камбия и межпучкового камбия) является примером естественной дедифференцировки (как бы возврата в эмбриональное состояние) уже дифференцированных в процессе развития клеток и образования раневого каллуса вследствие повреждения ткани и при срастании тканей при проведении прививок.
При прививке отрезанные части растения (привои), несущие почки, срастаются с надрезанными частями того же или совместимого близкородственного вида (подвои) с помощью каллуса, развивающегося на месте раны. В каллусе дифференцируются флоэмные и ксилемные элементы, которые при успешно произведенной прививке связывают между собой соответствующие ткани в проводящих пучках привоя и подвоя. Прививки особенно важны для садовой и сельскохозяйственной практики, потому что таким образом на подвоях могут сохраняться и размножаться, например, негомозиготные формы и сорта, которые нельзя размножить семенами (например, в плодоводстве и виноградарстве, в селекции роз).
К тому же после срастания каждый партнер сохраняет свой наследственный материал неизмененным. Благодаря обмену веществ, происходящему между привоем и подвоем, возможна модификация свойств обоих прививочных компонентов. Изменение свойств особенно впечатляет в прививках, у которых из каллуса в месте прививки возникают адвентивные побеги, составленные из сросшихся друг с другом тканей обоих партнеров (химеры). У секторккальных химер один сектор побега или листа образуется из привоя, а остальные, напротив, — из подвоя. Особенно примечательны периклинальные химеры, у которых эпидермис и, возможно, некоторые внешние слои происходят от одного партнера, а внутренние ткани, напротив, — от другого партнера (прививки у видов Cytisus, прививки между Crataegus и Mespilus и др.). Такого рода «прививочные гибриды» могут внешне производить впечатление настоящих гибридов, возникших половым путем, однако им не тождественны: даже при таких теснейших срастаниях каждая клетка или соответственно клеточный слой все-таки сохраняет свой видовой генетический материал, несмотря на то что внешний облик позволяет отчетливо узнать взаимное влияние слоев ткани различных видов.
Центральный, но до сих пор недостаточно объясненный этап физиологии развития касается детерминации, т. е. определения судьбы дифференцирующейся клетки, ткани или органа. Следствием детерминации является переключение каким-то образом активности генов, которое обеспечивает производство генных продуктов, требующихся для процесса дифференцировки. Как упоминалось ранее (см. 7.1), клеточно-автономные процессы при этом играют лишь определенную роль. Кроме того, процесс дифференцировки находится одновременно под индуктивным контролем со стороны своего окружения. Индуцирующие раздражения могут исходить из самого организма (эндогенные раздражители, например, фитогормоны, см. 7.6) и/или речь идет о внешних влияниях. Подобные экзогенные раздражители могут иметь биотическую природу (т. е. исходят от других живых существ, как, например, при галлообразовании или при образовании корневых клубеньков — см. гл. 9) или их происхождение абиотическое (физические или химические раздражители, как, например, фактор света — см. 7.7). Раздражителем назовем любой физический или химический сигнал, вызывающий в организме специфичную последовательность реакций, энергетические потребности которой покрываются самим организмом. Процесс развития, на который можно повлиять внешними факторами, называется актиономным, а не подверженный их влиянию — эндономным.1
1 Последние два термина не являются общеупотребительными и введены, скорее, из натурфилософских соображений (греч. aitios — причинный, nomos — закон, т. е. аитиономный — требующий (внешней) причины; греч. endos — внутренний, т.е. подчиняющийся внутренним законам). — Примеч. ред.
Эндономна, например, детерминация и установленное тем самым развитие флоэмных элементов, отделяемых камбиальными инициалами у Тахасеае, Taxodiaceae и Cupressaceae («четырехтактный цикл»: ситовидная клетка — флоэмное волокно — ситовидная клетка — клетка паренхимы и т.д.).
Эндономно детерминирована также клеточная дифференцировка у Volvox caríen (см. 11.2). Эта водоросль состоит из 2 000—4000 соматических и 16 репродуктивных клеток, которые находятся в клеточном сообществе в строго определенных позициях. При эмбриогенезе во время шестого клеточного деления (и только здесь!), т. е. при переходе от 32- к 64-клеточной стадии, у 16 клеток 32-клеточного эмбриона происходит неравное клеточное деление: возникшие более мелкие клетки (диаметр < 6 мкм) развиваются в соматические клетки, более крупные (>9 мкм) — в гониды. Каким образом величина клетки определяет дальнейшую дифференцировку, неизвестно.
В значительной степени эндономно детерминирован эмбриогенез у многоклеточных растений (см. рис. 3.1; 7.4.1). Пример аитиономных процессов развития, при которых наряду с эндогенными факторами судьбу клетки в значительной степени определяют внешние факторы, — это переход меристемы побега в меристему цветка, управляемый фотопериодом. Этот процесс хорошо исследован, особенно механизмы формирования органов, которые подробно рассмотрены далее (см. 7.4.3).
Градиенты веществ внутри клетки ведут к полярности; они могут влиять на дифференциацию дочерних клеток и тем самым обусловливать полярность целых органов. Градиенты веществ между клетками, кроме того, важны для процессов детерминации, при которых судьба клетки определяется ее позицией в органе или соответственно в ткани; тем самым градиенты веществ важны также для процесса разметки (см. 7.4.2). Наконец, градиенты веществ между органами ответственны за коррелятивные процессы развития (см. 7.5).
Под полярностью в биологии понимают физиологическую или морфологическую неравноценность двух полюсов или двух поверхностей в живой системе, в простейшем случае — в клетке. Морфологическая полярность выражается, например, в строении таллофитов и листостебельных растений: она заметна уже в раннем эмбриогенезе (см. рис. 3.1) и объясняется выраженной еще в зиготе биохимической (физиологической) полярностью (см. ниже). Неравное клеточное деление, которое (как в примере с Volvox) является решающим этапом дифференцировки, предполагает также физиологическую полярность, отмеченную лишь внешне положением веретена деления и новообразованной клеточной стенки. Не сами клеточные деления, а лежащая в их основе поляризация клеток определяет соответственно характерную форму тела растения в пространстве.
Когда яйцеклетки или споры у низших растений (например, яйцеклетки бурых водорослей Sargassum и Coccophora) покидают материнское растение, то они лишь в исключительных случаях уже поляризованы материнским растением. Как правило, их поляризация происходит только под влиянием внешнего воздействия (света, силы тяжести); у яйцеклеток она возможна только после оплодотворения.
Если споры Equisetum или оплодотворенные яйцеклетки Fucus или Pelvetia (Phaeophyceae) освещаются односторонне, то индуцируется неравное распределение веществ в цитоплазме и в итоге происходит неравное клеточное деление, причем клетка на теневой стороне становится ризоидным полюсом, а другая, более крупная, — исходной клеткой остального таллома (рис. 7.22). У зигот Pelvetia или Fucus ризоид дает отростки уже перед клеточным делением, т. е. деление лишь стабилизирует заранее прошедшую в клетке поляризацию (см. ниже). Как показывают опыты с освещением половины зиготы, определяющим фактором для индукции полярности является ослабление общей освещенности клетки, а не направление света (рис. 7.23, В).
Рис. 7.22. Поляризация споры Equisetum: А — неполяризованная спора; В — начало поляризации; С — отграничение ризоидной и проталломной клетки; D — ранняя многоклеточная стадия
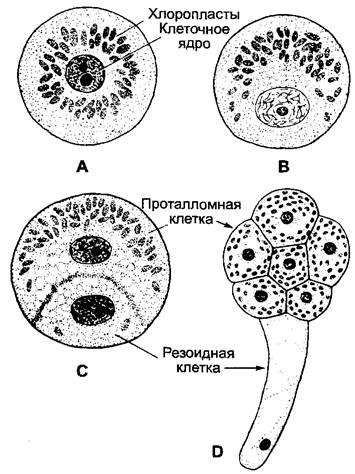
Продолжительность освещения, необходимая для индукции поляризации, снижается с ростом интенсивности света; следовательно, существенно количество света. У спор Equisetumдля максимальной поляризации необходимо при 2 В • м-2 белого света ~10 мин, при 20 В • м-2 — 1 — 5 мин, при использовании осветителя с газоразрядной импульсной лампой только 10-3 с. Действенные длины волн у яйцеклеток или соответственно зигот бурых водорослей и спор Equisetum располагаются чаще всего в синей и ультрафиолетовой области. У бурых водорослей в качестве фоторецептора выступает, предположительно, белок, содержащий ретиналь, имеющий сходство с сенсорным родопсином зеленых водорослей. Первой заметной реакцией в спорах Equisetum, поляризованных односторонним освещением, является перемещение пластид на обращенную к свету сторону клетки, т.е. в будущую клетку проталлома, и смещение клеточного ядра в противоположном направлении (рис. 7.22, В). Это движение индуцируется даже тогда, когда освещены не пластиды и не клеточное ядро, а исключительно цитоплазма.
Если индуцирующего влияния одностороннего освещения нет, то часто индуцирующее действие оказывает сила тяжести (ризоидный полюс направлен к центру Земли). Если нет никаких других направляющих внешних факторов (что достижимо лишь в эксперименте), то ризоиды возникают у зигот Pelvetia или соответственно Fucus в случайном месте внедрения сперматозоида, а у спор Equisetum — в определенном месте, ризоидной точке, которая при направленной индукции светом или силой тяжести обычно не проявляется. Доказано влияние соседних клеток на индукцию поляризации: если как минимум 10 зигот Fucus расположены плотно друг к другу, то часть внутренних клеток совсем не образует ризоидов, в то время как они возникают у внешних клеток по направлению к центру группы. Вскоре после индукции поляризацию у зигот Fucus еще можно остановить или даже обратить вспять, воздействуя противоположно направленным градиентом (например, освещением).
Молекулярные процессы при поляризации клеток у зигот Pelvetia и Fucus исследованы особенно хорошо (рис. 7.23). При одностороннем освещении на противоположной от света стороне зиготы в кортикальной цитоплазме сначала образуется цитоскелетный «чехлик» из F-актина (см. 2.2.2.1). При отсутствии каких-либо внешних влияний эта структура образуется на месте внедрения сперматозоида в яйцеклетку. Актиновый «чехлик» маркирует образующийся ризоидный полюс клетки и способствует тому, что определенные популяции пузырьков Гольджи транспортируются в направлении ризоидного полюса и там сливаются с плазмалеммой. Пузырьки Гольджи несут с собой, с одной стороны, специальные мембранные белки (например, Са2+-каналы и анкерные белки для микротрубочек) а, с другой стороны, ферменты, которые, среди прочего, требуются для перестройки клеточной стенки при ризоидном росте, а также структурные компоненты клеточной стенки (среди них специфический сульфатированный фукан). Поток пузырьков усиливается и направляется благодаря Са2+-градиенту, растущему в направлении ризоидного полюса. Са2+- градиент возникает очень скоро после образования F-актинового «чехлика», вероятно, в то время как равномерно распределенные поначалу в плазмалемме Са2+-каналы перемещаются на возникший ризоидный полюс (в направлении актинового «чехлика»); позже секреторные пузырьки Гольджи, сливаясь с плазмалеммой, доставляют другой канальный белок. В области модифицированной клеточной стенки начинает расти ризоидный полюс, и пузырьки Гольджи поставляют необходимый для построения клеточных стенок материал.
Рис. 7.23. Возникновение клеточной полярности у зиготы Fucus: А — в оплодотворенной яйцеклетке на месте проникновения сперматозоида начинается построение оси полярности (1), которая, однако, после образования клеточной стенки зиготы и закрепления зиготы на субстрате под влиянием внешних факторов, особенно света, заменяется новой осью полярности (2). На образующемся ризоидном полюсе специфическим образом модифицируются плазмалемма и клеточная стенка и начинается рост ризоида (3, 4), центриоли также располагаются параллельно оси полярности (4), (5). Тем самым устанавливаются плоскость клеточного деления и положение новой клеточной стенки перпендикулярно по отношению к оси клеточной поляризации (5), (6). Обе дочерние клетки дифференцируют таллом или ризоид при ограничивающем влиянии клеточной стенки. Снизу находится модифицированная область клеточной стенки. Дальнейшие объяснения см. в тексте; В — возникновение ризоидов у зиготы Fucus на самом темном месте
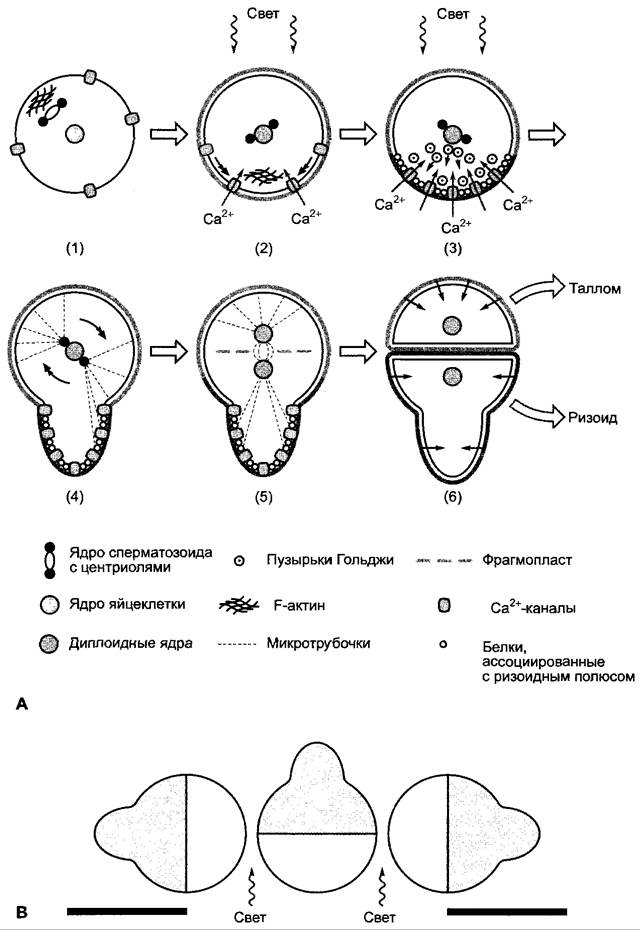
Поляризованная вдоль оси клетка проходит теперь первое неравное клеточное деление, плоскость которого расположена строго перпендикулярно по отношению к оси поляризации клетки. Из базальной дочерней клетки дифференцируется ризоид, в то время как апикальная дочерняя клетка образует таллом. Для организации клеточного ядра и веретена деления ризоидный полюс также крайне важен тем, что микротрубочки от одной из двух центросом, которые образуют будущий полюс веретена (см. бокс 2.2), своим свободным концом вступают в контакт с анкерными белками на ризоидном полюсе. Таким образом, полюса веретена организуются параллельно оси поляризации клетки (рис. 7.23, А). Так, плоскость фрагмопласта (см. 2.2.3.6), а соответственно и плоскость будущей клеточной стенки располагаются перпендикулярно по отношению к продольной оси поляризованной зиготы.
Дальнейшая судьба обеих дочерних клеток при дифференцировке определяется главным образом различным составом клеточных стенок: если выделить из этих клеток протопласты, то дальнейшая дифференцировка нарушается. Если разделить две клетки, то они, напротив, сохраняют дифференцировку: независимо друг от друга верхняя клетка развивается в таллом, а из нижней клетки формируется ризоид. Если соединить протопласт одной дочерней клетки с клеточной стенкой другой дочерней клетки, то детерминирование изменяется: протопласт клетки ризоида в контакте с клеточной стенкой, оставшейся от дочерней клетки таллома, дифференцируется в клетки таллома, и, наоборот, при контакте с клеточной стенкой, оставшейся от клетки ризоида, протопласт клетки таллома образует клетки ризоида.
Показано, что сходные процессы идут и при поляризации других клеток. Так, существует много параллелей с ранними стадиями эмбриогенеза у покрытосеменных (см. 7.4.1) и с асимметричным ростом других клеток, в основе которого лежит направленная локальная секреция материала клеточной стенки, например, при почковании дрожжей и, предположительно, также при апикальном росте клеток.
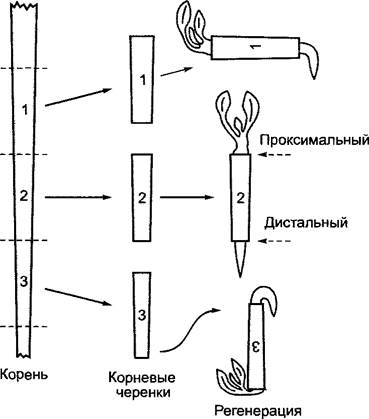
Особенно устойчива и, как правило, необратима однажды приобретенная полярность у высших растений. Так, например, на отрезанных ивовых ветках во влажной атмосфере на апикальном конце прорастают почки, в то время как на базальном конце образуются только корни, хотя и здесь имеется достаточно зачатков почек (рис. 7.24). Корневые черенки, например, львиного зева или цикория, во влажной земле дают почки на проксимальной стороне, а корни, напротив, — на дистальной стороне (рис. 7.25). При прививках также обнаруживается полярность прививочных компонентов, поскольку срастаются друг с другом только правильно ориентированные части. Эта полярность определяется эндогенно и не может быть перенаправлена внешними факторами, например, измененным воздействием силы тяжести (см. рис. 7.24; 7.25). Полярность выражена в любом небольшом фрагменте побега и корня, что напоминает поведение постоянного магнита, когда даже обломки всегда сохраняют два разноименных полюса. Кажется, обоснованным вывод, что и у высших растений каждая отдельная клетка поляризована и полярность отдельных клеток определяет полярность органа в целом.
Рис. 7.24. Полярная регенерация и прорастание стеблевых черенков ивы, подвешенных во влажном пространстве в нормальном (А) и противоположном (В) положениях
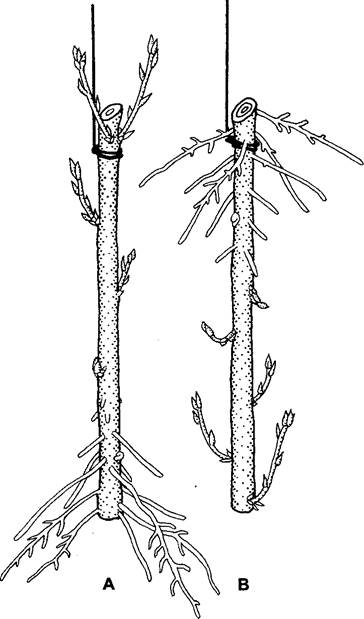
Рис. 7.25. Полярная регенерация у корневых черенков. Побеговые почки возникают всегда на проксимальном (ближайшем к корневой шейке) конце, независимо от положения в пространстве
Только недавно у животных, а также у зигот бурых водорослей было обнаружено, что в образовании клеточной полярности участвует также асимметричное распределение мРНК и, как следствие, асимметричное распределение транслируемых белков. Направленное распределение мРНК осуществляется, вероятно, с помощью специфичных мРНК-связывающих белков, которые перемещаются, перенося мРНК с затратой энергии вдоль элементов цитоскелета в соответствующую целевую область клетки.