БОТАНИКА ТОМ 2 - ФИЗИОЛОГИЯ РАСТЕНИЙ - 2007
7. ФИЗИОЛОГИЯ РАЗВИТИЯ
7.4. Взаимодействие клеток в процессе развития
Уже у клеточных сообществ прокариот, основанных на разделении функций (пример; образование гетероцист у азотфиксирующих цианобактерий), а также у многоклеточных растений детерминация и направляемая ею дифференцировка клетки зависят от положения клетки в клеточном сообществе или соответственно организме. Так, проводящие пучки в аспексе побега однодольных растений развиваются на определенном расстоянии от поверхности, в то время как эпидермис обычно возникает только непосредственно на поверхности. В оси побега и в корне слои ткани всегда расположены в характерной последовательности. Названные примеры подтверждают наличие радиальной позиционной информации в осевых органах высших растений (рис. 7.26). Напротив, например, дифференцировка замыкающих клеток устьиц и трихом в эпидермисе или дифференцировка корневых волосков в ризодерме происходит в характерных позициях на поверхности организма, что можно рассматривать как выражение действующей в плоскости тангенциальной позиционной информации, которая, по крайней мере частично, отличается от радиального позиционного сигнала. Так, rhytidiophyllum- мутант Epilobium hirsutumразвивает во внутренних слоях тканей листа дополнительные участки эпидермиса, в котором образуются (правда нефункциональные) замыкающие клетки устьиц. Наконец, недавно удавшиеся микрохирургические эксперименты на корнях Arabidopsis thaliana также доказывают наличие формирующейся вдоль оси органа продольной позиционной информации,которая определяет клеточную дифференцировку образованных меристемными инициалиями дочерних клеток (рис. 7.26).
Рис. 7.26. Клеточная детерминация в кончике корня Arabidopsis thafiana: А, В — строение кончика корня (А) и корневой меристемы (В) в радиальном продольном срезе; С — серия экспериментов по разрушению лазером (а —е) подтверждает детерминацию клеточной дифференцировки через позицию клетки в тканевом сообществе. Темно-серый цвет: разрушенная (аблатированная) облучением УФ-лазером клетка (клетки); остальные цвета, как на А, или соответственно на В. (а) Норма. Из инициальной клетки коры при поперечном делении получается дочерняя клетка, которая образует путем периклинального продольного деления клетку паренхимы коры и клетку эндодермы. (b) Разрушение инициальной клетки коры. Позицию разрушенной клетки занимает инициальная клетка перицикла. Она меняет свою дифференцировку и образует после поперечного деления и периклинального продольного деления клетку паренхимы коры и клетку эндодермы. Это свидетельствует о том, что уже дифференцированные дочерние клетки накладывают отпечаток на дифференцировку нижележащих более молодых клеток независимо от их происхождения, чему, пожалуй, противоречит результат опыта с разрушением дочерней клетки коры (с). Эксперимент (d), однако, доказывает, что гипотеза справедлива. Очевидно, позиционная информация распространяется не только вдоль ряда клеток в направлении инициальной клетки, расположенной непосредственно ниже, но достигает ее также и от обеих соседних клеток. То, что речь идет не об артефакте вследствие разрушения трех клеток, доказывает в свою очередь (е). Если благодаря облучению УФ-лазером разрушить три клетки в радиальном направлении (инициальные клетки эпидермиса, коры и перицикла), то происходит правильная дифференцировка, как в (а) или соответственно в (с)
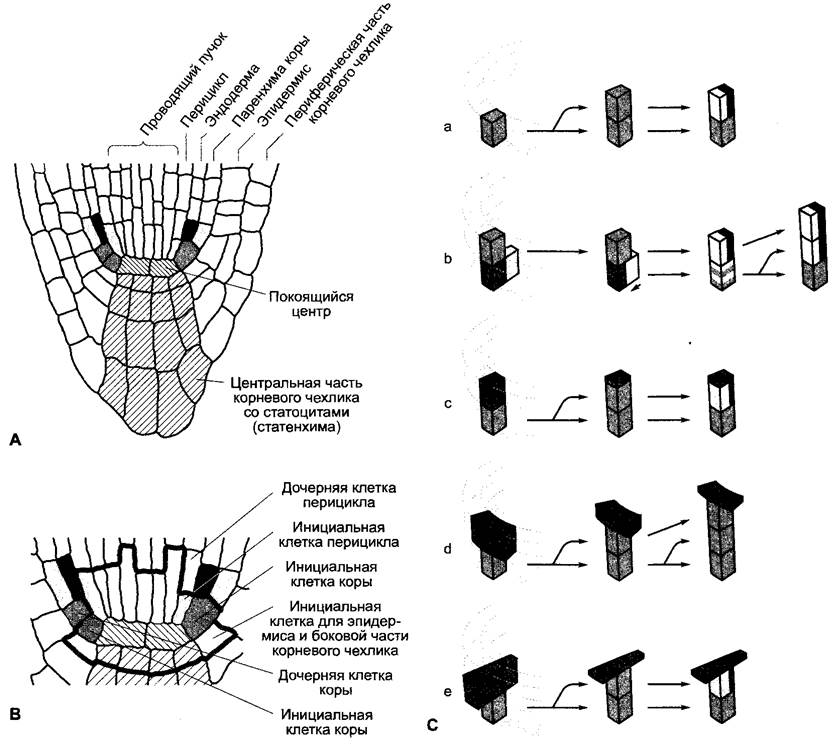
В этих экспериментах отдельные клетки убивали точечно-фокусированными высокоэнергетическими лазерными лучами. В дальнейшем наблюдалась дифференцировка клеток, вросших в эти области: клетки перицикла, вросшие в область убитых инициалей коры, становятся инициалями коры и производят дочерние клетки, из которых путем периклинальных делений получаются клетки эндодермы и коровой паренхимы. Однако если убить еше и дочерние клетки инициалей коры, то подавляется дифференцировка последующих образующихся дочерних клеток в клетки эндодермы и коровой паренхимы. Это показывает, что от дифференцированных клеток в продольном направлении на находящиеся ниже более молодые клетки независимо от их происхождения идет детерминирующий сигнал, определяющий дифференцировку этих клеток (рис. 7.26).
Химическая природа веществ и механизмы, с помощью которых растения производят позиционную информацию, и, наконец, влияние этой информации на дифференцировку, в деталях еше неизвестны.
В последнее время при исследованиях растительных мутантов по развитию были получены особенно важные сведения, большинство из них — на Arabidopsis thaliana (см. бокс 7.1). Дальнейшее описание хода эмбриогенеза (см. 7.4.1), формирования меристем и органов в меристеме побега (см. 7.4.3) и разметки в слоях тканей (см. 7.4.2) ограничивается в основном этим объектом. Механизмы коммуникации клеток при указанных процессах известны лишь частично.
Здесь следует также отметить отклонения от нормального процесса развития, которые встречаются в болезненном состоянии (например, при галлообразовании, опухолях) или при организации симбиозов (например, корневые клубеньки). Они рассмотрены в главе 9.
Образование зародыша после оплодотворения обладает многими характерными чертами (см. 3.1, рис. 3.1). Яйцеклетка уже поляризована, предположительно под влиянием материнского растения, семяпочка также поляризована. Поляризация зиготы (рис. 7.27, А) и установление плоскости первого, асимметричного, деления зиготы похожи на аналогичные процессы у бурых водорослей. Они также протекают путем дифференцировки стенки зиготы, так что клеточные стенки обеих дочерних клеток значительно различаются биохимически (рис. 7.27, В). Эти различия требуются, как у Fucus, для дальнейшей детерминации дочерних клеток. Из базальной клетки получаются суспензор и гипофиза, из апикальной клетки — проэмбрио, за исключением тканей, производимых гипофизой: покоящегося центра и центральной части корневого чехлика. Участки клеточной стенки базальной клетки, которые отличаются наличием характерного гликопротеида (арабиногалактана), определяют область, из которой в последующих делениях получается 6 — 9-клеточный суспензор (рис. 7.27, С, D), который на поздней стадии эмбриогенеза отомрет путем запрограммированной клеточной гибели (см. 7.3.2), в то время как часть базальной клетки, образующей гипофизу, свободна от этого гликопротеида.
Рис. 7.27. Проявление полярности во время эмбриогенеза Arabidopsis thafiana. Уже поляризованная зигота А неравно делится (В). Из вакуолизированной базальной клетки дифференцируется суспензор, чья самая верхняя клетка, гипофиза, позже входит в состав зародыша и образует покоящийся центр, а также центральную часть корневого чехлика. Оставшийся суспензор отмирает во время созревания зародыша путем запрограммированной гибели клеток. Эти суспен- зорные клетки характеризуются наличием в их клеточных стенках гликопротеидов, связанных с арабиногалактанами (серый), которые синтезируются уже в зиготе. В глобулярном зародыше (С — 16- клеточный, D — более поздняя стадия) уже на 8-клеточной стадии появляется новая ось полярности (апикальный —> базальный). Зародыш подразделяется на три слоя (апикальный, центральный, базальный) с различной судьбой при дифференцировке. Дальнейшая дифференцировка (D —> Е —> F) управляется в значительной степени полярным распределением ауксина (серые стрелки). Поток ауксина зависит от перераспределения переносчиков ауксина в мембранах клеток зародыша. Есть данные, что в области обеих верхушечных меристем транспорт ауксина протекает схожим образом и в более позднем развитии растения после прорастания (кончик корня; см. рис. 8.24). Дальнейшие объяснения в тексте
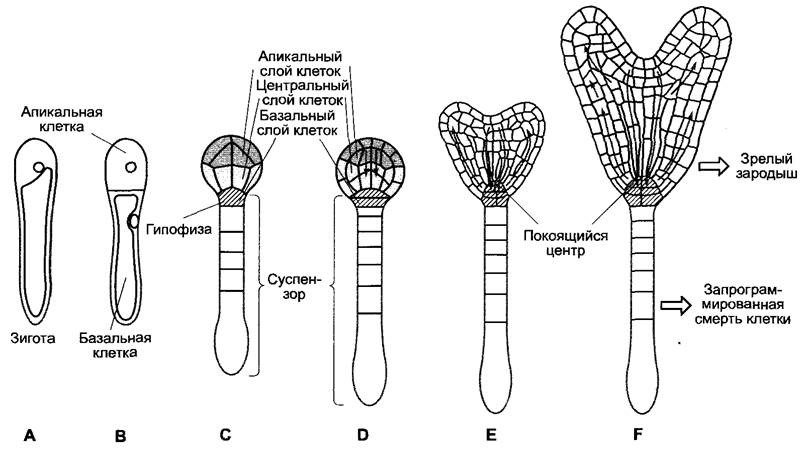
Из апикальной клетки развивается сначала глобулярный зародыш, который на 8-клеточной стадии (стадия октанта) претерпевает новую осевую поляризацию, которая впервые становится видимой позже у 100-клеточного (приблизительно) глобулярного зародыша при переходе к стадии сердечка и закрепляется в образовании эмбриональных органов — семядолей, гипокотиля и зародышевого корня, — а также обеих апикальных меристем (см. рис. 3.1). Осевая поляризация позволяет определить три участка глобулярного зародыша (рис. 7.27, С, D), которые дифференцируются по-разному: апикальный слой образует меристему побега и семядоли, центральный слой — осевые органы (гипокотиль и зародышевый корень) и происходящие от гипофиза клетки — покоящийся центр и центральную часть корневого чехлика со статенхимой1 (лат. columella) (рис. 7.27, F; 7.26, А). Установление оси полярности в уже многоклеточном глобулярном зародыше создает позиционную информацию в пределах границ клетки.
1 Статенхимой здесь названа ткань, в которой много крахмальных зерен, которые, предположительно, являются статолитами. Удаление этой ткани корневого чехлика ведет к нарушению геотропизма корня. Название «статенхима» подчеркивает возможное участие ткани в восприятии силы тяжести. — Примеч. ред.
Очень вероятно, что в случае этого позиционного сигнала важную роль играет фитогормон индолил-3-уксусная кислота из группы ауксинов (см. 7.6.1) (рис. 7.27, D — F). Эксперименты свидетельствуют о переориентации молекул-переносчиков, которые транспортируют гормон из клетки (см. 7.6.1.3), от исходного равномерного распределения в плазмалемме до все более направленного распределения в плазматических мембранах глобулярного зародыша.
В мутантах gnom у Arabidopsis thaliana правильное распределение переносчиков ауксина подавляется, продольная поляризация вдоль оси зародышей не происходит. GNОМ-ген дикого типа (GМ) кодирует белок, участвующий в направленном клеточном транспорте пузырьков. Однако у мутантов gnom первое деление зиготы уже нарушено, так как клеточная поляризация подавлена. Однако поляризация зиготы независима от ауксина. Очевидно, GN-белок имеет значение для осуществления различных направленных транспортных процессов на разных фазах эмбриогенеза.
Образующийся в эмбрионе градиент индолил-3-уксусной кислоты (рис. 7.27, D — F) способствует дифференциальной активации генов в зависимости от концентрации клеток и чувствительности их к ауксину: на месте наименьшей концентрации ауксина формируется меристема побега, повышенная концентрация ауксина по бокам от меристемы побега требуется для образования зачатков семядолей, а на месте наивысшей концентрации ауксина у основания эмбриона дифференцируются ткани кончика корня. И в последующем развитии растения распределение ауксина в меристемной области, обусловленное, вероятно, полярным транспортом ауксина (см. 7.6.1.3), важно для сохранения меристемного характера и дифференцировки органов: непосредственно в области меристемы побега концентрация ауксина сохраняется очень низкой, ауксин транспортируется в области ниже собственно меристемы, которые дифференцируются в зачатки листьев. Напротив, благодаря полярному транспорту в области кончика корня ауксин концентрируется в центральном цилиндре в направлении покоящегося центра и достигает своей наивысшей концентрации в клеточном слое непосредственно под покоящимся центром: в инициальных клетках для образования статенхимы (см. рис. 7.26, А; 7.27, D — F). Здесь, вероятно, высокие концентрации ауксина требуются для сохранения меристемной функции. Однако ауксин, очевидно, не единственный важный для развития межклеточный позиционный сигнал. Условия, возможно, сложнее и включают также другие фитогормоны (например, цитокинины, см. 7.6.2).
Есть данные, что на ранних стадиях развития органа направленный транспорт ауксина частично является самоорганизующимся. В соответствии с этим представлением, клетки экспрессируют тем больше белков, транспортирующих ауксин, чем больше они содержат ауксина. Таким образом, изначально малые различия в концентрации ауксина и в направлении его потока могут автокаталитически усилиться и стабилизироваться, так что в конце концов образуются стабильные градиенты гормона в направлении транспорта. Такие «процессы образования каналов» ауксина происходят, предположительно, например, при образовании проводящей системы во время развития листа (богатые ауксином участки дифференцируются в проводящие пучки), в камбии (см. рис. 7.38), во время эмбриогенеза (см. выше), при сохранении дифференцировки верхушки побега и корня, а также при индукции ауксином закладки боковых корней.
7.4.2. Процесс самоорганизации в слоях ткани (разметка)
В основе пространственной разметки, определяющей положение дифференцирующихся клеток, лежат процессы самоорганизации, правда биохимические особенности разметки изучены мало.
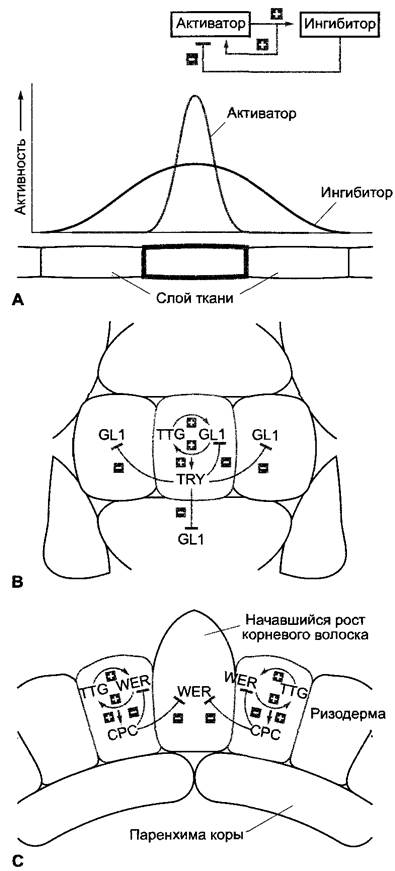
Простая модель разметки, как показанная на рис. 7.28, А, исходит из медленно диффундирующего или совсем не диффундирующего активатора процесса дифференцировки, который сначала стохастически (случайно) образуется в определенных клетках слоя ткани, автокаталитически усиливает свое собственное образование и одновременно индуцирует образование быстро диффундирующего ингибитора. Ингибитор благодаря своему большему радиусу действия подавляет образование активатора в окружении «активированной» клетки.
Исследования на мутантах Arabidopsis thaliana с нарушенным расположением дифференцированных клеток показали, что активатор/ингибиторная система действительно лежит в основе разметки трихом эпидермиса листа и корневых волосков ризодермы (рис. 7.28, В, С). Однако поскольку корневые волоски у Агаbidopsis thaliana дифференцируются только из клеток ризодермы, которые расположены над более чем одной клеткой паренхимы коры, здесь мог бы также участвовать радиальный сигнал, исходящий из клеток паренхимы коры. В обоих случаях (рис. 7.28, В, С) активаторы действуют определенно внутриклеточно, в то время как ингибиторы влияют также на соседние клетки. Возможные механизмы такого рода межклеточной коммуникации описаны в разделе 7.4.4.
Рис. 7.28. Основы разметки в слоях ткани: А — модель самоорганизующегося процесса разметки: автокаталитически усиливающий свое образование активатор с малой подвижностью одновременно индуцирует образование движущегося быстрее ингибитора; в непосредственной близости от образующей активатор клетки ингибитор подавляет дальнейшее образование активатора. Реализация подобных систем при развитии трихом в эпидермисе листа (В) и при образовании корневых волосков в ри- зодерме (С) Arabidopsisthafiana; В — активация трихобластов (серый цвет: клетки-предшественники трихом) происходит при участии клеточно-автономного транскрипционного фактора GL1 и его регулятора TTG, которые оба авто- каталитически усиливают синтез друг друга и одновременно индуцируют образование транскрипционного фактора TRY выходящего из трихобластов и ингибирующего образование GL1 в соседних клетках; С — схожий процесс регуляции лежит в основе дифференциации корневых волосков. Здесь авто каталитическая активация транскрипционного фактора WER и уже упомянутого регулятора TTG ведет к подавлению дифференцировки корневых волосков и индукции образования подвижного ингибитора СРС (предположительно, является также транскрипционным фактором, инактивирующим синтез WER). Клетки, которые не экспрессируют WER, дифференцируются в клетки корневых волосков. Так как эти клетки всегда лежат над участками, где две нижележащих клетки паренхимы коры соприкасаются друг с другом, должно присутствовать (еще неизученное) позиционное влияние паренхимы коры на разметку ризодермы. Обозначение участвующих белков происходит от фенотипов мутантов, которые привели к их открытию; они здесь значения не имеют
7.4.3. Контроль формирования меристем и органов в меристеме побега
Рассматриваемые здесь процессы, как и многие процессы биологии развития, были особенно хорошо исследованы на Агаbidopsis thaliana с использованием многочисленных мутантов по развитию. У модельного объекта из другого семейства — львиного зева (Antirrhinum majus, Scrophula- riaceae) — обнаружены те же закономерности развития, что и у Arabidopsis, сходные даже в деталях. Поэтому предполагают, что полученные на Arabidopsis thaliana данные можно применить для всех покрытосеменных.
Меристема побега в вегетативном состоянии дает начало оси побега и листьям, она может — часто благодаря внешним факторам, например, длине дня, — перейти в меристему цветка и образовать ось и органы цветка, причем она расходуется (следовательно, переходит из недетерминированного в детерминированное состояние). Программа развития органов цветка на флоральной меристеме репрессируется (ее проявление подавляется) комплексом генов, пока не повлияет индуцирующий фактор. Это подтверждается тем, что мутации в генах репрессорного комплекса, которые приводят к потере функции, вызывают образование цветка даже без влияния индуцирующих внешних факторов. Мутант embryonicflower (emf) Arabidopsis thaliana сразу после прорастания образует единственный цветок и обладает лишь двумя семядолями, но не образует листьев.1 Индуцирующие процесс цветения внешние факторы подавляет EMF-активность. Если концентрация (еще неизвестного) продукта EMF-гена в меристеме побега снижается ниже критического порога, то наступает переключение формирования меристемы и активируется программа развития цветка. Эта частично еще гипотетическая модель объясняет, почему индукция образования цветка у Arabidopsis thaliana протекает постепенно: исследуемый объект является количественным длиннодневным растением (табл. 7.6), т. е. при длинном дне он переходит к цветению значительно быстрее, чем при коротком дне.
1 Описание цветка мутанта еmf дано слишком схематично. Так, у него нет лепестков, а на органах, похожих на чашелистики, происходит эпидермальная дифференцировка, такая же, как на вегетативных листьях. Есть нетипичные плодолистики, число тычинок уменьшено, сам «цветок» развивается в терминальном положении (нормальный цветок — в боковом). Пока не ясно, является ли эта структура настоящим цветком. — Примеч. ред.
Дифференцировка зачатков органов цветка, т.е. формирование органов, управляется группой генов, которые можно разделить на четыре класса — А, В, С и D. Их относят к гомеозисным генам, так как утрата или экспрессия этих генов в неправильном месте (эктопическая экспрессия) ведет к изменениям в нормальном развитии органов (гомеозису). Под гомеозисными мутантами в генетике развития понимают такие мутанты, которые вместо обычно формирующегося органа несут другой (т. е., например, вместо чашелистика образуется плодолистик).1
1 Часто у мутантов происходит не только гомеозисная замена одного органа на другой, но изменяется вся структура цветка (число, положение органов). Это означает, что многие гены отвечают также за разметку флоральной меристемы, участвуют в процессах самоорганизации (разд. 7.4.2). — Примеч. ред.
У Arabidopsis thaliana имеется 7 генов, ответственных за формирование органов цветка:
✵ ген класса A APETALA1(AP1);
✵ два гена класса В APETALA3 (АРЗ) и PISTILLA ТА (PI);
✵ ген класса С AGAMOUS (AG);
✵ 3 гена класса D SEP ALL АТА1, 2 и 3 (SEP 1, SEP2, SEP3).2
2 На самом деле генов, определяющих тип органов в цветке, больше. Например, в тексте пропущен ген АРЕТАЕА2, относящийся к классу А. Класс D пока еще считается дискуссионным. К нему относят гены FBР1 и FВР1 1 петунии, а гены SЕРАLLАТА теперь относят к классу Е. — Примеч. ред.
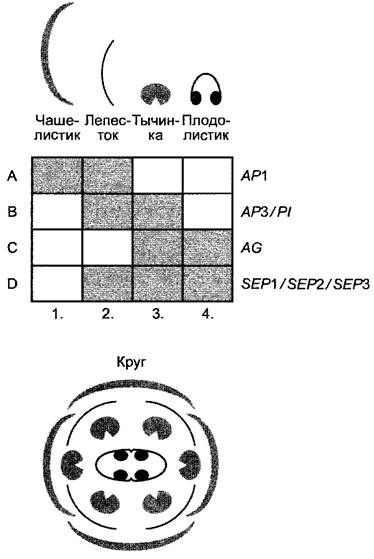
Все гены кодируют транскрипционные факторы, многие из них при регуляции генной активности вступают во взаимодействие непосредственно друг с другом и связываются в различном составе с промоторами различных целевых генов. В зависимости от комбинации генов дифференцируются чашелистики (Sepalen), лепестки (Petalen), тычинки (Stamina) или плодолистики (Pistille) (рис. 7.29). Точная в пространстве и во времени экспрессия генов формирования органов цветка в меристеме обеспечивается, с одной стороны, тем, что некоторые из генов оказывают взаимное влияние друг на друга (например, А-активность подавляет экспрессию генов С-класса, а С-активность подавляет экспрессию генов А-класса), с другой стороны, в регуляции экспрессии генов классов А, В и С в области меристемы цветка участвуют дополнительные гены (так В- активность в первом и в четвертом круге подавляется продуктами трех других генов, которые сами напрямую не обладают функцией формирования органов).
Рис. 7.29. Генетический контроль формирования органов при развитии цветков Arabidopsis thafiana. Четыре класса генов (А, В, С и D) управляют формированием органов в меристеме цветка. Продукты генов, контролирующих дифференцировку органов цветка, находятся в различных местах в меристеме, причем области экспрессии генов А- и В-класса, а также В- и С-класса частично перекрываются, а D-класс экспрессируется во втором, третьем и четвертом круге. A-класс представлен геном APETALA1 (АР1). Клетки, вкоторых активизирован толькоА-класс, дифференцируются в чашелистики (Sepalen). Если проявляется активность генов как А-, так и В-класса, возникают лепестки венчика (Petalen). В-класс представлен генами APETALAS (АРЗ) и PÍSTILLATA (РI); С-класс — геном AGAMOUS (AG). Если В- и С-гены активизированы вместе, то дифференцируются тычинки (Stamina), если проявляется активность только генов С-класса — плодолистики (Karpelle). Правда, во втором, третьем и четвертом кругах дополнительно требуется активность D-класса, которая кодируется генами SEPALLATA1, 2 и 3 (SEP1, SEP2, SEP3) (В последних публикациях эти гены относят к Е-классу. — Примеч. ред.) При мутациях в генах, контролирующих формирование органов цветка, происходят характерные гомеотические замены. Если выпадает активность A-класса, то активность С-класса проявляется во всех четырех кругах (гены класса А подавляют экспрессию генов С-класса); в первом и четвертом кругах образуются плодолистики, во втором и третьем — тычинки. Так как мутанты характеризуются отсутствием лепестков (Petalen), они были названы apétala. Если выпадает активность С-класса, то активность A-класса проявляется во всех кругах (гены С-класса подавляют экспрессию генов A-класса). Мутанты образуют в первом и четвертом кругах чашелистики, а во втором и третьем — лепестки, таким образом, обладают стерильными цветками и поэтому были названы agamous. Если выпадает активность В-класса, это никак не влияет на активность А- и С-класса; в первом и втором кругах образуются чашелистики, а в третьем и четвертом — плодолистики. Так как у мутантов отсутствуют лепестки (Petalen) или соответственно развиваются дополнительные пестики в цветках (отсутствие тычинок), они были названы apétala или pistiffata. Если мутация затрагивает D-класс, то во всех четырех кругах образуются чашелистики, поэтому эти мутанты называются sepaífata. Активность генов D-класса необходима, таким образом, для реализации активности генов А-, В- и С-класса в меристеме цветка при формировании органов цветка второго, третьего и четвертого круга
Насколько известно, у других покрытосеменных были найдены соответствующие гомологичные гены (гены с общим эволюционным происхождением и чаще консервативной функцией)1, поэтому можно предположить, что формирование органов цветка у покрытосеменных происходит по общим принципам, также в значительной мере эволюционно консервативным. Модель справедлива, например, для зигоморфного цветка львиного зева. Дорсовентральность, однако, обусловливается дополнительным геном CYCLOIDEA. При нарушенной функции генов (cycloidea- мутанты) львиный зев образует радиально-симметричные цветки.
1 Их называют ортологами (см. ранее разд. 7.2.2.3). — Примеч. ред.
7.4.4. Механизмы коммуникации клеток
Позиционный контроль процессов развития, который, как было описано ранее (см. 7.3.3; 7.4.1 — 7.4.3), имеет у растений решающее значение, предполагает возможность направленно транспортировать за пределы клетки молекулы, управляющие развитием. Насколько известно на сегодняшний день, это может происходить несколькими способами:
✵ целенаправленная секреция регуляторных макромолекул в пространство клеточной стенки, например, при поляризации зиготы; состав клеточных стенок определяет детерминацию дочерних клеток через контакт с протопластом (например, клетки таллома и ризоидов у Fucus, см. 7.3.3);
✵ полярный транспорт низкомолекулярных регуляторов; таким способом транспортируются ауксины (см. 7.6.1), например, во время эмбриогенеза у Arabidopsis thaliana (см. 7.4.1);
✵ локальный синтез и диффузия (по симпласту и/или по апопласту) из места синтеза в окружающие ткани; таким способом гиббереллины по апопласту попадают из эмбриона в алейроновый слой зерновок (см. 7.6.3.3);
✵ транспорт по проводящей системе: этот процесс важен для системного управления развитием (корреляции) (см. 7.5);
✵ транспорт регуляторных макромолекул от клетки к клетке через плазмодесмы (см. 7.4.4.1).
7.4.4.1. Обмен макромолекулами между клетками
Растительная клеточная стенка проницаема для ионов, небольших водорастворимых молекул и небольших белков с молекулярной массой примерно до 5 кДа, однако препятствует свободной диффузии более крупных макромолекул. Плазмодесмы (структура, см. 2.2.7.3, рис. 2.70), которые связывают друг с другом клетки, объединенные в симпластическую систему, также рассматривались долгое время только как поры для низкомолекулярных метаболитов с предельным размером до 1 кДа. Поэтому неожиданностью стало сделанное лишь недавно открытие, что плазмодесмы участвуют также в межклеточном обмене макромолекулами и представляют собой регулируемые поры, через которые от клетки к клетке транспортируются совершенно определенные макромолекулы, белки или даже рибонуклеопротеиновые комплексы.
Впервые это было показано на примере транспорта фитопатогенных вирусов (например, вируса табачной мозаики). У пораженных вирусом растений предельный размер веществ, проходящих через плазмодесмы, составляет более 10 кДа, в непораженных растениях — менее 1 кДа. За это ответственны кодируемые геномом вируса транспортные белки (англ, movement proteins) с молекулярной массой ~30 кДа. Эти белки образуют с вирусной нуклеиновой кислотой (у вируса табачной мозаики одноцепочечная РНК) рибонуклеопро- теиновый комплекс, который передвигается через плазмодесмы от клетки к клетке, благодаря чему вирус распространяется в растении и проявляются симптомы болезни — вирусной мозаики (пораженные межжилковые участки). Лишь значительно позже было открыто, что вирусы используют только тот механизм транспорта, который играет важную роль и в здоровом растении и служит для транспорта белков (рис. 7.16), а также рибонуклеопротеиновых комплексов (см. ниже). Так, у покрытосеменных безъядерные и безрибосомные ситовидные клетки белков импортируются через плазмодесмы из клеток-спутниц, где они синтезируются в ситовидные клетки. Для объяснения процессов транспорта белков через плазмодесмы предложены различные модели (рис. 7.30). Поскольку транспортируются только определенные белки, они должны нести (подробности пока неизвестны) топогенные структурные элементы1, которые вступают во взаимодействие со специфичными рецепторами (экспорт-рецепторы на стороне экспортирующей клетки и импорт-рецепторы на стороне импортирующей клетки), которые включают белок в транспортный путь или соответственно удаляют из него. Есть данные, что небольшие белки транспортируются по плазмодесмам свернутыми (модель I), более крупные белки — частично или полностью развернутыми (модель II). Но многие подробности пока гипотетичны.
1 По аналогии с внутриклеточным транспортом (см. 7.3.1). — Примеч. ред.
Рис. 7.30. Модель транслокации белков через плазмодесмы. Согласно этому представлению, белок, который необходимо транспортировать (ТР) либо в свернутом (А, модель 1), либо в развернутом состоянии (В, модель II), связывается с экспорт-рецепторами (Re) экспортирующей клетки и через импорт-рецепторы (R1) импортирующей клетки освобождается в ее цитоплазму. В развертывании и обратном свертывании белков в модели II, вероятно, участвуют шапероны
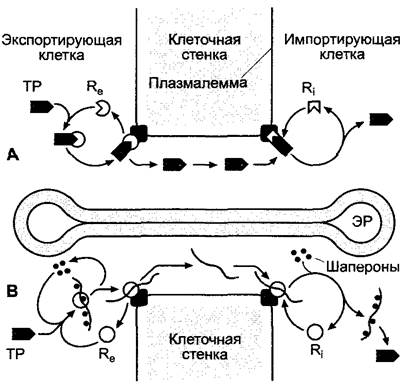
Среди белков, для которых был обнаружен межклеточный транспорт, есть несколько регулирующих развитие транскрипционных факторов, перемещающихся из более глубоко лежащих слоев меристемы побега, где они синтезируются, в наружные (см. 3.1.1.1, рис. 3.5). Один из этих транскрипционных факторов — белок KN1 кукурузы. KN1 является продуктом гена KNOTTED, который обеспечивает сохранение меристематического состояния клеток и не экспрессируется в немеристематических клетках. Однако в knotted-мутантах кукурузы транскрипционный фактор экспрессируется еще вне нормальной области: в зоне роста листовой пластинки. Из- за этого образуются ненормальные, узловатые структуры на поверхности листа, которые появляются благодаря чрезмерному размножению клеток и по которым получили свое название мутанты (англ, knotted — узловатый). Предполагают, что белок KN1 должен перемещаться через плазмодесмы в виде комплекса со своей собственной мРНК. Кроме того, есть данные, что молекулы мРНК из клеток-спутниц перемещаются в ситовидные клетки и, таким образом, могут потенциально нести информацию по флоэме на большое расстояние. Подобные межклеточные перемещения макромолекул, возможно, играют важную роль в реализации позиционной информации (межклеточной коммуникации) при дифференцировке клеток и разметке, но также, при необходимости, могли бы участвовать в системной корреляции процессов развития (см. 7.5).
Недавно выяснилось, что пропускная способность плазмодесм зависит от изменений, связанных с развитием. Только сложно разветвленные плазмодесмы дифференцированных тканей (прежде всего, «sources-тканей1, см. 6.8.3), вероятно, представляют собой регулируемые поры, сквозь которые макромолекулы проходят только тогда, когда могут активировать механизм транспорта. Напротив, через простые неразветвленные плазмодесмы растущих «sinks- тканей беспрепятственно проходят макромолекулы с молекулярной массой до 50 — 70 кДа. Сложно устроенные плазмодесмы между клетками-спутницами и ситовидными клетками, вероятно, также перманентно проницаемы для макромолекул с молекулярной массой, по крайней мере, до 25 — 30 кДа. Поэтому белки после входа в ситовидные клетки могут транспортироваться на далекие расстояния и по симпласту распределяться в «sinк»-тканях. Пока остается неясном, как обеспечивается селективность транспорта белков через эти плазмодесмы. Так, тиоредоксин очень эффективно перемещается из клеток-спутниц в ситовидные клетки, убиквитин, однако, совсем не транспортируется, хотя молекулярные массы обоих белков составляют менее предельной величины.
1 В тексте дана заимствованная из англоязычной литературы терминология. Ткани, являющиеся донорами фотоассимилятов, названы source (источник), а ткани-акцепторы — sink(потребитель). — Примеч. ред.