БОТАНИКА ТОМ 2 - ФИЗИОЛОГИЯ РАСТЕНИЙ - 2007
9. АЛЛЕЛОФИЗИОЛОГИЯ
9.3. Патогены
Фотоавтотрофные растения как начальное звено в пищевой цепи являются источником питания для большого числа других организмов и тем самым подвержены их отрицательному воздействию (табл. 9.2).
Таблица 9.2. Доля вредителей растений в составе определенных групп организмов
Группа |
Известно видов |
Из них вредителей растений |
Вироиды |
30 |
30 |
Вирусы |
2 000 |
>500 |
Бактерии |
1600 |
100 |
Грибы |
100000 |
>10000 |
Животные |
1 200000 |
800000 |
Болезнью растений называется любое повреждение растения, сопровождающееся характерными симптомами, вызванными абиотическими или биотическими факторами. Абиотическая причина болезней растений — недостаток важных питательных элементов (см. 6.2.2). Уже упомянутые паразиты (9.1.1) также относятся к возбудителям болезней растений и поэтому являются предметом исследования фитопатологии.
Биотические причины болезни называются патогенами (возбудители болезни). Большинство патогенов является микроорганизмами (бактерии, грибы, некоторые простейшие), но сюда также относятся вирусы и вироиды (см. 1.2.5). Вред, вызываемый «поедателями» растений (травоядными животными) или другими растениями, обычно не называют болезнью растения и рассматривают отдельно (см. 9.4, 9.5).
9.3.1. Основные понятия фитопатологии
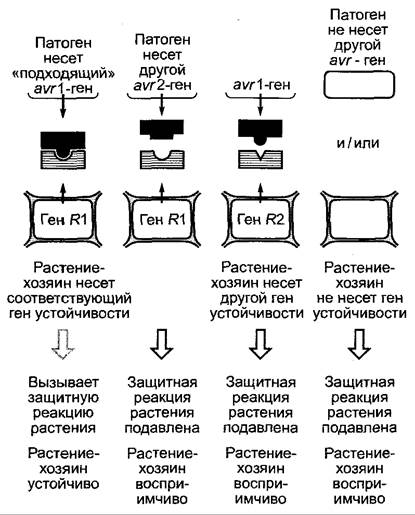
На каждый вид растений приходится, по разным оценкам, до 100 возможных патогенов. Другими словами, каждый вид невосприимчив к подавляющему большинству потенциальных возбудителей болезни, и каждый патоген обладает, очевидно, способностью успешно инфицировать лишь узкий спектр возможных хозяев. Если болезнь вспыхивает, то пораженное растение восприимчиво, а патоген вирулентен, в этом случае хозяин и патоген совместимы. Если, напротив, заболевания не происходит, то растение-хозяин называется устойчивым, а патоген — а вирулентным, хозяин и патоген в этом случае несовместимы. В любом случае исход взаимодействия определяют генотипы хозяина и патогена. Со стороны патогена различают две группы генов: те, которые кодируют факторы патогенности, определяющие проявление симптомов болезни у растений-хозяев, и те, которые определяют спектр хозяев и служат для узнавания растений-хозяев. Все виды, для которых невозможно узнавание, не являются хозяевами, все остальные могут поражаться. Некоторые патогены обладают широким спектром хозяев, другие поражают только отдельные виды или даже лишь определенные расы вида. Расоспецифичное взаимодействие особенно хорошо изучено, так как оно имеет большое сельскохозяйственное значение. Было показано, что в основе этих строго специфичных отношений хозяин — патоген лежит взаимодействие ген-на-ген обоих партнеров: со стороны патогенов речь идет о генах авирулентности (avr-гены, названные так потому, что их наличие ведет к потере вирулентности, их отсутствие или потеря ими функции из-за мутации обусловливает вирулентность), со стороны растения- хозяина речь идет о генах устойчивости (R-гены).1Если имеется подходящий R-ген, то существует устойчивость к патогену, имеющему соответствующий ген авирулентности; если он отсутствует, то растение восприимчиво (рис. 9.13). Гены аvг кодируют расоспецифичные элиситоры (= возбудители, лат. еliсеге — выманивать, побуждать) защиты растения от патогена (см. 9.3.4); R-гены кодируют подходящие рецепторы элиситоров. Если расоспецифичный элиситор связывается с соответствующим рецептором, то в затронутых растительных клетках возникает сильная защитная реакция, выражающаяся в гиперчувствительной смерти клеток, в ходе которой с локально гибнущими растительными клетками убивается и поражающий патоген. За последнее время были идентифицированы несколько растительных генов устойчивости, а также соответствующие гены авирулентности патогенов (см. 9.3.4).2
1 От англ. resistance — устойчивость. — Примеч. ред.
2 В русской литературе для специфических защитных реакций растения введено понятие вертикальной устойчивости. — Примеч. ред.
Рис. 9.13. Модель «ген-на-ген» расоспецифичного взаимодействия патогена и растения-хозяина. Совместная эволюция патогена и растения-хозяина приводит к появлению групп генов устойчивости и авирулентности. Защитная реакция растения включается лишь тогда, когда имеется подходящая комбинация гена авирулентности (аvг) и устойчивости (R). Растения, которые несут много различных генов устойчивости, особенно хорошо защищены от различных рас патогена; патоген поражает тем больше рас растений-хозяев, чем меньше генов авирулентности он несет. Спектр хозяев определяется генами узнавания хозяев и у патогенов с расоспецифичностью, как правило, оченьузок. Симптомы болезни определяются генами патогенности или соответственно вызываются продуктами их генов
Наряду с локальными защитными реакциями, такими, как гиперчувствительная смерть клеток, патогены вызывают во многих растениях и так называемые сис-
темные (затрагивающие весь организм) реакции. Так, заражение листа табака вирусом табачной мозаики обусловливает через несколько дней усиленную устойчивость всего растения (т. е. и не пораженных вирусом органов) ко многим патогенным бактериям и грибам. Эта не специфичная к патогену защита всего организма называется системной приобретенной устойчивостью(SAR, англ. systemic acquired resistance). Эта реакция показывает, что растение наряду с расоспецифичными обладает и многими менее специфичными, широко действующими защитными механизмами, которые индуцируемы патогенами и дополняют конститутивные, т.е. имеющиеся и без присутствия патогена, меры защиты (см. 9.3.4). Индуцируемый широкий спектр механизмов защиты1 вызывается нерасоспецифичными элиситорами, которые часто являются низкомолекулярными продуктами деградации бактериальных или грибных и/или растительных клеточных стенок либо компонентами мембраны, которые высвобождаются литическими процессами в месте проникновения патогена (например, олигогалактурониды из растительной первичной стенки, бактериальные обломки флагеллина, хито- олигомеры из грибных клеточных стенок, грибные стероиды, такие, как эргостерол, или гликопептидные фрагменты грибных гликопротеинов).
1 В русской литературе обсуждают механизмы горизонтальной устойчивости, включающие широкий набор реакций неспецифической защиты. — Примеч. ред.
Большому числу известных патогенов растений (см. табл. 9.2) соответствует множество болезней растений, которое рассмотрено здесь лишь схематично. Наибольшую группу патогенов составляют грибы, среди них есть как облигатные, так и факультативные паразиты. Так как облигатные паразиты растут только в присутствии своих хозяев, но не на искусственных средах, они также обозначаются как биотрофные. Патогенные грибы в виде спор попадают на поверхность растения и прорастают там — вероятно, стимулируемые веществами, образуемыми растением-хозяином. Мицелий внедряется в растение в зависимости от патогена либо через естественные отверстия (устьица, чечевички или гидатоды), либо через раны или трещины (например, в местах, где пробиваются боковые корни), либо напрямую. В последнем случае сначала благодаря грибным ферментам (кутиназы, целлюлазы) распадаются поверхностные структуры, через которые затем прорастают гаустории (проникающие гифы).
Некротрофные грибы — паразиты, они внедряются в растение, убивают и разрушают при этом клетки в области растущего мицелия и поглощают из «разоренных» районов питательные вещества.
Большинство фитопатогенных бактерий являются факультативными паразитами (они растут также и на искусственной питательной среде) и внедряются в растениях в зависимости от вида через раны, устьица или через гидатоды или железистые ходы нектарных железок. Важнейшие бактериальные фитопатогены относятся к грамположительным родам Agrobacterium, Erwinia, Pseudomonas и Xanthomonas\ речь идет о жгутиковых палочковидных бактериях. Сюда же относятся виды Clavibacter (грамотрицательные, жгутиковые или не- жгутиковые палочки) и стрептомицеты (Streptomyces). Agrobacterium tumefaciens, возбудитель раковых опухолей (корончатого галла), был исследован особенно подробно и используется для введения генетической информации во многие (но не во все) виды растений (см. бокс 9.2; 7.3).
Только в 1967 г. с помощью электронного микроскопа были открыты новые возбудители болезней — очень просто устроенные бактерии без клеточной стенки, которые имеют либо спиралевидную структуру (и тогда называются спироплазмами), либо образуют клетки от сферических до палочковидных (и тогда называются фитоплазмами). Они были идентифицированы как возбудители более 200 различных болезней растений (например, у груши, яблони, персика, кукурузы, томата и кокосовой пальмы) и вызывают симптомы поражения, сходные с симптомами поражения многими вирусами (например, пожелтение листа, патологическое укорочение междоузлий, нарушение апикального доминирования). Таксономическое положение спироплазм и фитоплазм неясно. Их ставят рядом с микоплазмами (см. 11.2).
Вирусы (см. 1.2.5) являются инфекционными нуклеопротеиновыми частицами сложной структуры, предназначенными для размножения облигатно в хозяйских клетках, и состоят, по крайней мере, из белка и нуклеиновой кислоты. Нуклеиновая кислота находится у большинства растительных вирусов в виде одноцепочечной РНК (например, вирус табачной мозаики), у некоторых (40 видов) — в виде двухцепочечной РНК, в виде одноцепочечной ДНК (50 видов) или в виде двухцепочечной ДНК (30 видов, например, вирус мозаики цветной капусты). Вирусы обычно располагают среди микробных патогенов, хотя они не имеют ранга клетки или соответственно организма. Вирусы внедряются в растения через раны, нанесенные чаще всего насекомыми, которые служат переносчиками, или они переносятся при оплодотворении с зараженной пыльцой. Репликация вируса происходит только в живых клетках и дает от 105 до 107 вирусных частиц на клетку. Вирусы попадают в незараженные клетки через плазмодесмы, причем от клетки к клетке при помощи вирусных транспортных белков «путешествует» только нуклеиновая кислота вируса, и вирус использует механизм, который используют растения для клеточного транспорта белков и молекул мРНК (см. 7.4.4). Таким образом вирус движется через 8 — 10 клеток (~1 мм) ежедневно. Как только вирусы достигают ситовидных трубок, распространение очень сильно ускоряется, так что локально инфицированное растение в течение 3 — 4 недель заражается полностью. Как и Agrobacterium tumefaciens, вирус мозаики цветной капусты используют для введения генетической информации в клетки растений, цикл репликации этого вируса хорошо изучен (бокс 9.1).
Удивительный механизм естественного переноса генетической информации от прокариота в геном эукариотической растительной клетки изучали очень интенсивно. После того как было показано, что механизм переноса функционирует и без наличия опс-генов, а Т-ДНК может быть удалена (делетирована) вплоть до концевых последовательностей по 25 н.п. на левом и правом конце Т-ДНК (= последовательности левой и правой границы) и на ее месте могут присутствовать любые чужеродные гены, Agrobacterium tumefaciens стал наиболее значимым векторным организмом при создании трансгенных растений (см. бокс 7.3). Arabidopsis thaliana, модельный организм молекулярной биологии развития высших растений (см. бокс 7.1), также можно трансформировать с помощью Agrobacterium tumefaciens.
Бокс 9.1. Вирус мозаики цветной капусты
Вирус мозаики цветной капусты (англ, cauliflower mosaic virus, CaMV), относящийся к группе каулимовирусов, переносится тлями и вызывает мозаичные симптомы на пораженных растениях, которые к тому же характеризуются замедленным ростом и пониженной урожайностью при снижении качества. Вирус распространяется через плазмодесмы в паренхиме и затем через флоэму системно, т. е. по всему растению. Часто цитоплазма пораженных клеток густо наполнена реплицированными вирусными частицами (вироплазма).
Каулимовирусы — изодиаметрические тела примерно 50 нм в диаметре (рис. А), белковая оболочка которых (капсид) построена из одной субъединицы с молекулярной массой 42 кДа. Геном вируса мозаики цветной капусты (рис. В) составляет 8 тыс. н. п. и состоит из кольцевой двухцепочечной ДНК, собранной из 3 одноцепочечных ДНК-молекул, α-, β - и у- цепи, которые связаны друг с другом нековалентно. Он содержит 6 генов с известной функцией (I-VI, рис. В) и 2 более коротких гена с еще неизвестной функцией (VII, VIII), а также 2 промотора с сильной активностью в растении, 19S-npoMOTop (p19S) и 35S-npoмотор (p35S) (названные так по константам Сведберга молекул мРНК, образование которых контролируется промоторами, см. ниже). После вхождения вируса в хозяйскую клетку ДНК высвобождается и отправляется в клеточное ядро. Там растительными лигазами сначала репарируются одноцепочечные разрывы. Теперь ковалентно замкнутая, кольцевая молекула ДНК ассоциируется с гистонами и образует как бы «минихромосому», оба промотора которой эффективно узнаются ДНК-зависимой РНК-полимеразой II растения (см. 7.2.2.2) и гены которой поэтому интенсивно транскрибируются. Образуется два транскрипта: 19S- мРНК, кодирующая ген VI, а также полицистронная 35S-MPHK, охватывающая весь вирусный геном. При этом матрицей служит α - цепь (минус-цепь). 19S-MPHK и часть 35S- мРНК (последняя, предположительно, только после сплайсинга) транслируются в цитоплазме хозяйской клетки, причем белок, кодируемый 19S-MPHK усиливает трансляцию 35S-мРНК. Функции отдельных продуктов гена представлены в таблице на рис. В. В случае продукта гена I речь идет о «транспортном белке» (VMP, англ. viral movement protein), который обеспечивает симпластический транспорт вируса из клетки в клетку (о механизме, см. 7.4.4.1). Обратная транскриптаза, кодируемая геном V, транскрибирует не требующуюся для трансляции часть 35S-MPHK в ДНК, причем сначала образуется а-цепь. Транскриптаза останавливается на двух богатых пурином участках 358-мРНК и расщепляет последовательности мРНК по обе стороны от этого участка; над этими областями, которые соответствуют более поздним ∆2- и ∆З-разрывам между β- и у-цепью, возникают после распада остальной мРНК праймероподобные области двойной цепи РНК-ДНК, на которые садится ДНК- полимераза, чтобы синтезировать обе комплементарные цепи (β и у). Репликация вируса на этом заканчивается и начинается упаковка ДНК в капсиды.
Рис. А. Внешний вид каулимовирусов
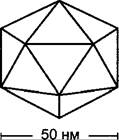
Рис. В. Геном вируса мозаики цветной капусты
Рис. С. Последовательность нуклеотидов и строение З5S-промотора. Границы доменов обозначены в последовательности стрелками и номерами нуклеотидов

Вирус мозаики цветной капусты является эффективным вектором для внедрения чужеродной ДНК в растительные клетки, однако сегодня в сравнении с векторной системой Аgrobacterium tumefaciens (см. 9.3.3, см. боксы 7.3; 9.2) он менее удобен. Вирусный промотор, который регулирует образование 358-мРНК (кратко называемый 35S-промотором), является одним из самых сильных промоторов растений (рис. С). Поэтому он часто используется для гиперэкспрессии чужеродных генов в растениях. 35S-промотор не обладает тканеспецифичностью и поэтому очень активен почти во всех типах растительных клеток. Район от -46 до +8 (начало транскрипции принимается +1) представляет собой минимальный промотор, который содержит ТАТА-бокс (см, 7.2.2.1, 7.2.2.2). Остальные участки промотора (домены А1 и В1-В5) представляют собой сильные энхансеры (энхансеры — усиливающие транскрипцию цис-элементы, которые активны независимо от их ориентации и положения относительно минимального промотора, см. 7.2.2.1, 7.2.2.2). Каждая из этих энхансерных последовательностей обладает независимо от других определенной тканеспецифичностью; суммирование последовательностей в полном промоторе оказывает влияние на его активность во всем растении.
Бокс 9.2. Биология опухолей, вызванных агробактериями1
1 В русской литературе к опухолям, вызванным агробактериями, относят болезнь корончатого галла (A. tumefaciens), болезнь бородатого корня (A. rhizogenes) и корневой рак (A. rubí). Два последних заболевания здесь не рассмотрены. — Примеч. ред.
Раковые опухоли корневой шейки (корончатые галлы) встречаются в природе по всему миру как симптом поражения палочковидной, перитрихиально жгутиковой почвенной бактерией Agrobacterium tumefaciens (представитель семейства Rhizobiaceae, как и родственный род Rhizobium) прежде всего на кустарниках, например, у розоцветных, ив и винограда. В искусственных условиях образование опухоли можно вызвать у многочисленных видов из более чем 60 семейств, особенно у двудольных покрытосеменных (рис. А). Заражение происходит через раны в зоне перехода между побегом и корнем (корневая шейка) и связано с наличием бактериальной вирулентной плазмиды, так называемой Ti-плазмиды (от англ. tumor inducing — опухоль-индуцирующая плазмида), включающей 0,2 млн н.п. и присутствующей у различных бактериальных штаммов в нескольких вариантах, похожих, однако, по строению (рис. В).
Рис. А. Опухоль в возрасте нескольких недель, экспериментально полученная на побеге Lycopersion esculentum
Рис. В. Строение Тi-плазмиды. В приведенном примере присутствует полная Т-область. Она также может быть разделенной максимум натри участка. Отдельные опероны v/г-области приведены с количеством генов на оперон (в скобках)
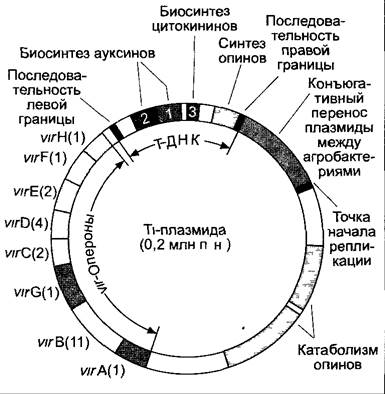
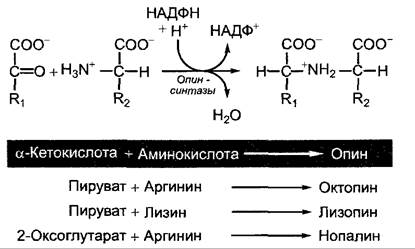
В процессе патогенеза происходит перенос части ДНК плазмиды, так называемой области Т-ДНК (от англ. transferred DNA), в растительную клетку и стабильная интеграция в ядерный геном этой Т-ДНК в количестве одной или нескольких (до 20) копий. Трансформированная растительная клетка начинает опухолевый рост, т.е. наступает неконтролируемая активность клеточных делений, которая приводит к большей части недифференцированному и неструктурированному образованию каллуса — опухоли корневой шейки (корончатого галла). Удалив агробактерии, можно неограниченно размножать опухоль корончатого галла в стерильной культуре без добавления в питательную среду ауксинов и цитокининов (что невозможно для нетрансформированной ткани, ср. 7.6.2.3, рис. 7.47). опухоль растет независимо от гормонов. Тем временем ткань опухоли образует опин. Опины (рис. С) являются продуктами конденсации α-кетокислот (пирувата, 2-оксоглутарата) с аминокислотами (например, лизином, аргинином), которые не могут дальше включаться растением в обмен веществ, однако могут служить агробактериям, живущим в ткани опухоли и в окружении опухоли в почве, единственным источником С и N. Каждая опухоль образует определенный опин в зависимости от индуцирующего штамма агробактерии.
Рис. С. Биосинтез опинов бактериальными опинсинтазами
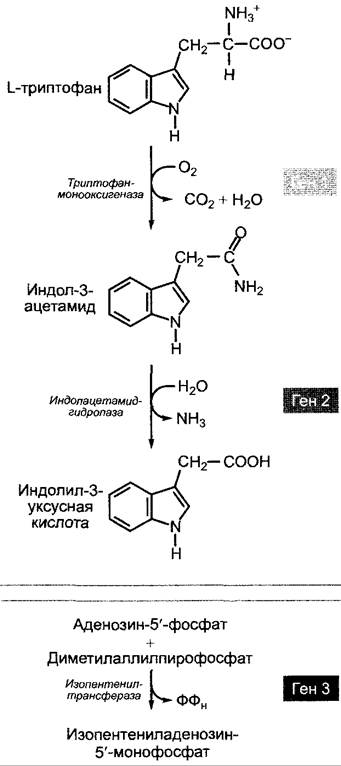
Как гены по обеспечению ауксин- и цитокининнезависимости, так и гены синтеза опинов находятся на Т-ДНК, а гены, ответственные за разложение опинов, вирулентность и трансформацию, — на части Ti-плазмиды, не переносящейся в растение (см. рис. В). Независимость роста опухоли от гормонов обусловливается тремя генами (опс-гены)1, функции которых установлены. Ген 1 кодирует триптофанмонооксигеназу, ген 2 — индол- ацетамидамидогидролазу и ген 3 — изопенте- нилтрансферазу. Эти ферменты обеспечивают синтез ауксина ИУК (см. 7.6.1.2) и первой промежуточной стадии растительного биосинтеза цитокининов, изолентениладенозин-5'-моно- фосфата (см. 7.6.2.2) (рис. D). Их образование и активность не контролируются растительной клеткой. Благодаря этому клетки опухоли корончатого галла производят большие количества ауксина и цитокинина и ведут себя как растительные клетки, которым добавляют эти гормоны в культуру извне (см. рис. 7.47).
1 Эти растительные онкогены обозначают также iааН, iааМ, iрt или tms2, tms2; tmr. — Примеч. ред.
Рис. D. Кодируемые опс-генами ферменты биосинтеза ауксинов и цитокининов (структурные формулы для реакции изопентенил- трансферазы, см. рис. 7.46)
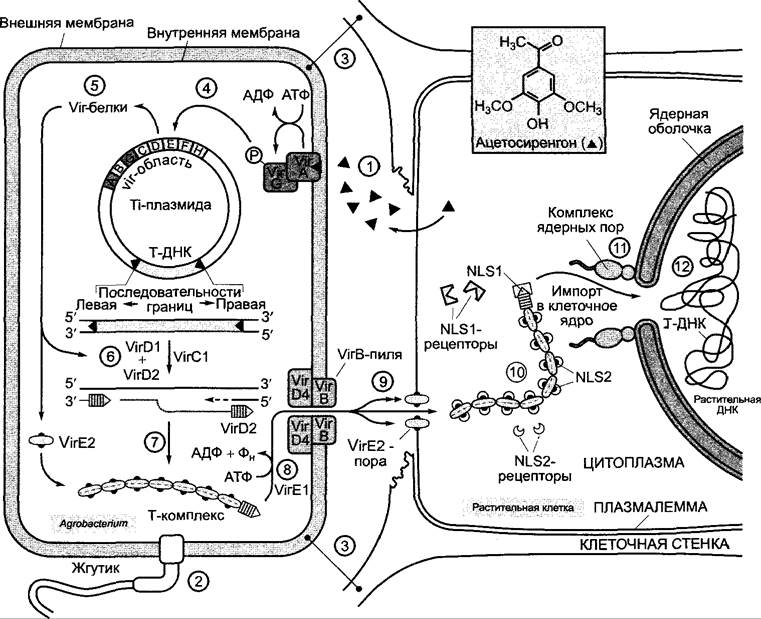
С вырезанной одноцепочечной Т-ДНК связываются многочисленные (около 600) VirE2- белки, так что образуется нитевидный Т-комплекс длиной -3,6 мкм, состоящий из одноцепочечной ДНК (ssDNA), ковалентно связанной с З'-концом белка VirD2, и оболочки из белка VirE2 (молекулярная масса -50000 кД); последний обладает сходством с простым вирусом, имеющим в качестве генетического материала одноцепочечную ДНК. Т-комплекс выходит теперь из бактериальной клетки через пилю, построенную из многочисленных различных белков VirB. Транспортная пиля в значительной степени сходна, с одной стороны, с F-пилями, которые обеспечивают транспорт ДНК во время конъюгации бактерий, с другой — с так называемыми секреторными аппаратами III типа других патогенных бактерий, которые служат для введения токсина в клетку-хозяина (например, у Bordetella pertussis, Yersinia pestis или фитопатогена Xanthomonas campestris). Белок VirE2 выполняет другую задачу при прохождении Т-комплекса в растительную клетку: он интегрируется в плазмалемму клетки-хозяина и образует (предположительно, путем олигомеризации) пору, через которую Т-цепь входит в растительную клетку. Подробности этого процесса еще не известны.
В растительной клетке Т-ДНК защищена от нападения растительных нуклеаз покрывающими ее белками. Кроме того, как VirD2-, так и VIrЕ2-белки имеют (различные) сигнальные последовательности (NLS1, NLS2) для импорта белков в клеточное ядро (ядерный импорт, см. рис. 7,17): Т-комплекс связывается растительными импортинами и вводится в клеточное ядро. Происходящая здесь интеграция Т-ДНК в ядерный геном еще не изучена. Она происходит, очевидно, в произвольном месте1, поэтому подходящие конструкции Т-ДНК (см. бокс 7.3) можно использовать также для инсерционного мутагенеза у растений. После интеграции в геном гены Т-ДНК эффективно транскрибируются растительной ДНК-зависимой РНК-полимеразой II. После того как синтез ИУК и цитокининов достаточно повышает клеточный уровень этих гормонов, трансформированные клетки из G0- фазы снова вступают в G1 фазу и тем самым — в активный клеточный цикл (см. 7.3.2). Благодаря выделяющимся гормонам соседние не трансформированные клетки также побуждаются к возобновлению деления, в результате этого опухоли, как правило, представляют собой смесь из трансформированных и нормальных клеток.
1 В последние годы появляются данные о более специфичном встраивании Т-ДНК. — Примеч. ред.
Рис. Е. Взаимодействие Agrobacterium tumefaciens с поврежденной хозяйской клеткой: 1 — образование раневого вещества ацетосирингона и активация рецептора ацетосирингона (VirА, VirG); 2 — хемотаксис бактерий; 3 — контактное соединение с растительной клеткой (процесс в подробностях неизвестен, однако агробактерии могут синтезировать целлюлозу и таким образом крепко связываться с клеточными стенками); 4 — активация индуцируемых vir-оперонов фос- форилированным VirG-белком; 5 — биосинтез индуцируемых Vir-белков; 6 — вырезание Т-цепи; 7, 8 — соответственно образование и экспорт Т-комплекса; 9 — переход Т-комплекса в растительную цитоплазму; 10 — связывание растительных NLS-рецепторов с NLS1 и NLS2 (NLS — от англ, nuclear localization signal — последовательность сигнала ядерной локализации); 11 — ядерный импорт Дальнейшие этапы до интеграции Т-ДНК в ядерный геном неизвестны (12)
Если используют Ti-плазмиды, у которых отсутствуют три опс-гена, то можно вырастить морфологически нормальные трансгенные растения. Образование опухоли, таким образом, подавляется, а вызывает его исключительно наличие трех опс- генов. Если делегируют, соответственно, один из генов, происходит образование тератом (организованно растущих опухолей). При отсутствии гена 1 (и/или гена 2) падает дополнительный синтез ИУК, производится много дополнительного цитокинина: опухоль растет как многочисленные уродливые побеги.1 Если делегируют ген 3, так что подавляется только синтез цитокинина, то опухоли растут как тератомы с множественными уродливыми корнями.2 Это органообразование сравнимо с тем, которое происходит, если для регенерации растений из каллусной ткани изменяют соотношение ауксинов/цитокини- нов в питательной среде (см. рис. 7.47).
1 По этому симптому мутации называют tms1и tms2: tumor morphology shooty (морфология опухоли побеговая). — Примеч. ред.
2 Аналогично мутацию называют tmr: tumor morphology rooty (морфология опухоли корневая). — Примеч. ред.
Ход взаимодействия Agrobacterium tumefaciens с растением-хозяином выяснен во многих подробностях, но пока еще не полностью. Особое значение имеют при этом гены vir-области Ti-плазмиды (vir — вирулентность). Бактерия находит пораненный участок растения-хозяина путем хемотаксиса. В качестве «раневых факторов»
были идентифицированы фенолы, например, (как у Rhizobium) флавоноиды, а также продукты разложения фенилпропанов (см. 6.16.1; 6.17.2), среди которых особое значение имеет ацетосирингон (рис. Е). Ацетосирингон связывается с одним из двух конститутивно экспрессирующихся продуктов vir-генов — белком VirA. При этом речь идет о рецепторном белке типичной бактериальной двухкомпонентной системы регулирования (ср. 7.6.5.3; рис. 7.63). Связывание влияет на фосфорилирование белка VirA, фосфатный остаток которого переносится на второй конститутивно экспрессирующийся Vir-белок, VirG, регуляторный белок двухкомпонентной системы, который в фосфорилированной форме представляет собой активный транскрипционный фактор, активирующий в свою очередь транскрипцию всех остальных vir-генов. При совместном действии белков VirD1, VirD2 и VirCl на 5'-конце перед последовательностью правой границы в ДНК вносится одноцепочечный разрыв, причем VirD2+VirDl действуют как эндонуклеазы, специфичные к последовательности и ДНК-цепи. VirD2 связывает новый образовавшийся 5'-конец ковалентно. Теперь Т-цепь разрывается у последовательности левой границы и отделяется от противоположной цепи, в то время как возникающая «брешь» на Ti-плазмиде застраивается в направлении 5' —» 3' благодаря репарационному синтезу, так что снова возникает полноценная двухцепочечная замкнутая плазмида.
Все известные вироиды фитопатогенны. Речь идет об очень небольших (см. рис. 1.10) кольцевых молекулах РНК, размножение которых, вероятно, происходит путем РНК-РНК-репликации и которые переходят от зараженных растений в здоровые, главным образом в результате деятельности человека и проводимых им сельскохозяйственных работ (например, размножение черенками). Механизм заболевания вироидами неизвестен. Предполагается, что вироиды активируют определенные растительные ферменты (например, протеинкиназы), из-за чего нарушается синтез белков. Предполагается также нарушение взаимодействия мРНК и рибосом.
Со стороны патогена для успешного заселения хозяев важны два процесса: (а) узнавание хозяина и (б) закрепление патогена в обход механизмов защиты растения или устранение механизмов защиты часто наряду с ослаблением растения-хозяина из-за производимых патогеном факторов патогенности. Со стороны растения успешная защита от патогена связана с (а) «узнаванием» патогена и (б) следующей за этим патогениндуцируемой защитой, которая усиливает конститутивные структурные и химические защитные барьеры. Эта защита от патогена рассматривается в следующем разделе (см. 9.3.4).
Схема патогенеза, характерная для многих совместимых взаимодействий хозяин— патоген, особенно с участием грибов, представлена на рис. 9.14. Патоген должен преодолеть как (paco)специфичную, так и общую защиту от патогена или соответственно предотвратить активацию индуцируемых защитных реакций растения. Мобилизация расоспецифичной защиты не происходит при наличии «неподходящих» комбинаций генов авирулентности и генов устойчивости растения-хозяина (см. 9.3.1, рис. 9.13). Веществами растений-хозяев (возможно, также поверхностными структурами) обеспечивается узнавание хозяина патогеном, из-за чего активируются (как правило, многочисленные) гены патогенности. К продуктам генов относятся многие литические ферменты, такие, как кутиназы, целлюлазы и полигалактуроназы, которые служат для преодоления кутикулы, клеточных стенок и срединных пластинок. Энзимные препараты из фитопатогенных грибов (например, Тrichoderma viride) используются в коммерческих целях для производства протопластов (это растительные клетки без клеточной стенки). Многие патогены производят токсины, среди которых найдены как некоторые хозяин-специфичные, так и многочисленные неспецифично действующие (рис. 9.15).
Рис. 9.14. Схема развития совместимого взаимодействия между патогеном и его хозяином, в ходе которого растение заболевает
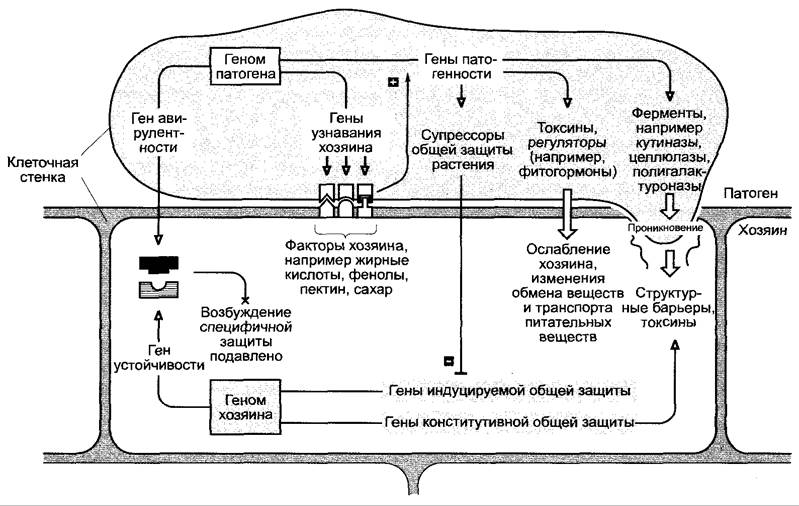
Рис. 9.15. Примеры фитотоксинов, не специфичных к хозяину (А — с любезного разрешения C.Oecking): А — фузикокцин — токсин Fusicoccum amygdali, вызывающий увядание; В — коронатин, индуцирующий хлорозы токсин фитопатогенных штаммов Pseudomonas syringae
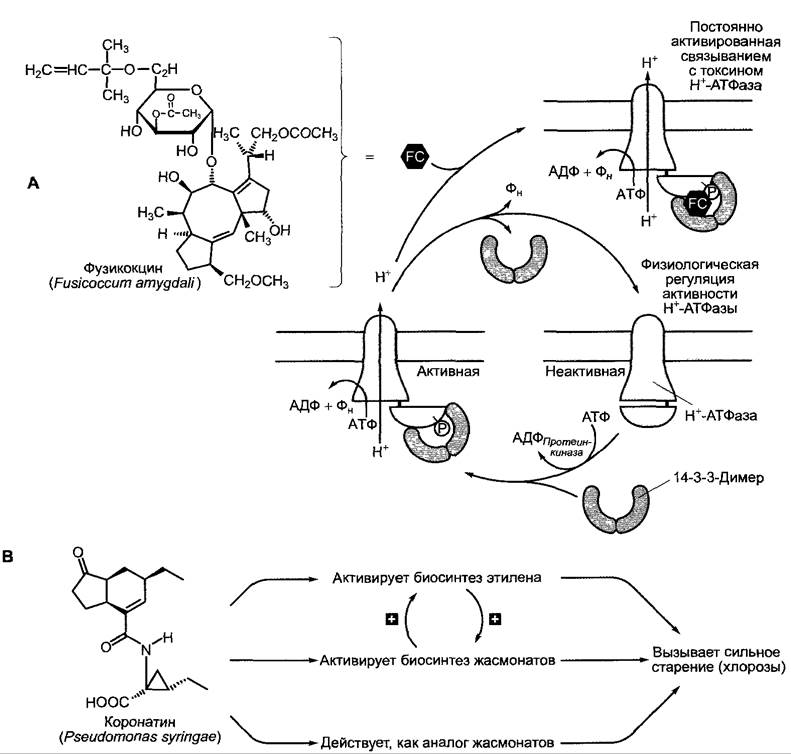
К хозяин-специфичным токсинам относится хлорсодержащий пентапептид викторин гриба Cochliobolus victoriae, который специфично поражает сорт овса «Victory». Викторин блокирует митохондриальную глицин-декарбоксилазу овса (см. рис. 6.75) и тем самым нарушает фотодыхание. К токсинам, не специфичным по отношению к хозяину, относится, например, уже упомянутый фузикокцин (см. рис. 9.15, А) гриба Fusicoccum amygdali; сильный активатор Н+-АТФазы P-типа на плазмалемме, который таким образом вызывает усиление транспорта протонов через мембрану и, как следствие, сильное открытие устьиц. Таким образом, фузикокцин действует как токсин, провоцирующий увядание и общее ослабление растения-хозяина. Коронатин, вызывающий хлорозы токсин фитопатогенных штаммов бактерии Pseudomonas syringae (рис. 9.15, В), оказался структурным аналогом жасмонатов (см. 7.6.6.2). Он стимулирует (как жасминовая кислота, данная в очень высоких дозах), — усилен-
ное образование этилена и тем самым старение. Так как коронатин в растении не транспортируется, в местах бактериального роста развиваются хлоротичные пятна. В ослабленных участках (как правило, на листьях) патоген может сильно размножаться.
Некоторые микробные патогены производят фитогормоны и через них влияют на процессы развития растения. Выше упоминались вызываемые цитокининами «ведьмины метлы» (см. 7.6.2.3). В некоторых случаях в галлообразовании принимают участие ауксины (например, при образовании цист и корневых узелков при поражении нематодами, см. 9.1.1, а также у вызываемой грибом Plasmodiophora brassicae килы капусты и вызываемого грибом Ustilago mayáis нароста на пораженных молодых зерновках кукурузы). Неясно, однако, поставляются ауксины патогеном или образуются по сигналу патогена самим растением-хозяином.1 Уже были упомянуты (см. 7.6.3) гиббереллины, которые выделяются некоторыми грибами и вызывают у растений-хозяев чрезмерное растяжение междоузлий (например, Gibberella fujikuroi у риса, Sphaceloma manihoticola у маниока). Особенно хорошо изучена роль ауксинов и цитокининов при возникновении опухолей и болезни бородатых корней, вызванных Agrobacterium (см. бокс 9.2).
1 В случае инфекции Pseudomonas syringae точно показано, что ауксины синтезируются в клетках бактерий. — Примеч. ред.
Наконец, некоторые патогены высвобождают супрессоры индуцируемой общей защиты растения (см. рис. 9.14). Эта общая защита вызывается не специфичными к хозяину элиситорами (см. 9.3.4), из которых, по крайней мере, некоторые распознаются специальными рецепторами растения. Гриб Mycosphaerella pinodes образует гликопептиды, которые должны связаться с рецептором гликопротеинового элиситора гороха и таким образом предотвратить узнавание патогена растением-хозяином.
Наряду с представленными на рис. 9.14 механизмами патогенеза многие патогены используют более специализированные стратегии, которые, однако, не могут быть
представлены в рамках этой книги. Лучше всего изученное взаимодействие хозяин — патоген между Agrobacterium tumefaciens и его растениями-хозяевами, ведущее к образованию раковых опухолей и болезни бородатого корня (см. бокс 9.2). Agrobacterium tumefaciens используется сегодня, как правило, для введения и стабильной интеграции чужеродных генов в растительный геном (см. бокс 7.3).
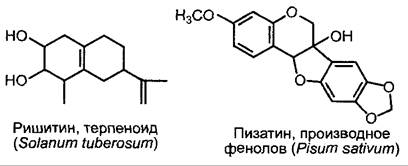
Наряду со сформировавшимися заранее (конститутивными) механизмами защиты от микробных вредных организмов (например, кутикула, клеточные стенки — особенно, если они лигнифицированы, — накопление токсичных веществ в клеточных стенках и вакуолях, например, сапонинов, фенолов и хинонов, ср. 6.16) растения обладают многочисленными индуцируемыми защитными реакциями, которые отличаются по механизмам действия, а также по структурным и химическим компонентам ответа на внедрение патогена. Индуцируемые внедрением патогена антимикробные органические вещества называются фитоалексинами; многие фитоалексины являются производными терпенового или фенилпропанового метаболизма (см. 6.16.1; 6.16.2; рис. 9.16). К индуцируемым структурным компонентам относятся: образование каллозы — (β1 —> 3)- глюкана — в месте проникновения патогена, усиление степени утолщения клеточной стенки, усиленная лигнификация.
Рис. 9.16. Примеры фитоалексинов. Антимикробное действие фитоалексинов было особенно четко показано на примере пизатина. Вирулентность патогенного для гороха гриба Nectria haematococca зависит от его способности энзиматически обезвреживать пизатин (структурная формула соевого фитоалексина глицеоллина представлена на рис. 6.118)
При защите от патогена можно различить, как уже упоминалось, общую, не специфичную к патогену, и (частично расо) специфичную защиту (см. рис. 9.14; 9.17). При подходящей комбинации ген-на-ген растительного гена устойчивости и гена авирулентности со стороны патогена (расоспецифичное несовместимое взаимодействие, см. рис. 9.17) вызывается гиперчувствительный ответ растения, который начинается быстрым и массовым образованием токсинов (особенно фенолов) и высвобождением активных форм кислорода (например, О-2), а также Н2O2, и вызывает локальную, запрограммированную смерть клетки, между тем погибает и патоген. Гиперчувствительная смерть клеток проявляется в форме небольших отмерших (- некротических) участков ткани, часто на листьях.
Общая защита вызывается не специфичными к хозяину элиситорами, которые возникают как продукты разложения клеточных стенок или мембран патогена и/или растительных клеточных стенок во время проникновения патогена. Многочисленные элиситоры уже были идентифицированы (например, олигогалактурониды, олигоглюканы, гликопептиды, олигохитозаны, грибные стероиды, такие, как эргостерол, гликолипиды и др.). Иногда достаточно концентрации менее 10-9 моль/л, чтобы элиситоры вызвали реакции общей защиты от патогена, а именно, с одной стороны, локальные процессы, такие, как образование фитоалексинов, утолщение клеточной стенки, лигнификация, а с другой — системные процессы, такие, как образование специальных РR-белков (РR, англ. pathogenesis related), функция которых, однако, до сих пор не выяснена.1
1 Среди РR-белков есть растительные хитиназы и глкжаназы. Одна из функций этих ферментов — расщепление клеточной стенки патогена с целью образования элиситоров. Кроме того, к РК-белкам относят SАR-короткие пептиды (системины), которые служат сигнальными молекулами, обусловливающими системную приобретенную устойчивость всего растения (см. 9.3.1). — Примеч. ред.
Рис. 9.17. Схема развития несовместимого взаимодействия между патогеном и его хозяином, которое ведет к защите от патогена. Слева — расоспецифичная несовместимость (ср. рис. 9.13), вследствие которой наступает гиперчувствительная смерть клетки. Справа — не специфичная к хозяину устойчивость, которая стимулируется выделением элиситоров и (в некоторых случаях) жасмонатами и включает общие локальные защитные реакции растения, а также системные защитные реакции
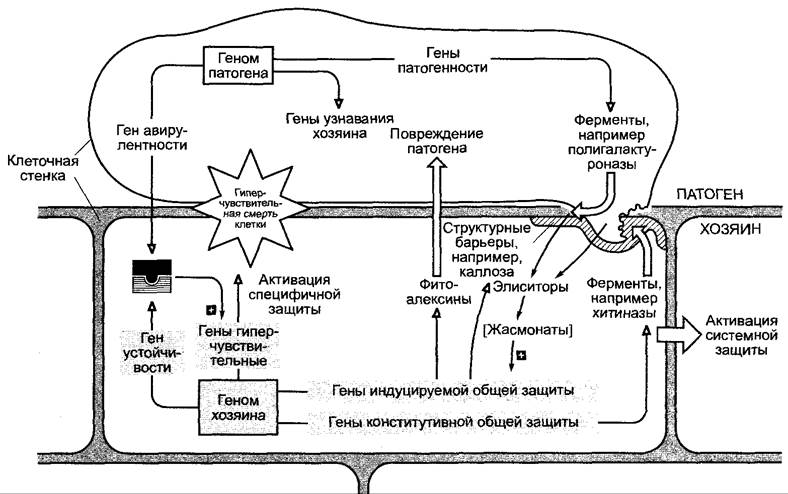
Предполагается, что элиситоры связываются с растительными рецепторами, расположенными на плазмалемме, и оттуда цепь сигналов ведет к патогениндуцируемым генам. Природа и способ действия этих рецепторов еще непонятны. Некоторые элиситоры, по-видимому, могут непосредственно интегрироваться в клеточные мембраны и работать в качестве ионопроводящих образователей пор, снижая растительный мембранный потенциал. Как это ведет к активации генов защиты, неизвестно, как не известна и природа системных сигналов, которые, исходя из места поражения патогеном, индуцируют начало определенных защитных реакций во всем растении.
Во многих случаях было показано, что жасмонаты (см, 7.6.6.2) представляют собой звено сигнальной цепи от элиситора к экспрессии генов защиты. Мутанты Arabidopsis thaliana с нарушенным биосинтезом жасмонатов были более восприимчивыми к микробным патогенам. В других случаях (например, при поражении вирусом) обсуждается участие салициловой кислоты (см. рис. 6.114). Однако скорее речь идет не о сигнальном веществе, а о фитоалексине. Салициловая кислота могла бы играть роль гормона при системно приобретенной устойчивости (SAR, см. 9.3.1).