Фізіологія людини - Вільям Ф. Ґанонґ 2002
Ендокринна система, метаболізм і репродуктивна функція
Енергетичний баланс, метаболізм і живлення
Обмін вуглеводів
Вуглеводи харчових продуктів - це переважно полімери гексоз, з яких найважливішими є глюкоза, галактоза і фруктоза (рис. 17-8). Більшість моносахаридів в організмі перебуває у вигляді D-ізомерів. Головний продукт, що всмоктується в травному тракті і циркулює в крові, - глюкоза. В нормі рівень глюкози в плазмі периферійної венозної крові становить 70-110 мг/дл (3,9-6,1 ммоль/л), а в плазмі артеріальної крові на 15-30 мг/дл вищий, ніж у венозній.

Рис. 17-7. Спрощена схема транспортування протонів через внутрішню і зовнішню поверхні внутрішньої мітохондріальноі мембрани за допомогою транспортної системи електронів (флавопротеїнцитохромна система) з подальшим зворотним рухом протонів за протонним ґрадієнтом, унаслідок чого утворюється АТФ.
Після поглинання клітинами глюкоза переважно фосфорилює до глюкозо-6-фосфату. Ензим, який каталізує цю реакцію, називають гексокіназою. У печінці, крім того, міститься глюкокіназа, яка більше споріднена з глюкозою й активність якої, як і гексокінази, посилюється під впливом інсуліну і послаблюється під час голодування та в разі діабету. Глюкозо-6-фосфат або використовується для утворення глікогену, або розщеплюється (катаболізм). Ці шляхи зображені на рис. 17-9. Процес утворення глікогену називають глікогенезом, а процес розщеплення - глікогенолізом. Глікоген, як форма зберігання глюкози, міститься в багатьох тканинах організму, проте найбільше його в печінці і скелетних м’язах. Розщеплення глюкози до nipy вату або лактату (чи до обох) називають гліколізом. Катаболізм глюкози відбувається шляхом утворення фруктози і розщеплення її до тріоз або ж шляхом окиснення і декарбоксилювання з утворенням пентоз. Шлях, що веде до утворення пірувату через формування тріоз, називають шляхом Ембдена-Мейєргофа, а шлях, що веде до утворення 6-фосфоглюконату і пентоз, - пентозофосфатним шляхом окиснення (пентозомонофосфатний шунт) (див. рис. 17-9). Піруват перетворюється на ацетил-КоА. У процесі взаємного перетворення вуглеводів, жирів та білків гліцерин жирів перетворюється на діоксіацетонфосфат, а низка амінокислот, вуглецевий скелет яких подібний на проміжні продукти шляху Ембдена-Мейєргофа і циклу лимонної кислоти, - на ці проміжні продукти після дезамінування. Таким способом, а також шляхом перетворення лактату до глюкози неглюкозні молекули можуть поповнювати кількість глюкози (глюконеогенез).
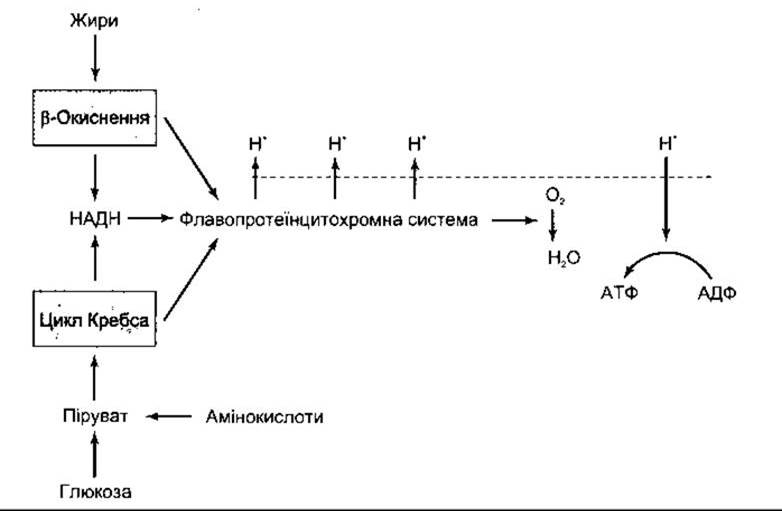
Рис. 17-6. Спрощена схема окисного фосфорилювання. В процесі обміну жирів, глюкози й амінокислот утворюються протони (Н+), які переходять крізь внутрішню мітохондріальну мембрану (штрихова лінія). Дифузія цих протонів за концентраційним фадієнтом, який виник, спонукає АТФ-азу до перетворення АДФ на АТФ. Ключові ензими цього перетворення показані на рис. 1-7.
Глюкоза через ацетил-КоА може перетворюватись на жири, та оскільки перетворення пірувату на ацетил-КоА, на відміну від інших реакцій гліколізу, є незворотним (рис. 17-10), то жири цим способом не можуть перетворюватись на глюкозу. В організмі перетворення жирів на глюкозу мінімальне (виняток становить кількісно незначне утворення глюкози з гліцерину) з огляду на те, що шляхів цього перетворення нема.
Цикл лимонної кислоти
Цикл лимонної кислоти (цикл Кребса, цикл трикарбонових кислот) - це послідовність реакцій, у яких ацетил-коензим А метаболізується до СО2 та атомів водню. Ацетил-коензим А спочатку конденсується з аніоном дикарбонової кислоти - оксалоацетатом, унаслідок чого утворюється цитрат і HS-KoA. В серії семи послідовних реакцій вивільняються дві молекули СО2, а також регенерується оксалоацетат (див. рис. 17-10). Чотири пари атомів водню переходять на флавопротеїнцитохромний ланцюг, завдяки чому утворюються 12 молекул АТФ і 4 молекули Н2О, з яких дві молекули Н2О використані в циклі. Цикл лимонної кислоти є спільним шляхом окиснення вуглеводів, жирів і деяких амінокислот до СО2 і Н2O.
Головним шляхом, що приводить до циклу лимонної кислоти, є шлях через ацетил-КоА, проте деякі амінокислоти можуть перетворюватись на проміжні продукти циклу лимонної кислоти дезамінуванням. Для перетворення в циклі лимонної кислоти потрібний О2, і він не діє в анаеробних умовах.
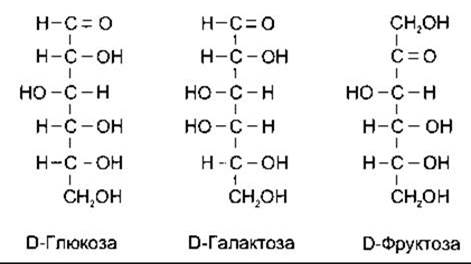
Рис. 17-8. Структура головних харчових гексоз. Зображені формули головних природних ізомерів.
Генерування енергії
Чистий вихід високоергічних фосфатних сполук, що утворюються під час метаболізму глюкози і глікогену до пірувату, залежить від того, чи відбувається метаболізм шляхом Ембдена-Мейєргофа чи пентозо-фосфатним. Під час фосфорилювання на субстратному рівні з І моля фосфогліцеральдегіду утворюється 1 моль АТФ, а перетворення 1 моля фосфоенолпірувату на піруват - ще 1 моль АТФ. ОСКІЛЬКИ внаслідок перетворення 1 моля глюкозо-6-фосфату по шляху Ембдена-Мейєргофа утворюється 2 молі фосфогліцеральдегіду, то з 1 моля глюкози, що метаболізується до пірувату, утворюється 4 молі АТФ. Усі ці реакції відбуваються без О2 і, відповідно, є шляхом анаеробного утворення енергії. Однак у цьому разі 1 моль АТФ потрібен для утворення фруктозо-1,6-дифосфату з фруктозо-6-фосфату, а 1 моль - для фосфорилювання глюкози. Отже, внаслідок утворення пірувату з глікогену в анаеробних умовах утворюються 3 молі АТФ на 1 моль глюкозо-6-фосфату; якщо ж піруват утворюється з 1 моля глюкози, то ця кількість становить лише 2 молі АТФ.
Для перетворення фосфогліцеральдегіду на фосфогліцерат потрібний НАД+. Можна було б сподіватись, що в анаеробних умовах (анаеробний гліколіз) повинно наставати блокування на рівні перетворення фосфогліцеральдегіду в міру перетворення наявного НАД+ на НАДН. Проте цього не відбувається, оскільки акцептором водню НАДН є піруват і, отже, утворюються НАД+ і лактат:
![]()
Цим шляхом метаболізм глюкози й утворення енергії можуть відбуватися без О2. Лактат, що накопичується, може перетворюватись знову на піруват, а за наявності О2 НАДН передає свій водень на флавопротеїнцитохромний ланцюг.
Під час аеробного гліколізу чистий вихід АТФ у 19 разів більший, ніж в анаеробних умовах. Чотири молекули АТФ утворюються внаслідок окиснення в флавопротеїнцитохромному ланцюгу двох молекул НАДН, які утворились під час перетворення 2 молів фосфогліцеральдегіду на фосфогліцерат (див. рис. 17-9); ще шість молекул АТФ утворюються внаслідок перетворення двох молекул НАДН, що виникли у разі конвертації пірувату на ацетил-КоА; 24 молекули АТФ утворюються під час послідовного дворазового проходження через цикл лимонної кислоти: з них 18 - унаслідок окиснення шести молекул НАДН; чотири - під час окиснення двох молекул ФАДН; дві - унаслідок фосфорилювання на субстратному рівні, коли сукциніл-КоА перетворюється на сукцинат. За умов цієї реакції фактично утворюється ГТФ, проте він еквівалентний до АТФ. Отже, чистий вихід АТФ на 1 моль глюкози, що метаболізується шляхом Ембдена-Мейєргофа і в циклі лимонної кислоти, становить 2 + [2 х 3] + [2 х 3] + [2 х 12] = 38.
У випадку окиснення глюкози по пентозофосфатному шляху утворюються значні кількості НАДФН. Цей відновлений коензим потрібний для багатьох метаболічних процесів. Пентози, що виникають, є матеріалом, необхідним для синтезування нуклеотидів (див. нижче). Кількість АТФ, що утворюється, залежить від кількості НАДФН, який обмінюється на НАДН, що далі окиснюється.
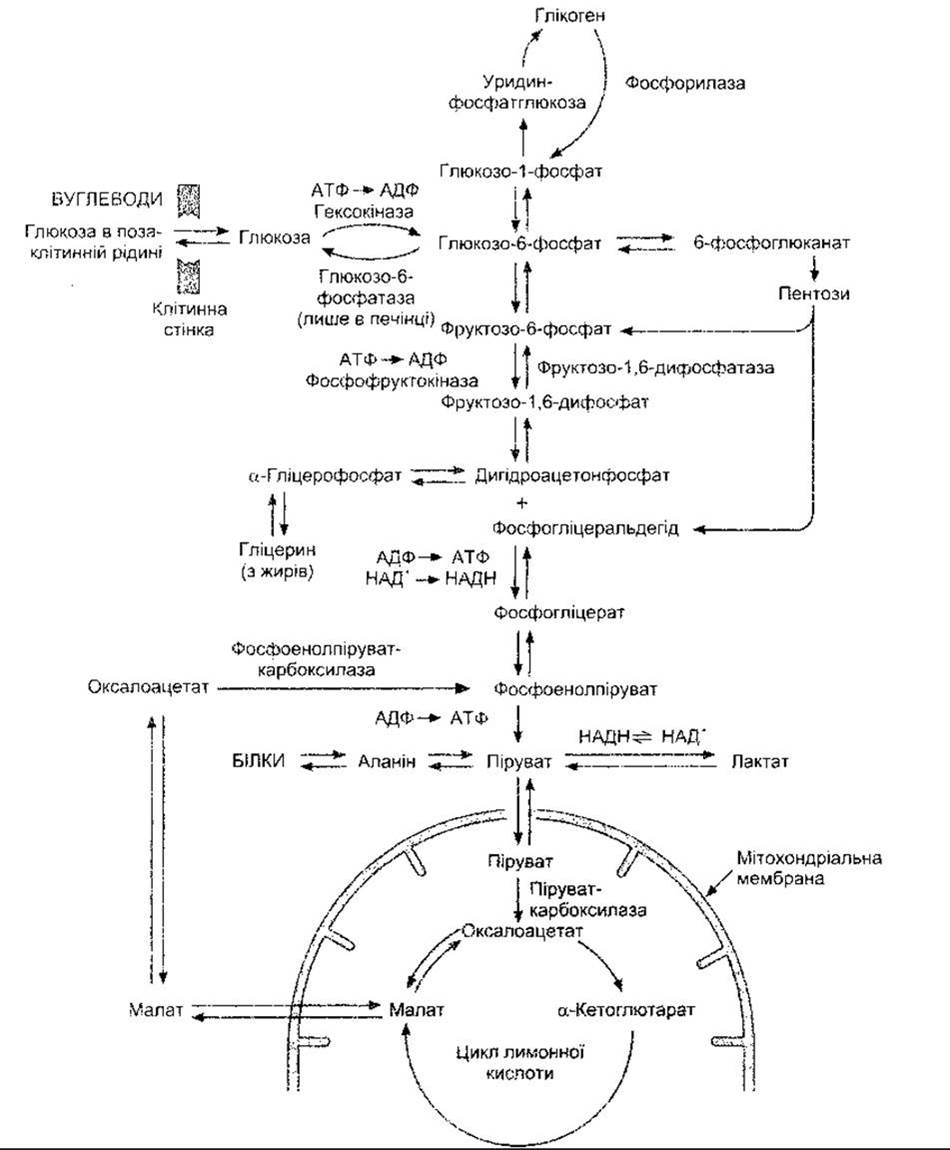
Рис. 17-9. Схема метаболізму вуглеводів у клітинах. Наведені головні ензими перетворення вуглеводів.
«Спрямовувальні клапани»
Метаболізм регулюють різноманітні гормони та інші чинники. З метою регулювання деяких метаболічних процесів потрібно скеровувати хімічні реакції в одному напрямі.
Більшість реакцій проміжного обміну зворотні, однак серед них є декілька «спрямовувальних клапанів», тобто реакцій, що відбуваються під впливом певного одного ензиму або транспортного механізму в одному напрямі, а їхній зворотний хід потребує іншого ензиму. На рис. 17-11 показано п’ять таких реакцій проміжного обміну вуглеводів. Прикладом можуть слугувати також різні шляхи синтезування і катаболізму жирних кислот (див. нижче). Чинники регулювання впливають на метаболізм шляхом прямої або опосередкованої дії на такого типу «спрямовувальні клапани».
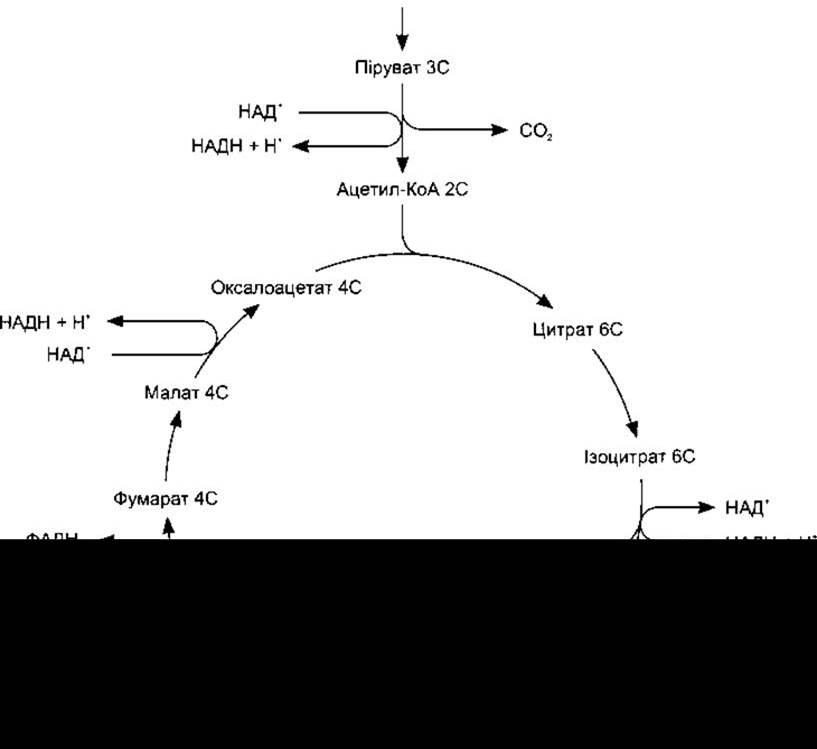
Рис. 17-10. Цикл лимонної кислоти. Числа (6С, 5С та інші) означають кількість атомів вуглецю в проміжних продуктах. Перетворення пірувату на ацетил-КоА і кожен обіг циклу зумовлюють утворення чотирьох молекул НАДН та однієї молекули ФАДН2, які далі окиснюються у флавопротеїнцитохромному ланцюгу, а також однієї молекули ГТФ, що легко перетворюється на АТФ (модифіковано і відтворено за дозволом з Alberts ВМ et al: Molecular Biology of the Cell, 2nd ed. Garland, 1989).
Синтез і розщеплення глікогену
Глікоген - це розгалужений полімер глюкози, утворений за допомогою двох типів глікозидних зв’язків: 1:4а та 1:6а (рис. 17-12). Він синтезується на глікогеніні - білковому індукторі - з глюкозо-1-фосфату через уридиндифосфоглюкозу (УДФГ). Ензим глікогенсинтаза завершує синтез. Наявність глікогеніну є одним з чинників, що визначає кількість утворення глікогену. Розщеплення глікогену за 1:4а-зв’язком каталізує фосфорилаза, тоді як розщеплення за 1:6а-зв’язком - інший ензим.
Фосфорилазу активує частково адреналін, який діє на Р2-адренорецептори печінки. Це, відповідно, ініціює послідовність реакцій, що слугують класичним прикладом гормонального впливу через цАМФ (рис. 17-13). Протеїн-кіназа А активується за допомогою цАМФ і каталізує перенесення фосфатної групи на кіназу фосфорилази, перетворюючи її на активну форму. Кіназа фосфорилази каталізує фосфорилювання і відповідне активування фосфорилази. Неактивна фосфорилаза відома як фосфорилаза а (дефосфофосфорилаза), а активована - як фосфорилаза b (фосфофосфорилаза).
Активування протеїнкінази А за допомогою цАМФ не тільки посилює розщеплення глікогену, а й гальмує його синтезування. Глікогенсинтаза (див. рис. 17-12) активна в дефосфорильованому вигляді і неактивна у фосфорильованому. Її фосфорилює кіназа фосфорилази, коли відбувається активування протеїнкінази А.
Глікоген розщеплюється також під впливом катехоламінів, що діють на а1-адренорецептори печінки. Це розщеплення опосередковане внутрішньоклітинним Са2+ і зумовлюване активуванням незалежної від цАМФ кінази фосфорилази. Великі дози вазопресину й ангіотензину II теж можуть зумовлювати глікогеноліз таким шляхом, однак це малоймовірно, бо ці гормони позитивно впливають на гомеостаз глюкози. Оскільки в печінці міститься ензим глюкозо-6-фосфатаза, то більшість глюкозо-6-фосфату, що утворюється в цьому органі, може перетворюватись на глюкозу і переходити в кров’яне русло, підвищуючи рівень плазматичної глюкози. Функція нирок теж сприяє підвищенню такого рівня. Інші тканини не містять цього ензиму, тому в них переважна кількість глюкозо-6-фосфату катаболізується шляхом Ембдена-Мейєргофа, а також за допомогою глюкозомонофосфатного шунта. Зростання катаболізму глюкози в скелетних м’язах зумовлює збільшення концентрації лактату в крові (див. Розділ 4).
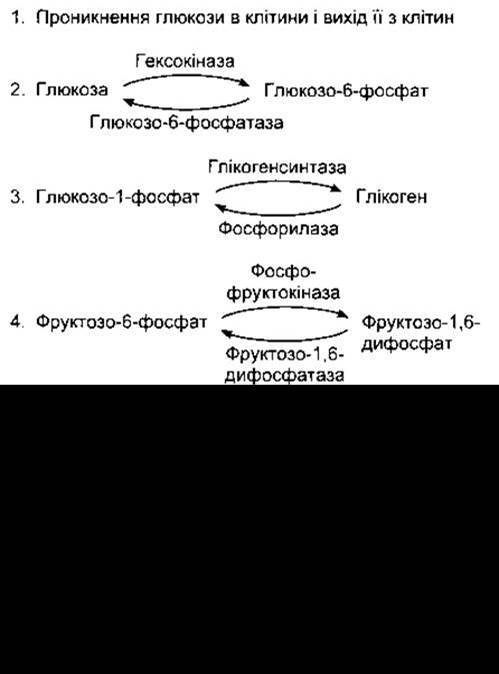
Рис. 17-11. П’ять прикладів «спрямовувальних клапанів» метаболізму вуглеводів, тобто реакцій, що відбуваються в одному напрямі за допомогою одного механізму, а в протилежному - за допомогою іншого. Подвійна лінія в прикладі 5 позначає мітохондріальну мембрану. Піруват перетворюється на малат у мітохондріях, а малат дифундує з мітохондрій до цитозолю, де перетворюється на фосфоенолпіруват.
Адреналін, стимулюючи аденілатциклазу, призводить до активування фосфорилази в печінці і скелетних м’язах. Наслідком цього є підвищення рівня глюкози в плазмі і збільшення кількості лактату в крові. Глюкагон має подібну дію, проте він впливає лише на фосфорилазу печінки. Відповідно, глюкагон зумовлює підвищення рівня глюкози в плазмі, однак не приводить до зміни кількості лактату в крові.
Хвороба Мак-Ардла
У випадку захворювання, відомого як хвороба Мак-Ардла, або міофосфорилазодефіцитний глікогеноліз, глікоген накопичується в скелетних м’язах унаслідок дефіциту м’язової фосфорилази. Такі хворі відчувають біль у м’язах, у них виникає ригідність під час фізичних зусиль і значно знижується працездатність. У скелетних м’язах не відбувається розщеплення глікогену, що потрібно для забезпечення енергії м’язового скорочення (див. Розділ 3), а кількість глюкози, що надходить до м’язів з кров’яного русла, достатня лише для виконання дуже обмежених рухів. У разі введення глюкагону або адреналіну рівень глюкози в плазмі стає нормальним, а це свідчить про те, що дефіциту печінкової фосфорилази в цих хворих немає.
«Печінковий глюкостат»
Якщо рівень глюкози у плазмі високий, то її поглинає печінка, а якщо низький, то глюкоза надходить з печінки у кров. Отже, печінка діє як «глюкостат», що підтримує сталу концентрацію глюкози в крові. Ця функція не відбувається автоматично. Процеси поглинання глюкози печінкою та її вивільнення перебувають під контролем численних гормонів. Питання ендокринного регулювання рівня плазматичної глюкози й обміну вуглеводів розглянуто в Розділі 19.
Нирковий регулятор глюкози
У нирках легко відбувається фільтрування глюкози, проте у випадку нормального рівня глюкози в плазмі вся глюкоза, за винятком дуже незначної кількості, підлягає реабсорбції в проксимальних канальцях (див. Розділ 38). Якщо ж кількість профільтрованої глюкози збільшується, то збільшується і її реабсорбція, проте до певної межі. Тобто у випадку перевищення максимальної можливості реабсорбції в канальцях (Кмг) у сечі з’являються помітні кількості глюкози (глюкозурія). Нирковий поріг для глюкози, тобто концентрація глюкози в артеріальній крові, за якої виникає глюкозурія, дорівнює приблизно 180 мг/дл. Проте він може бути і вищим, якщо рівень клубочкової фільтрації невисокий.
Глюкозурія
Глюкозурія виникає, якщо рівень глюкози в плазмі збільшується внаслідок нестачі інсуліну (цукровий діабет) або надмірного глікогенолізу після фізичного чи емоційного навантаження. В окремих осіб простежується природжена вада транспортних механізмів глюкози в ниркових канальцях, і в цьому випадку глюкозурія виникає і за нормального рівня глюкози в плазмі. Такий стан називають нирковою глюкозурією. Аліментарна глюкозурія, тобто глюкозурія після приймання багатої на вуглеводи їжі, обов’язково виникає в практично здорових людей, проте в значної кількості таких осіб насправді в легкій формі є цукровий діабет. Максимальна інтенсивність всмоктування глюкози в кишці становить 120 г/год.
Чинники, що визначають концентрацію глюкози в плазмі
Рівень глюкози в плазмі залежить від балансу між кількістю глюкози, що надходить до кров’яного русла, і кількістю, що поглинається. Головними чинниками, що впливають на цей баланс, є надходження глюкози з їжі, ступінь проникнення її в м’язові клітини, жирову та інші тканини і глюкостатична активність печінки (рис. 17-14). П’ять відсотків глюкози, що всмоктується в кишку, одразу перетворюється в печінці на глікоген, а 30-40% - на жири. Решта метаболізується в м’язах та інших тканинах. Під час голодування глікоген печінки розщеплюється і глюкоза надходить з печінки в кров’яне русло. У випадку тривалого голодування запаси глікогену вичерпуються, а в печінці відбувається глюконеогенез з амінокислот і гліцерину. В практично здорових людей унаслідок тривалого голодування рівень глюкози в плазмі може знижуватись приблизно до 60 мг/дл, проте в цьому разі не виникають симптоми гіпоглікемії, оскільки глюконеогенез запобігає подальшому зниженню рівня глюкози.
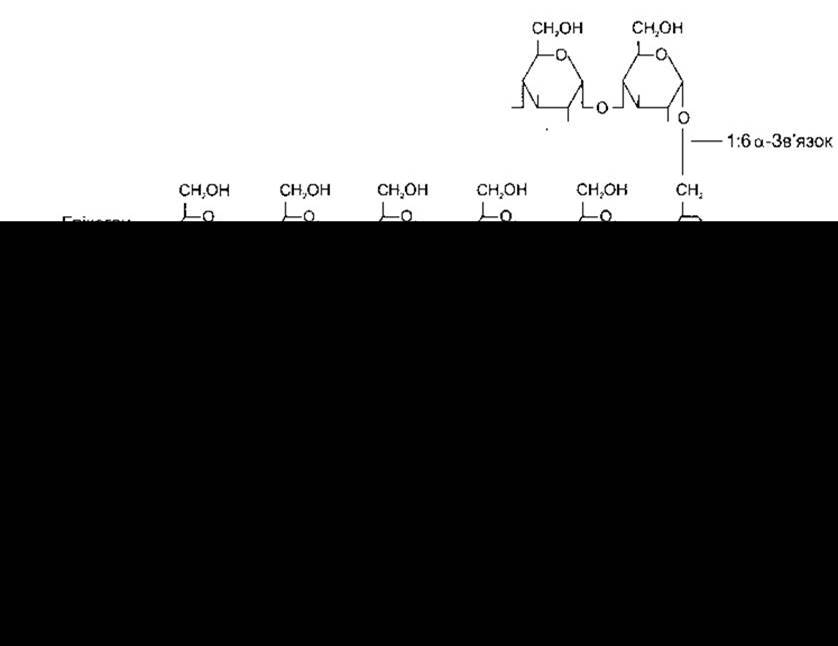
Рис. 17-12. Синтезування і розщеплення глікогену. Процес активування фосфорилази зображено на рис. 17-13.
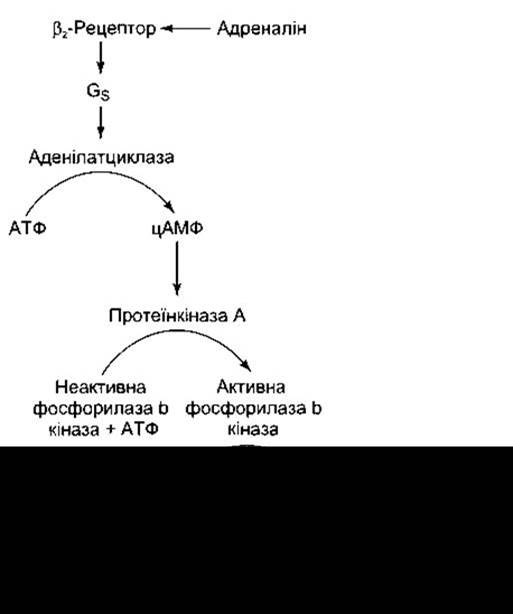
Рис. 17-13. Каскад реакцій, за допомогою якого відбувається активування адреналіном фосфорилази. Подібною є дія глюкагону в печінці, проте не в скелетних м’язах.
Гомеостаз вуглеводів у випадку фізичного навантаження
У людини масою 70 кг резерв вуглеводів становить приблизно 2500 ккал; вони зберігаються у вигляді 400 г м’язового глікогену, 100 г печінкового глікогену і 20 г глюкози, що міститься в міжклітинній рідині. Для порівняння: 112 000 ккал (приблизно 80% від енергетичних запасів організму) накопичені у вигляді жирів, а решта - у білкових сполуках. М’язи в стані відпочинку, а також після фізичної праці для потреб обміну використовують жирні кислоти. В разі утримання від споживання їжі в стані спокою головний мозок людини використовує 70-60% глюкози, а еритроцити - більшу частину решти.
Під час фізичної праці потреба м’язів у калоріях початково задоволена завдяки глікогенолізу і посиленому надходженню глюкози. Рівень глюкози в плазмі спочатку підвищується внаслідок посиленого глікогенолізу в печінці, проте у випадку напруженої тривалої праці він може суттєво знижуватись. Простежується зростання глюконеогенезу (рис. 17-15). У плазмі зменшується кількість інсуліну і збільшується кількість глюкагону й адреналіну. Після праці кількість глікогену в печінці поповнюється шляхом додаткового глюконеогенезу, а вихід глюкози з печінки зменшується.
Метаболізм інших гексоз
Окрім глюкози, у шлунково-кишковому тракті відбувається всмоктування галактози, яка утворюється під час розщеплення лактози і перетворюється в організмі на глюкозу, а також фруктози, частина якої надходить з їжі, а частина утворюється внаслідок гідролізу сахарози. Після фосфорилювання галактоза реагує з УДФГ, завдяки чому утворюється уридиндифосфогалактоза, яка знову перетворюється на УДФГ і бере участь у синтезі глікогену (див. рис. 17-12). Ця реакція є зворотною, і перетворення УДФГ на уридиндифосфогалактозу слугує для забезпечення галактозою процесів утворення гліколіпідів та мукопротеїнів, якщо надходження галактози з їжею недостатнє. Використання галактози, як і глюкози, є інсулінозалежним (див. Розділ 19). У разі спадкового порушення обміну речовин, відомого як галактоземія, простежується нестача галактозо-1-фосфатуридилтрансферази - ензиму, що каталізує реакцію між галактозо-1-фосфатом і УДФГ, унаслідок чого абсорбована галактоза накопичується в крові. У цьому випадку виникають значні порушення росту і розвитку організму. Застосування безгалактозного дієтичного харчування значно поліпшує стан хворого, завдяки цьому не виникає дефіциту галактози, оскільки уридиндифосфогалактоза утворюється з УДФГ. Фруктоза частково перетворюється на фруктозо-6-фосфат і далі метаболізує через фруктозо-1,6-дифосфат (див. рис. 17-9). Ензим, що каталізує утворення фруктозо-6-фосфату, називають гексокіназою, саме він каталізує перетворення глюкози на глюкозо-6-фосфат. Проте набагато більша кількість фруктози перетворюється на фруктозо-1-фосфат у реакції, яку каталізує фруктокіназа. Більша частина фруктозо-1-фосфату розщеплюється на діоксіацетонфос- фат і гліцеральдегід, який фосфорилює і разом з діоксіацетонфосфатом бере участь у метаболізмі глюкози. Оскільки реакції, що розпочинаються фосфорилюванням фруктози в першому положенні, можуть відбуватися з нормальною швидкістю без інсуліну, то застосування фруктози рекомендують хворим на діабет з метою поповнення в їхньому організмі запасу вуглеводів. Та оскільки більша частина фруктози метаболізує в кишці та печінці, то можливість поповнення вуглеводів в інших органах обмежена.
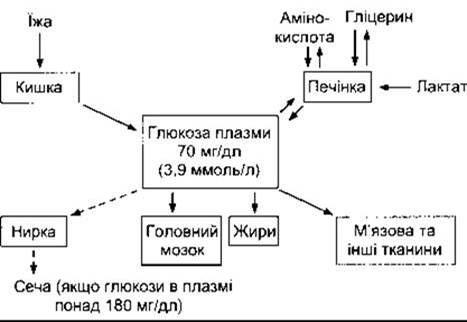
Рис. 17-14. Гомеостаз глюкози в плазмі. Зверніть увагу на глюкостатичну функцію печінки, а також на видалення глюкози з сечею в разі перевищення її ниркового порога (штрихова стрілка).
Фруктозо-6-фосфат може теж фосфорилювати у другому положенні з утворенням фруктозо-2,6-дифосфату. Ця сполука є важливим регулятором глюконеогенезу в печінці. За умов високої концентрації фруктозо-2,6-дифосфату посилюється процес перетворення фруктозо-6-фосфату на фруктозо-1,6-дифосфат і, як наслідок, активується розщеплення глюкози до пірувату. Зменшення кількості фруктозо-2,6-дифосфату посилює зворотну реакцію і, відповідно, сприяє глюконеогенезові. Протеїнкіназа під впливом глюкагону зумовлює зниження кількості фруктозо-2,6-дифосфату в печінці (див. Розділ 19).