Фізіологія людини - Вільям Ф. Ґанонґ 2002
Ендокринна система, метаболізм і репродуктивна функція
Ендокринні функції підшлункової залози й регулювання метаболізму вуглеводів
Глюкагон
Хімія
Глюкагон у людей - лінійний поліпептид із молекулярною масою 3485 - утворюють A-клітини підшлункових острівців та верхній відділ шлунково-кишкового тракту. Він містить 29 амінокислотних залишків (див. табл. 26-2). Глюкагони усіх ссавців мають однакову структуру. Людський препроглюкагон (рис. 19-16) є 179-амінокислотним поліпептидом, знайденим в А-клітинах, L-клітинах у нижньому відділі шлунково-кишкового тракту та в мозку. Це продукт однієї мРНК, яка, проте, по-різному оброблена в різних тканинах. В A-клітинах вона спершу перетворюється в глюкагон та головний проглюкагоновий фрагмент (MPGF - від англ. major proglucagon fragment), а в L-клітинах - у гліцентин (поліпептид, що складається з глюкагону, видовженого завдяки додатковим амінокислотним залишкам на кожному кінці), та глюкагоноподібні пептиди 1 і 2 (GLP-1 і GLP-2 - від англ. glucagon-like polypeptides 1, 2). Утворюється також деяка кількість оксинтомодуліну, а в А- та L-клітинах - гліцентинозв’язаний поліпептид (GRPP - glicentin-related polypeptide). Гліцентин має деяку глюкагонну активність. Пептиди GLP-1 і GLP-2 самі по собі не мають визначеної біологічної активності. Незважаючи на це, GLP-1 (7-36) є сильним стимулятором секреції інсуліну, що також збільшує утилізацію глюкози (див. вище). Крім того, GLP-1 та GLP-2 також утворюються в мозку, однак їхні функції в центральній нервовій системі не з’ясовані. Оксинтомодулін гальмує секрецію шлункового соку, проте його фізіологічна роль невідома, a GRPP не має визначених фізіологічних ефектів.
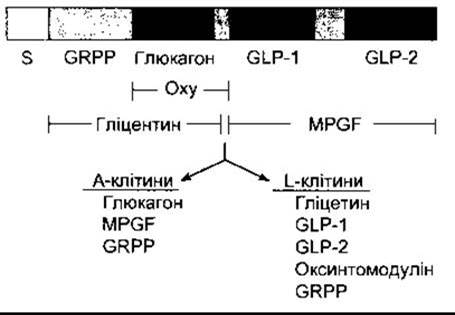
Рис. 19-16. Посттрансляційна обробка препроглюкагону в А- і L-клітинах; S - сигнальний пептид, MPGF - головний проглюкагоновий фрагмент; Оху - оксинтомодулін; GRPP - гліцентинозв’язаний поліпептид; GLP - глюкагоноподібний пептид (модифіковано з Drucker DJ: Glucagon and glucagon-like peptides. Pancreas 1990;5:484).
Дія
Глюкагон є глікогенолітичним, глюконеогенним, ліполітичним та кетогенним фактором. Він діє на серпентинові рецептори з молекулярною масою близько 190 000, а в печінці - через Gs для активування аденілатциклази та збільшення внутрішньоклітинного цАМФ. Це через протеїнкіназу А веде до активування фосфорилази, а отже, до збільшення розпаду глікогену та підвищення рівня глюкози в плазмі. Етапи, задіяні в цьому класичному прикладі посередництва цАМФ щодо прояву дії гормону, розглянуто в Розділі 17. Однак глюкагон діє на інші рецептори, розташовані на тих самих гепатоцитах, для активування фосфоліпази С, а завдяки збільшеному цитоплазматичному Са2+ також стимулює глікогеноліз. Протеїнкіназа А знижує метаболізм глюкозо-6-фосфату (рис. 19-17), зменшуючи перетворення фосфоенолпірувату в піруват, і зменшує концентрацію фруктозо-2,6-дифосфату, а це, відповідно, запобігає перетворенню фруктозо-6-фосфату у фруктозо-1,6-дифосфат. Як наслідок, накопичення глюкозо-6-фосфату веде до збільшеного вивільнення глюкози.
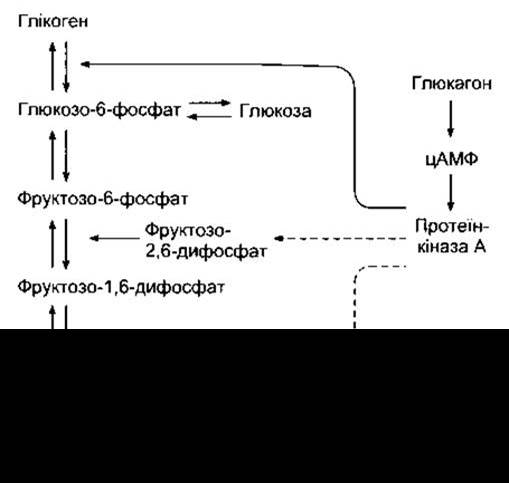
Рис. 19-17. Механізми, якими глюкагон збільшує вихід глюкози з печінки. Суцільні лінії показують стимулювання, а штрихові - пригнічення.
Глюкагон не спричинює глікогенолізу у м’язах, однак збільшує глюконеогенез із наявних амінокислот у печінці та підвищує рівень метаболізму. Він збільшує утворення кетонових тіл шляхом зменшення рівнів малоніл-КоА у печінці (див. Розділ 17). Його ліполітична активність, яка веде до збільшення кетогенезу, розглянута в Розділі 17. Калоригенна дія глюкагону сама по собі є наслідком не гіперглікемії, а, ймовірно, збільшеного печінкового деамінування амінокислот.
Великі дози екзогенного глюкагону зумовлюють позитивний інотропний ефект у серці (див. Розділ 29) без формування підвищеної серцевої збудливості, очевидно, внаслідок збільшення серцевого цАМФ. Цей гормон використовували для лікування серцевих хвороб, однак немає доказів фізіологічної ролі глюкагону в регулюванні функцій серця. Глюкагон також стимулює секрецію гормону росту, інсуліну та підшлункового соматостатину.
Метаболізм
У кров’яному руслі глюкагон має період півжиття 5- 10 хв. Його руйнують багато тканин, особливо печінка. Оскільки ж глюкагон секретується в портальну вену і досягає печінки, перш ніж периферійного кровообігу, то його вміст у периферійній крові порівняно низький. Підвищення рівня периферійного глюкагону в крові, спричинене збуджувальними подразниками (див. нижче), є анормально великим у пацієнтів із цирозом, імовірно, внаслідок зменшення печінкової деградації гормону.
Регулювання секреції
Головні чинники, що впливають на секрецію глюкагону, наведені в табл. 19-7. Секреція збільшується в разі гіпоглікемії і зменшується з підвищенням рівня глюкози в плазмі. Зокрема, В-клітини містять ГАМК; є також докази, що одночасно зі збільшенням секреції інсуліну, створеної гіперглікемією, вивільняється ГАМК, діючи на А-клітини через рецептори ГАМКА з пригніченням секреції глюкагону. Рецептори ГАМКА - це канали Сl-, а надходження Сl- гіперполяризує А-клітини.
Таблиця 19-7. Фактори, що впливають на секрецію глюкагону
Стимулятори |
Інгібітори |
Амінокислоти (зокрема, глюкогенні амінокислоти: аланін, серин, гліцин, цистеїн та треонін) ХЦК, гастрин Кортизол Фізичне навантаження Інфекції Інші стреси ß-Адренергічні подразники Теофілін Ацетилхолін |
Теофілін Ацетилхолін Глюкоза Соматостатин ВЖК Кетонові тіла Інсулін Дифенін а-Адренергічні подразники ГАМК |
Секрецію також збільшує подразнення симпатичних нервів підшлункової залози; цей симпатичний ефект зумовлений ß-адренергічними рецепторами і цАМФ. Вірогідно, що А-клітини подібні до В-клітин, оскільки подразнення ß-адренергічних рецепторів збільшує секрецію, а стимулювання a-адренергічних рецепторів її зменшує (див. вище). Проте відповіддю підшлункової залози на симпатичне подразнення, якщо нема блокувальних препаратів, є підсилення секреції глюкагону. Отже, ефект ß-рецепторів переважає в глюкагоносекретувальних клітинах. Спонукальні ефекти різних стресів і, можливо, фізичних навантажень та інфекцій опосередковані, принаймні частково, симпатичною нервовою системою. Подразнення блукаючого нерва також збільшує секрецію глюкагону.
Білкова їжа й уведення різних амінокислот збільшують секрецію глюкагону. Вірогідно, що глюкогенні амінокислоти особливо сильні щодо цього, адже під дією глюкагону вони у печінці перетворюються в глюкозу. Збільшення секреції глюкагону, що відбувається в разі споживання білкової їжі, також є цінним, оскільки амінокислоти стимулюють секрецію інсуліну, а секретований глюкагон запобігає розвиткові гіпоглікемії, тоді як інсулін сприяє запасанню спожитих вуглеводів, жирів та ліпідів. Секреція глюкагону збільшується під час голодування. Вона досягає максимуму на третій день посту під час максимального глюконеогенезу. Після цього, якщо жирні кислоти та кетонові тіла стають головним джерелом енергії, рівень глюкагону в плазмі зменшується.
Під час фізичного навантаження простежується збільшення утилізації глюкози (див. нижче), яке збалансовує збільшене утворення глюкози, зумовлене підвищенням рівня глюкагону в кровообігу.
Глюкагонова відповідь на пероральне введення амінокислот більша, ніж відповідь у разі внутрішньовенного уведення амінокислот. Це наводить на думку, що глюкагоностимулювальний фактор секретований кишковим епітелієм. ХЦК та гастрин збільшують секрецію глюкагону, тоді як секретин її пригнічує. Оскільки секреції і ХЦК, і гастрину збільшуються після білкової їжі, то будь-який з гормонів може бути шлунково-кишковим трансмітером глюкагонової відповіді. Пригнічення внаслідок впливу соматотропіну, розглянуто нижче.
Секрецію глюкагону також знижують ВЖК і кетонові тіла. Проте це зниження може бути знівельоване, оскільки рівні глюкагону в плазмі у разі діабетичного кетоацидозу високі.
Молярні співвідношення інсулін-глюкагон
Як зазначено вище, інсулін виявляє глікогенну, антиглюконеогенну, антиліполітичну та антикетонічну дії. Отже, він сприяє запасанню поглинутих поживних речовин і є гормоном енергетичних запасів. Глюкагон, з іншого боку, є глікогенолітичним, глюконеогенним, ліполітичним та кетогенним гормоном. Він мобілізує запаси енергії і є гормоном вивільнення енергії. З огляду на їхні протилежні ефекти у кожній ситуації треба розглядати рівні обох гормонів у крові. Зручно аналізувати молярні співвідношення цих гормонів. Молярне співвідношення інсулін-глюкагон можна легко визначити для кожного зразка крові на підставі рівнів гормонів у крові, визначених радіоімунологічним аналізом, та їхніх молекулярних мас.
Молярні співвідношення інсулін-глюкагон помітно змінюються, оскільки секреція і глюкагону, і інсуліну залежить від умов, що передують застосуванню будь-якого подразника (табл. 19-8). Наприклад, молярне співвідношення інсулін-глюкагон у разі збалансованого харчування становить близько 2,3. Уведення аргініну збільшує секрецію обох гормонів і підвищує співвідношення до 3,0. Після триденного посту співвідношення знижується до 0,4, а введення аргініну в цьому стані знижує його до 0,3. Навпаки, це значення дорівнює 25 в осіб, яким постійно вводять глюкозу, і підвищується до 170 у разі споживання білкової їжі та введення глюкози. Підвищення відбувається через різке збільшення секреції інсуліну, тоді як звичайна глюкагонова відповідь на білкову їжу нівельована. Отже, якщо під час голодування потрібна енергія, то молярне співвідношення інсулін-глюкагон є низьким, що сприяє розпаду глікогену і глюконеогенезу; і навпаки, якщо потреба в мобілізації енергії низька, то співвідношення високе, що сприяє відкладам глікогену, білка та жиру.