Фізіологія людини - Вільям Ф. Ґанонґ 2002
Ендокринна система, метаболізм і репродуктивна функція
Мозкова речовина і кора надниркових залоз
Кора надниркових залоз - Фармакологічні та патологічні ефекти глюкокортикоїдів
Синдром Кушінґа
Клінічну картину, зумовлену тривалим збільшенням рівня глюкокортикоїдів у плазмі, описав Генрі Кушінґ, її називають синдромом Кушінґа (рис. 20-14). Цей синдром буває АКТГ-незалежний або АКТГ-залежний. Призначення великих доз екзогенних гормонів (наприклад, у разі ревматоїдного артриту), глюкокортикоїдопродукувальні адренокортикальні пухлини та надниркова гіперплазія зумовлюють АКТГ-незалежний синдром Кушінґа. Синдром Кушінґа, спричинений попередніми пухлинами гіпофіза, часто називають хворобою Кушінґа, тому що саме ці пухлини були причиною випадків, описаних Кушінґом. Однак не зовсім правильно вважати хворобу Кушінґа підтипом синдрому Кушінґа, тому що різниця значно більша. Пацієнти з синдромом Кушінґа є протеїновиснажені внаслідок надлишкового білкового катаболізму. Шкіра і підшкірні тканини тонкі, м’язи погано розвинені. Рани загоюються погано. Волосся рідке і тонке. Багато пацієнтів з цією хворобою мають збільшене оволосіння і велику кількість вугрів, однак це зумовлено збільшеною секрецією надниркових андрогенів, що часто супроводжує збільшену глюкокортикоїдну секрецію.
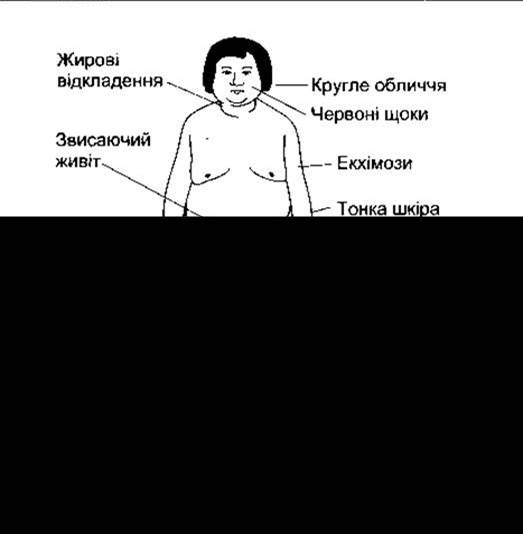
Рис. 20-14. Типові прояви синдрому Кушінґа (відтворено за дозволом з Forsham PH, Di Raimondo VC: Traumatic Medicine and Surgery for the Attorney. Butterworth, 1960).
Жирова тканина перерозподілена так: кінцівки тонкі, а жир збирається у черевній стінці, обличчі та верхній частині спини, утворюючи «горб бізона». Оскільки тонка шкіра черевної порожнини розтягнута зі збільшеними підшкірними жировими відкладеннями, то простежується підшкірне руйнування тканин з утворенням помітних червоно-фіолетових стрічок - стрій. Вони виникають кожного разу, коли відбувається швидке розтягування шкіри (наприклад, навкруги грудей дівчат у статевій зрілості або в черевній стінці під час вагітності), проте у нормі ці смуги звичайно не помітні.
Багато з амінокислот, які вивільняються під час катаболізму білків, перетворюються у глюкозу в печінці, що спричинює гіперглікемію. Зменшення периферійної утилізації глюкози може призвести до інсуліностійкого діабету, особливо у пацієнтів, спадково схильних до цієї хвороби. Внаслідок діабету виникають гіперліпемія і кетонемія, однак ацидоз звичайно помірний.
У разі синдрому Кушінґа глюкокортикоїди наявні у таких великих кількостях, що можуть спричинити потенціювання ефектів мінералокортикоїдів. Секреція дезоксикортикостерону також збільшена внаслідок гіперсекреції АКТГ. Затримка солі й води разом з лицевим ожирінням зумовлюють появу характерного круглого обличчя (місяцеподібного), суттєвою зменшення К+ і слабкості. Приблизно 85% пацієнтів із синдромом Кушінґа є гіпертоніками. Гіпертонія може бути спричинена гіперсекрецією дезоксикортикостерону й ангіотензиногену або прямою дією глюкокортикоїдів на кров’яні судини (див. Розділ 33).
Надлишок глюкокортикоїдів веде до порозності кістки внаслідок зменшення остеогенезу і збільшення кісткового поглинання. Це призводить до остеопорозу, зменшення кісткової маси, а в кінцевому підсумку сприяє руйнуванню хребта й інших наслідків. Механізми, за допомогою яких глюкокортикоїди спричинюють ці кісткові ефекти, описані у Розділі 21.
Глюкокортикоїди у надлишку прискорюють основні енцефалографічні ритми і зумовлюють психічні розлади, а саме: збільшення апетиту, безсоння, ейфорію і психози. Як зазначено вище, недостатність глюкокортикоїдів пов’язана з психічними симптомами, однак симптоми, спричинені надлишком глюкокортикоїдів, ще серйозніші.
Протизапальні й антиалергічні ефекти глюкокортикоїдів
Глюкокортикоїди гальмують запальну відповідь на пошкодження тканини, а також зменшують прояви алергічної хвороби, які з’являються внаслідок виходу гістаміну з тканини. Обидва ці ефекти потребують високих рівнів циркулювальних глюкокортикоїдів і не можуть бути досягнуті призначенням стероїдів, не зумовивши проявів ознак надлишку глюкокортикоїдів. Крім того, великі дози екзогенних глюкокортикоїдів блокують секрецію АКТГ і, по суті, після припинення терапії можливе виникнення небезпечної надниркової недостатності. Однак місцеве застосування глюкокортикоїдів (тобто введення у вогнище запалення або біля подразненого нерва) зумовлює високу місцеву концентрацію стероїду часто без значного його поглинання організмом і серйозних побічних ефектів.
Дія глюкокортикоїдів у хворих з бактеріальними інфекціями яскрава, проте небезпечна, наприклад у разі пневмококової пневмонії або активного туберкульозу лихоманкова реакція, токсикоз легко зникають; однак якщо антибіотики не приймають у той самий час, то інфекція поширюється по цілому тілу. Треба пам’ятати, що симптоми попереджують про наявність хвороби. Коли вони замасковані використанням глюкокортикоїдів, то можуть бути серйозні або навіть фатальні затримки у діагностуванні і початку лікування антимікробними ліками.
Коли деякі типи антитіл зв’язуються з їхніми антигенами, то спричинюють вихід гістаміну з мастоцитів різних тканин, що, відповідно, провокує багато симптомів алергії. Глюкокортикоїди блокують вихід гістаміну і завдяки цьому зменшують симптоми у випадку астми та алергічних реакцій, тому їх можна використати також у разі імуноглобулінозалежних хвороб, наприклад, у випадку серологічної хвороби.
Протизапальні й антиалергічні ефекти глюкокортикоїдів пояснюють також блокуванням виходу цитокінінів унаслідок інгібування руху NF-KB до ядра (див. вище і Розділ 33). Додатковою дією, що протидіє локальному місцевому запаленню, є інгібування фосфоліпази А2. Це зменшує вихід арахідонової кислоти з фосфоліпідів тканини і, відповідно, зменшує утворення лейкотрієнів, тромбоксанів, простагландинів і простацикліну (див. рис. 17-33).
Інші ефекти
Великі дози глюкокортикоїдів сповільнюють ріст, зменшуючи секрецію гормону росту (див. Розділ 22), стимулюють фенілетаноламін-N-метилтрансферазу (PNMT) і зменшують секрецію ТТГ. Упродовж ембріонального періоду глюкокортикоїди прискорюють дозрівання сурфактанту в легенях (див. Розділ 34).