Фізіологія людини - Вільям Ф. Ґанонґ 2002
Фізіологія нервових і м'язових клітин
Збудлива тканина: м'язова
Скелетні м'язи - Морфологія
Структура
Скелетні м’язи складаються з окремих м’язових волокон, що є так званими будівельними елементами м’язової тканини. Більшість скелетних м’язів починається і закінчується сухожилками, м’язові волокна проходять паралельно до закінчень сухожилків. Отже, у разі скорочення м’язів сила скорочень окремих їхніх елементів додається. Кожне м’язове волокно - це окрема багатоядерна довгаста клітина циліндричної форми, оточена клітинною мембраною - сарколемою (рис. 3-1). Між клітинами немає синцитіальних містків. М’язові волокна складаються з міофібрил, а ті, відповідно, - з окремих міофіламентів, утворених скоротливими білками.
Скоротливий механізм м’язової тканини формують білки міозин II (молекулярна маса 43 000), тропоміозин (молекулярна маса 70 000) і тропонін. Тропонін складається з трьох субодиниць - тропоніну І, тропоніну Т та тропоніну С; молекулярна маса кожної з них коливається в межах 18 000-35 000. Інші білки м’язової тканини виконують важливу функцію координації скоротливих білків.
Смугастість
Під час електронної мікроскопії унаслідок відмінності рефрактерних індексів у різних частинах м’язового волокна простежуються характерні поперечні смуги, які чітко видно у скелетних м’язах. На рис. 3-2 окремі частини поперечної смуги позначені латинськими літерами. Світлу I- смугу перетинає темна Z-лінія, а темна A-смуга в центрі містить світлу Н-смугу. Посередині Н-смуги є поперечна М-лінія, яку разом з вузькими світлими проміжками з боків деколи називають псевдо Н-зоною. Ділянку між двома найближчими Z-лініями називають саркомером. Порядок взаємного розташування ниток актину, міозину та інших білків, завдяки якому утворюється описана вище структура, зображений на рис. 3-3. Товсті міофіламенти, діаметр яких майже вдвічі більший, ніж у тонких, складаються з міозину; а тонкі - з актину, тропоміозину та тропоніну. Крім того, товсті міофіламенти утворюють A-смуги (анізотропні диски), тоді як сукупність тонких - менш щільні І-смуги (ізотропні диски). Світлі Н-смуги у центрі А-смуг - це ділянки, де в розслабленому стані м’яза тонкі міофіламенти не накладаються на товсті. Лінії Z перетинають фібрили, з’єднуючись з тонкими міофіламентами. Під час дослідження A-смуги під електронним мікроскопом можна виявити, що кожний товстий міофіламент оточений шістьма тонкими, які утворюють правильний шестикутник.
1 Пейсмейкерна клітина - атипова м’язова малодиференційована клітина
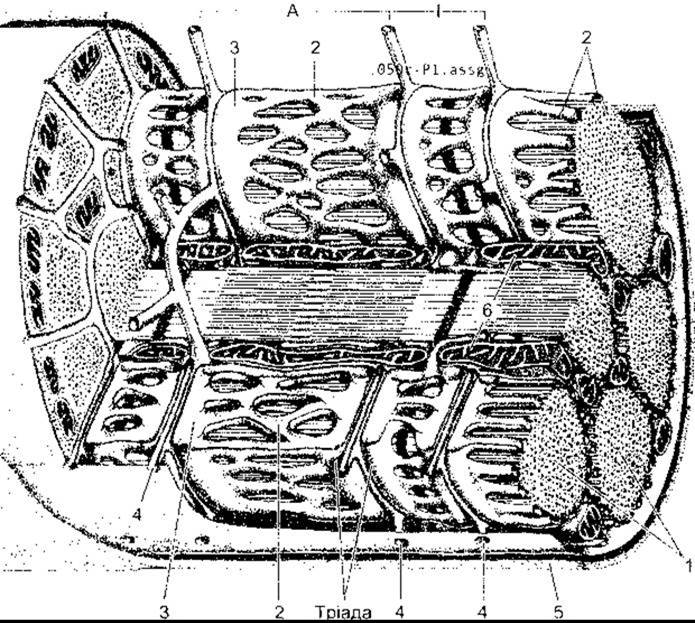
Рис. 3-1. Скелетний м’яз у ссавців М’язове волокно оточене сарколемою; його поперечний переріз відображає окремі міофібрилі (1). На перерізі видно товсті та тонкі філаменти Саркоплазматична сітка (2) з термінальними цистернами (3) оточує кожну міофібрилу. Система Т-трубок (4) (випинання сарколеми) стикається з міофібрилами через А- та І-смуги в кожному саркомері; Т-система і цистерни саркоплазматичної сітки утворюють тріаду. Базальна мембрана (5) оточує сарколему; 6 - мітохондрії (модифіковано і відтворено за дозволом з Krstic RV. Ultrastrusture of the Mammalian Cell, Springer, 1979).
Різновид білка міозину, що міститься в м’язовій тканині, називають міозин II. Він має дві глобулярні головки і довгий хвіст (див. рис. 1-11). Головки і шийки міозинових молекул утворюють поперечні з’єднання з актином. Міозин містить легкі та важкі ланцюги, а його головки складаються з легких ланцюгів та амінових закінчень важких ланцюгів. У головках є актинозв’язувальний сайт, а також каталітичний сайт, у якому відбувається гідроліз АТФ (див. нижче). Молекули міозину розташовані симетрично по обидва боки центру саркомера, і власне завдяки такому розміщенню утворюються світлі ділянки в псевдо Н-зоні. Місцем, де змінюється полярність молекул міозину в кожному товстому міофіламенті, є М-лінія. У світлих ділянках наявні тонкі поперечні з’єднання, які утримують товсті міофіламенти в певному порядку. В кожному товстому сегменті міститься декілька сотень міозинових молекул.
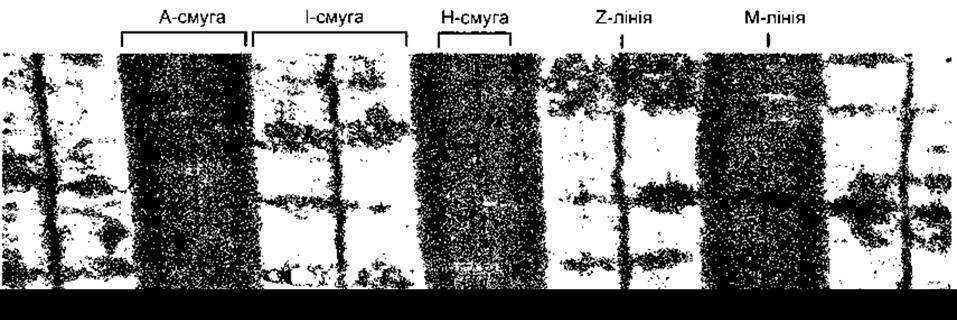
Рис. 3-2. Електронна мікроскопія литкового м’яза людини. Угорі позначено смуги та лінії (збільшено у 13 000 разів) (за SM Walker та GR Schrodt)
Молекулярні основи м’язового скорочення
Укорочення скоротливих елементів м’яза відбувається внаслідок ковзання тонких міофіламентів по товстих. Ширина A-смуг є сталою, тоді як Z-лінії в разі скорочення м’яза зближуються, а під час розтягнення - віддаляються (див. рис. 3-3).
Ковзання у випадку скорочення м’яза виникає, коли головки міозину міцно зв’язуються з актином, шийка міозинової молекули згинається, втягуючи актинове волокно в міозинову вилку, а потім відділяється. Інтенсивність ковзання залежить від паралельного гідролізу АТФ. Детально цей процес ще не з’ясовано; він може складатися з декількох кроків, проте загалом цикл є таким, як зображено на рис. 3-6. Велика кількість головок приєднується одночасно, що приводить до максимального скорочення м’яза. Кожен цикл ковзання скорочує саркомер на 10 нм. Тонка нитка контактує з близько 500 міозиновими голівками, кожна з яких у випадку швидкого скорочення м’яза виконує за 1 с близько п’яти повних циклів приєднання-від’єднання від молекули актину.
Процес, унаслідок якого деполяризація м’язового волокна приводить до його скорочення, називають збудливо-скоротливою координацією. Потенціал дії надходить до всіх фібрил у волокні через Т-систему (табл. 3-2). Він спричинює вивільнення Са2+ з термінальних цистерн (мішкоподібних розширень саркоплазматичної сітки, розміщених з боків від Т-системи), а це сприяє скороченню м’яза. Йони Са2+ ініціюють скорочення, зв’язуючись з тропоніном С. Коли м’яз перебуває в стані спокою, тропонін І щільно зв’язаний з актином, а тропоміозин покриває ті сайти, де головки міозину з’єднані з актином. Отже, тропонін-тропоміозиновий комплекс є розслаблювальним білком, який інгібує взаємодію між актином та міозином. Коли йони Са2+, що вивільнились унаслідок поширення потенціалу дії, з’єднуються з тропоніном С, то зв’язок тропоніну І з актином значно послаблюється, і внаслідок цього молекули тропоміозину зміщуються вбік (рис. 3-7). Після такого руху оголюються сайти зв’язування з головками міозину. Відбувається розщеплення АТФ і скорочення волокон. Зв’язування однієї молекули тропоніну з йоном Са2+ приводить до оголення семи сайтів зв’язування міозину.
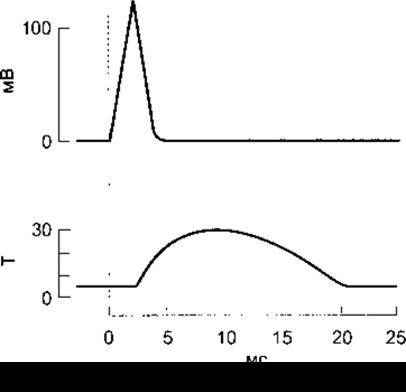
Рис. 3-5. Електричні та механічні відповіді волокон скелетного м’яза ссавців на поодинокі подразнення максимальної сили Електрична (зміна різниці потенціалів, мВ) і механічна (Т, у довільних одиницях) відповідь показані на графіку зі спільною віссю абсцис (час, мс)
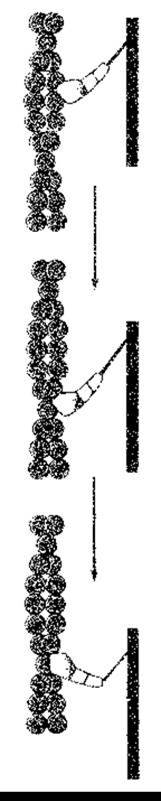
Рис. 3-6. Механізм дії міозину у скелетних м’язах. Головка міозину відділяється від актину (угорі), просувається на декілька нм паралельно до актинового ланцюга і знову приєднується (посередині). Після цього головка молекули міозину згинається на шийці і ковзає вздовж актинового ланцюга, тягнучи за собою всю молекулу. На відстані 3,5 нм від сайта зв’язування з актином є сайт зв’язування АТФ. Гідроліз АТФ відбувається під час ковзання, хоча детальний зв’язок цього процесу з рухом молекул актину та міозину одна щодо іншої ще не з’ясовано (модифіковано з Irving М, Gordman YE; Another step ahead for myosin. Nature 1999;398:463).
Відразу ж після вивільнення Са2+ саркоплазматична сітка починає відновлювати його запас шляхом активного транспортування в довгасту частину сітки. Цей процес виконує помпа Са2+-Na2+-АТФ-аза. У подальшому Са2+ шляхом дифузії переходить у термінальні цистерни, де й зберігається до наступного потенціалу дії. Якщо концентрація Са2+ за межами сітки значно зменшується, то хімічна взаємодія між міозином та актином припиняється, і м’яз розслаблюється. Зазначимо, що АТФ забезпечує енергією процеси як скорочення, так і розслаблення. Якщо транспортування Са2+ у саркоплазматичній сітці пригнічене, то розслаблення не відбувається навіть у разі, коли нема потенціалів дії. Постійне тривале скорочення м’яза, що виникає внаслідок цього, називають контрактурою.
Таблиця 3-2. Послідовність явищ у разі скорочення і розслаблення скелетних м’язів

1 Явища 1-4 описані в Розділі 4.
Саркоплазматична сітка унаслідок деполяризації мембрани Т-трубочок активується завдяки дигідропіридиновим рецепторам, які є потенціалозалежними Са2+-каналами в мембрані Т-трубок. У міокарді надходження Са2+ через ці канали приводить до вивільнення Са2+, що міститься в саркоплазматичній сітці, проте в скелетних м’язах надходження Са2+ з ПКР не обов’язкове для такого вивільнення. Замість цього дигідропіридинові рецептори відіграють роль електричного реле, яке регулює надходження Са2+ з розташованої поряд саркоплазматичної сітки. Дигідропіридинові рецептори одержали назву від медикаментозного препарата-дигідропіридину, який, власне, блокує їх. Такий рецептор має чотири гомологічні ділянки, кожна з яких перетинає Т-трубку шість разів. Канал Са2+ саркоплазматичної сітки, відкриття якого забезпечує викидання йонів Са2+, не є потенціалозалежним; його названо ріанодиновим рецептором, тому що його блокує рослинний алкалоїд ріанодин. Він тісно пов’язаний з ІФ3-рецептором - ліґандним Са2+-каналом, який, зв’язуючись з ІФ3, забезпечує надходження Са2+ в цитоплазму з ендоплазматичної сітки (див. Розділ 1).
Процеси, що забезпечують скорочення та розслаблення м’яза, наведені в табл. 3-2.
Типи скорочень
Під час скорочення м’язів зменшується довжина скоротливих елементів, та оскільки м’язи містять як еластичні, так і в’язкі елементи, то скорочення може відбуватись без значного зменшення загальної довжини м’яза (рис. 3-8А). Таке скорочення називають ізометричним (від гр. isos - сталий, metros - довжина). Скорочення м’яза у разі сталого навантаження із наближенням його кінців називають ізотонічним (від гр. isos - сталий, tonus - напруження). Оскільки робота є добутком сили на відстань, то у випадку ізотонічного скорочення виконується робота, тоді як у разі ізометричного - ні. В інших випадках м’язи під час скорочення можуть виконувати негативну роботу. Це відбувається, наприклад, унаслідок опускання важких предметів. У цьому разі м’язи активно опираються опусканню предмета, проте в кінцевому підсумку видовжуються, незважаючи на їхнє скорочення.
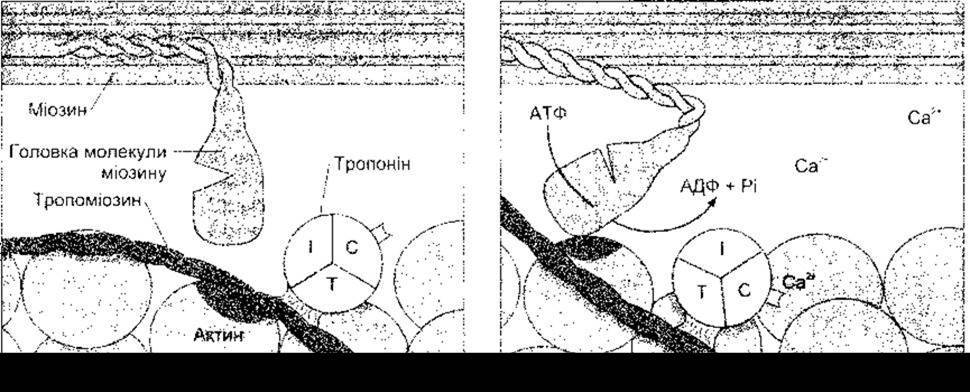
Рис. 3-7. Ініціація м’язового скорочення за допомогою Са2+. Коли Са2+ зв’язується з тропоніном С, тропоміозин зміщується латерально, оголюючи сайт зв’язування міозину з актином (темна ділянка). Згодом відбувається зв’язування головки міозину, гідроліз АТФ та зміна конфігурації головки і шийки молекули міозину. Для зручності показано лише одну з двох головок молекули міозину-ІІ.
Сумація скорочень
Електрична відповідь м’язового волокна на повторне подразнення подібна до тої, що виникає у нервах. Волокно є електрично рефрактерним лише під час фази підвищення і частково під час фази спадання потенціалу дії. У цей момент скорочення, що його ініціює перший подразник, лише починається. Оскільки ж для скоротливого механізму не характерний рефрактерний період, то повторне стимулювання м’язових волокон перед їхнім розслабленням приводить до додаткового активування скоротливих елементів, і в цьому разі додаткова скоротлива відповідь накладається на вже наявне скорочення. Це явище назвали сумац'я скорочень: тонус м’яза, що розвивається під час сумації, значно більший, ніж під час поодинокого скорочення м’яза. У разі швидкого повторення подразників активування скоротливого механізму багаторазово повторюється, перш ніж м’яз встигає розслабитись, унаслідок чого окремі відповіді зливаються в одне тривале скорочення. Такий процес називають тетанусом (тетанічне скорочення). У випадку повного (суцільного) тетанусу в інтервалах між подразниками не відбувається жодного розслаблення м’яза, тоді як у разі неповного (зубчатого) тетанусу скорочення під дією сумованих подразників чергується з періодами часткового розслаблення. Під час повного тетанусу тонус м’яза майже в чотири рази перевищує тонус у разі його поодиноких скорочень. Процес розвитку неповного, а згодом - повного тетанусу під впливом подразників частоти, що зростає, показаний на рис. 3-9.
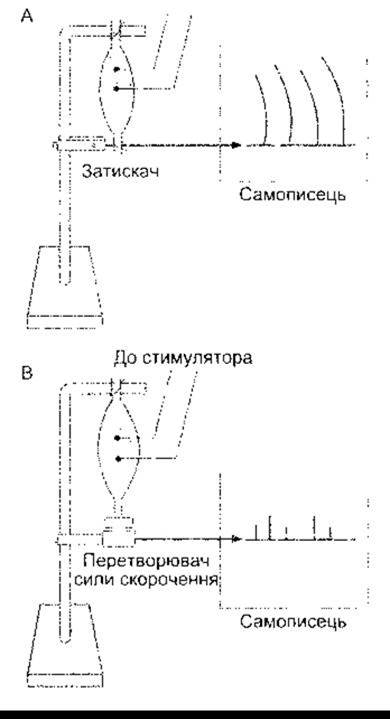
Рис. 3-8. А: препарат м’яза, приготований для запису ізотонічних скорочень. В: препарат м’яза, приготований для запису ізометричних скорочень. А - м’яз з’єднаний із записувальним важелем, фіксованим до затискача. В - м’яз з’єднаний з електронним пристроєм, який вимірює силу скорочення, якщо довжина м’яза стала.
Частота подразників, за якої відбувається сумація скорочень, визначена тривалістю скорочення конкретного м’яза. Наприклад, якщо тривалість посмикування становить 10 мс, то за частоти подразнення до 1/10 мс (100/с) простежуються поодинокі скоротливі відповіді, що чергуються з періодами повного розслаблення, а за частоти понад 100/с виникає їхня сумація.
«Феномен сходів»
Якщо м’яз піддається дії подразників максимальної сили, то за частоти, що наближена до тої, за якої виникає тетанус, м’язовий тонус із кожним скороченням поступово посилюється доти, доки після декількох скорочень не буде сталим. Це явище відоме як феномен сходів або треп (англ. treppe, від гр. trepp - сходи, драбина). Воно, зокрема, трапляється в міокарді. Вважають, що цей феномен спричинений надходженням додаткової кількості Са2+, які зв’язуються з тропоніном С. Важливо не плутати феномен сходів із сумацією скорочень і тетанусом.
Співвідношення між довжиною м’яза, м’язовим тонусом та швидкістю скорочення
Тонус, що розвивається в м’язі під час ізометричного скорочення (повний тонус), і пасивний тонус, притаманний м’язові у стані спокою, залежать від довжини м’язового волокна. Цей зв’язок можна досліджувати на суцільному препараті скелетного м’яза, як це схематично зображено на рис. 3-8В. Довжина м’яза змінюється внаслідок збільшення чи зменшення відстані між його кінцями. Пасивний тонус вимірюють для кожного послідовного значення довжини м’яза, потім м’яз піддають електричному стимулюванню і визначають повний його тонус. Різницю між цими двома показниками для будь-якої довжини м’яза, спричинену процесом скорочення, називають активним тонусом. Графіки залежності пасивного та повного тонусу від довжини м’яза показані на рис. 3-10. Подібні криві одержують у разі дослідження окремих м’язових волокон. Довжину м’яза, за якої активний тонус максимальний, називають довжиною спокою. Назва походить від експериментів, під час яких доведено, що в більшості м’язів максимальний тонус виникає при тій довжині, яка характерна для стану спокою. Співвідношення між довжиною і тонусом скелетних м’язів пояснюють механізмом ковзання волокон, що відбувається під час скорочення м’язів. У разі ізометричного скорочення м’язових волокон тонус прямо пропорційний до кількості перехресних з’єднань між молекулами актину та міозину. Внаслідок розтягу м’язів взаємодія між актином та міозином послаблюється і кількість перехресних з’єднань зменшується. Відповідно, коли довжина м’яза значно менша, ніж довжина в стані спокою, то відстань, на яку можуть зміщуватись тонкі м’язові волокна, значно зменшується.

Рис. 3-9. Тетанус. Ізометричне скорочення поодинокого м’язового волокна під час зростання або зменшення частоти подразника. Відстань між двома крапками відповідає проміжку часу 0,2 с (відтворено за дозволом з Buchthal F: Dan Biol. Med 1942; 17;1).
Швидкість скорочення м’язів обернено пропорційна до навантаження, що припадає на них. Для кожного заданого значення навантажень швидкість скорочення максимальна за довжини спокою і сповільнюється, якщо довжина м’яза збільшується або зменшується.
Типи м’язових волокон
Волокна скелетних м’язів у загальних рисах подібні, однак скелетні м’язи - це різнорідна тканина, що складається з волокон, які відрізняються за активністю міозинової АТФ-ази, швидкістю скорочення та іншими характеристиками. Загалом волокна поділяють на два типи (тип І і тип II), хоча обидва ці типи є насправді спектром різноманітних волокон. Головні властивості волокон типів І та II наведені в табл. 3-3.
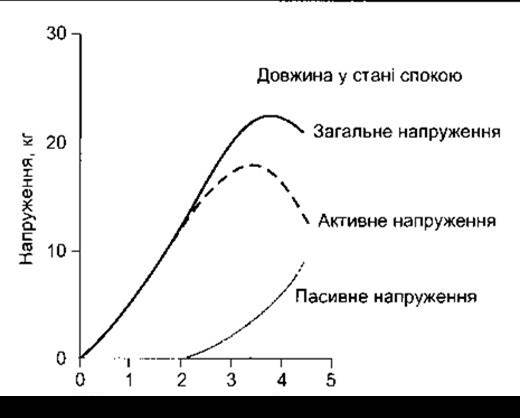
Рис. 3-10. Співвідношення між довжиною та напруженням для трицепсу людини. Крива пасивного напруження відповідає силі, яку розвиває цей скелетний м’яз за певної довжини без стимулювання. Крива загального напруження відображає силу, що виникає у випадку ізометричного скорочення м’яза у відповідь на подразник максимальної сили. Активне напруження - це різниця між цими двома показниками.
М’язи, що містять багато волокон типу І, називають червоними м’язами, оскільки вони виглядають темнішими від інших. Червоні м’язи, які повільно реагують і мають триваліший латентний період, призначені для тривалих повільних скорочень, головна функція яких - підтримання сталого положення тіла. Білі м’язи, які складаються переважно з волокон типу II, мають коротку тривалість скорочення і призначені для точних координованих рухів. М’язи очного яблука і деякі з м’язів кисті містять багато волокон типу II, отже, їх класифікують як білі.
Ізоформи м’язових білків та їхнє генетичне регулювання
В основі відмінностей між м’язовими волокнами є різниця між білками, з яких вони складаються. Більшість білків кодовані так званими мультигенами.
Виділяють десять різних ізоформ важких ланцюгів міозину (ВЛМ). Ці ізоформи подібні за біологічною активністю, однак мають різний амінокислотний склад. У кожному з двох типів легких ланцюгів також розрізняють повільні та швидкі ізоформи. Вважають, що є лише одна форма актину, три - тропоніну, і велика кількість ізоформ тропоміозину. Загальний склад повільних та швидких волокон наведений у табл. 3-4. Для волокон міокарда також характерно багато ізоформ.
Таблиця 3-3. Класифікація типів м’язових волокон1
Тип І |
Тип II |
|
Інші назви |
Повільні, окисні, червоні |
Швидкі, гліколітичні, білі |
Активність міозинової АТФ-ази |
Низька |
Висока |
Здатність саркоплазматичної сітки транспортувати Са2+ |
Помірна |
Висока |
Діаметр |
Помірний |
Великий |
Резерви системи гліколізу |
Помірні |
Високі |
Окиснювальна здатність (залежить від вмісту мітохондрій, щільності капілярів та концентрації міоглобіну) |
Висока |
Низька |
1 Модифіковано з Murphy RA: Muscle. In: Physiology, 2nd ed. Berne RM, Levy MN [editord]. Mosby, 1988.
Експресія ВЛМ чітко регульована в процесі розвитку організму і відмінності в експресії ВЛМ відіграють визначну роль у формуванні м’язової конституції людини. У дорослих осіб на функцію м’язів можуть впливати зміни фізичної активності, іннервації та гормонального фону; ці зміни, як звичайно, спричинені порушенням транскрипції генів ВЛМ. Прикладом цього є перетворення швидких скелетних м’язів на повільні в разі розладів іннервації (див. нижче) та значні зміни ізоформ білків скелетних м’язів і міокарда у випадку гіпотиреоїдизму.