Фізіологія людини - Вільям Ф. Ґанонґ 2002
Кровообіг
Рідини, що циркулюють в організмі
Кров - Гемостаз
Гемостаз - це процес утворення згустків в ушкоджених судинах, спрямований на запобігання крововтраті і забезпечення рідкого стану крові в просвіті кровоносних судин. Баланс між коагуляцією та антикоагуляцією відновлюється за допомогою складних взаємопов’язаних системних механізмів. Крім того, на цей баланс впливають локальні фактори у різноманітних органах.
Відповідь на ушкодження
Ушкодження невеликих кровоносних судин спричинює серію подій (рис. 27-24), які призводять до утворення згустку (гемостаз). Унаслідок цього ушкоджена судина закупорюється, що дає змогу запобігти подальшій крововтраті. Початковою подією є звуження судини й утворення тимчасового гемостатичного тромбу з тромбоцитів (тромбоцитарного тромбу) внаслідок зв’язування тромбоцитів з колагеном і їхньої агрегації. Далі відбувається перетворення тромбоцитарного тромбу на справжній тромб.
Звуження ушкоджених артеріол або малих артерій може бути настільки вираженим, що призводить до їхньої облітерації. Звуження судин відбувається внаслідок виділення серотоніну й інших вазоконстрикторних речовин з тромбоцитів, які прилипають до стінки ушкоджених судин. Стверджують, що в разі поперечного перерізання артерій навіть такого калібру, як променеві, відбувається звуження, що може припинити кровотечу. Однак це не означає, що можна не поспішати з накладанням лігатури на ушкоджену судину. Крім того, у випадку поздовжнього або безладного ушкодження артерій вазоконстрикція не забезпечує їхньої оклюзії, і кровотеча триває.
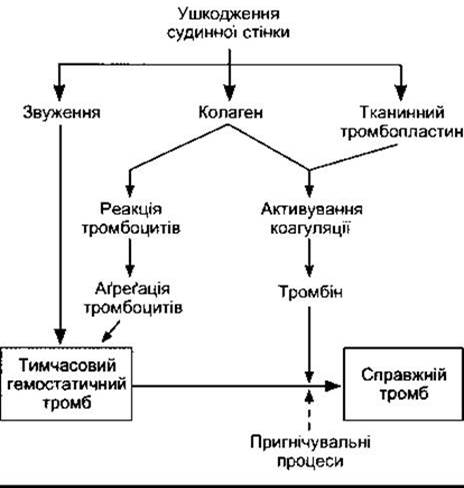
Рис. 27-24. Реакції, які беруть участь у гемостазі. Штрихова стрілка означає пригнічення (модифіковано та відтворено за дозволом з Deykin D: Thrombogenesis, N Engl J Med 1967;267 622).
Таблиця 27-10. Деякі білки, що їх синтезує печінка: фізіологічні функції та властивості1
Назва |
Головна функція |
Особливості зв’язування |
Концентрація у сироватці або плазмі |
Альбумін |
Зв’язування і транспортування речовин; осмотичне регулювання |
Гормони, амінокислоти, стероїди, вітаміни, жирні кислоти |
4500-5000 мг/дл |
Орозомукоїд |
Не вивчена; можливо, бере участь у запаленні |
Сліди; підвищується в разі запалення |
|
а1-Антипротеаза |
Інгібітор трипсину та інших протеаз |
Протеази сироватки і тканинних секретів |
1,3-1,4 мг/дл |
а-Фетопротеїн |
Осмотичне регулювання; зв’язувальний та транспортувальний білок2 |
Гормони, амінокислоти |
У нормі міститься у крові плоду |
а2-Макроглобулін |
Інгібітор ендопротеаз сироватки |
Протеази |
150—420 мг/дл |
Антитромбін III |
Інгібітор протеаз внутрішньої системи гемокоагуляції |
1:1 зв’язування протеаз |
17-30 мг/дл |
Церулоплазмін |
Транспортування міді |
Шість атомів міді/моль |
15-60 мг/дл |
С-реактивний білок |
Не вивчена; бере участь у запаленні |
Комплемент C1q |
<1 мг/дл; підвищується в разі запалення |
Фібриноген |
Попередник фібрину у гемостазі |
200-450 мг/дл |
|
Гаптоглобін |
Зв’язування, транспортування вільного гемоглобіну |
1:1 зв’язування гемоглобіну |
40-180 мг/дл |
Гемопексин |
Зв’язує порфірини, зокрема гем, для його повторного використання |
1:1 з гемом |
50-100 мг/дл |
Трансферин |
Транспортування заліза |
Два атоми заліза/моль |
3,0-6,5 мг/дл |
Аполіпопротеїн В |
Складання частинок ліпопротеїнів |
Транспортер ліпідів |
|
Ангіотензиноген |
Попередник пресорного пептиду ангіотензину II |
||
Білки, фактори зсідання II, VII, IX, X |
Зсідання крові |
20 мг/дл |
|
Антитромбін С, білок С |
Пригнічення зсідання крові |
||
Інсуліноподібний фактор росту І |
Трансмітер анаболічних ефектів гормону росту |
ІФР-І рецептор |
|
Глобулін, що зв’язує стероїдні гормони |
Білок, що переносить стероїди у крові |
Стероїдні гормони |
3,3 мг/дл |
Тироксинозв’язувальний глобулін |
Білок, що переносить тиреоїдний гормон у крові |
Тиреоїдні гормони |
1,5 мг/дл |
Транстиретин (тиреоїдозв’язувальний преальбумін) |
Білок, що преносить тиреоїдний гормон у крові |
Тиреоїдні гормони |
25 мг/дл |
1 Відтворено за дозволом з McPhee SJ et al: Pathophysiology of Disease, 3rd ed. McGraw-Hill, 2000.
2 Функція а-фетопротеїну остаточно не вивчена, однак завдяки структурній подібності до альбуміну йому приписують ці функції.
Коагуляційний механізм
Тимчасова гемостатична пробка за допомогою фібрину перетворюється на справжній тромб. Коагуляційний механізм, який забезпечує утворення фібрину, передбачає каскад реакцій, у процесі яких відбувається активування ензимів, що, відповідно, активують інші ензими. В минулому систему ускладнювала розбіжність у номенклатурі, однак прийняття номенклатури з нумерацією більшості факторів зсідання крові (див. табл. 27-9) дало змогу цього уникнути.
Фундаментальною реакцією в процесі зсідання крові є перетворення розчинного білка плазми крові фібриногену в нерозчинний фібрин (рис. 27-25). Реакція полягає у відщепленні двох пар поліпептидів від кожної молекули фібриногену. Унаслідок цього залишається частина - фібрин-мономер - яка потім полімеризується з іншими молекулами-мономерами з утворенням фібрину. Спочатку фібрин є сіткою переплетених ниток. Далі з утворенням ковалентних поперечних зв’язків він перетворюється на щільний агрегат (стабілізація). Цю реакцію каталізує активований фактор XIII, і вона потребує наявності Са2+. Перетворення фібриногену на фібрин каталізоване тромбіном. Тромбін належить до серинових протеаз і утворюється із попередника, що циркулює в крові, - протромбіну - під дією активованого фактора X. Він спричинює й інші ефекти, зокрема активування тромбоцитів, ендотеліальних клітин і лейкоцитів, діючи принаймні на один рецептор, зв’язаний з G-білком.
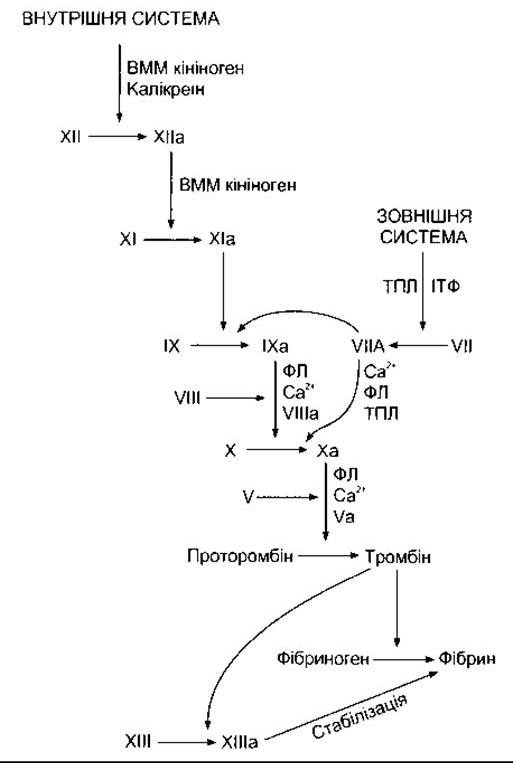
Рис. 27-25. Механізм зсідання крові; а - активна форма фактора зсідання; ВММ - висока молекулярна маса; ФЛ - фосфоліпід тромбоцитів; ТПЛ - тканинний тромбопластин; ІТФ - інгібітор фактора тканинного шляху.
Активування фактора X може відбуватися внаслідок реакцій двох систем - внутрішньої і зовнішньої (див. рис. 27-25). Початкова реакція внутрішньої (кров’яної) системи полягає у перетворенні неактивного фактора XII на активний фактор XII (ХІІа). Це активування каталізоване високомолекулярним кініногеном і калікреїном (див. Розділ 31), в умовах in vitro ініціюється внаслідок контакту крові з електронегативно зарядженими поверхнями, такими як скло та колагенові волокна. Активування за умов in vivo простежується завдяки контакту крові з колагеновими волокнами, що лежать під ендотелієм кровоносних судин. Далі активний фактор XII спричинює активування фактора XI, активний фактор XI - фактора IX. Активний фактор IX утворює комплекс з активним фактором VIII, активований у разі відокремлення від фактора Віллебранда. Комплекс факторів ІХа і Villa активує фактор X. Для повного активування фактора X необхідні фосфоліпіди аґрегованих тромбоцитів (ТР) та Са2+. Зовнішня (тканинна) система починає працювати у випадку виділення тканинного тромбопластину, суміші білка і фосфоліпіду, яка активує фактор VII. Тканинний тромбопластин і фактор VII спричинюють активування факторів IX і X. За наявності ТР, Са2+ та фактора V активний фактор X каталізує перетворення протромбіну в тромбін. Зовнішній шлях пригнічує інгібітор шляху тканинного фактора, який утворює четвертинну структуру з ТПЛ, фактором Vila і фактором Ха.
Антикоагуляційні механізми
Здатності крові до тромбоутворення протидіють in vivo реакції, спрямовані на запобігання утворенню тромбів у просвіті судин і розпад утворених тромбів. Ці реакції передбачають взаємодію між тромбоксаном А2, який посилює агрегацію тромбоцитів, і простацикліном, який пригнічує агрегацію. Така взаємодія сприяє утворенню тромбів у разі ушкодження кровоносної судини, однак забезпечує збереження цілісності ендотеліального шару (див. Розділ 31).
Антитромбін III - це інгібітор протеаз, що циркулює в крові, який зв’язується із сериновими протеазами системи коагуляції і блокує їхню активність як факторів зсідання. Зв’язування полегшене за наявності гепарину, природного антикоагулянта, який є сумішшю сульфатованих полісахаридів із молекулярною масою 15 000-18 000. До факторів зсідання, активність яких послаблюється, належать активні форми факторів IX, X, XI та XII. Важливу роль у попередженні поширення тромбів у кровоносних судинах відіграє також ендотелій. Усі ендотеліальні клітини, за винятком судин мікроциркуляторного русла головного мозку, виробляють тромбомодулін - тромбінозв’язувальний білок - і експресують його на своїй поверхні. У крові, що циркулює, тромбін відіграє роль прокоагулянта, який активує фактори V і VIII. Однак у разі зв’язування з тромбомодуліном він стає антикоагулянтом, оскільки комплекс тромбомодулін-тромбін активує білок С (рис. 27-26). Активований білок С (АБС) разом із кофактором білком S інактивує фактори V і VIII, а також пригнічує активність інгібітора активатора тканинного плазміногена, посилюючи утворення плазміну.
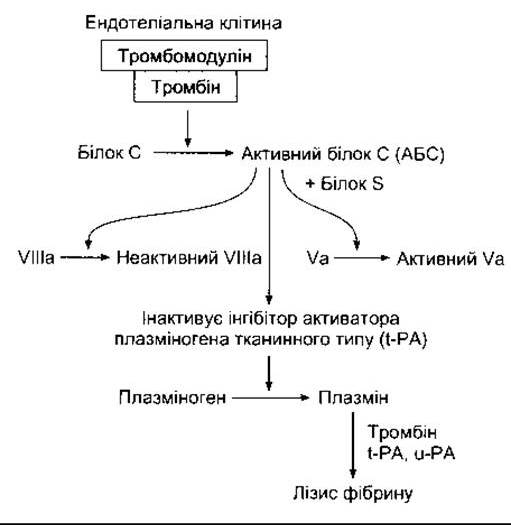
Рис. 27-26. Фібринолітична система та її регулювання за допомогою білка С.
Плазмін (фібринолізин) - це активний компонент системи плазміногену (фібринолітичної) (див. рис. 27- 26). Цей ензим спричинює лізис фібрину і фібриногену з утворенням продуктів розпаду фібриногену (ПРФ), які пригнічують тромбін. Плазмін формується з неактивного попередника (плазміногену) під дією тромбіну і активатора плазміногену тканинного типу (t-PA - від англ. tissue-type plasminogen activator). Його активує також активатор плазміногену урокіназного типу (u-РА - від англ. urokinase-type plasminogen activator). У випадку нокауту гена t-PA або гена u-РА у мишей відкладається невелика кількість фібрину і сповільнюється лізис згустку. У разі нокауту обох генів простежується масивне відкладання фібрину. Сповільнюється загоєння ран (див. Розділ 33). Характерні також порушення росту та фертильності, оскільки система плазміногену не тільки розщеплює згусток крові, а також впливає на рух клітин і овуляцію.
Людський плазміноген складається з 560-амінокислотного важкого ланцюга і 241-амінокислотного легкого ланцюга. Важкий ланцюг з глутаматом на амінозакінченні формує п’ять петель, кожну з яких утримують три дисульфідні зв’язки (рис. 27-27). Ці петлі називають крінглі, тому що вони нагадують данське печиво з відповідною назвою. Крінглі - це місця зв’язування лізину, за допомогою яких молекула прикріплена до фібрину та інших факторів зсідання, вони характерні також для протромбіну. Процес перетворення плазміногену на плазмін полягає у тому, що t-PA гідролізує зв’язок між Arg 560 та Val 561.
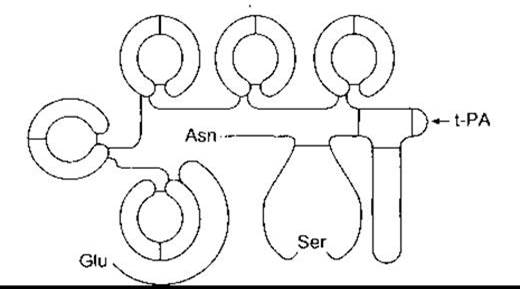
Рис. 27-27. Будова плазміногену людини. Зверніть увагу на Glu на амінозакінченні та Asn на карбоксильному закінченні, а також на п’ять петлевих структур (крінглі). Під впливом t- РА відбувається гідроліз у місці, позначеному стрілкою. В результаті легкий ланцюг із карбоксилзакінченням відокремлюється від важкого ланцюга з амінозакінченням, дисульфідні зв’язки в цьому разі є інтактними. Все це призводить до активування молекули (модифіковано та відтворено за дозволом з Bachman F, in: Thrombosis and Hemostasis. Verstraete M et al [editors]. Leuven University Press, 1987).
Рецептори плазміногену локалізовані на поверхні різноманітних клітин і особливо численні на ендотеліальних клітинах. У разі зв’язування плазміногену зі специфічними рецепторами відбувається його активування. Отже, для інтактної стінки кровоносних судин характерний механізм, який протидіє тромбоутворенню.
Сьогодні людський t-PA отримують за допомогою технології рекомбінантних ДНК і використовують у клінічній практиці (як лікарський засіб альтеплазу). У випадку застосування в перші години у хворих з інфарктом міокарда препарат спричинює лізис тромбу в коронарних артеріях. До фібринолітичних засобів, які використовують на ранніх етапах лікування інфаркту міокарда, належать також бактеріальний ензим стрептокіназа (див. Розділ 32).
Є група гомологічних білків - анексинів, - які впливають на процеси коагуляції та фібринолізу. Описано гіонад 20 анексинів, зокрема 10 із них - у ссавців. Один із них, анексин II, утворює на ендотеліальних клітинах «платформу», на якій відбувається взаємодія компонентів фібринолітичної системи і фібриноліз. Анексин V утворює оболонку навколо фосфоліпідів, що беруть участь у коагуляції, спричинюючи антитромботичний ефект. Однак детально фізіологічна роль різноманітних анексинів не вивчена.
Антикоагулянти
Як зазначено вище, гепарин - це природний антикоагулянт, який посилює ефекти антитромбіну III. Він відіграє також роль кофактора ліпопротеїнліпази (див. Розділ 17). Білок протамін, який має виражені основні властивості, незворотно зв’язується з гепарином, його використовують у клініці для нейтралізації гепарину. Шляхом деполімеризації нефракціонованого гепарину отримують фрагменти гепарину з низькою молекулярною масою (в середньому 5000). Сьогодні гепарини низької молекулярної маси щораз ширше застосовують у клінічній практиці, оскільки вони мають довший період півжиття і більшу передбачуваність ефектів.
За умов in vivo концентрація Са2+ низька настільки, щоб це відобразилось на процесі гемокоагуляції, є смертельною. Однак в умовах in vitro запобігти зсіданню крові можна, додавши оксалати, які утворюють з Са2+ нерозчинні солі, або хелатоутворювальні сполуки, які зв’язують Са2+. До ефективних антикоагулянтів належать також похідні кумарину, такі як дикумарол та варфарин. Вони блокують ефекти вітаміну К. Вітамін К відіграє роль кофактора для ензиму, що каталізує перетворення залишків глутамінової кислоти на залишки у-карбоксиглутамінової кислоти. Шість білків з тих, що беруть участь у гемокоагуляції, перед надходженням у кровообіг підлягають реакції перетворення залишків глутамінової кислоти на залишки у-карбоксиглутамінової кислоти, отже, шість білків є вітамін-К-залежними. До них належать фактори II (протромбін), VII, IX і X, білки С та S (див. вище).
Порушення гемостазу
Порушення тромбоутворення можуть бути спричинені змінами тромбоцитів (див. вище), однак геморагічні розлади виникають унаслідок селективного дефіциту більшості факторів зсідання (табл. 27-11). Досить поширеною є гемофілія А, зумовлена дефіцитом фактора VIII. За цього захворювання позитивний результат дає застосування препаратів фактора VIII, які виготовляють з плазми. Однак у багатьох випадках уведення таких препаратів призвело до інфікування хворих ВІЛ. Сьогодні є високоочищені препарати, зокрема фактор VIII, отриманий за допомогою технології рекомбінантних ДНК. Крім того, що фактор Віллебранда сприяє прилипанню тромбоцитів (див. вище), він ще утворює комплекс з фактором VIII і регулює його рівень у плазмі. Вроджений дефіцит фактора Віллебранда призводить до розвитку кровотеч (хвороба Віллебранда).
Таблиця 27-11. Приклади захворювань, зумовлених дефіцитом факторів зсідання крові
Дефіцит фактора |
Клінічний синдром |
Причина |
I |
Афібриногенемія |
Під час вагітності з передчасним відшаруванням плаценти; також вроджена (зрідка) |
II |
Гіпопротромбінемія (схильність до геморагій у разі захворювань печінки) |
Пригнічення синтезу в печінці, здебільшого внаслідок дефіциту вітаміну К |
V |
Парагемофілія |
Вроджена |
VII |
Гіпоконвертинемія |
Вроджена |
VIII |
Гемофілія А (класична гемофілія) |
Вроджений дефект, зумовлений різноманітними змінами гена на хромосомі X, що кодує фактор VIII; спадкова хвороба, пов’язана зі статтю |
IX |
Гемофілія В (хвороба Крістмаса) |
Вроджена |
X |
Дефіцит фактора Стюарта-Прауера |
Вроджений |
XI |
Дефіцит РТА |
Вроджений |
XII |
Дефект Хагемана |
Вроджений |
Всмоктування вітаміну К, так само як і інших жиророзчинних вітамінів, пригнічене в разі механічної жовтяниці внаслідок відсутності жовчі у кишці і подальшого порушення всмоктування жирів (див. Розділ 26). У результаті виникає дефіцит факторів зсідання, який може призводити до кровотеч. Утворення тромбів у просвіті кровоносних судин називають тромбозом (на відміну від екстраваскулярного тромбоутворення, яке відбувається в нормі). Тромбози - це серйозна медична проблема. Особливо часто тромбози виникають у разі сповільнення плину крові, наприклад, у венах нижніх кінцівок після операцій або пологів. Це пояснюють тим, що внаслідок сповільнення плину крові активовані фактори зсідання не вимиваються, а нагромаджуються. Тромбоз виникає також у вінцевих і мозкових артеріях у ділянках атеросклеротичних бляшок в інтимі і місцях ураження ендокарда. Тромби часто спричиняють порушення надходження артеріальної крові до органів, у яких вони утворилися. Частинки тромбів (емболи) можуть відриватися від місць утворення, надходити з плином крові у віддалені ділянки і спричиняти ураження органів. Наприклад, тромби з вен нижніх кінцівок можуть закупорювати легеневу артерію або її гілки (емболія легеневої артерії), частинки тромбів з лівого шлуночка в разі інфаркту міокарда (пристінковий тромбоз) можуть зумовити емболію судин мозку або нижніх кінцівок.
Таблиця 27-12. Приблизний вміст білків у лімфі людини1
Джерело лімфи |
Вміст білків, г/дл |
Судинне сплетення |
0 |
Війкове тіло |
0 |
Скелетні м’язи |
2 |
Шкіра |
2 |
Легені |
4 |
Шлунково-кишковий тракт |
4,1 |
Серце |
4,4 |
Печінка |
6,2 |
1 Дані від JN Diana
Вроджена відсутність білка С призводить до неконтрольованої внутрішньосудинної гемокоагуляції і зазвичай смерті в дитинстві. Якщо своєчасно визначено діагноз і призначено лікування препаратами крові з високим вмістом білка С, то порушення гемокоагуляції зникають. Іншою досить поширеною причиною тромбозу є резистентність до АБС. Вона виникає внаслідок точкової мутації гена фактора V, що запобігає інактивації фактора АБС. Описані також мутації, пов’язані з білком S та антитромбіном III, які призводять до тромбозу, однак вони трапляються рідше.
Дисеміноване внутрішньосудинне зсідання належить до важких ускладнень септицемії - масивного ушкодження тканин та інших захворювань, за яких у кровоносних судинах накопичується фібрин, і виникає тромбоз багатьох судин малого та середнього калібру. Надмірне використання тромбоцитів та факторів зсідання спричинює водночас розвиток кровотечі. Вважають, що головною причиною цього синдрому є посилене утворення тромбіну, зумовлене підвищеною активністю ТПЛ без адекватної активності системи інгібіторів тканинних факторів.