Фізіологія людини - Вільям Ф. Ґанонґ 2002
Дихання
Транспортування газів між легенями і тканинами
Транспортування кисню
Постачання кисню у тканини
Система організму з постачання у тканини охоплює легені і серцево-судинну систему. Ступінь постачання О2 у певні тканини залежить від кількості О2, що потрапляє в легені, адекватності газообміну в легенях, кровопостачання тканини і спроможності крові переносити О2. Плин крові визначений ступенем звуження судинного русла у тканинах та серцевим викидом. Кількість О2 у крові зумовлена кількістю розчиненого О2, кількістю гемоглобіну в крові і спорідненістю гемоглобіну до О2.
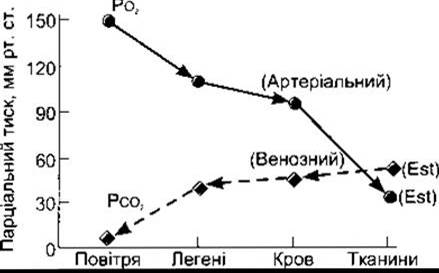
Рис. 35-1. Сумарні рівні РО2 і РО2 У повітрі, легенях і тканинах графічно відображають факт, що О2 і СО2 дифундують донизу уздовж знижувальних ґрадієнтів парціального тиску (відтворено за дозволом з Kinney JM: Transport of carbon dioxide in blood Anesthesiology 1960,21:615).
Реакції гемоглобіну і кисню
Динаміка реакції гемоглобіну з О2 перетворює його в особливу відповідну сполуку - оксигемоглобін, носій О2. Гемоглобін (див. Розділ 27) є білком, що складається з чотирьох субодиниць - поліпептидних ланцюгів, кожний з яких приєднується до небілкової частини - гему. У нормі в дорослих більшість гемоглобіну містить два а- і два ß- ланцюги. Гем (див. рис. 27-17) - це комплекс, створений порфірином і одним атомом двовалентного заліза. Кожний з чотирьох атомів заліза може приєднати або віддати одну молекулу О2. Залізо залишається у двовалентному стані, тому цю реакцію називають оксигенацією, а не окисненням. Записують реакцію гемоглобіну з О2 так: Нb + O2 ⇄ НbO2. Утворену сполуку називають оксигемоглобін. Оскільки він містить чотири Hb-одиниці, то молекулу гемоглобіну можна також записувати як Нb4; він справді реагує з чотирма молекулами O2 для утворення Hb4O8:
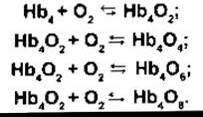
Реакція є стрімкою, триває до 0,01 с. Деоксигенація (відновлення) Нb4O8 теж дуже швидка.
Четвертинна структура гемоглобіну визначає його спорідненість до O2. У дезоксигемоглобіні глобінові одиниці щільно зв’язані у напружену (Н) конфігурацію, яка зменшує спорідненість молекули до O2. Якщо першим приєднується O2, то зв’язки, що утримують глобінові одиниці, вивільняються, утворюючи розслаблену (Р) конфігурацію, яка експонує більше сайтів для зв’язування. Остаточним наслідком є посилення спорідненості до O2 у 500 разів. У тканинах ці реакції оборотні (змінюють напрям), унаслідок чого вивільнюється O2. Відомо, що перехід від одного стану до іншого за час існування еритроцита відбувається близько 108 разів.
Крива дисоціації оксигемоглобіну - нелінійне співвідношення у відсотках О2-транспортувальної сили насичення гемоглобіну киснем до РО2 (рис. 35-2) - має S-подібну форму, що залежить від Н-Р-взаємозаміни. Комбінація першого гему в молекулі Нb з О2 посилює спорідненість другого гему для О2, а оксигенація другого посилює спорідненість третього і так далі, отже, спорідненість Нb для четвертої молекули О2 у декілька разів більша, ніж для першої.
Якщо кров урівноважується на 100% О2 (РО2 дорівнює 760 мм рт. ст.), то нормальний гемоглобін стає 100% насичений. У разі повного насичення кожний 1 г нормального гемоглобіну вміщує 1,39 мл О2, хоча кров у нормі містить невелику кількість неактивних похідних гемоглобіну, і рівень, який вимірюють in vivo, є нижчий: традиційно він становить 1,34 мл О2. У нормі концентрація гемоглобіну крові в середньому 15 г/дл (14 г/дл для жінок і 16 г/дл у чоловіків; див. Розділ 27). Отже, 1 дл крові містить 20,1 мл (1,34 мл X 15) О2, зв’язаного з гемоглобіном за 100% насичення гемоглобіну. Кількість розчиненого О2 є в лінійному співвідношенні до РО2 (0,003 мл/дл крові/мм рт. ст.)
На закінченнях легеневих капілярів in vivo гемоглобін крові на 97,5% насичений О2 (РО2 = 97 мм рт. ст.). Однак невелика частка венозної крові, що обходить легеневі капіляри (фізіологічний шунт), зумовлює лише 97% насиченості гемоглобіну крові у великому колі кровообігу. Тому артеріальна кров містить 19,8 мл О2 на 1 дл: 0,29 мл у розчині і 19,5 мл, зв’язаного з гемоглобіном. За стану спокою у венозній крові гемоглобін на 75% насичений, і загальний вміст О2 становить близько 15,2 мл/дл: 12 мл у розчині і 15,1 мл зв’язаного з гемоглобіном. Як бачимо, у спокої тканина вилучає 4,6 мл О2 з кожного декалітра крові, що проходить через неї (табл. 35-1); 0,17 мл цієї загальної кількості належить О2, що був у розчинений у крові, а решта - звільнена гемоглобіном. Отже, у стані спокою щохвилини 250 мл О2 транспортується з крові у тканини.
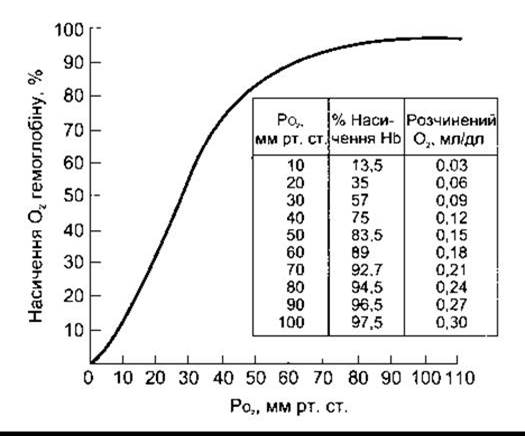
Рис. 35-2. Крива дисоціації оксигемоглобіну при pH 7,40 і температурі 38°С.
Чинники, що впливають на спорідненість гемоглобіну до кисню
Три важливі чинники впливають на криву дисоціації гемоглобіну: pH, температура і концентрація 2,3-дифосфогліцерату (2,3-ДФГ). Підвищення температури або зменшення pH зміщує криву праворуч (рис. 35-3). Якщо крива зміщується у цьому напрямі, то підвищений РО2 потрібний, щоб гемоглобін зв’язувався з оптимальною кількістю О2. Натомість зниження температури або збільшення pH зміщує криву ліворуч, і знижений РО2 необхідний для зв’язування отриманої кількості О2. Зручним показником для таких зміщень є Р50- РО2, за якого гемоглобін насичується О2 наполовину. Чим вищий Р50, тим нижча спорідненість гемоглобіну до О2.
Зменшення спорідненості О2 до гемоглобіну, коли pH крові зменшується, називають ефектом Бора; воно тісно пов’язане з фактом, що деоксигенований гемоглобін (дезоксигемоглобін) зв’язує Н+ активніше, ніж оксигемоглобін. Показник pH у крові зменшуватиметься зі збільшенням вмісту в ній СО2 (див. нижче), тому, коли зростатиме РСО2, крива зміщуватиметься праворуч, і зростатиме Р50. Більшість ненасиченого гемоглобіну, що трапляється у тканинах, є вторинним для зниження РО2, однак додаткові 1-2% ненасичення зумовлюють зростання РСО2 і послідовне зміщення кривої дисоціації праворуч.
Еритроцити багаті на 2,3-ДФГ, що формується (рис. 35- 4) з 3-фосфогліцеральдегіду, який є продуктом гліколізу за шляхом Ембдена-Мейєргофа (див. Розділ 17). Це високообмінний аніон, який приєднується до ß-ланцюгів дезокси- гемоглобіну. Один моль дезоксигемоглобіну зв’язує 1 моль 2,3-ДФГ:
![]()
У цьому рівнянні збільшення концентрації 2,3-ДФГ зміщує реакцію праворуч, зумовлюючи вивільнення більшої кількості О2. АТФ приєднується до дезоксигемоглобіну і поширюється менше; деякі органічні фосфати зв’язуються меншою мірою.
До чинників, які впливають на концентрацію 2,3-ДФГ в еритроцитах, належить pH. Оскільки ацидоз інгібує гліколіз в еритроцитах, то концентрація 2,3-ДФГ зменшується, якщо pH низький. Тиреоїдні гормони, гормон росту й андрогени збільшують концентрацію 2,3-ДФГ і Р50.
Таблиця 35-1. Газовий склад крові
Кров, мл/дл, що вміщує 15 г гемоглобіну |
||||
Артеріальна кров, |
Венозна кров, |
|||
РО2 95 мм рт. ст.; |
РО2 40 мм рт. ст.; |
|||
Газ |
РСО2 40 мм рт. ст.; |
РСО2 46 мм рт. ст.; |
||
Нb 97% насичення |
Нb 75% насичення |
|||
Розчинений |
Сполучений |
Розчинений |
Сполучений |
|
О2 |
0,29 |
19,5 |
0,12 |
15,1 |
СО2 |
2,62 |
46,4 |
2,98 |
49,7 |
N2 |
0,98 |
0 |
0,98 |
0 |
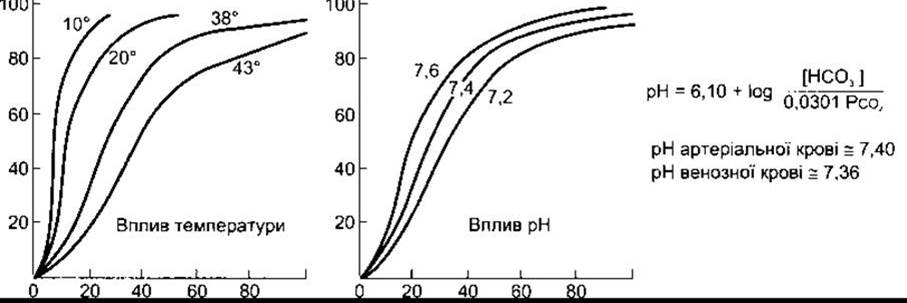
Рис. 35-3. Вплив температури та pH на криву дисоціації оксигемоглобіну. Осі координат такі, як на рис. 35-2 (відтворено за дозволом з Comroe JH et al: The Lung: Clinical Physiology and Pulmonary Function Tests, 2nd ed. Year Book, 1962).
Як зазначено, фізичне навантаження збільшує утворення 2,3-ДФГ через 60 хв, хоча у тренованих атлетів збільшення може не виникати. Підвищення Р50 у разі фізичного навантаження настає тому, що температура підвищується в активних тканинах і СО2, а метаболіти нагромаджуються, зменшуючи pH. Крім того, щораз більше О2 виводиться з кожної одиниці крові, що протікає через активні тканини, бо РСО2 у тканинах знижується. Остаточно при низьких значеннях РО2 крива дисоціації гемоглобіну стає крутою, і значна кількість О2 вивільняється на одиницю зниження РО2.
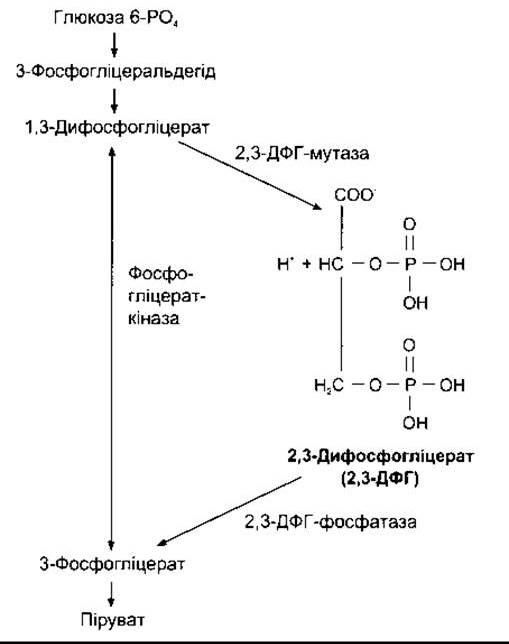
Рис. 35-4. Утворення і катаболізм 2,3-ДРГ.
Стрімке піднімання вгору зумовлює суттєве збільшення концентрації 2,3-ДФГ в еритроцитах з послідовним підвищенням Р50 за наявності О2 у тканинах. Збільшення 2,3-ДФГ, який має період напівжиття 6 год, є вторинним для збільшення pH крові (див. Розділ 37). Рівень 2,3-ДФГ знижується до норми внаслідок повернення до рівня моря.
Більша спорідненість фетального гемоглобіну (гемоглобіну F), на відміну гемоглобіну дорослих (гемоглобіну А), до О2 полегшує надходження О2 від матері до плоду (див. Розділ 27 і 32). Причиною такої збільшеної спорідненості є погане з’єднання з 2,3-ДФГ у-поліпептидних ланцюгів, які замінюють ß-ланцюги у фетальному гемоглобіні. Деякі аномальні гемоглобіни у дорослих мають низький рівень Р50, і кінцева висока спорідненість гемоглобіну до О2 зумовлює виражену тканинну гіпоксію, яка стимулює збільшене утворення еритроцитів, що спричинює поліцитемію (див. Розділ 24). Цікавим є міркування, що такі гемоглобіни не можуть зв’язувати 2,3-ДФГ.
Концентрація 2,3-ДФГ в еритроцитах збільшується в разі анемії та різноманітних хвороб, що супроводжуються хронічною гіпоксією. Це полегшує постачання О2 до тканин у випадку підвищення РО2, коли О2 вивільняється у периферійних капілярах. Зберігання крові у спеціальних банках зумовлює зниження рівня 2,3-ДФГ, і спорідненість такої крові для вивільнення О2 у тканини зменшується. Це зниження, яке, очевидно, обмежує доцільність використання такої крові для переливання хворому з гіпоксією, є меншим, якщо кров зберігають у цитрат-фосфат-декстрозному розчині, а не у звичайному кислотно-цитрат-декстрозному.
Транспортування гемоглобіном оксиду азоту
Сайти двовалентного заліза, що зв’язують у гемоглобіні О2, також приєднують оксид азоту (NO), однак є один додатковий NO-зв’язувальний сайт на ß-ланцюгах. Спорідненість цього сайту збільшується за допомогою О2, тому гемоглобін зв’язує NO у легенях і вивільнює його в тканинах, зумовлюючи вазодилатацію (див. Розділ 31).
Отже, гемоглобін виконує чотири функції: сприяє транспортуванню О2, полегшує транспортування СО2, відіграє важливу роль як буфер (див. Розділ 39) і транспортує NO.
Інші аспекти хімії гемоглобіну описані у Розділі 27. Фетальний гемоглобін та трансплацентарний обмін О2 розглянуто у Розділі 32.
Міоглобін
Міоглобін - це залізовмісний пігмент, який є у скелетних м’язах. Він подібний до гемоглобіну, однак зв’язує 1, а не 4 молі О2. Його крива дисоціації - це прямокутна гіпербола, а не S-подібна крива. Оскільки вона розташована лівіше, ніж гемоглобінова (рис. 35-5), то міоглобін бере О2 від гемоглобіну в крові, вивільнюючи О2 тільки за низького рівня РО2, однак PО2 у м’язах під час фізичного навантаження близький до нуля. Вміст міоглобіну найбільший у м’язах, що витримують скорочення. Скорочення м’язів перетискають судини, по яких тече кров, і міоглобін забезпечує О2, коли кровоплин припинений. Є також докази, що міоглобін полегшує дифузію О2 з крові у мітохондрії, де відбуваються реакції окиснення. Хоча у мишей з нокаутом гена, відповідального за синтез міоглобіну, простежується нормальна спроможність до фізичних навантажень. Отже, додаткові дослідження фізіологічної ролі міоглобіну потрібні.