Фізіологія людини - Вільям Ф. Ґанонґ 2002
Дихання
Пристосувальні зміни дихання у нормі та патології
Гіпоксична гіпоксія
Гіпоксична гіпоксія - це проблема багатьох осіб, що перебувають на значній висоті, а також ускладнення пневмонії та різноманітних інших захворювань дихальної системи.
Вплив зниженого барометричного тиску
Склад повітря є однаковим, проте загальний барометричний тиск знижується зі збільшенням висоти (рис. 37- 6). Саме тому РО2 також знижується. На висоті 3000 м над рівнем моря альвеолярний РО2 близько 60 мм рт. ст., і цього достатньо для гіпоксичного подразнення хеморецепторів та збільшення вентиляції. У разі підіймання вище альвеолярний РО2 знижується повільніше, альвеолярний РСО2 знижується незначно, оскільки гіпервентиляція внаслідок зниження артеріального РСО2 створює дихальний алкалоз.
Гіпоксичні симптоми в разі дихання повітрям
У випадку дії численних компенсаторних механізмів для збільшення толерантності до висоти (акліматизації) потрібний час, бо в неаклімітизованих осіб симптоми ураження психіки, такі як роздратованість, з’являються на висоті 3700 м. На рівні 5500 м гіпоксичні симптоми стають важчими, а на висоті понад 6100 м свідомість у більшості випадків втрачена (рис. 37-7).
Гіпоксичні симптоми в разі дихання киснем
Загальний атмосферний тиск стає фактором обмеження для толеранції висоти, якщо дихають 100% О2. Парціальний тиск водяної пари в альвеолярному повітрі є незмінним - 47 мм рт. ст., і якщо СО2 у нормі становить 40 мм рт. ст., то нижній барометричний тиск, за якого альвеолярний РО2 у нормі 100 мм рт. ст., може стати 187 мм рт. ст., що відповідає тиску на рівні 10 400 м. Вище збільшена вентиляція, що настала внаслідок зниження альвеолярного РО2, зменшує РСО2 незначно.
Проте максимальний альвеолярний РО2, що може бути досягнутий у разі дихання 100% О2 за навколишнього барометричного тиску 100 мм рт. ст. на висоті 13 700 м становить 40 мм рт. ст.
На висоті 14 000 м людина непритомніє, не зважаючи на введення 100% О2 (див. рис. 37-5). Однак штучну атмосферу можна створити навколо особи у скафандрі або кабіні з відповідним тиском і забезпеченням О2 та системою виведення СО2, тоді можливий підйом на будь-яку висоту та життя у вакуумі в міжпланетному просторі.
На висоті 19 200 м барометричний тиск становить 47 мм рт. ст. За такого тиску (або нижче) рідини організму «закипають» при температурі тіла: утворюються бульбашки газу внаслідок зниженої розчинності газів. Цей погляд здебільшого академічний, бо будь-яка особа, піддана впливу низького тиску, могла б померти від гіпоксії перш ніж смерть спричинили б бульбашки у кров’яному руслі.
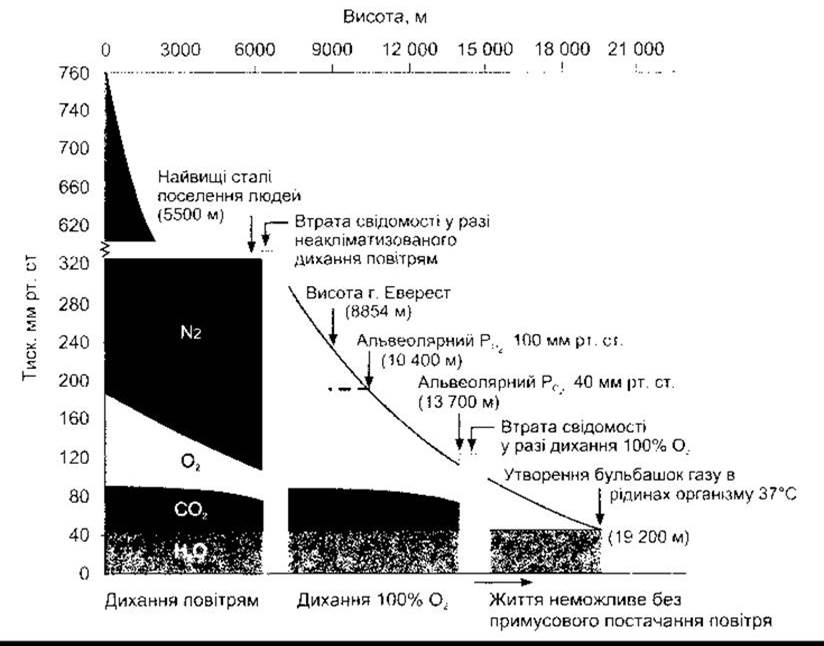
Рис. 37-6. Склад альвеолярного повітря в осіб, що дихають повітрям (0-6100 м) і 100% О2 (6100-13 700 м). Мінімальний альвеолярний РО2, який неакліматизована особа може витримувати без втрати свідомості, - 35-40 мм рт. ст. Зверніть увагу, що зі збільшенням висоти альвеолярний РСО2 знижується, оскільки гіпервентиляція є наслідком токсичного стимулювання каротидних та аортальних хеморецепторів. Зниження барометричного тиску зі збільшенням висоти не є лінійним, оскільки повітря стискальне.
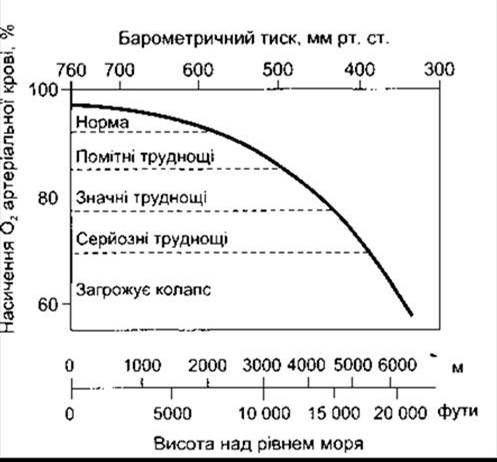
Рис. 37-7. Гострі ефекти гіпоксії в осіб, що дихають повітрям на різній висоті.
Відтерміновані ефекти значної висоти
Коли вперше люди приїжджають у високогір’я, то в багатьох розвивається короткочасна гірська хвороба. Такий синдром настає через 8-24 год після приїзду і триває чотири-вісім днів. Він супроводжується болем голови, роздратованістю, безсонням, задишкою, нудотою та блюванням. Причини, що спричинюють такий симптомокомплекс, остаточно не з’ясовані, однак його появу пов’язують з набряком мозку. Низький РО2 на височині спричинює артеріолярну дилатацію, і якщо церебральне авторегулювання не компенсоване, то підвищується капілярний тиск, який сприяє збільшенню трансудації рідини у тканини головного мозку.
Особи, у яких не виникає гірської хвороби, мають діурез у нормі на височині, а зменшення об’єму сечі характерне для осіб, у яких розвивається такий стан. Крім того, лікування діуретиками, відмінними від ацетазоламіду, не запобігає гірській хворобі. Симптоми послабляться, якщо алкалоз зменшиться внаслідок лікування ацетазоламідом або якщо набряк мозку зменшити призначенням великих доз глюкокортикоїдів.
Набряк легень на височині є серйозною формою гірської хвороби. Схильність до такого стану властива особам, які піднімаються швидко на висоту 2500 м і займаються важкою фізичною працею у перші три дні після приїзду. Набряк легень може виникнути і в осіб, акліматизованих до височини, однак які провели два або більше тижні на рівні моря і потім знову піднялися на височину. Він трапляється, якщо нема серцево-судинних або легеневих захворювань, і супроводжується вираженою легеневою гіпертензією, проте ліві передсердні тиски у нормі. Рідина, що утворюється в разі набряку, належить до типу рідин з доброю проникністю, високим вмістом білка та формених елементів крові. Можна припустити таке: ця рідина утворюється тому, що не всі легеневі артерії мають достатньо гладких м’язів для скорочення у відповідь на гіпоксію, і в капілярах, що забезпечують такі артерії, загальне підвищення легеневого артеріального тиску спричинює збільшення капілярного тиску, який порушує цілісність їхніх стінок (стрес-недостатність). В інших випадках блокатор Ca2+ -каналів ніфідепін, який знижує легеневий артеріальний тиск, є корисним для лікування та попередження такого стану. На набряк легень позитивно впливає спокій та лікування О2, і переважно він не розвивається в осіб, які піднімаються на височину поступово й уникають фізичного навантаження у перші декілька днів перебування на високогір’ї.
Акліматизація
Акліматизація до височини настає внаслідок взаємодії різноманітних компенсаторних механізмів. Дихальний алкалоз утворюється завдяки гіпервентиляційним зміщенням кривої дисоціації оксигемоглобіну ліворуч з одночасним супутнім збільшенням кількості 2,3-ДФГ в еритроцитах, що зумовлює зменшення афінності О2 до гемоглобіну. Кінцевий ефект полягає у зниженні P50 (див. Розділ 35). Зменшення афінності О2 сприяє доступності О2 для тканин. Крім того, підвищення P50 є обмеженим, бо якщо артеріальний РО2 відчутно підвищується, то зменшення афінності О2 також перешкоджає поглинанню О2 гемоглобіном у легенях.
Початкова відповідь вентиляції у разі підіймання на висоту є порівняно невеликою, оскільки алкалоз нейтралізує стимулювальний ефект гіпоксії. Однак стійке збільшення вентиляції настає через чотири дні (рис. 37-8). Активне транспортування Н+ у СМР або розвиток лакгоацидозу у головному мозку зумовлює зменшення pH у СМР, що збільшує реакцію на гіпоксію. Після чотирьох днів вентиляційна відповідь починає поступово сповільнюватись, проте потрібні роки для перебування на височинах для зниження до початкового рівня. Супутньою до такого зниження є поступова десенситизація на стимулювальні впливи гіпоксії.
З підійманням на височину швидко збільшується секреція еритропоетину (див. Розділ 24), а потім через наступні чотири дні незначно зменшується, коли вентиляційна відповідь посилюється й артеріальний РО2 підвищується. Збільшення кількості еритроцитів, що циркулюють, зумовлене еритропоетином, розпочинається через два-три дні і триває стільки, скільки особа перебуває на височині.
У тканинах також відбуваються пристосувальні зміни. Кількість мітохондрій, які є місцем оксидативних реакцій, збільшується, і рівень міоглобіну підвищується (див. Розділ 35), що сприяє рухові О2 у тканини. Одночасно в тканинах збільшується вміст цитохромоксидази.
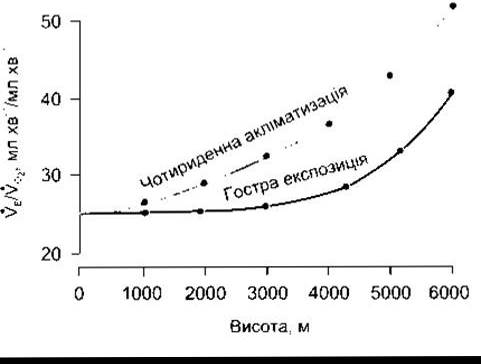
Рис. 37-8. Вплив акліматизації на вентиляційні реакції на різних висотах VЕ/VО2- вентиляційна рівновага - співвідношення експіраторного хвилинного об’єму (VE) до споживання О2 (VО2) (відтворено за дозволом з Lenfant С, Sullivan К+. Adaptation to high altitutude N Engl J Med 1971 ;284 1298)
Ефективність процесу акліматизації визначає факт, що в Андах та Гімалаях довгочасне людське житло розташоване на висоті 5500 м. Тубільці, що проживають у таких поселеннях, мають бочкоподібну грудну клітку і виражену поліцитемію. Значення альвеолярного РО2 у них є низькими, проте інші показники нормальні.
Хвороби внаслідок гіпоксичної гіпоксії
Гіпоксична гіпоксія є найпоширенішою формою гіпоксії, яку фіксують у клініці. Хвороби, що спричинюють її, можна класифікувати як перші, за яких настає недостатність газообмінного апарату (наприклад, вроджені вади серця, у яких великі кількості крові потрапляють з венозної частини кровообігу відразу в артеріальну, минаючи мале коло кровообігу), і другі, в яких простежується вентиляційна недостатність (порушення нагнітальної функції дихальної системи, табл. 37-1). Легенева недостатність трапляється, коли за таких станів, як легеневий фіброз, виникає блокада альвеолярно-капілярного бар’єру і порушення співвідношення між вентиляцією та перфузією. Вентиляційна недостатність може бути зумовлена слабістю дихальних м’язів у станах, коли робота з виконання дихання збільшується, або в разі різноманітних механічних порушень, наприклад пневмотораксу або бронхіальної недостатності, що обмежує вентиляцію. Також її можуть спричинювати аномалії нейрональних механізмів, що регулюють дихання, такі як депресія дихальних нейронів у довгастому мозку морфієм та іншими ліками.
Таблиця 37-1. Порушення, що спричинюють гіпоксичну гіпоксію

Порушення співвідношення між вентиляцією та перфузією
Відновлення порушення між співвідношенням вентиляція-перфузія, що є найчастішою причиною гіпоксичної гіпоксії, головне завдання у клінічній практиці. Фізіологічні впливи на порушення вентиляційно-перфузійної рівноваги та їхня роль у створенні змін альвеолярного газу внаслідок земного тяжіння описані у Розділі 34.
У разі розвитку хвороби, яка заважає вентиляції в деяких альвеолах, співвідношення вентиляція-кровоплин у різних частинах легень визначене відхиленням системного артеріального РО2. Якщо невентильовані альвеоли перфузувати, то у невентильованій, але перфузованій частині легені виникає ефект шунта справа наліво: скидання неоксигенованої крові у ліву половину серця. Переважно поширені менші ступені порушень вентиляційно-перфузійного співвідношення. У прикладі, що показаний на рис. 37-9, невентильовані альвеоли (В) мають низький РО2, тоді як надмірно вентильовані (А) - високий альвеолярний PО2. Крім того, ненасичений гемоглобін крові, що надходить з В, не є повністю компенсований більшим насиченням крові, що надходить з А, оскільки гемоглобін у нормі майже повністю насичується у легенях. Підвищення альвеолярного РО2 додає лише трошки більше О2 до гемоглобіну, ніж той звичайно може переносити. Як наслідок, артеріальна кров ненасичена. З іншого боку, вміст СО2 в артеріальній крові здебільшого нормальний у тих випадках, коли надлишкова втрата СО2 у надмірно вентильованих ділянках може врівноважувати зменшені втрати у невентильованих ділянках.
Венозно-артеріальні шунти
Коли серцево-судинні вади, такі як міжпередсердний дефект перегородки, дають змогу великій кількості неоксигенованої крові обходити легеневі капіляри і розводити оксигеновану кров у системних артеріях (шунт справа наліво), то розвивається хронічна гіпоксична гіпоксія і ціаноз (ціанотична застійна хвороба серця). Уведення 100% О2 збільшує вміст О2 в альвеолярному повітрі, послаблює дифузію або порушує вентиляційно-перфузійну рівновагу (короткочасна перфузія у загально невентильованих сегментах), збільшуючи вміст О2 у крові, що виходить з легень. Крім того, у хворих з венозно-артеріальним шунтами і нормальними легенями будь-який корисний вплив 100% О2 є незначним і зумовлений єдиним збільшенням кількості нерозчиненого О2 у крові.
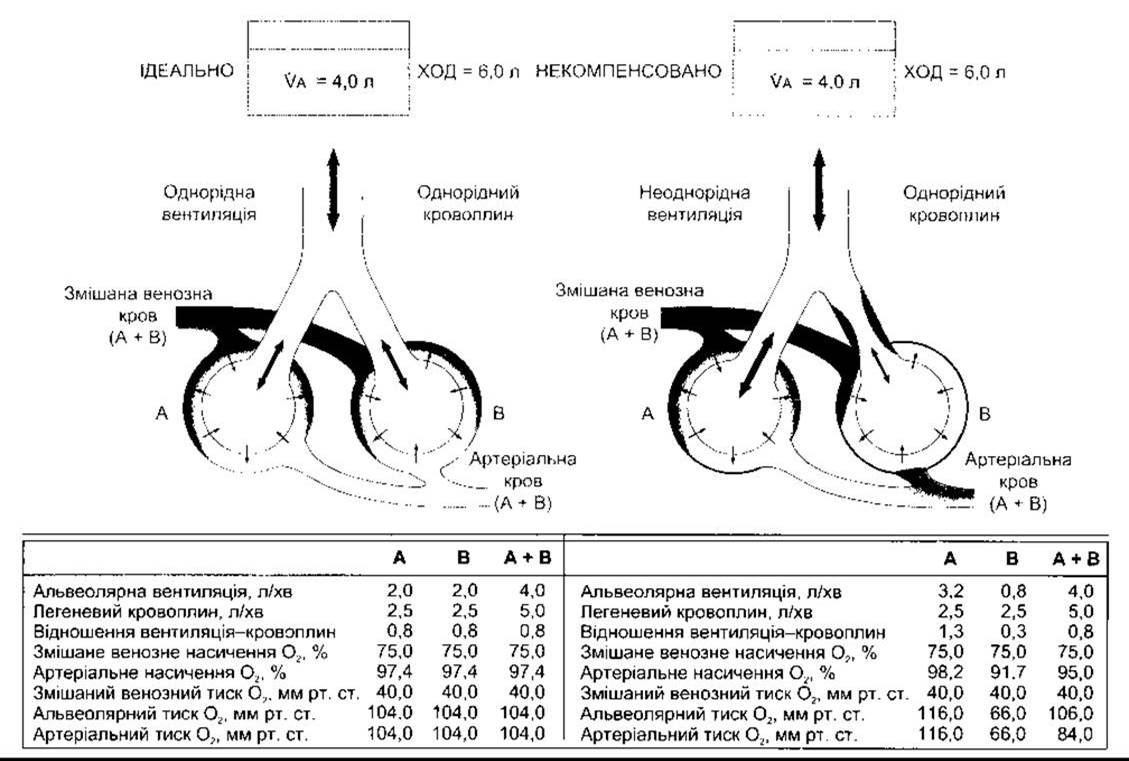
Рис. 37-9. Ліворуч: «ідеальний» взаємозв’язок між вентиляцією і кровоплином Праворуч: некомпенсовані неоднорідна вентиляція й однорідний кровоплин VA - альвеолярна вентиляція; ХОД - хвилинний об’єм дихання (відтворено за дозволом з Comroe JH Jr et al: The lung. Clinical Physiology and Pulmonary Function Tests, 2nd ed. Year Book, 1962).
Колапс легень
У випадку, коли бронхи або бронхіоли обструктують, то газ в альвеолах поза обструкцією абсорбується, і сегмент легені колабує. Колапс альвеол називають ателектазом. Ділянка ателектазу може мати розміри від невеликого клаптика до цілої легені. Частина крові відходить від ділянки колапсу до ліпше вентильованих частин легені, і це зменшує відхилення РО2.
Коли велика частина легені колабує одночасно, то помітно зменшується об’єм легені. Тому внутрішньоплевральний тиск стає негативнішим і тягне середостіння, яке у людей є достатньо рухомою структурою, до ураженої частини.
Іншою причиною ателектазу є відсутність або інактивація сурфактанту - речовини, що зменшує поверхневий натяг і в нормі міститься у тоненькому прошарку рідини, яка вистеляє альвеоли (див. Розділ 34). Таке порушення є головною причиною недостатності легень у разі їхнього розширення у нормі під час народження. Колапс легень може також бути наслідком наявності у плевральному просторі повітря (пневмоторакс), тканинної рідини (гідроторакс, хілоторакс) або крові (гемоторакс).
Пневмоторакс
Якщо повітря надходить у плевральний простір через розрив легень або отвір у грудній стінці, то легеня на ураженому боці колабує внаслідок еластичної тяги. З моменту, коли внутрішньоплевральний тиск на ураженій стороні стає знову атмосферним, середостіння зміщується у нормальне положення. Якщо взаємозв’язок між плевральним простором та зовнішнім середовищем відкритий (відкритий, або аспіраційний, пневмоторакс) то більше повітря рухається у плевральний простір або від нього кожного разу, коли хворий вдихає. Якщо ж отвір великий, то опір для потоку повітря у плевральний простір менший, ніж опір для потоку повітря в інтактну легеню, і невелика кількість повітря потрапляє у легені. Під час вдихання середостіння зміщується у неуражений бік, вигинаючи великі судини, зміщуючи серце й утруднюючи його діастолічне наповнення під час видихання. Також відбувається значне стимулювання дихання через гіпоксію, гіперкапнію й активування легеневих рецепторів спадіння. Дихальний дистрес є важким.
У разі якщо над отвором у легенях або грудній клітці є тканина, що її закриває, то вона працює як рухомий клапан, що перешкоджає руху повітря: входженню під час вдихання, і затримує його вихід під час видихання, і тиск у плевральному просторі підвищується понад атмосферний (пневмоторакс напруження). Якщо гіпоксичний подразник для дихання спричинює глибші зусилля під час вдихання, які у подальшому збільшують тиск у плевральній порожнині, то відхиляються великі вени і виникає гіпоксія та шок. Внутрішньоплевральний тиск у таких випадках може збільшуватись до 20-30 мм рт. ст. Периферійні вени стають розтягнутими, розвивається інтенсивний ціаноз, і стан стає потенційно небезпечним, якщо пневмоторакс не декомпресувати виведенням повітря.
З іншого боку, якщо отвір, через який повітря потрапляє у плевральний простір, герметично закритий (закритий пневмоторакс), то дихальний дистрес не є великим, бо з кожним вдиханням повітря плине в легені на неуражену сторону швидше, ніж у плевральний простір; оскільки судинна резистентність збільшується у колабованій легені, то кров відводиться до іншої легені. Отже, якщо пневмоторакс є не дуже великим, то він не спричинить важкої гіпоксії.
Повітря у закритому пневмотораксі абсорбується. З того часу як воно дорівнює атмосферному тиску, його загальний тиск, РО2 і PN2 Є ВИЩИМ, НІЖ у венозній крові (порівняйте значення для повітря і венозної крові на рис. 34-18). Газ дифундує вниз за такими градієнтами у крові і після одного-двох тижнів зникає.
Астма
Астму характеризує епізодичне або хронічне дихання з присвистом, кашлем і відчуттям стискання у грудях унаслідок бронхоконстрикції. Захворювання на астму та смертність від неї збільшується, проте її фундаментальна причина остаточно не з’ясована, незважаючи на інтенсивні дослідження. У разі астми виникають три порушення: повітряна обструкція, яку найважче унормувати; запалення дихальних шляхів і гіперчутливість до різних подразників. Давно визначений зв’язок астми з алергією; рівень IgE у плазмі часто підвищений. Білки, що вивільняються з еозинофілів унаслідок запальних реакцій, можуть уражувати епітелій дихальних шляхів і відповідають за гіперчутливість. Лейкотрієни (див. Розділ 17), що вивільняються з еозинофілів і мастоцитів, зумовлюють бронхоконстрикцію. Численні інші аміни, нейропептиди, хемокіни та інтерлей- кіни впливають на гладкі м’язи бронхів або створюють запалення.
Асматичні приступи найважчі у пізні нічні або ранні ранкові години, оскільки, як зазначено вище, це періоди максимальної констрикції у циркадних ритмах бронхіального тонусу. Холодне повітря та навантаження, які у нормі спричинюють бронхоконстрикцію, також зумовлюють астматичні приступи. У 5% осіб астматичні приступи спричинює аспірин. Інгібітори лейкотрієнового синтезу, такі як зілеутон, і блокатори CysLT1 -рецепторів, такі як монтелукаст, є ефективними в лікуванні цих форм астми (і, вірогідно, інших). Стимулювання ß-адренорецепторів зумовлює бронходилатацію, тому лікування інгаляціями ß-адреноергічних агоністів є стандартною терапією для астми. Посередництво мускаринових рецепторів створює бронхоконстрикцію, і ліки, що належать до мускаринових холіноблокаторів, також використовують у лікуванні. Додатковими препаратами, що часто застосовують, є кромолін, який інгібує вивільнення продуктів з мастоцитів, і глюкокортикоїди, які гальмують запальну реакцію.
Емфізема
У разі дегенеративної і потенційно небезпечної легеневої хвороби, яку називають емфізема, легені втрачають еластичність, а унаслідок руйнування еластичної тканини і стінок між альвеолами альвеоли заміщуються великими повітряними мішками. Фізіологічний мертвий простір значно збільшується, і з огляду на неадекватну та нерівну альвеолярну вентиляцію і перфузію у погано вентильованих альвеолах виникає важка гіпоксія. За подальшого перебігу хвороби виникає гіперкапнія. Вдихання та видихання утруднені, і робота для виконання дихання значно збільшується. Зміни у кривій тиск-об’єм у легенях показані на рис. 34-11. Грудна клітка збільшується і стає бочкоподібною. Оскільки грудна стінка розтягується, то протилежно до цього еластична тяга зменшується. Гіпоксія призводить до поліцитемії. Виникає легенева гіпертензія, і права половина серця збільшується (легеневе серце, cor pulmonale), а потім унаслідок виснаження резервів міокарда настає слабкість його скоротливої здатності.
У більшості випадків причиною емфіземи є куріння тютюну. Дим цигарок спричинює збільшення кількості легеневих альвеолярних макрофагів, які вивільняють хімічні речовини, що притягують лейкоцити до легень. Лейкоцити, відповідно, вивільняють протеази включно з еластазою, які ушкоджують еластичну тканину в легенях. Водночас а1-антитрипсин інактивують кисневі радикали, що їх вивільняють лейкоцити. Наслідком є порушення співвідношення між протеазами та антипротеазами зі збільшенням деструктивних змін у легеневій тканині.
У 2% причин емфіземи є вроджена недостатність активного а1-антитрипсину. В осіб, які гомозиготні на таку ваду і курять, швидко виникає емфізема, і в них на 20 років зменшена тривалість життя. У некурців з недостатністю а1- антитрипсину теж може виникнути емфізема, однак тривалість життя набагато довша і якість його поліпшується. Наприклад, у формуванні хвороби недостатність а1-антитрипсину забезпечує взаємовплив генетичних факторів і факторів зовнішнього середовища.
Муковісцидоз (кістозний фіброз)
Муковісцидоз є іншим станом, який призводить до повторних легеневих інфекцій з прогресивною, фактично небезпечною деструкцією легень. За такого вродженого рецесивного порушення Сl- -канали в апікальних мембранах епітеліальних клітинах дихальних шляхів не активовані нормальним способом цАМФ. Додаткові Сl--канали у мембрані є нормальними, однак можливе пригнічення їхньої функції. У будь-якому випадку втрата цАМФ-активованих каналів відображається у зменшенні транспортування Сl- у дихальні шляхи. Подальші події остаточно не з’ясовані. Проте Сl з’являється, тому NaEK-канали у дихальних шляхах активовані і більше Na+, ніж у нормі, абсорбується. Вода рухається назовні з дихальних шляхів, а їхня слизова стає товстішою й ущільненою, полегшуючи появу обструкції та інфікування. Серед кавказців муковісцидоз є одним з найпоширеніших генетичних захворювань: 5% у популяції є носіями дефективного гена, і хвороба виникає у кожного одного на 2000 народжень.
Ген, який є анормальним у разі муковісцидозу, розміщений на довгому плечі 7-ї хромосоми й енкодах Сl-каналу називають регуляторами трансмембранної провідності в разі муковісцидозу, які мають 12-інтервальні мембранні домени, два АТФ-зв’язувальні сайти і ділянку, що вміщує
фосфориляційні сайти для цАТФ-залежної протеїнкінази (протеїнкіназа А) (див. Розділ 1). Такий канал є членом надродини транспортерів, що опосередковують серед іншого експорт a-фактора феромону у дріжджах, і, можливо, секретує білки, яких бракує в сигнальній послідовності у ссавців. Численних повідомлень про мутації гена CFTR, що спричинює муковісцидоз, є багато; важкість порушень змінюється з мутаціями, тому зрозуміло, що енкодувальний ген має властивості комплексного білка. Здебільшого мутації перешкоджають АТФ-зв’узуванню, або виникає конформаційна зміна, яка переважно продукована зв’язуванням.
У чоловіків з міковісцидозом згущення секретів трапляється у протоках, якими проходять сперматозоїди, і це може спричинювати обструкцію і безпліддя. Хронічні панкреатити в обох статей є наслідком анормального функціювання панкреатичних проток (див. Розділ 26). У потових залозах транспортування Na+ і Сl- з просвіту недостатнє, і характерний високий вміст у поті цих електролітів.