Фізіологія людини - Вільям Ф. Ґанонґ 2002
Утворення і виділення сечі
Функція нирок і сечовипускання
Функція канальців
Загальні положення
Кількість будь-якої речовини, що пройшла клубочкові фільтри, дорівнює добутку швидкості клубочкового фільтрування на концентрацію цієї речовини в плазмі крові (КІН х Пх). Клітини канальців можуть додавати речовини до фільтрату (канальцева секреція), повністю чи частково видаляти певну речовину з фільтрату (канальцева реабсорбція) чи виконувати обидва процеси. Кількість речовини, що екскретується за одиницю часу (Сх х V), дорівнює сумі відфільтрованої і сумарної кількості речовини, перенесеної через стінки канальців (її значення може бути і від’ємним). Цю величину часто позначають Тх (рис. 38- 7). Кліренс речовини дорівнює ШКФ, якщо в канальцях не відбувається ані секреції, ні реабсорбції; перевищує ШКФ, якщо простежується канальцева секреція; і менший від ШКФ, якщо в канальцях відбувається реабсорбція.
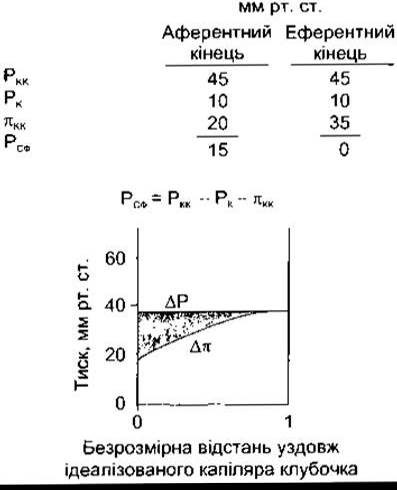
Рис. 38-6. Гідростатичний (РКК) та осмотичний (пКК) тиск у клубочкових капілярах щурів. РК - тиск у капсулі Шумлянського-Боумена; РСФ-середній фільтраційний тиск. Значення пК, звичайно, нехтувано мале. Отже, Δр = пКК. ΔР = РКК- РК (відтворено за дозволом з Mercer PF, Maddox DA, Brenner BM: Current concepts of sodium chloride and water transport by the mammalian nephron. J West Med 1974; 120:33).
Таблиця 38-4. Чинники, що впливають на швидкість клубочкового фільтрування

Більшу частину сучасних відомостей про клубочкове фільтрування і функцію канальців одержано завдяки методиці мікропункцій. Мікропіпетки вводять у канальці живої нирки і визначають хімічний склад аспірованої канальцевої рідини за допомогою мікрохімічних методик. Крім того, за допомогою цих піпеток можна промивати канальці in vivo. Альтернативно in vitro можна досліджувати доступні для вирощування і дослідження культури клітин канальців та ізольовані сегменти канальців.
Механізми канальцевої реабсорбції та секреції
Невеликі за розміром білки та деякі пептидні гормони легко реабсорбуються в проксимальних відділах канальців шляхом ендоцитозу. Інші речовини секретуються або реабсорбуються в канальцях шляхом пасивної міжклітинної дифузії та полегшеної дифузії в напрямі хімічних та електричних градієнтів чи активного транспортування проти цих градієнтів (див. Розділ 1). Рух відбувається за допомогою йонних каналів, обмінників, котранспортерів і помп. Багато з них було клоновано, проте їхній регуляторний вплив ще вивчають. Мутації окремих генів, що відповідають кожному з цих білків, зумовлюють специфічні синдроми, такі як хвороба Дента, синдром Барттера і синдром Ліддла, а також багато інших мутацій. Цікавим прикладом є білки поліцистин-1 (PKD-1) і поліцистин-2 (PKD-2). PKD-1, ймовірно, є рецептором до Са2+, що активує неспецифічний йонний канал, поєднаний з PKD-2. Функція цього йонного каналу ще невідома, однак обидва білки мають аномальну структуру в разі полікистозу нирок (захворювання, за якого ниркова паренхіма поступово заміщується множинними рідинними кистами аж до розвитку термінальної ниркової недостатності). Дуже важливо зазначити, що помпи та інші складові частини мембрани, яка контактує з просвітом, відрізняються від аналогічних складників базолатеральної мембрани. Саме ця особливість уможливлює рух через епітелій розчинених речовин.
Подібно до будь-яких транспортних систем в організмі активні транспортні системи нирок мають транспортний максимум (Тм), або максимальну швидкість, з якою вони можуть транспортувати ті, чи інші речовини. Отже, пропорційність залежності між швидкістю транспортування речовини та її концентрацією в розчині зберігається доти, доки концентрація не перевищує значення Тм для цього розчину, а за більших концентрацій транспортний механізм насичується повністю, і подальшого збільшення швидкості транспортування не простежується. Однак для деяких систем значення Тм є високими і, отже, їх важко наситити повністю.
Зазначимо також, що епітелій канальців, подібно до епітелію тонкої кишки і жовчного міхура, є високопроникним епітелієм, у якому через щільні з’єднання між клітинами (рис. 38-8) можуть проходити вода і деякі електроліти. Яку частку в загальному водно-електролітному транспортуванні становить параклітинний шлях, - питання суперечливе, оскільки це важко практично визначити. Сучасні дослідження свідчать, що він є досить значним фактором. Один з доказів цього той, що мутація гена білка парацеліну-1, який міститься в ділянках щільних з’єднань та бере участь у реабсорбції Mg2+, спричинює втрату функцій цього гена і значні втрати Mg2+ і Са2+ з сечею.
Вплив канальцевої реабсорбції та секреції на головні важливі фізіологічно речовини відображає табл. 38-5.
Реабсорбція натрію
Реабсорбція Na+ і Сl відіграє важливу роль у водно- електролітному балансі організму. Крім того, транспортування Na+ поєднується з рухом через стінки канальців йонів Н+, інших електролітів, глюкози, амінокислот, органічних кислот, фосфатів тощо. Головні котранспортні й обмінні системи в різних частинах нефрона наведені в табл. 38-6. У проксимальних відділах канальців, товстій частині висхідного коліна петлі Генле, дистальних відділах канальців і збирних трубочках Na+ пересувається шляхом котранспортування або обміну між канальцевою рідиною й епітеліальними клітинами канальців за спаданням концентрації та електричними градієнтами й активно переходить з цих клітин в інтерстиційний простір. Отже, Na+ активно транспортується зі всіх відділів ниркових канальців, окрім тонкої частини петлі Генле; а переходить в інтерстиційний простір за допомогою ензиму Na+-К+-АТФ-ази. Механізм дії цієї йонної помпи детально розглянуто в Розділі І. Вона виводить три йони Na+ в обмін на два йони К+, що надходять у клітину.
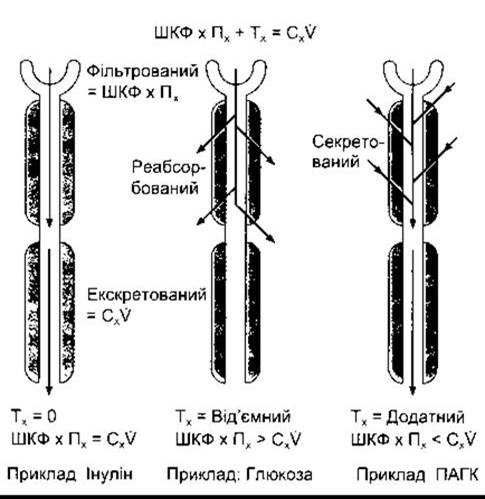
Рис. 38-7. Функція канальців. Пояснення символів див. у тесті підручника.
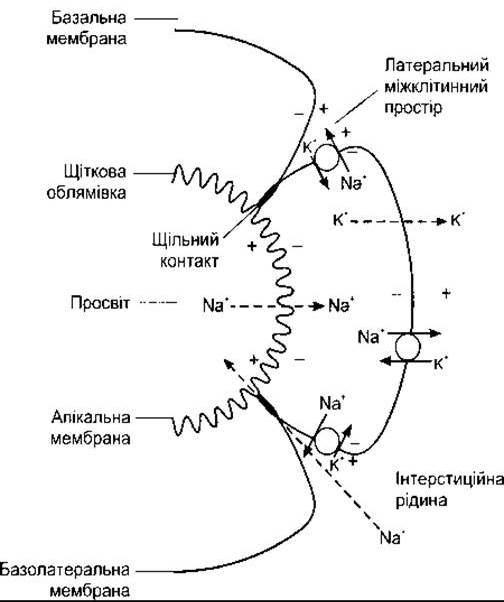
Рис. 38-8. Механізм реабсорбції Na+ у проксимальному відділі канальця. Суцільними лініями показано активне транспортування, штриховими - котранспортування або дифузію. Зверніть увагу, що Na+ переходить з просвіту канальця всередину клітин шляхом котранспортування, і що Na+ і Н2O переходять у просвіт канальця в ділянках щільних з’єднань. Біоелектричні потенціали клітинної мембрани позначені знаками + та -.
Клітини канальців у ділянці стінок з’єднані щільно з боку, оберненого в просвіт канальця, однак уздовж зовнішніх країв між ними є проміжки. Велика кількість Na+ виводиться внаслідок активного транспортування в ці відгалуження інтерстиційного простору, які названо латеральними міжклітинними проміжками (див. рис. 38-8).
Рідина, що утворюється внаслідок канальцевої реабсорбції, помірно гіпертонічна, і вода пасивно рухається за осмотичним градієнтом, що утворився після її абсорбції в епітеліальні клітини канальців. Сьогодні з’ясовано, що апікальні мембрани проксимальних клітин канальців містять водні канали, які полегшують рух рідини (див. нижче). З клітин вода переміщається у латеральні міжклітинні проміжки. Швидкість, з якою вода і розчинені в ній речовини рухаються з латеральних міжклітинних проміжків та інших відділів інтерстицію в просвіт капілярів, визначає закон Старлінґа, що описує рух через стінки будь-яких капілярів, тобто зміни гідростатичного й осмотичного тиску в міжклітинній рідині та в капілярах (див. Розділ 30). Речовини Na+ і Н2О зворотно проникають у просвіт канальців через міжклітинні з’єднання, особливо в тому випадку, якщо латеральні міжклітинні проміжки розширені.
Реабсорбція глюкози
Глюкоза, амінокислоти і НСО3 у початкових відділах проксимальних канальців піддаються реабсорбції разом з Na+ (рис. 38-9). В інших відділах канальців Na+ реабсорбується в парі з Сl-. Глюкоза є типовим представником речовин, які виходять з сечі шляхом вторинного активного транспортування. Вона фільтрується зі швидкістю близько 100 мг/хв (80 мг/дл плазми х 125 мл/хв). Практично вся глюкоза реабсорбується, і за добу з сечею виділяється не більше декількох міліграмів. Кількість реабсорбованої глюкози пропорційна до відфільтрованої і, отже, дорівнює добутку концентрації глюкози в плазмі крові ПГ на ШКФ, якщо цей добуток не перевищує транспортного максимуму ТмГ; однак якщо ТмГ перевищено, то кількість глюкози в сечі збільшується (рис. 38-10). Значення ТмГ становить близько 375 мг/хв у чоловіків і 300 мг/хв у жінок.
Таблиця 38-5. Транспортування у нирках різноманітних складників плазми крові у здорової дорослої людини, що застосовує звичайну дієту
Речовина |
За 24 години |
Реабсорбція, % |
Локалізація |
|||
фільтрація |
реабсорбція |
секреція |
есксреція |
|||
Na+ мекв |
26 000 |
25 850 |
150 |
99,4 |
П, Г, Д, Т |
|
К+, мекв |
600 |
5602 |
502 |
90 |
93,3 |
П, Г, Д, Т |
Сl-, мекв |
18 000 |
17 850 |
150 |
99,2 |
П, Г, Д, Т |
|
НСO3-, мекв |
4 900 |
4 900 |
0 |
100 |
П, Д |
|
Сечовина, ммоль |
870 |
4603 |
410 |
53 |
П, Г, Д, Т |
|
Креатинін, ммоль |
12 |
14 |
14 |
12 |
||
Сечова кислота, ммоль |
50 |
49 |
4 |
5 |
98 |
П |
Глюкоза, ммоль |
800 |
800 |
0 |
100 |
П |
|
Всі складники, мосм |
54 000 |
53 400 |
100 |
700 |
98,9 |
П, Г, Д, Т |
Вода, мл |
180 000 |
179 000 |
1000 |
99,4 |
П, Г, Д, Т |
|
1 П - проксимальні відділи канальців; Г - петлі Генле; Д - дистальні відділи канальців; Т - збірні трубочки.
2 К+ реабсорбується і секретується.
3 Сечовина рухається як у нефрон, так і з нього.
4 Секреція креатиніну у людини є варіабельною, і він, можливо, реабсорбується
Таблиця 38-6. Транспортні білки, які переміщують Na+ і Cl- через апікальні мембрани клітин ниркових канальців1
Ділянка |
Апікальний транспортний білок |
Функція |
Проксимальний відділ канальця |
КТ Nа+/глюкози KT Na+/Pi КТ Nа+/амінокислот КТ Nа+/лактату Обмінник Na+/H+ Обмінник Cl-/OH- |
Захоплення Na+, глюкози, Рі, амінокислот, лактату, Cl- Звільнення від Н+ |
Товста частина висхідної петлі |
КТ Na+, 2Сl-, К+ Обмінник Na+/H+ К+-канали |
Захоплення Na+, Сl-, К+ Звільнення від К+ і Н+ |
Дистальний звивистий каналець |
КТ NaCl |
Захоплення Na+ і Cl- |
Збірна трубочка |
Nа+-канал (NaEK) |
Захоплення Na+ |
1 Поглинання відповідає руху речовин з просвіту канальця всередину клітини; КТ - котранспортер; Рі - неорганічний фосфат (відтворено за дозволом з Schnermann JB, Sayegh El: Kidney Physiology. Lippincott-Raven, 1998).
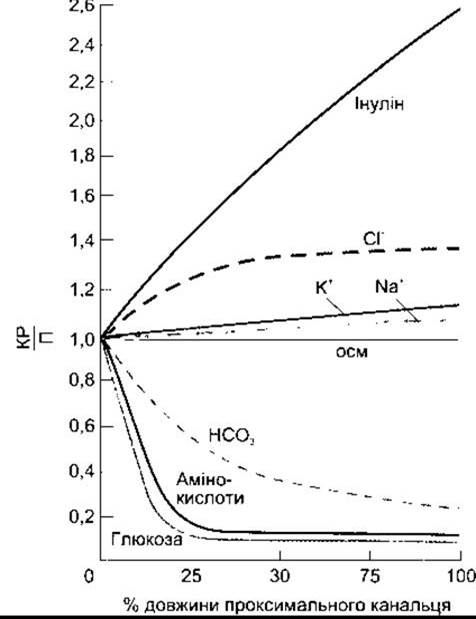
Рис. 38-9. Реабсорбція різних речовин у проксимальній частині канальця; КР/П - відношення концентрації речовини у канальцевій рідині до її концентрації в плазмі крові (з дозволу FC Rector Jr).
Нирковий поріг для глюкози - це такий рівень глюкози в плазмі крові, за якого вона з’являється в сечі в більш ніж нормальних - слідових кількостях. Логічно було б очікувати, що нирковий поріг для глюкози повинен становити близько 300 мг/дл, тобто 375 мг/хв (Тмг), поділене на 125 мл/хв (ШКФ). Однак реальний нирковий поріг для глюкози - близько 200 мг/дл плазми артеріальної крові, що відповідає близько 180 мг/дл у венозній крові. На рис. 38-10 пояснено, чому реальний нирковий поріг для глюкози менший від теоретично розрахованого. Ідеальну криву можна було б одержати, якби ТмГ у всіх клубочках був однаковим і глюкоза повністю вилучалась з кожного канальця (за умови, що відфільтрована кількість є меншою від ТмГ). Та насправді у людини реальна крива заокруглена і значно відхиляється від ідеальної. Це відхилення називають сплай (з англ. splay - сплющення). Значення сплаю обернено пропорційне до значення активності, з якою транспортний механізм зв’язує ту речовину, яку переносить.
Механізм транспортування глюкози
Процес реабсорбції глюкози у нирках нагадує аналогічний процес у кишці (див. Розділ 25). Глюкоза і Na+ зв’язуються зі спільним носієм - SGLT 2, що міститься у внутрішній мембрані канальця (рис. 38-11), глюкоза переходить усередину клітини під час руху Na+ за його електричним та хімічним градієнтами. У подальшому Na+ виходить з клітин у латеральні міжклітинні проміжки, а глюкоза за допомогою GLUT 2 переходить в інтерстиційну рідину. В дослідах на щурах з’ясовано, що SGLT 1 і GLUT 1 також беруть деяку участь у транспортуванні глюкози. Отже, транспортування глюкози у нирках і в кишці є прикладом вторинного активного транспортування.
Зазначимо, що d-ізомер глюкози специфічно зв’язується спільним носієм, унаслідок цього швидкість транспортування d-глюкози в кілька разів перевищує швидкість транспортування 1-глюкози. Рослинний глікозид флоризин здатний інгібувати транспортування глюкози як у нирках, так і у кишці шляхом конкуренції з глюкозою за зв’язування з носієм.
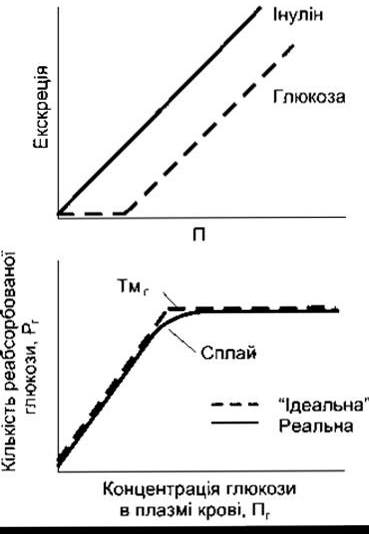
Рис. 38-10. Угорі: зв’язок між концентрацією в плазмі крові П та екскрецією глюкози й інуліну. Унизу: зв’язок між концентрацією в плазмі крові Пг та реабсорбцією Рг глюкози.
Додаткові приклади вторинного активного транспортування
Шляхом вторинного активного транспортування відбувається перенесення величезної кількості інших речовин. Потрібну для цього енергію забезпечує активне транспортування Na+ за межі клітин ниркових канальців. До таких речовин належать деякі амінокислоти, лактат, фосфат (Рі), Н+ і Сl.
Реабсорбція амінокислот і глюкози найінтенсивніша в початковому відділі проксимального звивистого канальця. Процес реабсорбції відбувається тут так само, як і в кишці (див. Розділ 25). Головні носії у внутрішній мембрані канальця виконують транспортування Na+, тоді як носії базолатеральних мембран не беруть участі в транспортуванні Na+. Йони Na+ виходять з клітин за допомогою ензиму Nа+-К+-АТФ-ази, а амінокислоти переходять в інтерстиційну рідину шляхом пасивної чи полегшеної дифузії.
У товстій частині висхідного коліна петлі Генле разом з Na+ і К+ реабсорбується невелика кількість Сl (див. нижче). Крім цього, у нирці було виявлено два представники родини CP-каналів. Ця родина має 12 трансмембранних доменів і також наявна в м’язах та інших тканинах. Мутації гена одного з ниркових каналів призводять до утворення кальційвмісних каменів нирок та гіперкальцинурії (хвороба Дента), однак ще не з’ясовано, як пов’язані транспортування Са+ і Сl.
Транспортування ПАГК
Процес транспортування ПАГК наочно відображає роботу активних транспортних систем, які секретують речовини у канальцеву рідину. Залежність швидкості фільтрування ПАГК від її концентрації в плазмі крові є лінійною, проте швидкість секреції ПАГК збільшується відповідно до зростання ППАГК лише доти, доки ППАГК не перевищує максимальної швидкості секреції (ТмПАГК) (рис. 38-12). Якщо ППАГК низька, то КПАГК високий; однак якщо ППАгк збільшується понад ТмПАГК, то КПАГК різко зменшується. У цьому разі КПАГК фактично наближається до кліренсу інуліну (КІН) (рис. 38-13), оскільки частка секреції у загальному об’ємі екскреції стає щораз меншою. І навпаки, якщо концентрація глюкози в плазмі крові ПГ нижче ниркового порогу, то кліренс глюкози практично дорівнює нулю, та зі збільшенням Пг вище ниркового порогу КГ поступово наближається до КІН.
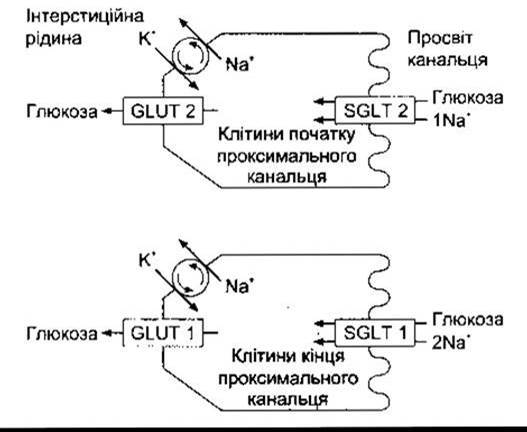
Рис. 38-11. Реабсорбція глюкози. У початковому відділі проксимальної частини канальця відбувається котранспортування глюкози і Na+ з просвіту канальця за допомогою SGLT 2; Na+ виводиться з клітин канальця Nа+-К+-АТФ-азою, що міститься в базолатеральних мембранах, глюкоза переходить в міжклітинну рідину за допомогою GLUT 2. У щурів деяка кількість глюкози виводиться за допомогою SGLT 1 і GLUT 1 у кінцевому, прямому відрізку проксимальної частини канальця. SGLT 1 переносить два йони Na+ на кожну молекулу глюкози, тоді як SGLT 2 - один йон Na+.
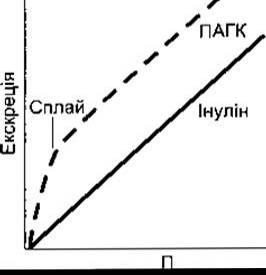
Рис. 38-12. Зв’язок між концентрацією в плазмі крові П й екскрецією ПАГК та інуліну.
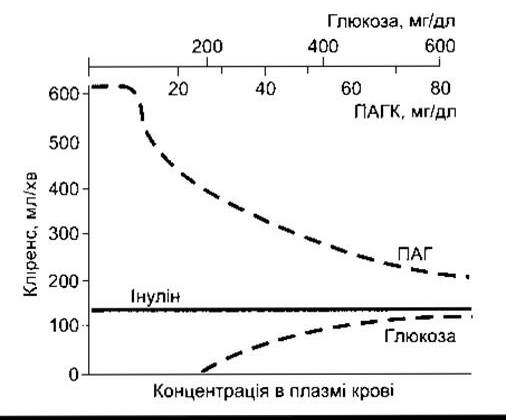
Рис. 38-13. Кліренс інуліну, глюкози та ПАГК за різних концентрацій кожної з речовин у плазмі крові людини.
Застосування КПАГК для визначення ефективного ниркового плину плазми описано вище.
Канальцева секреція інших речовин
Крім ПАГК, у канальцеву рідину активно секретують похідні гіпурової кислоти, фенол червоний та інші сульфафталеїнові барвники, пеніцилін та велика кількість йодованих барвників. До речовин, які синтезуються в організмі і піддаються канальцевій секреції, належать також різноманітні ефірні сульфати, глюкуроніди, 5-гідроксиіндол-оцтова кислота - головний метаболіт серотоніну (див. Розділ 4).
Канальцево-клубочковий зворотний зв’язок та клубочково-канальцевий баланс
Сигнали, що надходять від ниркових канальців, за механізмом зворотного зв’язку впливають на клубочкове фільтрування. Якщо швидкість проходження рідини через висхідне коліно петлі Генле і початкову частину дистального відділу канальця збільшується, то сповільнюється клубочкове фільтрування у відповідному нефроні, і навпаки, зі зменшенням швидкості потоку рідини простежується збільшення ШКФ (рис. 38-14). За допомогою цього явища, яке називають канальцево-клубочковим зворотним зв’язком, забезпечена сталість навантаження на дистальні відділи канальців. Роль рецептора в цьому разі відіграє щільна пляма; ШКФ регульоване шляхом констрикції або дилатації аферентної артеріоли. Можливим трансмітером констрикції вважають тромбоксан А2.
Навпаки, збільшення ШКФ зумовлює посилення реабсорбції води і розчинених у ній речовин, головно це відбувається у проксимальних відділах канальців, отже, частка реабсорбованих речовин є на сталому рівні. Цей процес називають клубочково-канальцевим балансом; він найяскравіше виявляється під час транспортування Na+. Зі зміною швидкості фільтрування упродовж декількох секунд відбувається відповідна зміна швидкості реабсорбції Na+, отже, малоймовірно, що в цьому процесі беруть участь екстраренальні гуморальні фактори. Одним з чинників є онкотичний тиск у перитубулярних капілярах. За високої ШКФ, доки кров досягне еферентних артеріол та їхніх капілярних гілок, досить значно підвищується онкотичний тиск її плазми. Внаслідок цього посилюється реабсорбція Na+ з просвіту канальця.
Однак відомо, що в цьому процесі також беруть участь ще не з’ясовані внутрішньониркові механізми.
Синдром Фанконі
Унаслідок дії різноманітних токсичних речовин, набутих захворювань, таких як дефіцит вітаміну D, або спадкових аномалій, наприклад, вродженого несприйняття глюкози, кількість АТФ у клітинах проксимальних відділів канальців різко зменшується. У цьому разі послаблюється виведення йонів Na+ за межі клітини за допомогою Na+ - К+-АТФ-ази і, як наслідок, виникають генералізовані порушення вторинного активного транспортування глюкози, амінокислот, Н+ і фосфату. Результатом цього є синдром Фанконі, який супроводжується метаболічним ацидозом, глюкозурією, аміноацидурією і фосфатурією.