Фізіологія людини - Вільям Ф. Ґанонґ 2002
Фізіологія нервових і м'язових клітин
Синаптичне і контактне передавання
Синаптичне передавання - Головні нейротрансмітерні системи
Фізіологія синапсів - це складний розділ нейрофізіології, що швидко розвивається, тому її не можна в деталях відтворити в цій книзі. Однак все ж доцільно підсумувати інформацію, що стосується головних нейротрансмітерів і їхніх рецепторів.
Ацетилхолін
Порівняно проста структура алетилхоліну, що є оцтовим ефіром холіну, зображена на рис. 4-16. Ацетилхолін міститься у високих концентраціях переважно в маленьких прозорих синаптичних пухирцях кінцевих ґудзиків нейронів, що продукують ацетилхолін (холінергічні нейрони).
Синтез ацетилхоліну
Ацетилхолін синтезується в реакції холіну з ацетатом. Холін - це важливий амін, який теж є попередником мембранних фосфоліпідів - фосфатидилхоліну і сфінгомієліну, сигнальних фосфоліпідів тромбоцитарного акти- вувального фактора і сфінгозилфосфорилхоліну. Холін активно поглинають холінергічні нейрони за допомогою транспортера (рис. 4-17), він також синтезується в нейронах. Ацетат активується шляхом сполучення ацетатних груп з відновленим коензимом А. Реакцію між активованим ацетатом (ацетил-коензим А, ацетил КоА) і холіном каталізує ензим холінацетилтрансфераза. Цей ензим у високій концентрації міститься в цитоплазмі холінергічних нервових закінчень. Його локалізація настільки специфічна, що наявність цього ензиму у високій концентрації в певній нервовій ділянці є свідченням, що синапси в цій ділянці належать до холінергічних. Ацетилхолін потрапляє в синаптичні пухирці за допомогою пухирцевого транспортера - VAChT.
Холінестерази
У разі реполяризації ацетилхолін повинен бути швидко видалений з синаптичної щілини. Це відбувається шляхом гідролізу ацетилхоліну з утворенням холіну й ацетату: цю реакцію каталізує ензим ацетилхолінестераза (інша назва справжня, або специфічна, холінестераза). Ацетилхолінестераза виявляє найвищу афінність стосовно ацетилхоліну, проте гідролізує й інші ефіри холіну.
В організмі є багато естераз. Одна з них, що міститься в плазмі, теж здатна гідролізувати ацетилхолін, хоч і відрізняється від ацетилхолінестерази. Цей ензим названо псевдохолінестеразою, або неспецифічною холінестеразою. Псевдохолінестераза плазми частково регульована гуморально, а також перебуває під впливом функційних змін у печінці. З іншого боку, молекули специфічної холінестерази утворюють кластери в постсинаптичній мембрані холінергічних синапсів. Естераза кодована одним геном, однак завдяки альтернативному з’єднанню різних мРНК утворюються дві каталітичні одиниці: одна з них фіксується до клітинної мембрани за допомогою гліколіпідів, а інша має колагеновий хвіст. Гідроліз ацетилхоліну відбувається швидко, що пояснює зміни в провідності Na+ і явища електричної активності під час синаптичної провідності.
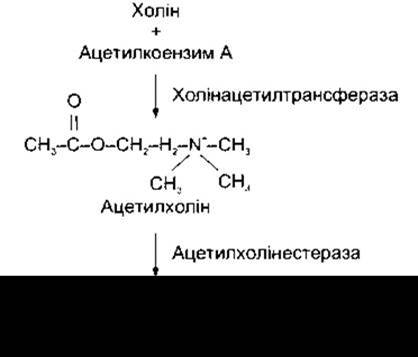
Рис. 4-16. Біосинтез і катаболізм ацетилхоліну.
Ацетилхолінові рецептори
Традиційно ацетилхолінові рецептори поділяють на два головні типи, які відрізняються за фармакологічними властивостями. Мускарин - це токсичний алкалоїд отруйних грибів: він лише незначно впливає на рецептори в автономних вузлах, проте повністю імітує стимулювальну дію ацетилхоліну на гладкі м’язи і залози. Тому цю дію ацетилхоліну називають мускариноподібною дією, а відповідні рецептори - мускариноподібними холінорецепторами. Цій дії запобігає атропін, що блокує мускариноподібні рецептори. В симпатичних вузлах невеликі кількості ацетилхоліну стимулюють постгангліонарні нейрони, а великі кількості блокують проходження імпульсів з пре- на постгангліонарні нейрони. Такого типу вплив усуває атропін, проте його відтворює нікотин. Ця дія ацетилхоліну названа нікотиноподібною, а відповідні рецептори - нікотиноподібними холінорецепторами. Нікотиноподібні рецептори поділяють на ті, що містяться в нервово-м’язових контактах, і ті, що містяться в автономних вузлах та центральній нервовій системі. Як мускарино-, так і нікотиноподібні рецептори у великих кількостях є в головному мозку.
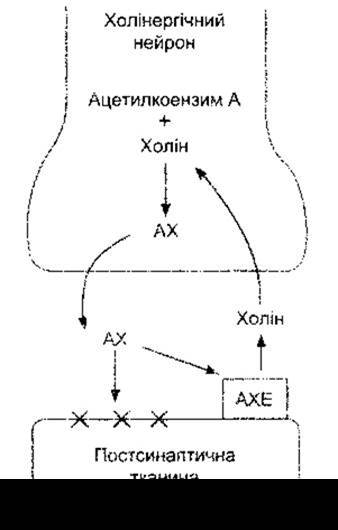
Рис. 4-17. Біохімічні перетворення в холінергічних закінченнях. АХ - ацетилхолін; АХЕ - ацетилхолінестераза; X - рецептор Порівняйте з рис. 4-21 та 4-24.
Нікотиноподібні холінорецептори належать до надродини ліґандозалежних йонних каналів, у складі якої є теж ГАМКА, гліцинові рецептори та деякі глютамінові рецептори. Вони утворені багатьма субодиницями, що кодовані різними генами. Кожен нікотиноподібний холінорецептор складається з п’яти субодиниць, що утворюють центральний канал, який у разі активування рецептора проводить Na+ або інші катіони. Ці п’ять субодиниць належать до набору, що складається з 16 відомих субодиниць: а1-а9, ß2-ß5, у, δ та є, кодованих 16 різними генами. Деякі рецептори є гомомерними, тобто містять, наприклад, п’ять а7-субодиниць, проте більшість - гетеромерні. Нікотиноподібний рецептор м’язового типу, виявлений у плоду, утворений двома а1,-субодиницями, ß1-cyбoдиницeю, у-субодиницею і δ-субодиницею (рис. 4-18). У дорослих ссавців δ-субодиниця заміщена ε-субодиницею, яка зменшує тривалість часу, протягом якого канал відкритий, проте збільшує його провідність. Нікотиноподібні холінорецептори автономних вузлів є гетеромерами, що містять переважно а3-субодиниці, які комбінуються з іншими субодиницями, а нікотиноподібні рецептори головного мозку утворені багатьма різними субодиницями. Велика кількість нікотиноподібних холінорецепторів у головному мозку розміщені пресинаптично, на аксонних закінченнях, що продукують глютамін (див. нижче), і вони підсилюють вивільнення цього трансмітера. Проте інші займають постсинаптичне положення. Деякі містяться в позанейронних структурах, а окремі, ймовірно, навіть в інтерстиційній рідині, тобто займають перисинаптиче положення.
На кожній а-субодиниці міститься сайт зв’язування ацетилхоліну, і коли молекула ацетилхоліну зв’язується із кожним з цих сайтів, то вони індукують зміну конфігурації білка, унаслідок чого цей канал відкривається, що зумовлює провідність Na+ та інших катіонів, а надходження Na+ приводить до виникнення деполяризаційного потенціалу. Важливою особливістю нейронних нікотиноподібних холінорецепторів є їхня висока проникність для Са2+, що може свідчити про їхню участь у процесах синаптичного збудження і навчання (див. нижче).
Мускариноподібні холінорецептори дуже відрізняються від нікотиноподібних. Клоновано п’ять типів цих рецепторів, що кодовані п’ятьма окремими генами. Характер М5- рецептора точно не з’ясований. Інші чотири - це серпантинові рецептори, зв’язані за допомогою G-білків з аденілатциклазою, К+-каналами або фосфоліпазою С (див. табл. 4-2). Номенклатура цих рецепторів ще не стандартизована. Рецептор, позначений у табл. 4-2, у великих кількостях міститься в головному мозку. Рецептор М2 виявлений у серці (див. Розділ 28), рецептор М4 - у тканині панкреатичних ацинусів і панкреатичних острівців, де зумовлює підвищення секреції підшлункових ензимів та інсуліну. Рецептори і М4 містяться в гладких м’язах.
Норадреналін і адреналін
Хімічним трансмітером у більшості симпатичних постгангліонарних закінчень є норадреналін. Він міститься в синаптичних пухирцях нейронів, які синтезують трансмітер і накопичують його в характерних невеликих пухирцях, що містять щільну гранулу (зернисті пухирці; див. вище). Норадреналін і його метиловий похідний адреналін продукує мозкова речовина надниркової залози (див. Розділ 20), однак адреналін не є трансмітером симпатичних постгангліонарних закінчень. Закінчення симпатичних постгангліонарних нейронів на гладких м’язах описані нижче; кожен нейрон має численні варикозні розширення вздовж аксонів, кожна з яких, очевидно, слугує місцем, де виділяється норадреналін. У головному мозку теж є норадреналіно-, дофаміно- і адреналінопродукувальні нейрони (див. Розділ 15). Нейрони, що синтезують норадреналін, відповідно, називають норадренергічними нейронами, хоча теж використовують термін адренергічні нейрони. Очевидно, що для адреналінопродукувальних нейронів прийнятнішим є другий термін. Нейрони, що синтезують дофамін, називають дофамінергічними нейронами.
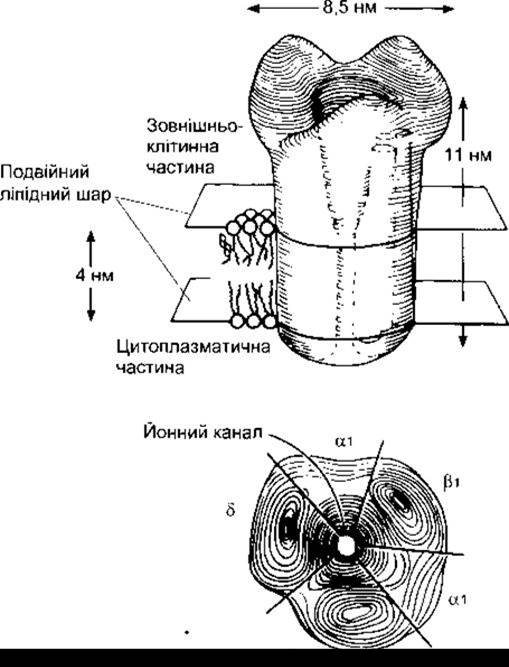
Рис. 4-18. Нікотиноподібний ацетилхоліновий рецептор плоду; вигляд збоку (вгорі) і від верхівки (внизу). a1, ß1, у, δ - субодиниці рецептора (з McCarthy МР et al: Molecular biology of the acetylcholine receptor. Annu Rev Neurosci 1986;9:383. Відтворено за дозволом з Annual Review of Neuroscience, vol. 9, 1986).
Біосинтез і виділення катехоламінів
Головні катехоламіни організму - норадреналін, адреналін і дофамін - утворюються шляхом гідроксилювання і декарбоксилювання амінокислоти тирозину (рис. 4-19) Частина тирозину утворюється з фенілаланіну, проте більшість - харчового походження. Фенілаланінгідроксилаза міститься головно в печінці. Тирозин транспортується до нейронів, що синтезують катехоламіни, а також до клітин мозкової речовини надниркової залози завдяки концентраційному механізму. В цитоплазмі клітин тирозин перетворюється на диоксифенілаланін (ДОФА), а далі тирозингідроксилаза і ДОФА декарбоксилаза перетворюють його на дофамін. Декарбоксилаза, інша назва якої - декар боксилаза ароматичних L-амінокислот, дуже подібна до 5 гідрокситриптофандекарбоксилази, проте, очевидно, не ідентична з нею. Далі дофамін проникає в зернисті пухирці всередині яких дофамін ß-гідроксилаза перетворює його на адреналін. У цій реакції вихідною речовиною є L- ДОФА, проте норадреналін, який утворюється, перебуває в D-конфігурації. Це саме так, незважаючи на те, що він обертає поляризоване світло ліворуч (-). Правообертальний (+) норадреналін набагато менше активний. Стадією, що лімітує швидкість реакції в цьому синтезі, є перетворення тирозину на ДОФА. Тирозингідроксилазу, що каталізує цю стадію, інгібує дофамін і норадреналін, таким способом відбувається внутрішнє регулювання процесу синтезу шляхом зворотного зв’язку. Кофактором тирозингідроксилази є тетрагідробіоптерин, який під час перетворення тирозину на ДОФА перетворюється на дигідробіоптерин.
Частина нейронів і клітини мозкової речовини надниркової залози містять цитоплазматичну фенілетаноламін-N-метилтрансферазу (PNMT - від англ. phenylethanolamino-N-methyltransferasa), що каталізує перетворення норадреналіну на адреналін. У цих клітинах норадреналін, очевидно, виходить з пухирців, перетворюється на адреналін і тоді проникає в інші пухирці, де накопичується.
У зернистих пухирцях норадреналін і адреналін зв’язуються з АТФ і приєднуються до хроматограніну А - білка, функція якого невідома. Великі зернисті пухирці деяких норадренергічних нейронів містять теж нейропептид Y (див. нижче). Хроматогранін А - це білок з молекулярною масою 49 кДа, що міститься у багатьох ендокринних та нейроендокринних клітинах і може відігравати важливу роль у секреції та накопиченні гормонів. У деяких тканинах виробляється подібний білок-хроматогранін В. Кількість хроматограніну А в плазмі збільшується в хворих з різними пухлинами ендокринних органів.
Транспортування катехоламінів у зернисті пухирці виконують два пухирцеві транспортери (див. вище), а це транспортування гальмує резерпін.
Катехоламіни виділяються з автономних нейронів і клітин мозкової речовини надниркової залози внаслідок екзоцитозу (див. Розділ 1). Оскільки в зернистих пухирцях містяться теж не зв’язані з мембраною АТФ, хроматогранін А і дофамін ß-гідроксилаза, то вони виділяються з пухирців разом з норадреналіном і адреналіном. Період півжиття дофамін ß-гідроксилази, що циркулює, набагато довший, ніж період півжиття катехоламінів, а кількість цього циркулювального ензиму перебуває під впливом генетичних та інших факторів і, крім того, залежить від рівня активності симпатичної нервової системи. Очевидно, що рівень циркулювального хроматограніну А є ліпшим показником активності симпатичної нервової системи.
Фенілпіруватна олігофренія
Фенілкетонурія, або фенілпіруватна олігофренія, - захворювання, яке супроводжується значним розумовим відставанням і накопиченням у крові, тканинах і сечі великих кількостей фенілаланіну та його кетокислотних похідних. Це зумовлено вродженим дефіцитом фенілаланінгідроксилази (див. рис. 4-19). Ген цього ензиму міститься в довгому плечі хромосоми 12. Описано численні мутації цього гена, що спричинюють фенілкетонурію. Катехоламіни постійно утворюються з тирозину, і розумове відставання зумовлене головно накопиченням у крові фенілаланіну і його похідних. Тому в разі лікування фенілкетонурії необхідне дієтичне харчування - обмежене вживання фенілаланіну.
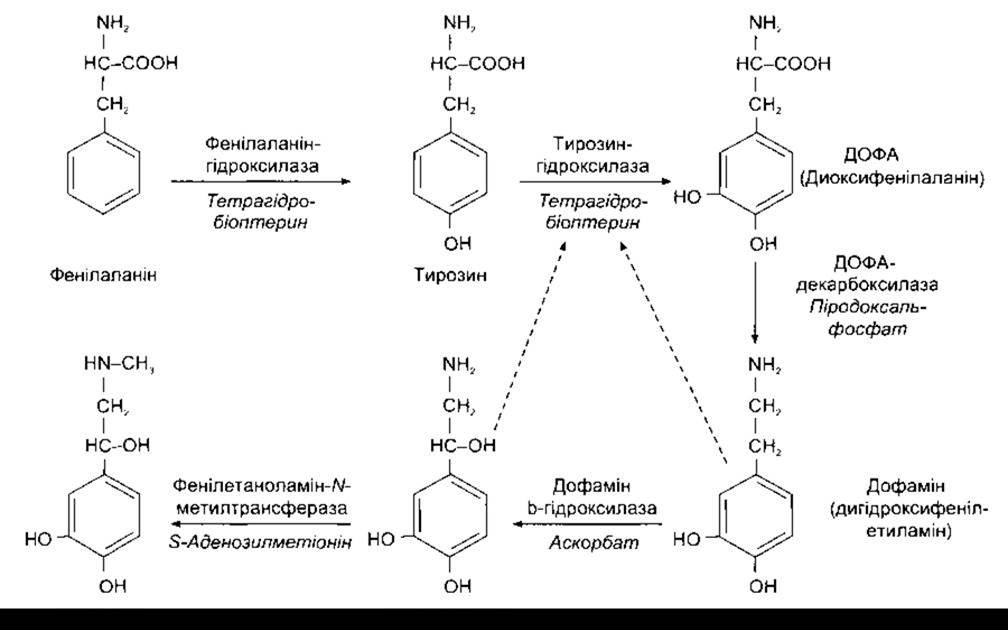
Рис. 4-19. Біосинтез катехоламінів. Штриховими лініями показано інгібування тирозингідроксилази норадреналіном і дофаміном. Головні кофактори виокремлені курсивом.
Захворювання може бути теж спричинене недостатністю тетрагідробіоптерину. Оскільки тетрагідробіоптерин - кофактор тирозингідроксилази, триптофангідроксилази (див. вище), а також фенілаланінгідроксилази, то його дефіцит зумовлює нестачу катехоламінів і серотоніну, що поєднується з гіперфенілаланінемією. Внаслідок цього виникають гіпотонія, знижена активність і вади розвитку. Для лікування застосовують тетрагідробіоптерин, леводопа, 5-гідрокситриптофан, а також низькофенілаланінову дієту.
Катаболізм катехоламінів
Норадреналін, як і інші амінові та амінокислотні трансмітери, видаляється з синаптичної щілини шляхом зв’язування з пост- або пресинаптичними рецепторами (див. рис. 4-15), зворотного поглинання пресинаптичними нейронами або внаслідок катаболізму (рис. 4-20). Головним механізмом видалення норадреналіну є його зворотне поглинання, і цим частково пояснюють надмірну чутливість структур, що позбавлені симпатичного впливу внаслідок денервації.
Після перетинання норадренергічних нейронів їхні закінчення дегенерують і, відповідно, зворотне поглинання стає неможливим. Тому значна кількість норадреналіну, що надходить з інших джерел, має змогу стимулювати рецептори автономних ефекторних органів.
Адреналін і норадреналін метаболізуються шляхом окиснення і метилювання з утворенням біологічно неактивних продуктів. Окиснення каталізує моноамінооксидаза (МАО), а метилювання - катехол-О-метилтрансфераза (КОМТ) (див. рис. 4-20). МАО міститься на зовнішній поверхні мітохондрій.
Є дві ізоформи МАО: МАО-А та МАО-В, що відрізняються за субстратною специфічністю і чутливістю до фармакологічних засобів. Обидві ізоформи містяться в нейронах. МАО досить поширена, особливо значна її кількість є в нервових закінченнях, у яких продукуються катехоламіни. КОМТ теж поширена, особливо в печінці, нирках і гладких м’язах. У головному мозку вона міститься в клітинах глії, і лише невелика кількість - у постсинаптичних нейронах, а в пресинаптичних норадренергічних нейронах КОМТ взагалі не виявлена. Отже, є два різні шляхи метаболізму катехоламінів.
Позаклітинні адреналін і норадреналін здебільшого О-метильовані, і вимірювання концентрації О-метильованих похідних (норметанефрину і метанефрину в сечі) є важливим показником рівня секреції норепінефрину й епінефрину. О-метильовані похідні не виділяються, а переважно окиснюються, і в сечі найбільша кількість катехоламінового метаболіту перебуває у вигляді З-метокси-4-гідроксиманделової кислоти (ванілілманделова кислота, МГМК). (див. рис. 4-20). Невеликі кількості О-метильованих похідних зв’язуються також з сульфатами і глюкуронідами.
У норадренергічних нервових закінченнях (рис. 4-21), з іншого боку, частину норадреналіну МАО постійно перетворює на фізіологічно неактивні деаміновані похідні - 3,4-дигідроксиманделову кислоту (ДГМК) і її відповідниі гліколь (ДГФГ). Далі вони перетворюються на їхні від повідні О-метилові похідні - МГМК та МГФГ (див. рис 4-20).
Альфа- і бета-рецептори
Адреналін і норадреналін діють, відповідно, на а- і ß рецептори, оскільки норадреналін більше споріднений а-адренергічними рецепторами, а адреналін - з ß-адренергічними. Як зазначено вище, а- і ß-рецептори є типовими серпентиновими рецепторами, зв’язаними з G-білками, й існують у вигляді різних складних форм. Вони тісно пов’язані з клонованими рецепторами дофаміну і серотоніну, а також з мускариноподібними холінорецепторами.
Дофамін
У малих інтенсивно флуоресцентних (SIF - від англ small intensely fluorescent) клітинах автономних вузлів (див. Розділ 13) і в деяких ділянках головного мозку (див. Розділ 15) синтез катехоламінів припиняється на утворенні дофаміну (див. рис. 4-19), і цей катехоламін слугує синаптичним трансмітером. Дофамін підлягає активном; зворотному поглинанню за допомогою Na+- і Сl- -залежного транспортера (див. вище). Його метаболізують МАС і КОМТ з утворенням неактивних компонентів (рис. 4 22), і відбувається це таким самим способом, як інакти вація норадреналіну. ДОФОК і ГВК теж кон’югуються переважно із сульфатами.
Клоновано п’ять різних дофамінових рецепторів, окремі з них існують у вигляді складних форм. Усі вони зв’язані за допомогою G-білків з сімома трансмембранними доме нами. Рецептори D1, та D5 зумовлюють збільшення концент рації цАМФ (див. табл. 4-2), проте вони по-різному розміщені в головному мозку. Рецептори D2, D3 та D зумовлюють зниження рівня цАМФ, і теж дещо відрізняються за розміщенням. Рецептор D4 більше, ніж інш дофамінові рецептори, споріднений з «атиповим» антипсихотичним засобом - клозапіном, який ефективний у раз шизофренії, однак має декілька екстрапірамідальних ефектів, як і більшість інших транквілізаторів. Крім того, як зазначено, кількість D4-рецепторів у головному мозку у випадку шизофренії збільшується в шість разів.
Серотонін
Серотонін (5-гідрокситриптамін, 5-НТ - від англ. 5 hydroxytryptamune) у високих концентраціях є в тромбоцитах і шлунково-кишковому тракті, де міститься в ентерохромафінних клітинах і м’язово-кишковому сплетенні (див Розділ 26). Менші кількості серотоніну виявлено в голов ному мозку і сітківці. Утворюється серотонін в організмі шляхом гідродекарбоксилювання незамінної амінокислоти триптофану (рис. 4-23 та 4-24). У нормі гідроксилаза не насичується, і відповідно, збільшення рівня надходження триптофану з їжею може призвести до збільшення вмісту серотоніну в головному мозку. Після виділення з серотонінергічних нейронів більша частина серотоніну повертається внаслідок активного зворотного поглинання (див. рис. 4-24), є також його інактивує МАО (див. рис. 4-23) з утворенням 5-гідроксііндолацетатної кислоти (5-ГІАК). Ця речовина становить головний метаболіт серотоніну, який виділяється з сечею, тому визначення його кількості в сечі є показником швидкості метаболізму серотоніну в організмі. В шишкоподібній залозі серотонін перетворюється на мелатонін (див. Розділ 24).
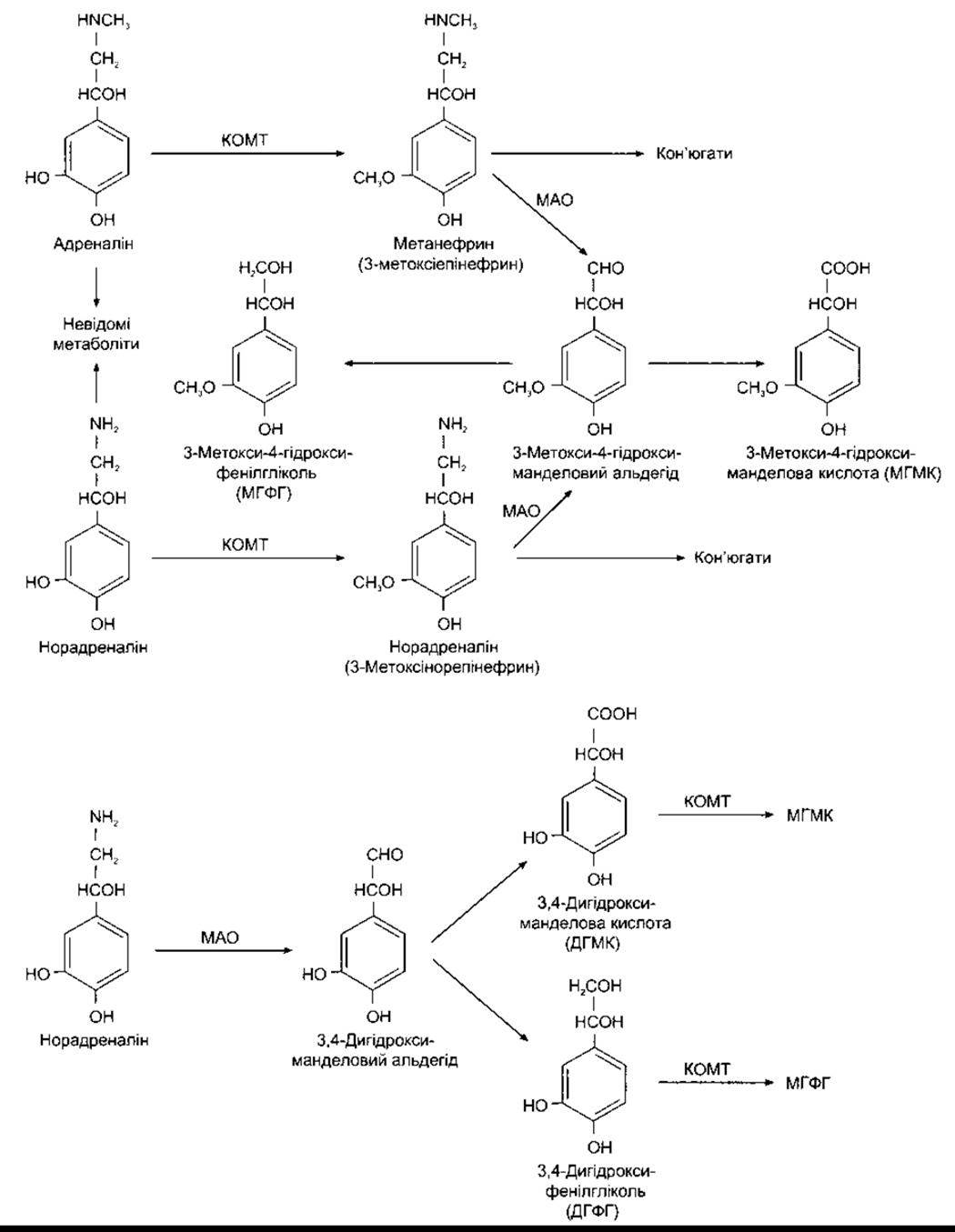
Рис. 4-20. Угорі: катаболізм зовнішньоклітинних адреналіну і норадреналіну. Катаболізм відбувається головно в печінці. Продукти катаболізму зв’язуються переважно з глюкуронідами і сульфатами (кон’югати). З-метокси-4-гідроксифунілгліколь (МГФГ) теж зв’язується. Внизу: катаболізм норадреналіну в норадренергічних нервових закінченнях. Кислота і гліколь, що утворюються за допомогою МАО, проникають у позаклітинну рідину і далі підлягають О-метилюванню з утворенням 3-метокси-4-гідроксимонделової кислоти (МГМК) та МГФГ. Адреналін у нервових закінченнях, очевидно, катаболізується тим самим шляхом.
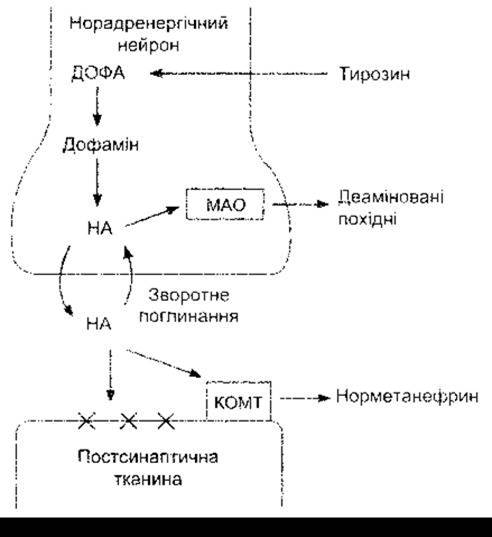
Рис. 4-21. Біохімічні перетворення в ділянці норадренергічних закінчень НА-норадреналін; КОМТ - катехол-О-метилтрансфераза; МАО - моноамінооксидаза; X - рецептор. Для спрощення схеми не зображено пресинаптичних рецепторів. Зверніть увагу, що МАО розміщується внутрішньоклітинно, тому норадреналін постійно деамінується в нервових закінченнях. КОМТ діє головно на продукований норадреналін. Порівняйте з рис 4-17 та 4-24.
Кількість клонованих і характеризованих серотонінових рецепторів постійно збільшується. Відомі 5-НТ1-, 5-НТ2-, 5-HT3-, 5-НТ4-, 5-НТ5-, 5-НТ6- І 5-НТ7-рецептори. В межах 5-НТ1-групи розрізняють 5-НТ1А-, 5-HT1B-, 5-HT1D-, 5-HT1F -, 5-НТ1F -підтипи. У 5-НТ2-групі виділяють 5-НТ2A-, 5-НТ2В- і 5-НТ2С (раніше відома як 5-НТ1С)-підтипи. Є два 5-НТ5- підтипи: 5-НТ5А та 5-НТ5В. Більша частина цих рецепторів зв’язана з G-білками і діє на аденілатциклазу і фосфоліпазу С (див. табл. 4-2). Рецептори 5-НТ3 як і нікотиноподібні холінорецептори, є йонними каналами. Деякі серотонінові рецептори пресинаптичні, а інші - постсинаптичні. Рецептори 5-НТ2А опосередковують агрегування тромбоцитів і скорочення гладких м’язів. Миші з нокаутом гена 5-НТ2А-рецепторів набирають масу внаслідок збільшення кількості споживання їжі, незважаючи на адекватне реагування налептин (див. Розділ 14), і досягають дивовижних розмірів. Рецептори 5-НТ3 містяться в шлунково-кишковому тракті, а також задньому полі і пов’язані з актом блювання (див. Розділ 14). Рецептори 5-НТ4 теж є в шлунково-кишковому тракті, де вони зумовлюють посилення секреції і перистальтики, і, крім того, у головному мозку. Рецептори 5-HT6 та 5-НТ7 головного мозку містяться в межах лімбічної системи, а 5-НТ6 - виявляють високу афінність до антидепресантів.
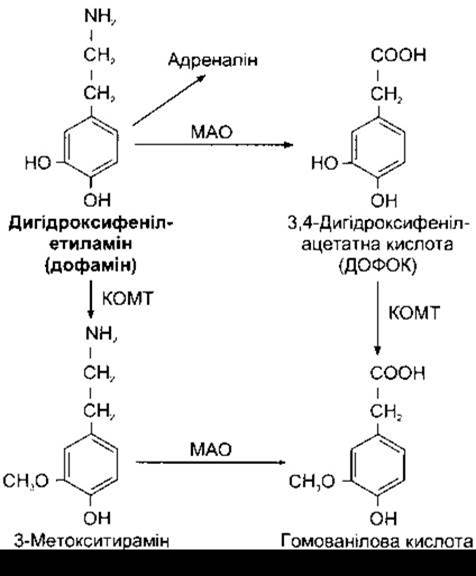
Рис. 4-22. Катаболізм дофаміну. Як і в інших реакціях окисного деамінування, що їх каталізує МАО, спочатку утворюються альдегіди, далі вони окиснюються в присутності альдегіддегідрогенази з утворенням відповідних кислот (ДОФОК і ГВК) Альдегіди теж відновлюються до 3,4-дигідроксифенілетанолу і З-метокси-4-гідроксифенілетанолу. ДОФОК і ГВК утворюють сульфатні кон’югати.
Гістамін
Тіла гістамінергічних нейронів містяться в горбо-сосочкових ядрах задньої гіпоталамічної ділянки (див. рис. 15- 6), а їхні аксони прямують до всіх відділів головного мозку, у тім числі до кори великого мозку і спинного мозку. Отже, гістамінергічна система подібна до норадренергічної, адренергічної, дофамінергічної і серотонінергічної в тому, ще порівняно невелика кількість клітин цієї системи налагоджує зв’язки з усіма відділами ЦНС.
Гістамін міститься також у клітинах слизової оболонки шлунка (див. Розділ 6) та в гепариновмісних клітинах, як називають повними клітинами, і яких особливо багато Е передній та задній частках гіпофіза.
Утворюється гістамін шляхом декарбоксилюванш амінокислоти гістидину (рис. 4-25). Ензим, що каталізує цю стадію, відрізняється від декарбоксилаз L-ароматичних кислот, що декарбоксилюють 5-гідрокситриптофан і L ДОФА. Гістамін перетворюється на метилгістамін або альтернативно, на імідазолацетатну кислоту. Остання реакція в людини кількісно менш значна. Для неї більше придат ний ензим діамінооксидаза (гістаміназа), ніж МАО, хочa МАО каталізує окиснення метилгістаміну до метилімід азолацетатної кислоти.
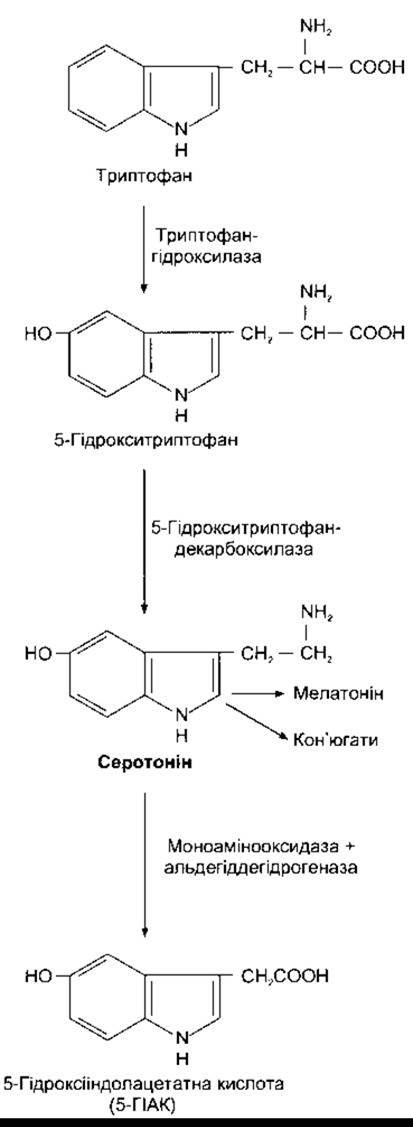
Рис. 4-23. Біосинтез і катаболізм серотоніну (5-гідрокситриптаміну). Ензим, що каталізує декарбоксилювання 5-гідрокситриптофану, дуже подібний, проте, очевидно, не ідентичний до екзиму, який каталізує декарбоксилювання ДОФА. Кофактором триптофангідроксилази є тетрагідробіоптерин. Утворення мелатоніну показано детально на рис. 24-11.
Відомі три типи гістамінових рецепторів: Н1, Н2 та Н3 (від англ. histamine), усі вони містяться як у периферійних тканинах, так і в головному мозку. Більшість, якщо не всі, Н3-рецептори пресинаптичні і зумовлюють гальмування виділення гістаміну та інших трансмітерів, діючи через G-білки. Рецептори H1 активують фосфоліпазу С, а Н2 - підвищують внутрішньоклітинну концентрацію цАМФ. Функція гістамінергічних систем головного мозку не з’ясована, проте відомо, що гістамін бере участь у процесах, пов’язаних зі спонуканням, мотивацією, статевою поведінкою, у регулюванні секреції окремих гормонів передньої частини гіпофіза, кров’яного тиску, приймання рідин і порога болю.
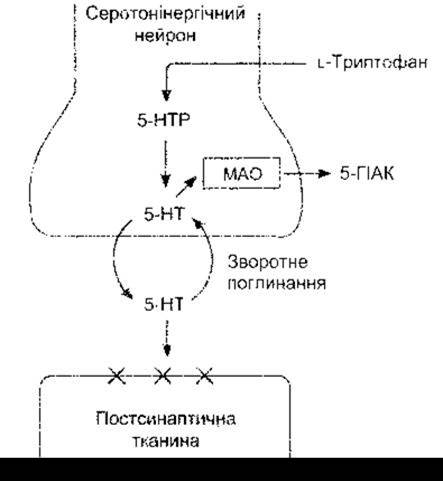
Рис. 4-24. Біохімічні перетворення в серотонінергічних синапсах. Порівняйте з рис. 4-17 та 4-21. 5-НТР - 5-гідрокси- триптофан; 5-НТ - 5-гідрокситриптамін (серотонін); 5-ГІАК - 5-гідроксііндолацетатна кислота; X - серотоніновий рецептор. З метою спрощення на схемі не зображено пресинаптичних рецепторів.
Збуджувальні амінокислоти: глютамат і аспартат
Глютамат і аспартат деполяризують багато різних нейронів ссавців, безпосередньо впливаючи на їхні клітинні мембрани шляхом йонофорезу. Глютамат є головним збуджувальним трансмітером у головному і спинному мозку. Підраховано, що глютамат забезпечує 75% передавань збуджувального типу в межах головного мозку. Аспартат, ймовірно, є трансмітером у пірамідних і шипуватих зірчастих клітинах зорової кори, проте це детально не досліджено. Глютамат утворюється внаслідок відновного амінування проміжного продукту циклу Кребса - a-кетоглютарату (рис. 4-26), а аспартаттрансамінування проміжного продукту циклу Кребса - оксалоацетату (див. Розділ 17). Обидві реакції зворотні, і подальший метаболізм відбувається в циклі лимонної кислоти. Як зазначено вище, гліальні клітини і пресинаптичні нейрони знову поглинають глютамат за допомогою принаймні трьох різних транспортерів.
Є два типи глютамінових рецепторів: метаболотропні та йонотропні. Метаболотропні рецептори - це зв’язані з G-білками серпантинові рецептори, які зумовлюють збільшення кількості внутрішньоклітинних ІФ3 та ДАГ, або зменшення кількості внутрішньоклітинного цАМФ. Ідентифіковано 11 різних субодиниць цих рецепторів (див. табл. 4-2). Вони поширені в головному мозку і, очевидно, беруть участь у забезпеченні синаптичної пластичності, зокрема в морському конику і мозочку. Нокаут гена одного з цих рецепторів (однієї з форм mGluRl), спричинює значні порушення координації рухів і просторового навчання.
Йонотропні рецептори - це ліґандозалежні йонні канали, близькі до нікотиноподібних холінорецепторів (див. вище), а також до ГАМК і гліцинових рецепторів (див. нижче). Є три головні типи йонотропних рецепторів, назви яких подібні до назв споріднених з глютаматом сполук: каїнатні рецептори (каїнат - кислота, виділена з морських водоростей), АМПА-рецептори (рецептори для а-аміно-3-гідрокси-5-метил-4-ізоксазолпропріонату) і NMDA-peцептори (рецептори для N-метил-О-аспартату). Як і нікотинові, ГАМК та гліцинові йонотропні рецептори утворені багатьма субодиницями. Ідентифіковано чотири субодиниці АМПА-рецепторів, п’ять субодиниць каїнатних рецепторів і шість субодиниць NMDA-рецепторів; усіх їх кодують різні гени. Вважають, що ці рецептори мають пентамерну структуру, проте окремі з них можуть бути тетрамерами, наразі ж їхня стехіометрія не з’ясована.
Каїнатні і АМПА-рецептори - це прості йонні канали, які в разі відкривання забезпечують надходження Na+ і зменшення К+. NMDA-рецептор теж є катіонним каналом. Він забезпечує проходження порівняно великих кількостей Са2+ і є унікальним у такому. По-перше, гліцин, що зв’язується з ним, підсилює його функцію. Вірогідно, що гліцин необхідний для нормального реагування рецептора на глютамат (рис. 4-27). По-друге, зв’язування з глютаматом зумовлює відкривання каналу, проте в разі нормального мембранного потенціалу канал блокують йони Mg2+. Це блокування усувається лише у випадку, коли нейрон, що містить рецептор, частково деполяризується шляхом активування АМПА або інших каналів, які зумовлюють швидку деполяризацію іншими синаптичними ланцюгами. По- третє, фенциклідин і кетамін - засоби, що спричинюють амнезію і відчуття дисоціації з довкіллям, - зв’язуються з іншими сайтами каналу. Більшість глютамінергічних нейронів забезпечені АМПА- і NMDA-рецепторами. Каїнатні рецептори розміщені пресинаптично на ГАМК-продукувальних нервових закінченнях і постсинаптично - в різних точках у межах головного мозку. Каїнатні і АМПА-рецептори містяться як у глії, так і в нейронах, а NMDA-рецептори, - ймовірно, лише в нейронах.
Висока концентрація NMDA-рецепторів виявлена в морському конику. Блокування цих рецепторів запобігає довготривалій потенціації - тривалому збудженню в нервових шляхах, що виникає після короткого періоду високочастотного подразнення (див. нижче). Отже, ці рецептори можуть мати важливе значення для процесів, пов’язаних з пам’яттю і навчанням. Особливістю глютамату і деяких його синтетичних аналогів є те, що, діючи на тіла нервових клітин, вони можуть проводити в клітину таку велику кількість Са2+ яка спричинить загибель клітини. Це дає змогу використовувати ці збуджувальні речовини шляхом мікроін’єкцій для дискретного руйнування тіл нервових клітин, уникаючи ушкодження суміжних аксонів.
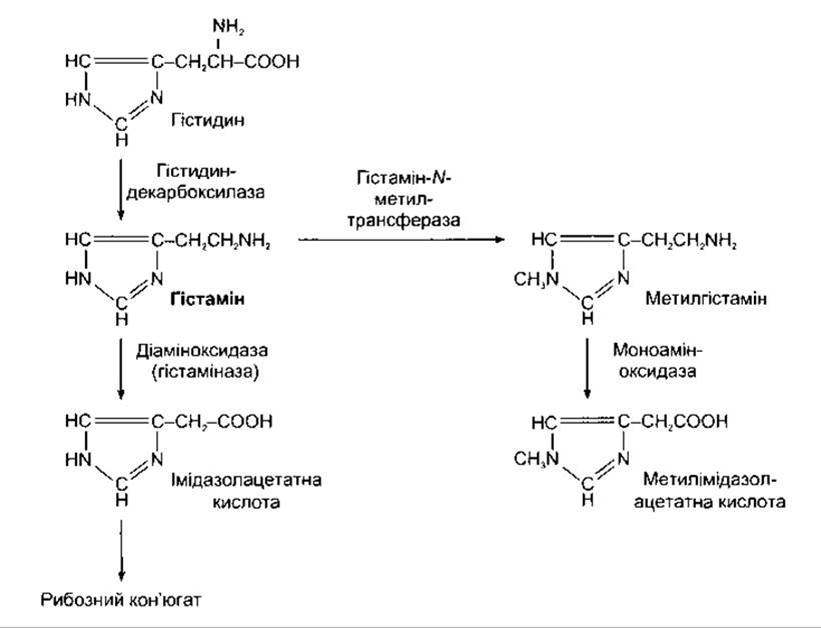
Рис. 4-25. Синтез і катаболізм гістаміну.
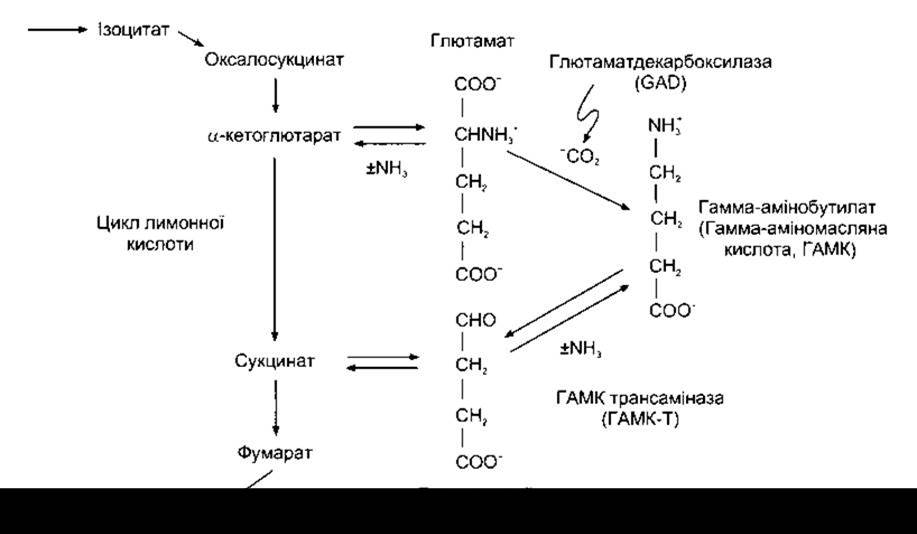
Рис. 4-26. Утворення і метаболізм глютамату і ГАМК.
Є багато доказів того, що збуджувальні речовини відіграють важливу роль в ушкодженні головного мозку у разі апоплексії (див. Розділ 32). Усування глютамату з позаклітинної рідини головного мозку відбувається переважно за допомогою Nа+-залежних поглинальних систем нейронів і глії. У випадку закупорення мозкової артерії клітини гостро ішемізованої ділянки гинуть, а клітини навколишньої частково ішемізованої ділянки можуть виживати, проте втрачають здатність утримували трансмембранний градієнт Na+, завдяки якому відбувається поглинання глютамату. Внаслідок цього глютамат накопичується в ПКР до рівня, що спричинює збуджувальне ушкодження і загибель клітин у ділянці навколо інфаркту (ішемічна півтінь). Вплив цих змін у процесі лікування наслідків апоплексії розглянуто в Розділі 33.
Гальмівні амінокислоти: гамма-аміномасляна кислота
Гамма-аміномасляна кислота (ГАМК, гамма-амінобутират) є головним гальмівним трансмітером у головному мозку, де забезпечує проведення приблизно в 20% синапсів ЦНС. ГАМК теж міститься в сітківці і є трансмітером, причетним до пресинаптичного гальмування (див. вище).
ГАМК, що в рідинах організму перебуває у вигляді у-амінобутирату, утворюється шляхом декарбоксилювання глютамату (див. рис. 4-26). Цю реакцію каталізує глютаматдекарбоксилаза (GAD - від англ. glutamate decarboxylase) - ензим, що, як виявлено за допомогою імуноцитохімічних методів, міститься в нервових закінченнях у багатьох частинах головного мозку. (ГАМК метаболізує переважно трансамінуванням до сукцинатного півальдегіду і далі перетворюється в циклі лимонної кислоти на сукцинат (див. Розділ 17). Трансамінування каталізує ГАМК-трансаміназа (ГАМК-Т). Кофактором GAD і ГАМК-Т слугує піридоксаль фосфат - похідне піридоксину (вітамін В6). ГАМК активно поглинається за допомогою ГАМК-транспортера (див. вище). Пухирцевий транспортер ГАМК забезпечує проникнення ГАМК усередину секреторних пухирців. Цей транспортер має 10 трансмембранних доменів, тоді як пухирцевий моноаміновий - 12 (див. вище).
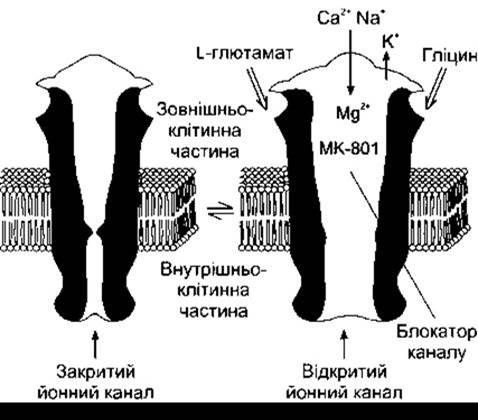
Рис. 4-27. Схематичне зображення NMDA-рецептора. У випадку зв’язування з рецептором гліцину і глютамату йонний канал, що був закритий (ліворуч), відкривається, проте в умовах мембранного потенціалу спокою канал блокований Мд2+ (праворуч). Цей блок усувається у разі часткової деполяризації, зумовленої іншим впливом на нейрон, що містить рецептор, і Са2+ та Na2+ надходять до нейрона. Блокування може зумовити також і дизоцилпін малеат (МК-801).
Автоімунна реакція до GAD і, як наслідок, нестача ГАМК, спричинюють синдром ригідності (SMS - від англ. stiff-man syndrome), що супроводжується нестійкою, але прогресуючою м’язовою ригідністю і болісними м’язовими спазмами.
Цікаво, що GAD міститься теж у подібних до синаптичних пухирців структурах інсулінопродукувальних В-клітин підшлункової залози, і ГАМК може відігравати роль паракринового трансмітера в острівцях (див. Розділ 19). Інсулінозалежний цукровий діабет (тип 1 діабету) - це автоімунне захворювання, яке характеризує деструкція В-клітин, а більша частина автоантитіл є антитілами до GAD. Однак SMS є рідкісним захворюванням, тоді як діабет типу 1 досить поширений, і не всі хворі SMS мають діабет типу 1. Отже, співвідношення цих двох захворювань не з’ясоване.
Описано три типи ГАМК-рецепторів: ГАМКA, ГАМКВ та ГАМКС. Рецептори ГАМКA і ГАМКВ поширені в ЦНС, тоді як у дорослих організмах хребетних ГАМКC-рецептори містяться майже винятково в сітківці; ГАМКA- і ГАМКC-рецептори - це йонні канали, утворені п’ятьма субодиницями, які оточують отвір, що характерно для будови нікотиноподібних холінорецепторів, а також багатьох глютамінових рецепторів. У конкретному випадку йоном, що проходить, є Сl (рис. 4-28).
Рецептори ГАМКВ - це метаболотропні рецептори, які зв’язані з гетеродимерними G-білками, що підвищують провідність K+ -каналів, гальмують активність аденілатциклази і надходження Са2+. Збільшення надходжень С;, виходу К+ і зменшення надходжень Са2+ зумовлюють гіперполяризацію в нейронах з виникненням ГПСП. Характер опосередковування дії ГАМКB -рецептора G-білками в конкретному випадку унікальний, оскільки в цьому процесі переважно бере участь гетеродимер G-білка, а не його поодинока молекула.
Рецептори ГАМКС мають порівняно просту будову. Це пентамери, утворені трьома р-субодиницями, які поєднуються в різних комбінаціях. Рецептори ГАМКA теж є пентамерами, проте утворюються шляхом різного комбінування шести а-, чотирьох ß-, чотирьох у-, однієї δ- та однієї ε- субодиниць. Цим зумовлена значна різноманітність їхніх властивостей у різних точках розташування.
Надходження Сl, зумовлене ГАМКA, стимулюють бензодіазепіни - речовини, що мають помітну заспокійливу дію, а також є ефективними міорелаксантами й антисудомними засобами. Бензодіазепіни зв’язуються з a-субодиницями. Діазепам та інші бензодіазепіни широко застосовують в усьому світі. Барбітурати й алкоголь, принаймні частково, теж стимулюють проходження Сl через Сl - канали. Метаболіти стероїдних гормонів - прогестерону і деоксикортикостерону - зв’язуються з ГАМКA -рецепторами і посилюють провідність Сl. Упродовж багатьох років відомо, що прогестерон і деоксикортикостерон у великих дозах виявляють снодійну і знеболювальну дію; такі ефекти зумовлені впливом цих гормонів на ГАМКA - рецептори.
Іншого класу бензодіазепінові рецептори виявлено в стероїдопродукувальних ендокринних залозах та інших периферійних тканинах, тому їх названо периферійними бензодіазепіновими рецепторами. Вони, ймовірно, беруть участь у біосинтезі стероїдів, виконуючи функцію, подібну до функції StAR-білка (див. Розділ 20), тобто забезпечують проникнення стероїдів у мітохондрії. Інша можлива роль периферійних бензодіазепінових рецепторів полягає у регулюванні клітинної проліферації. Периферійні бензодіазепінові рецептори виявлені також в астроцитах та пухлинах головного мозку.
Гліцин
Впливом на NDMA-рецептори гліцин виявляє збуджувальний ефект у головному мозку. Втім, він теж бере участь у прямому гальмуванні, здебільшого у стовбурі головного і спинному мозку. Як і ГАМК, гліцин діє шляхом посилення провідності Сl-. Його антагоністом щодо цього є стрихнін. Клінічна картина конвульсій і м’язової гіперактивності, спричинених стрихніном, свідчить про важливість постсинаптичного гальмування для нормального функціонування нервової системи. Гліцинові рецептори, що зумовлюють гальмування - це Сl-канали. Вони є пентамерами, що утворені двома субодиницями: ліґандозв’язувальною а-субодиницею і структуральною ß-субодиницею. Нещодавно наведено вагомі докази стосовно наявності трьох видів нейронів, які беруть участь у прямому гальмуванні в спинному мозку: це нейрони, що виробляють гліцин; нейрони, що виробляють ГАМК; нейрони, що виробляють і гліцин, і ГАМК. Вірогідно, що нейрони, які виробляють лише гліцин, містять гліциновий транспортер GLYT2; нейрони, які виробляють лише ГАМК, містять GAD; а нейрони, які виробляють і гліцин, і ГАМК, містять обидві ці речовини. Третій вид нейрона становить особливий інтерес, оскільки в нейронах, очевидно, гліцин і ГАМК містяться в одних і тих самих пухирцях.
У деяких осіб простежуються надмірно активні рефлекси переляку (гіперексплексія), і, принаймні в окремих випадках, у цьому разі виявлено заміни поодиноких амінокислот у складі гліцинових рецепторів.
Анестезія
Механізм дії головних анестетиків донедавна був таємницею. Однак нові дані свідчать, що не тільки алкоголь і барбітурати, а й інгаляційні анестетики діють на йонні канали, зокрема на ГАМКВ - і гліцинові рецептори, зумовлюючи посилення провідності Сl.
Речовина Р та інші тахікініни
Речовина Р - це поліпептид, який складається з 11 амінокислотних залишків і міститься в кишці, різних периферійних нервах і багатьох відділах ЦНС. Його структура наведена в табл. 26-2. Речовина Р є одним з шести представників родини поліпептидів ссавців, які називають тахікінінами. Ці сполуки відрізняються NН2-кінцями, проте мають спільну карбоксильну кінцеву послідовність Phe-X-Gly-Leu-Met-NH2, де X - Val, His, Lys або Phe. Представники цієї родини перелічені в табл. 4-3. Багато подібних тахікінінів є в організмах інших хребетних та безхребетних.
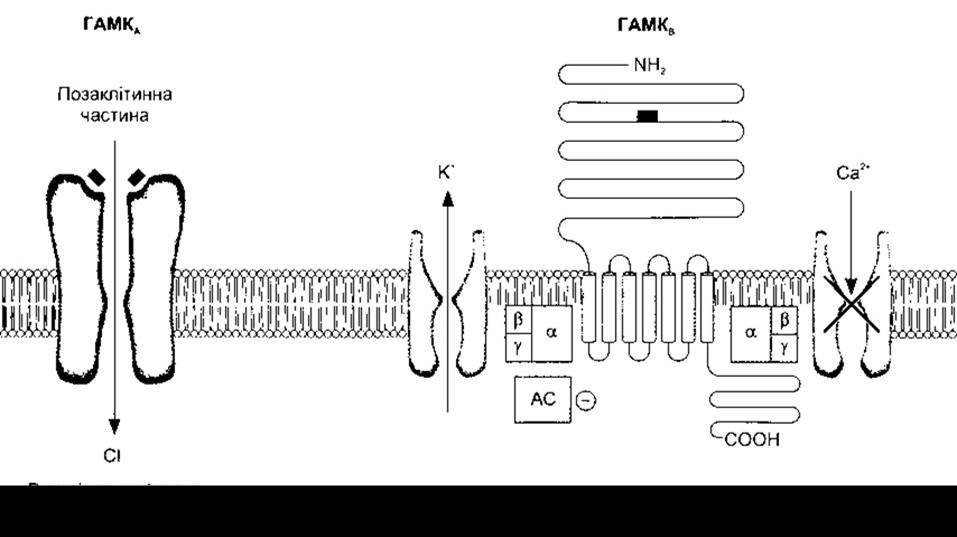
Рис. 4-28. Схематичне зображення ГАМКA- І ГАМКB-рецепторів і головних механізмів їхньої дії. G-білок, що опосередковує дію ГАМКB-рецепторів, є гетеродимером (відтворено за дозволом з Bowery NG, BrownDA: The cloning of GABAB receptors. Nature 1997;386:223).
Тахікініни ссавців кодовані двома генами. Ген нейрокініну В кодує лише один поліпептид - нейрокінін В, ген речовини Р (нейрокініну А) кодує решта п’ять поліпептидів. Три з них утворені шляхом альтернативного процесингу первинної РНК, а два інші - посттрансляційного процесингу.
Є три нейрокінінові рецептори. Два з них - рецептор речовини Р та рецептор нейрокініну К, клоновано. З’ясовано, що це серпентинові рецептори, зв’язані з G-білками. Активування рецептора речовини Р зумовлює активування фосфоліпази С і збільшення утворень ІФ3 та ДАГ.
Речовина Р у високих концентраціях міститься в закінченнях первинних аферентних нейронів спинного мозку і, ймовірно, є трансмітером перших синапсів провідних шляхів відчуття тупого болю (див. Розділ 7). Крім того, цю речовину виявлено в чорноречовинно-смугастій системі, де її концентрація пропорційна до концентрації дофаміну, а також у гіпоталамусі, де може відігравати певну роль у нейрогуморальному регулюванні. У разі внутрішньошкірного введення речовина Р спричинює почервоніння і припухлість, ймовірно, вона є трансмітером, що його виділяють нервові волокна під час аксон-рефлексу (див. Розділ 32). Речовина Р бере участь у процесі регулювання перистальтики кишок. Нещодавно з’ясовано, що центрально активний антагоніст NK-I рецептора виявляє антидепресантну активність у людини. Подібно, як під час дії антидепресантів, що впливають на обмін моноамінів у головному мозку (див. Розділ 15), для розвитку цього антидепресантного ефекту потрібний певний проміжок часу. Проте інгібітор NK-I в експерименті на тваринах не спричинив змін в обміні моноамінів у головному мозку. Функції інших тахікінінів не з’ясовані.
Опіоїдні пептиди
У головному мозку і шлунково-кишковому тракті містяться рецептори, що зв’язують морфін. Дослідження ендогенних лігандів цих рецепторів дало змогу виявити два споріднені між собою пентапептиди, названі енкефалінами (табл. 4-4), які зв’язуються з цими опіоїдними рецепторами. Один з них містить метіонін (мет-енкефалін), а інший - лейцин (лейенкефалін). Ці, а також інші поліпептиди, що зв’язуються з опіоїдними рецепторами, називають опіоїдними пептидами. Енкефаліни містяться в нервових закінченнях у шлунково-кишковому тракті, а також у багатьох різних ділянках головного мозку і функціонують, очевидно, як синаптичні трансмітери. Вони є в драглистій речовині, і в разі введення в стовбур головного мозку виявляють знеболювальну дію. Енкефаліни також сповільнюють перистальтику кишок (див. Розділ 26).
Таблиця 4-3. Тахікініни ссавців
Ген |
Поліпептидні речовини |
Рецептори |
SP/NKA |
Речовина Р |
Речовини Р (NK-1) |
К+ |
Нейрокінін А |
|
Н2O |
Нейропептид К |
Нейропептиду К (NK-2) |
Са2+ |
Нейропептид а |
|
Na+ |
Нейрокінін А (3-10) |
|
NKB |
Нейрокінін В |
Нейрокініну В (NK-3) |
Як і інші невеликі пептиди, опіоїдні синтезуються в складі великої молекули-попередника (див. Розділ 1). Ідентифіковано понад 20 активних опіоїдних пептидів. На відміну від інших пептидів, опіоїдні мають багато різних попередників. Кожен з них є у вигляді препроформи і проформи, від якої відщеплюється сигнальний пептид. Три досліджені попередники, а також опіоїдні пептиди, що утворюються з них, наведені в табл. 4-4. Проенкефалін уперше виявлено в мозковій речовині надниркової залози (див. Розділ 20), він теж є попередником мет-енкефаліну і лей-енкефаліну в головному мозку. Кожна молекула проенкефаліну містить чотири мет-енкефаліни, один лей-енкефалін, один октапептид і один гептапептид. Проопіомеланокортин - велика молекула-попередник, виявлена в передній і проміжній частках гіпофіза і в головному мозку, - містить ß-ендорфін - поліпептид, що складається з 31 амінокислотного залишка, в складі якого на NH2 -кінці міститься мет-енкефалін (див. Розділ 22). Утворюються й інші, коротші ендорфіни.
Молекула-попередник дає початок також АКТГ та меланоцитостимулювальному гормону (МСГ). У головному мозку є окремі енкефаліно- і ß-ендорфінопродукувальні системи нейронів (див. Розділ 15). Бета-ендорфін у кров’яне русло виділяє гіпофіз. Третьою молекулою-попередником є продинорфін - білок, який має три лей-енкефалінові залишки, зв’язані з динорфіном і неоендорфіном. Динорфін 1-17 міститься в дванадцятипалій кишці, а динорфін 1 -8 - у задній частці гіпофіза і гіпоталамусі. В гіпоталамусі теж є a- і ß-неоендорфіни. Причина існування багатьох молекул-попередників опіоїдних пептидів, а також наявності цих пептидів як у кровоносному руслі, так і в головному мозку та шлунково-кишковому тракті сьогодні остаточно не з’ясована.
Енкефаліни метаболізовані головно двома пептидазами: енкефаліназою А, яка розщеплює Gly-Phe-зв’язок, і енкефаліназою В, яка розщеплює Gly-Gly-зв’язок. У метаболізмі енкефалінів теж бере участь амінопептидаза, яка розщеплює Tyr-Gly-зв’язок.
Опіоїдні рецептори вивчені детально. Ідентифіковано μ-, к- та δ-рецептори, які відрізняються за фармакологічними властивостями, розміщенням у головному мозку та інших органах, а також афінністю до різних опіоїдних пептидів. Усі три є серпентиновими рецепторами, що зв’язані з Gq-білками, і всі вони гальмують активність аденілатциклази. Ймовірно, є підтипи μ,- та к-рецепторів. Активування μ-рецепторів зумовлює підвищення провідності К+ шляхом гіперполяризації центральних і первинних аферентних нейронів. Активування к- та 5-рецепторів зумовлює закривання Са2+-каналів.
Нещодавнє дослідження природних лігандів μ рецептора - рецептора, на який діє морфін, дали змогу виявити ще два опіоїдні пептиди: ендоморфін 1 (Tyr-Pro-Trp-Phe-NH2) І ендоморфін 2 (Tyr-Pro-Phe-Phe-NH2). Молекула- попередник цих двох μ-агоністів ще невідома. Афінність природних опіоїдних пептидів до К-, μ- та δ-рецепторів показана на рис. 4-29. Фізіологічні ефекти, що виникають під час стимулювання рецепторів, значно перекривають один одного, проте головні результати цього стимулювання можна визначити, вони наведені в табл. 4-5.
Інші поліпептиди
У головному мозку виявлено численні інші поліпептиди. В різних відділах нервової системи містяться тропні гормони гіпофіза, і, очевидно, більшість з них (якщо не всі) виконують функції як нейротрансмітерів, так і гормонів. Препросоматостатин є попередником двох поліпептидів: соматостатину 14 (див. рис. 14-19) і соматостатину 28 (рис. 4-30). Вони трапляються в тканинах разом. Соматостатин міститься в різних відділах головного мозку, де, очевидно, виконує функцію нейротрансмітера, впливаючи на надходження чутливих імпульсів, рухову активність і процеси пізнання. В гіпоталамусі він виділяється в портальні гіпофізарні судини і відіграє роль гормону, що інгібує утворення гормону росту (див. Розділ 14). В ендокринній частині підшлункової залози він гальмує секрецію інсуліну й інших панкреатичних гормонів (див. Розділ 19), у шлунково-кишковому тракті теж є важливим гальмівним гормоном (див. Розділ 26). Обидва поліпептиди біологічно активні, проте щодо пригнічення секреції інсуліну соматостатин 28 активніший, ніж соматостатин 14. Родина соматостатинових рецепторів налічує п’ять різних, зв’язаних з G-білком, членів (від SSTR1 до SSTR5). Усі вони пригнічують активність аденілатциклази і впливають на системи внутрішньоклітинних месенджерів. Ймовірно, що SSTR2 опосередковує процеси пізнання і пригнічує секрецію гормону росту, a SSTR5 зумовлює гальмування секреції інсуліну.
Таблиця 4-4. Опіоїдні пептиди та їхні попередники
Попередник |
Опіоїдні пептиди |
Структура |
Проенкефалін |
Мет-енкефалін |
Tyr-Gly-Gly-Phe-Met5 |
(див. Розділ 20) |
Лей-енкефалін |
Tyr-Gly-Gly-Phe-Leu5 |
Октапептид |
Tyr-Gly-Gly-Phe-Met-Arg-Gly-LeU8 |
|
Гептапептид |
Т yr-Gly-Gly-Phe-Met-Arg-Phe7 |
|
Проопіомеланокортин |
ß-Ендорфін |
Див. Розділ 22 |
(див. Розділ 22) |
Інші ендорфіни |
Див. Розділ 22 |
Продинорфін |
Динорфін 1-8 |
Tyr-Gly-Gly-Phe-Leu-Arg-Arg-Ile8 |
Динорфін 1-17 |
Tyr-Gly-Gly-Phe-Leu-Arg-Arg-lle-Arg-Pro-Lys-Leu-Lys-Trp-Asp-Asn-Gln17 |
|
а-Неоендорфін |
Тyr-Gly-Gly-Phe-Leu-Arg-Lys-Tyr-Pro-Lys10 |
|
ß-Неоендорфін |
Тyr-Gly-Gly-Phe-Leu-Arg-Lys-Tyr-Pro9 |
Вазопресин і окситоцин не тільки виділяються в кров, а також містяться в нейронах, аксони яких прямують до стовбура головного мозку і до спинного мозку. В головному мозку є брадикінін, ангіотензин II і ендотелій (див. Розділи 24 та 31), гормони шлунково-кишкового тракту ВІП, ХЦК- 4 та ХЦК-8 (див. Розділ 26), а також два види ХЦК-рецепторів: ХЦК-А та ХЦК-В. ХЦК-8 діє на сайти зв’язування обидвох рецепторів, тоді як ХЦК-4 - лише на сайти ХЦК-В рецепторів (див. Розділи 14 та 26). Гастрин, нейротензин, галанін і гастрин-рилізинг-пептид теж наявні як у шлунково-кишковому тракті, так і в головному мозку. Нейротензинові і ВІП-рецептори клоновані; виявлено, що вони є серпентиновими рецепторами. Гіпоталамус містить гастрин 17 і гастрин 34 (див. Розділ 26). ВІП зумовлює розширення судин і є в вазомоторних нервових волокнах. Функції цих пептидів у нервовій системі не з’ясовані.
Пептид, залежний від гена кальцитоніну (CGRP - від англ. calcitonin gene-related peptide) - це пептид, який у щурів і людини існує в двох формах: CGRPa та CGRPß. У людини, ці дві форми відрізняються лише трьома амінокислотними залишками, і їх кодують різні гени. У щурів і, ймовірно, в людини CGRPß міститься в кишково-шлунковому тракті, а CGRPa - у первинних аферентних нейронах, нейронах, якими імпульси відчуття смаку надходять до таламуса, і нейронах медіального пучка переднього мозку. Він разом з речовиною Р також є в розгалуженнях первинних аферентних нейронів, що закінчуються на кровоносних судинах. CGRP-подібна імунореактивність виявляється в крові, і ін’єкція CGRP зумовлює розширення судин. Пептид CGRPa і кальцитонін - гормон, що зменшує концентрацію кальцію (див. Розділ 21), кодовані геном кальцитоніну. Однак у щитоподібній залозі під час сплайсінґу утворюється мРНК, що кодує кальцитонін, тоді як у головному мозку під час альтернативного сплайсінґу формується мРНК, що кодує CGRPa; CGRP незначно впливає на обмін Са2+, а кальцитонін виявляє лише слабкий судинорозширювальний ефект. Нейропептид Y - це поліпептид, що містить 36 амінокислотних залишків і споріднений з панкреатичним поліпептидом (див. Розділ 19). Він міститься в багатьох відділах головного мозку і в автономній нервовій системі. Поза головним мозком, а також в автономній нервовій системі він переважно є в норадренергічних нейронах, з яких виділяється у відповідь на високочастотне подразнення. Нейропептид Y підсилює судинозвужувальну дію норадреналіну. Кількість нейропептиду Y, що циркулює і походить з симпатичних нервів, збільшується під час важкої фізичної праці. В гіпоталамусі нейропептид Y опосередковує підвищення апетиту і зростання рівня споживання їжі (див. Розділ 14). Клоновано Y1-, Y2-, Y4-, Y5- та Y6-рецептори цього поліпептиду.
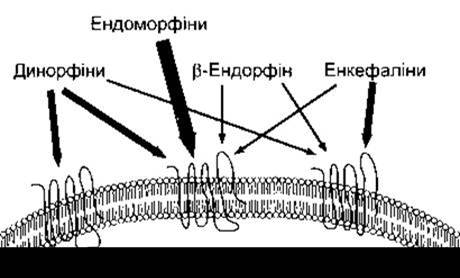
Рис. 4-29. Опіоїдні рецептори. Товщина стрілок, що простягаються від назв лігандів к-, μ- та δ-рецепторів, пропорційна афінності рецептора до кожного з ліґандів (відтворено за дозволом з Julius DJ: Another spark for the masses? Nature 1997; 386:442).
Таблиця 4-5. Фізіологічні ефекти, що виникають у разі стимулювання рецепторів опіоїдних пептидів
Рецептор |
Ефект |
μ |
Знеболювання Місце впливу морфіну Пригнічення дихання Закреп Ейфорія Заспокоєння Збільшення секреції гормона росту і пролактину Мейоз |
к |
Знеболювання Діурез Заспокоєння Мейоз Тривога |
δ |
Знеболювання |
Пуринергічні трансмітери
Зв’язки між АТФ, аденозином і метаболітами аденозину відображено на рис. 4-31. АТФ позаклітинної рідини - це АТФ, що вивільняється разом з норадреналіном, дофаміном, ГАМК, глютаматом, ацетилхоліном і гістаміном з нейронів, у яких ці речовини виробляються. Аденозин є нейромодулятором, що діє як головний депресант ЦНС. Аденозин виявляє також судинорозширювальну дію в серці (див. Розділ 32) і різноманітно впливає по всьому організму. Він діє на чотири рецептори: А1, А2А, А2В та А3, що є серпентиновими і зв’язані з G-білком. Рецептори А2А та А2В підвищують концентрацію цАМФ, а А1 та А3 знижують її. Стимулювальна дія кави і чаю зумовлена блокуванням аденозинових рецепторів кофеїном і теофіліном. Значний інтерес становить можливість застосування антагоністів з метою зменшення надмірного виділення глютамату і, отже, мінімізації наслідків інсультів.
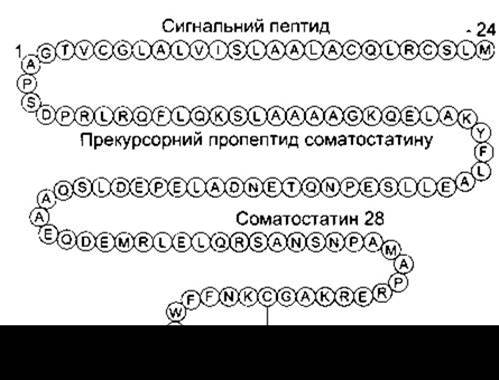
Рис. 4-30. Препросоматостатин людини. Головні залишки, по яких на N-кінці відбувається розщеплення молекули-попередника з утворенням соматостатину 14 і соматостатину 28, виділені кольором. Амінокислотні залишки позначені однією буквою (відтворено за дозволом з Reisine Т, BellGI: Molecular biology of somatostatin receptors. Endocr Rev 1995; 16:427).
АТФ теж має властивості трансмітера, і його дія на рецептори виявляється у всьому організмі. Вірогідно, що не зв’язані зі структурами нуклеотидази виділяються разом з АТФ, і завдяки цьому прискорюється усунення АТФ після виконання ним його функції. Вивчено чотири пуринергічні рецептори, що зв’язують АТФ: P2Y та P2U, які через G-білки активують фосфоліпазу, і Р2Х та P2Z, які є ліґандо-залежними йонними каналами. Ідентифіковано три підтипи Р2Х-рецептора: Р2Х1, Р2Х2 та Р2Х3. Рецептори P2X1 та Р2Х2 МІСТЯТЬСЯ В задніх рогах спинного мозку, а Р2Х3 - у спинномозкових вузлах і трійчастому вузлі, що свідчить про значення АТФ у проходженні імпульсів чутливими шляхами. Окрім того, є Р2Т-рецептор; це вірогідно, йонний канал, активований АДФ. Як засвідчили останні дослідження, АТФ опосередковує швидкі синаптичні реакції в автономній нервовій системі і повідцях. Пуринергічні рецептори виявлені також у клітинах глії.
Канабіноїди
Клоновано два рецептори, афінні до ∆9-тетрагідроканабінолу (ТГК) - психогенного інгредієнта маріхуани. Рецептор CB1 зумовлює опосередковане G-білком зниження внутрішньоклітинного рівня цАМФ. Він поширений у центральних нейронах шляхів проведення відчуття болю, а також у частині мозочка, у морському конику (гіпокампі) і корі великого мозку. Ендогенним лігандом цього рецептора є анандамід - похідний арахідонової кислоти (рис. 4-32). Ця сполука, як і маріхуана, спричинює ейфорію, заспокоєння, сонливість, дрімоту і знеболення. Рецептори СВ1 містяться також у периферійних тканинах, і блокування їх призводить до зменшення судинорозширювального впливу анандаміду. Втім, очевидно, цей судинорозширювальний ефект є непрямим. Клоновано теж СВ2-рецептор, і його ендогенним лігандом, вірогідно, є пальмітоїл-етаноламід (ПЕА). Фізіологічна роль цієї сполуки, однак, не з’ясована.
Інші вірогідні трансмітери
Оксид азоту (NO) - це сполука, яку виділяє ендотелій кровоносних судин, вона є фактором релаксації ендотелію. Він утворюється також у головному мозку. Синтез NО з аргініну - реакція, яку каталізує одна з трьох форм NО-синтази, - описаний у Розділі 31 (див. рис. 31-1). Оксид азоту активує гуанілатциклазу (див. Розділ 1) і, на відміну від інших трансмітерів, є газом, тому легко проникає крізь клітинну мембрану і безпосередньо зв’язується з гунілат-циклазою. Це може бути сигналом, за допомогою якого постсинаптичні нейрони налагоджують зв’язок з пресинаптичними закінченнями у разі довготривалих потенціації і депресії (див. нижче). Синтаза NО є НАДФН-залежним ензимом. Тепер відомо, що НАДФН-діафораза, гістохімічне забарвлення якої використовують уже багато років, - це власне NO-синтаза. Отже, NO-синтазу можна легко виявити гістохімічними методами в головному мозку та інших тканинах.
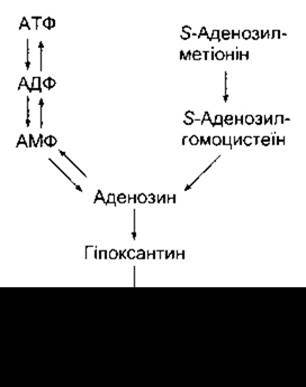
Рис. 4-31. Зв’язок між АТФ та аденозином і метаболізм аденозину до сечової кислоти.
Оксид вуглецю (СО) - це ще один газ, який є вірогідним трансмітером у головному мозку. Він утворюється в процесі метаболізму гему (див. Розділ 27) за допомогою одного з підтипів гемоксигенази (ГО), позначеного на рис. 4-33 як ГО2. Оксид вуглецю, як і NО, активує гуанілілциклазу.
Простагландини - це похідні арахідонової кислоти (див. Розділ 17), що є в нервовій системі. Вони містяться у фракції нервових закінчень гомогенатів головного мозку і виділяються з нервової тканини in vitro. Ймовірний транспортер простагландинів має 12 фіксованих у мембрані доменів. Однак простагландини виконують свою дію, швидше за все, шляхом модуляції реакцій, опосередкованих цАМФ, а не як синаптичні трансмітери.
Багато стероїдів нейроактивні, тобто впливають на функції головного мозку, хоч і не є нейротрансмітерами в загальноприйнятому розумінні. Стероїди, що циркулюють, легко проникають до головного мозку, де в нейронах містяться численні рецептори до статевих стероїдів і глюкокортикоїдів. Окрім відомої дії шляхом зв’язування з ДНК (геномний ефект), деякі стероїди, вірогідно, швидко впливають, діючи безпосередньо на клітинні мембрани (негеномний ефект). Роль стероїдів у нейрокринному регулюванні висвітлена в Розділі 14. Вплив стероїдів на ГАМК - рецептори описаний вище.
Щораз більше даних свідчать про те, що в головному мозку можуть вироблятися окремі гормонально активні стероїди. Вони утворюються з простіших стероїдних попередників, і їх називають нейростерощами. Прогестерон сприяє утворенню мієліну (див. Розділ 2). Роль більшості стероїдів у процесах регулювання функцій головного мозку, проте, до кінця не з’ясована.
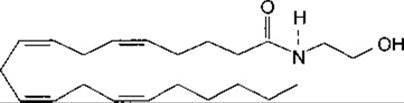
Рис. 4-32. Анандамід.
Котрансмітери
Сьогодні наведено багато прикладів того, що нейрони містять і продукують два або навіть три трансмітери. Котрансмітерами в такому випадку часто є катехоламін або серотонін плюс поліпептид, або ж поліпептид і ГАМК, або ацетилхолін. Трапляється також суміщення двох поліпептидів або ГАМК з різними катехоламінами або ацетилхоліном. У деяких нейронах стовбура головного мозку є серотонін, речовина Р та ТРГ. Багато холінергічних нейронів містять ВІП, багато норадренергічних і адренергічних нейронів - АТФ і нейропептид Y. Нейрони, що містять декілька трансмітерів, часто розташовані поряд з нейронами, що містять один трансмітер. Уважають, що низькочастотні імпульси в нейронах зумовлюють виділення низькомолекулярних трансмітерів, тоді як високочастотні - також і поліпептидних котрансмітерів. Проте це ще остаточно не доведено, і фізіологічне значення котрансмітерів не з’ясоване. Відомо, однак, що ВІП, який виробляється разом з ацетилхоліном, підсилює його постсинаптичну дію, а нейропептид Y підсилює дію норадреналіну.