Фізіологія людини - Вільям Ф. Ґанонґ 2002
Вступ
Загальні засади та клітинні основи фізіології людини
Загальні засади
Будова організму
Клітини, з яких складаються всі організми, за винятком найпростіших багатоклвтинних водних і сухопутних тварин, омиває позаклітинна рідина (ПКР), обмежена зовнішніми покривами. З цієї рідини клітини отримують О2 і харчові речовини, сюди ж вони виділяють метаболічні шлакові продукти. ПКР більше розведена, ніж теперішня морська вода, проте її склад подібний до первісного океану, з якого, за припущеннями, виникло життя.
У тварин із замкненою системою кровообігу ПКР поділяють на два типи інтеретиційну рідину і внутрішньо-судинну плазму крові. Плазма і клітинні елементи крові, головно червоні кров’яні тільця, наповнюють судинну систему і разом становлять загальний об’єм крові. Інтеретиційна рідина перебуває поза межами судинного русла й омиває клітини. Спеціальні рідини, що змішані разом як міжклітинні, описані нижче. Об’єм ПКР становить третину від загальної води організму (ЗВО), решта внутрішньоклітинна рідина (ВКР).
Устрій організму людини
У пересічного молодого дорослого чоловіка 18% маси тіла становлять білки та споріднені речовини, 7% мінеральні речовини і 15% - жири. Решта 60% - це вода. Водні простори організму показані на рис. 1-1.
Внутрішньоклітинна рідина в організмі становить приблизно 40% від маси тіла, а позаклітинна - 20%. Майже 25% ПКР міститься в системі судин (плазма становить 5% від маси тіла) і 75% - у позасудинному руслі (інтеретиційна рідина становить 15% від маси тіла). Загальний об’єм крові - близько 8% від маси тіла.
Вимірювання об’ємів водних середовищ організму
Об’єм кожного типу рідини в організмі людини можна визначити тільки теоретично. У разі введення речовини, яка залишатиметься тільки в одному середовищі, обчислюють об’єм речовини, у якому тестована речовина поширилась (об’єм поширення введеної речовини). Цей об’єм дорівнює кількості введеної речовини (мінус кількість будь-якої речовини, що виділяється і організму під час метаболізму або піддається екскреції в разі змішування), розділеній на концентрацію цієї речовини в зразку. Наприклад: уведено 150 мг сахарози особі з масою 70 кг. Рівень сахарози в плазмі - 0,01 мг/мл. Відомо, що 10 мг може екскретуватись або піддатись метаболізму під час змішування. Об’єм поширення сахарози
![]()
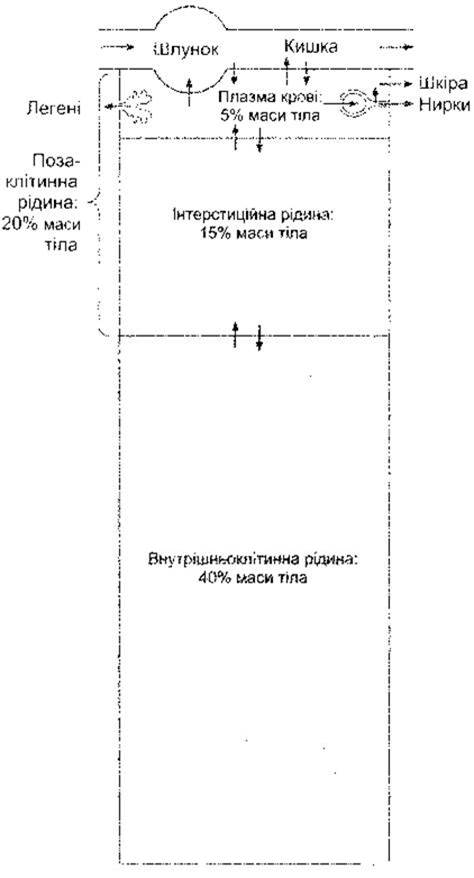
Рис. 1-1. Водні середовища організму. Стрілками зображено напрям руху рідини. Міжклітинні рідини, що становлять дуже незначний відсоток серед усіх рідин тіла, не зображено
Оскільки 14 000 мг с простором розповсюдження сахарози, то його ще також називають сахарозним простором.
Об’єм поширення можна обчислити для будь-якої речовини, яку вводять у тіло, за умови, що є змога точно визначити її концентрацію в рідині тіла і кількість, виведену внаслідок екскреції та метаболізму.
Незважаючи на те, що принцип, покладений в основу такого вимірювання, простий, потрібно врахувати низку чинників, які можуть призвести до ускладнень. Речовина, яку вводять, повинна бути нетоксичною, рівномірно змішуватися в об’ємі, що його вимірюють, а також самостійно не впливати на поширення води чи інших речовин у тілі. Окрім того, вона не повинна змінюватися під час змішування або ж кількість речовини, що змінилася, повинна бути відомою. І неодмінно речовина повинна порівняно легко піддаватися вимірюванню.
Об’єм плазми, загальний об’єм крові та об’єм еритроцитів
Об’єм плазми вимірюють з використанням барвників, які зв’язуються з білком плазми, зокрема Еванса синього (Т-1824). Його також можна виміряти шляхом уведення альбуміну, значеного радіоактивним йодом. Відповідні порції введеного розчину та зразків плазми, отримані після ін’єкції, досліджують за допомогою сцинтиляційного лічильника. Середнє значення об'єму плазми - 3500 мл (5% від маси тіла людини, яка має 70 кг).
Якщо відомий об’єм плазми, а також гематокрит (тобто відсоток від об’єму зразка крові, зайнятий клітинами), то загальний об’єм крові можна обчислити за такою формулою:
![]()
Приклад. Гематокрит становить 38, а об'єм плазми - 3500 мл. Тоді загальний об’єм крові
![]()
Об’єм еритроцитів (об’єм усіх еритроцитів, що циркулюють в організмі людини) визначають, віднімаючи об’єм плазми від загального об’єму крові. Його можна також визначити, увівши значені червоні кров’яні тільця і після змішування обчисливши частку значених еритроцитів.
Загальноприйнятою позначкою є 51Сr, радіоактивний ізотоп хрому, який приєднується до червоних кров’яних тілець, і який визначають у конкретному об’ємі крові. Практикують використання ізотопів заліза і фосфору (59Fei 32Р), а також антигенні позначки.
Об’єм позаклітинної рідини
Об’єм позаклітинної рідини важко виміряти тому, що межі цього простору погано визначені, а речовин, які швидко змішуються в цьому просторі і залишаються позаклітинними, є небагато. Лімфу не можна відокремити від позаклітинної рідини, тому їх вимірюють разом. Багато речовин надходять у спинномозкову рідину (СМР) повільно внаслідок наявності гематоенцефалічного бар’єра (див. Розділ 32). Зрівноважування концентрацій речовин у суглобній рідині, водянистій рідині та позаклітинній рідині у безсудинних тканинах, таких як щільна сполучна тканина, хрящова, та в деяких частинах кістки відбувається поволі Речовини, що поширюються в позаклітинній рідині, можна виявити в секретах залоз, а також у вмісті шлунково-кишкового тракту. Оскільки ці рідини відокремлені від решти позаклітинної рідини, то їх, як і СМР, рідини ока та деякі інші, називають міжклітинними рідинами. їхній об’єм порівняно незначний.
Найточніше об’єм ПКР можна виміряти за допомогою інуліну, полісахариду з молекулярною масою 5200. Для вимірювання об’єму ПКР також застосовують манітол та сахарозу. Загальноприйнятий об’єм ПКР становить 20% від маси тіла, або 14 л у людини масою 70 кг (3,5 л - плазма; 10,5 л - інтерстиційна рідина).
Об’єм інтерстиційної рідини
Простір, який займає інтерстиційна рідина, не можна виміряти безпосередньо, оскільки цю рідину важко отримати, а речовини, що зрівноважуються в ній, також зрівноважуються в плазмі. Об’єм інтерстиційної рідини обчислюють, віднімаючи об’єм плазми від об’єму ПКР. Індекс співвідношення об’єму ПКР до об’єму внутрішньоклітинної рідини у немовлят та дітей більший, ніж у дорослих. Однак зрозуміло, що загальний об’єм ПКР у дітей менший, тому в них збезводнення розвивається набагато швидше і часто має гостріші форми, ніж у дорослих.
Об’єм внутрішньоклітинної рідини
Об’єм внутрішньоклітинної рідини також не можна виміряти безпосередньо. Його обчислюють відніманням об’єму ПКР від ЗВО. ЗВО вимірюють за допомогою того самого принципу розчинення, який використовують для визначення інших обмежених просторів тіла. Найчастіше для цього використовують дейтерій оксид (D2О - важка вода). За властивостями D2О мало чим відрізняється від Н2О, проте в експериментах з вимірювання об’ємів води організму дає точніші результати завдяки принципу зрівноважування концентрацій речовин. З цією метою також використовують тритій оксид та амінопурин. Вміст води в пісній* масі тіла є сталим і становить 71-72 мл на 100 г тканини, оскільки ж жир практично не містить води, то співвідношення ЗВО до маси тіла змінюється пропорційно до вмісту в ньому жиру. ЗВО є дещо нижчим у жінок, ніж у чоловіків і в обидвох статей ці показники зменшуються з віком (табл. 1-1).
Одиниці вимірювання концентрації розчинених речовин
Кількість молекул, електричних зарядів чи частинок речовини на одиницю об’єму певної рідини тіла під час аналізування впливу різних фізіологічно важливих речовин та взаємодії між ними є часто важливішими, ніж просто маса речовини на одиницю об’єму. З огляду на це концентрацію часто виражають у молях, еквівалентах чи осмолях.
Моль
Моль відображає грам-молекулярну масу речовини, тобто молекулярну масу речовини в грамах. В одному молі міститься приблизно 6x1023 молекул. Мілімоль (ммоль) становить 1/1000 моля, а мікромоль - 1/1 000 000 моля. Отже, 1 моль NaCl має масу 23 + 35,5 = 58,5 г, а 1 ммоль - 58,5 мг. Моль є стандартизованою одиницею вимірювання кількості речовин у системі Сl (див. Додаток).
* Пісна маса тіла - маса тіла без жирової тканини.
Таблиця 1-1. Об’єм загальної води організму людини (у відсотках до маси тіла) залежно від віку і статі
Вік |
Чоловіки |
Жінки |
10-18 |
59% |
57% |
18-40 |
61% |
51% |
40-60 |
55% |
47% |
Понад 60 |
52% |
46% |
Молекулярна маса речовини - це відношення маси молекули речовини до маси 1/12 атома карбону 12. Оскільки молекулярна маса є відношенням, то вона безрозмірна. Одиницю маси, що дорівнює 1/12 маси атома карбону 12, називають дальтон** (Да); а 1000 Да = 1 кілодальтон (кДа). Кілодальтон, який часто позначають літерою К, є зручною одиницею вимірювання маси білків. Наприклад, можна говорити про 64 К білка, чи стверджувати, що молекулярна маса білка становить 64 000 Да. Оскільки ж молекулярна маса - це співвідношення, і вона безрозмірна, то твердження про те, що молекулярна маса білка становить 64 кДа, є неправильним.
Еквіваленти
Поняття електричної еквівалентності важливе для фізіології з огляду на те, що багато важливих розчинених речовин у тілі людини перебувають у вигляді заряджених частинок. Один еквівалент (екв.) - це 1 моль йонізованої речовини, поділений на її валентність. Один моль NaCl дисоціює на 1 екв. Na+ та 1 екв. Сl. Один еквівалент Na+ = 23 г/моль = 23 г; а 1 екв. Са2+ = 40 г/2 = 20 г. Міліеквівалент (мекв.) дорівнює 1/1000 одного еквівалента.
Електрична еквівалентність не завжди те саме, що хімічна. Моль-еквівалент є масою речовини, що хімічно еквівалентна до 8000 г кисню. Молярна концентрація еквівалента (нормальність (н.)) у розчині - це кількість моль- еквівалентів в 1 л; 1 н. розчин соляної кислоти містить 1+35,5 г/л = 36,5 г/л.
рН
Підтримання сталої концентрації йонів водню у водних середовищах людини є життєво важливим. Уважають, що pH розчину - це негативний логарифм [Н+]. Наприклад, pH води при 25°С, у якій однакова кількість йонів Н+ та ОН , становить 7,0 (рис. 1-2). Для кожної зміни показника pH на одиницю, що менша ніж 7,0, [Н+] удесятеро збільшується; для кожного показника pH, що збільшується від 7,0, [Н+] удесятеро зменшується.
** В Україні цю одиницю називають атомною одиницею маси (а.о.м.).

Рис. 1-2. Значення pH (відтворено за дозволом з Alberts В et al: Molecular Biology of the Cell. Garland, 1983).
Буфери
Внутрішньоклітинний та позаклітинний pH, як звичайно, є сталими. Наприклад, pH ПКР становить 7,40 і в здорової людини цей показник, здебільшого, не відхиляється більше ніж на ±0,05 pH В організмі pH стабілізує буферна ємність рідин. Буфер - це система організму людини, що має здатність зв’язувати чи вивільнювати Н+ у розчині, тобто підтримувати pH розчину порівняно сталим, незважаючи на значне збільшення концентрації кислоти чи лугу. Одним з таких буферів є система, що утворюється з карбонатної кислоти, яка тільки частково дисоціює на Н+ та гідрої енкарбонат: Н2СО3 ⇄ Н+ ±НСО2 . Якщо додавати Н+ до розчину карбонатної кислоти, то рівноваїа зміщуватиметься ліворуч і більшість Н+ буде виведена з розчину. У разі додавання ОН йони Н+ та ОН+ сполучаються, унаслідок чого концентрація Н+ зменшується. Однак процес зменшення концентрації Н зводить до мінімуму подальша дисоціація Н2СО3. Інші буферні системи представлені білками крові та білками в клітинах. Кількісні аспекти процесу буферування, а також механізми регулювання дихальною системою та ниркою, що керують буферами для підтримання стабільної pH ПКР на рівні 7,40, описані в Розділі 39.
Дифузія
Дифузія - це процес, під час якого газ чи речовина, частинки яких рухаються, поширюється, заповнюючи весь доступний простір. Частинки (молекули чи атоми) речовини, розчинені в розчиннику, перебувають у постійному хаотичному русі. Вони з однаковою ймовірністю можуть рухатися всередину або поза межі місця їхньої високої концентрації. Та оскільки в місці високої концентрації таких частинок є більше, то загальна кількість частинок, що рухаються в місця меншої концентрації, збільшується, тобто, виникає потік частинок розчиненої речовини з місць високої концентрації в місця низької концентрації. Час, потрібний для досягнення рівноваги в разі дифузії, пропорційний до квадрата дифузійної відстані. Схильність поширення дифузії з одного місця в інше прямо пропорційна до площі поперечною перерізу об’єму, у якому відбувається дифузія, та градієнта концентрації, чи хімічного градієнта, що є різницею концентрації речовини, яка дифундує, поділеної на щільність середовища (закон дифузії Фіка)
Отже,
![]()
де J - рівень дифузії; D - коефіцієнт дифузії; А - площа; ∆с/∆х - градієні концентрації. Знак мінус означає напрям дифузії. Під час руху молекул від вищої концентрації до нижчої ∆с/∆х є від’ємним і у разі множення на DA дає додатне значення. Проникність середовищ, у яких відбувається дифузія в організмі, різна, однак дифузія є головним чинником, який впливає на розподіл води та розчинених речовин.
Осмос
Якщо речовина розчинена у воді, то концентрація молекул води у цьому розчині менша, ніж у чистій воді, оскільки внаслідок додавання речовини до води утворюється розчин, що має більший об’єм, ніж сама вода. І якщо цей розчин помістити по один бік мембрани, що проникна для води і не проникна для розчиненої речовини, а однаковий об’єм води - по інший, то молекули води дифундуватимуть до розчину, знижуючи градієнт концентрації (рис. 1-3). Процес дифузії молекул розчинника в місця вищої концентрації розчиненої речовини, для якої мембрана непроникна, називають осмосом. Він є важливим у фізіологічних процесах. Схильність молекул розчинника до руху в місця вищої концентрації розчинюваної речовини можна подолати, застосовуючи тиск до концентрованішого розчину. Тиск, потрібний для запобігання руху розчинника, називають осмотичним тиском.
Осмотичний тиск, як і зниження тиску пари, зниження температури замерзання, підвищення температури кипіння, залежить швидше від кількості, ніж від типу частинок у розчині; це суттєва спільна властивість розчинів. В ідеальному розчині осмотичний тиск Р співвідноситься з температурою та об’ємом так само, як і тиск газу:
![]()
де n - кількість частинок; R - газова стала; Т - абсолютна температура; V - об’єм. Очевидно, що в разі сталого значення Т осмотичний тиск пропорційний до кількості частинок у розчині на одиницю об’єму розчину. Тому концентрацію осмотично активних частинок звичайно виражають в осмолях. Один осмоль дорівнює молекулярній масі речовини в грамах, поділеній на кількість частинок, вивільнених кожною молекулою в розчині. Міліосмоль (мосмоль) - це 1/1000 осмоль.
У випадку, коли розчиненою речовиною є неелектроліт, наприклад глюкоза, то осмотичний тиск є функцією кількості наявних молекул глюкози. Якщо ж розчинена речовина йонізується й утворює ідеальний розчин, то кожний йон є осмотично активною частинкою. Наприклад, NaCl дисоціюватиме на йони Na+ та Сl, отже, кожний моль у розчині постачатиме 2 осмолі. Один моль Na2SО4 дисоціюватиме на два Na+ та SО42 , постачаючи 3 осмолі. Проте рідини організму не є ідеальними розчинами і, хоча дисоціація сильних електролітів повна, кількість частинок, що чинять осмотичний тиск, зменшується внаслідок взаємодії між йонами. Отже, власне діюча концентрація (активність) рідин організму швидше, ніж кількість еквівалентів електроліту в розчині, визначає його осмотичну дію. Ось чому, наприклад, на 1 ммоль NaCl в 1 л рідини тіла припадає менше ніж 2 мосмолі осмотично активних частинок. Чим розчин концетрованіший, тим більше відхилення від ідеального. Осмоляльну концентрацію речовини в рідині визначає ступінь зниження температури замерзання за умови, що одномоляльний розчин має температуру замерзання, меншу на 1,86°С. Кількість мосмолів на літр розчину дорівнює зниженню температури замерзання розчину, поділеної на 0,00186. Осмолярність - це кількість осмолів на літр розчину - наприклад плазми, а осмоляльність - це кількість осмолів на кілограм розчинника. Тому на осмолярність впливає об’єм розчинених речовин та температура, тоді як на осмоляльність ці чинники не впливають. Осмотично активні речовини в організмі розчиняються у воді, а густина води дорівнює одиниці, отже, осмоляльні концентрації можна виразити в осмолях на літр (осмоль/л) води. Ми більше розглядатимемо осмоляльні (а не осмолярні) концентрації, і осмоляльність виражатимемо в мілюсмолях на літр (води).
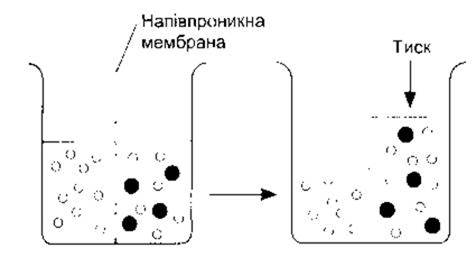
Рис. 1-3. Схематичне зображення осмосу Молекули води показано у вигляді маленьких білих кілець, а молекули розчиненої речовини - у формі великих чорних кругів. На схемі ліворуч воду розміщують з одного боку мембрани, проникної для води і непроникної для розчиненої речовини, а з іншого боку поміщають однаковий об’єм розчиненої речовини. Молекули води рухаються в напрямі зниження їхнього концентраційного ґрадієнта до розчину і, як зображено на схемі праворуч, об’єм розчину збільшується Стрілкою праворуч вказано, що осмотичний тиск - це тиск, який необхідно докласти, щоб запобігти рухові молекул води
Незважаючи на те, що гомогенний розчин містить осмотично активні частинки і, можна сказати, мас осмотичний тиск, він може чинити його лише в разі контакту з іншим розчином, відділеним мембраною, що є проникною для розчинника і непроникною для розчиненої речовини.
Осмоляльна концентрація плазми: тонічність
Температура замерзання плазми людини дорівнює в середньому -0,54°С, що відповідає осмоляльній концентрації плазми 290 мосмоль/л, а також осмотичному тиску 7,3 атмосфери. Можна передбачати, що рівень осмоляльності буде більшим, оскільки сума всіх катіонних та аніонних еквівалентів у плазмі перевищує 300. Однак цей рівень не настільки високий, тому що плазма не є ідеальним розчином і йонни взаємодії зменшують кількість частинок, що чинять осмотичний тиск. За винятком випадків, коли після рантової зміни складу рівновага не встигла відновитися, усі відділи організму людини, що містять рідину, перебувають в осмотичній рівновазі або в близькому до неї стані.
Термін тонічність використовують для описання осмоляльності розчину щодо плазми. Розчини, що мають таку ж осмоляльність, як і плазма, називають ізотонічними; ті, що мають вищу, - гіпертонічними, а ті що мають нижчу, - гіпотонічними. Всі розчини, які початково ізоосмотичні з плазмою (зокрема, мають такий же осмотичний тиск, чи зниження температури замерзання) були б такими, якби не те, що деякі розчинені речовини дифундують у клітини, а деякі - піддаються метаболізму. Отже, 0,9% розчин NaCl ізотонічний, оскільки в ньому нема руху осмотично активних частинок у клітини і вони не підлягають метаболізму. З іншого боку, 5% розчин глюкози у разі внутрішньовенного введення теж є ізотонічним, однак глюкоза піддається метаболізму, внаслідок чого кінцевий ефект тотожний уведенню гіпотонічного розчину.
Важливим є вплив різноманітних компонентів плазми на її загальну осмоль концентрацію. Майже 20 із 290 мосмоль на кожен літр плазми дає Na та аніони, з якими він сполучається, головно Сl та НСО3. Частка інших катіонів і аніонів порівняно мала. Незважаючи на те, що концентрація білків у плазмі, виражена у грамах на літр, значна, вони, як звичайно, становлять менше 2 мосмоль/л. Причина цього - їхня надзвичайно висока молекулярна маса. Головними неелектролітами плазми є глюкоза та сечовина, які в стійкому стані перебувають у рівновазі з клітинами, їхня частка осмоляльності здебільшого становить по 5 мосмоль/л, однак може значно збільшитися у разі гіперглікемії та уремії.
Загальна осмоляльність плазми важлива для визначення рівня дегідрагації, гіпергідратації та інших водно-електролітних відхилень. Гіперосмоляльність може спричинити кому (гіпсросмолярну кому; див. Розділ 19). Незважаючи на вплив багатьох розчинених речовин на осмотичний гиск і відхилення плазми від ідеального розчину, можна легко обчислити приблизний рівень осмоляльності плазми з похибкою в кілька міліосмоль на літр, використовуючи таку формулу:
![]()
де сталі клінічні одиниці переводять у мілімолі розчиненої речовини на літр; АСК - азот сечовини крові. Ця формула важлива ще й тому, що свідчить про надмірно високу концентрацію інших розчинених речовин. Якщо осмоляльність плазми, яку розглядають (визначена за зниженням температури замерзання), значно перевищує рівень, одержаний за допомогою формули, то це може свідчити про наявність чужорідної речовини, зокрема етанолу чи манітолу (які деколи вводять, щоб осмотично зменшити набряклі клітини), або ж отруйних речовин, таких як етиленгліколь чи метанол (компоненти антифризу).
Регулювання об’єму клітин
На відміну від рослинних клітин, які мають негнучкі стінки, мембрани клітин тварин еластичні. Клітини живих організмів розширюються, якщо вони піддані позаклітинній гіпотонії, і звужуються в разі позаклітинної гіпертонії. Внаслідок розширення клітин відбувається активування каналів клітинної мембрани, що приводить до посилення виходу К, СІ , органічних аніонів та незначної кількості органічних розчинюваних речовин, відомих як органічні осмолітичні речовини.
Вода проходить за цими осмотично активними частинками з клітини, після чого об’єм клітини стає нормальним. Йонні канали та інші мембранні транспортні білки детальніше розглянуто нижче.
Нейонна дифузія
Деякі слабкі кислоти й основи достатньо розчинні в клітинних мембранах, якщо не дисоціювали, тоді як у вигляді йонів вони важко проникають через мембрани. Отже, якщо молекули непродисоційованої речовини дифундують з одного боку мембрани до іншого і потім дисоціюють, то виникає окреслений кінцевий напрям руху непродисоційованої речовини з одного боку мембрани до іншого. Це явище називають нейонною дифузією. Воно простежується в шлунково-кишковому тракті (див. Розділ 25) та нирках (див. Розділ 38).
Ефект Доннана
У випадку, коли з одного боку мембрани міститься йон, що не може дифундувати через мембрану, то розподіл інших йонів, для яких мембрана проникна, є передбачуваним. Наприклад, негативний заряд аніона, що недифундує, сповільнює дифузію катіонів і прискорює дифузію аніонів. Розглянемо такий приклад:
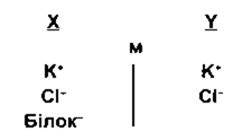
де мембрана (м) між секціями Х та Y непроникна для білка, однак вільно проникна для К+ та Сl-. Припустимо, що концентрація аніонів та катіонів з обох боків початково однакова; Сl дифундує, внаслідок чого зменшується його градієнт концентрації з Y до X, а K+ рухається разом з негативно зарядженим Сl, підтримуючи електронейтральність боку Y, а отже, і стан рівноваги:
![]()
Далі
![]()
тобто на боці X осмотично активних частинок є більше, ніж на боці Y.
Доннан та Ґіббс довели, що за наявності йона, нездатного до дифузії, йони, які дифундують розподіляються так, що в разі рівноваги співвідношення їхніх концентрацій є однаковими:
![]()
Перемноживши члени пропорції, отримаємо рівняння Ґіббса-Доннана:
![]()
Воно правильне для будь-якої пари катіонів та аніонів з однаковою валентністю.
Ефект розподілу йонів Доннана по-різному впливає на процеси, що відбуваються в організмі. По-перше, з огляду на наявність у клітинах білків (Білок) кількість осмотично активних частинок там більша, ніж в інтерстиційній рідині. Оскільки клітини живих організмів мають еластичні стінки, то внаслідок осмосу вони б розбухали чи навіть розривалися, якби Na+ -K+-АТФ-аза не випомповувала з них йонів (див. нижче). Отже, нормальний об’єм клітини та тиск залежать від Na+ -K+ -АТФ-ази. По-друге, внаслідок рівноваги розподіл йонів, що проникають через мембрану (м), асиметричний, а це призводить до електричної різниці з обох боків мембрани, значення якої можна обчислити за рівнянням Нернста (див. нижче). У нашому прикладі бік X стосовно Y буде негативно зарядженим. Зазначимо, що в будь-якій макроскопічній частині розчину кількість позитивних та негативних зарядів однакова. Проте в описуваній ситуації заряди розподіляться вздовж мембрани з градієнтом концентрації для Сl, що точно збалансований з електричним градієнтом протилежного напряму; це також стосується і К+. По-третє, оскільки в плазмі є більше білків, ніж в інтерстиційній рідині, то ефект Доннана виникає під час руху через капілярну стінку (див. нижче).
Сили, що діють на йони
Сили, що діють через мембрану клітин на кожен йон, можна описати математично. У позаклітинній рідині концентрація йонів хлору вища, ніж усередині клітин, тому ці йони, як звичайно, дифундують у клітину за градієнтом концентрації. Сумарний внутрішньоклітинний заряд негативний щодо сумарного зовнішньоклітинного заряду, тому відбувається виштовхування йонів хлору з клітини вздовж електричного градієнта. Рівновага настає тоді, коли приплив та відплив Сl однаковий. Мембранний потенціал, за якого ця рівновага стабільна, називають потенціалом рівноваги. Його значення можна обчислити з рівняння Нернста
![]()
де ЕCl - потенціал рівноваги для Cl ; R - газова стала; Т - абсолютна температура; F - стала Фарадея (кількість кулонів на моль заряду); ZCl - валентність Cl (І); [Сl], - концентрація Сl ззовні клітини; [Сl]B - концентрація СІ всередині клітини.
Після перетворення звичайного логарифма в десятковий і заміни деяких сталих цифровими значеннями отримаємо
![]()
Зазначимо, що в разі спрощення виразу, співвідношення концентрації обернено пропорційне, тому що валентність Cl -І вилучена з виразу.
Потенціал рівноваги ЕСl, обчислений зі значень, наведених у табл. 1 -2, становить -70 мВ, що ідентичне значенню мембранного потенціалу. Отже, щоб пояснити розподіл СІ на різні боки мембрани, потрібно враховувати ті сили, які виражені в хімічних та електричних градієнтах.
Тотожний потенціал рівноваги можна обчислити й для йонів К+:
![]()
де ЕK потенціал рівноваги для K+; ZK - валентність К+ (І); [К+]B - концентрація К+ ззовні клітини; [К+]B - концентрація К+ всередині клітини.
У цьому випадку градієнт концентрації спрямований назовні, а електричний - всередину. У спінальних моторних нейронах ссавців ЕK дорівнює - 90 мВ (див. табл. 1 -2). Оскільки ж мембранний потенціал становить -70 мВ, то в нейронах міститься дещо більше К+, ніж це визначено електричним та хімічним градієнтами.
На відміну від співвідношення концентрацій K+ та Сl , хімічний градієнт Na+ спрямований досередини - у зону його меншої концентрації, як і електричний. Потенціал рівноваги ENa становить +60 мВ (див. табл. 1-2). Оскільки ні ЕK, ні ENa не ототожнюються з мембранним потенціалом, то можна було б очікувати, що клітина поступово набуватиме Na+ і втрачатиме К+ за умови, що на мембрану діяли тільки пасивні електричні та хімічні сили. Однак внутрішньоклітинна концентрація Na+ та K+ є сталою, оскільки відбувається активне транспортування Na+ з клітини в напрямі, протилежному до його електричного та концентраційного градієнтів. Це транспортування поєднане з активним транспортуванням К+ в клітину (див. нижче).
Значення мембранного потенціалу в будь-який момент часу залежить, звичайно, від розподілу K+ та Сl і проникності мембрани для кожного з цих йонів. Рівняння, що досит ь точно описує цю взаємодію, називають рівнянням сталого поля Ґолдмана:
![]()
де Е - мембранний потенціал; R - газова стала; Т - абсолютна температура; F - стала Фарадея; РK+, PNa+ та РCl - проникність мембрани для К+, Na+ та Сl, відповідно. Дужки означають концентрацію, в та з стосуються внутрішнього та зовнішнього простору клітини. Оскільки PNa порівняно з РK+ в клітинах у стані спокою є низьким, то Na+ мало впливає на значення Е.
Як випливає з рівняння Ґолдмана, зміни у зовнішній концентрації Na+ не спричинюють значних змін клітинного потенціалу, тоді як збільшення зовнішньої концентрації K+ приводить до його зменшення.
Таблиця 1-2. Концентрація деяких йонів усередині та ззовні спинномозкових мотонейронів у ссавців
Йон |
Концентрація, ммоль/л Н2O |
Потенціал спокою мембрани, мВ |
|
усередині клітини |
ззовні клітини |
||
Na+ |
15,0 |
150,0 |
+60 |
К+ |
150,0 |
5,5 |
-90 |
Сl- |
9,0 |
125,0 |
-70 |
Описане властиве клітинам різноманітних типів. Наприклад, у клітині скелетного м’яза, мембранний потенціал спокою становить приблизно -90 мВ; ЕCl дорівнює - 86 мВ; ЕK, становить - 100 мВ і ЕNa, - +55 мВ.
Походження мембранного потенціалу
Процес переміщення йонів через клітинну мембрану та природа цієї мембрани дають змогу пояснити виникнення мембранного потенціалу. Як відомо, концентраційний градієнт К+ сприяє рухові К+ з клітини через К+ -канали, натомість електричний градієнт К+ має протилежне (внутрішнє) спрямування. Унаслідок цього настає баланс, за якого схильність К до руху з клітини врівноважена його ж схильністю до руху у клітину. В такому випадку виникає незначний надлишок катіонів ззовні та аніонів усередині. Цей стан підтримує Na+ -K+-АТФ-аза, що перепомповує K+ назад у клітину й утримує внутрішньоклітинну концентрацію Na+ низькою. Дія Na+ -K+ -помпи теж робить внесок у створення мембранного потенціалу, оскільки на кожні гри Na+, випомпованих з клітини, припадає два ІС, упомпованих у неї. Отже, Na+ -K+ -АТФ-аза також незначно впливає на мембранний потенціал. Зазначимо, що йони, відповідальні за мембранний потенціал, становлять дуже незначну частину від загальної кількості йонів, загальна ж концентрація позитивних та негативних йонів однакова всюди, за винятком концентрації тих, які розташовані вздовж мембрани. Надходження Na+ не компенсує відтоку K+, оскільки завдяки К+ - каналам (див. нижче) мембрана є більше перепускною для K+, ніж для Na+.