Фізіологія людини - Вільям Ф. Ґанонґ 2002
Вступ
Загальні засади та клітинні основи фізіології людини
Функціональна морфологія клітини
Застосування методів сучасної клітинної та молекулярної біології привело до низки революційних зрушень у тлумаченнях структури та функціонування клітини, як і у вивченні ембріонального та постембріонального розвитку на клітинному рівні. Хоча постембріональний розвиток, а також деталі біології клітин є поза межами нашого дослідження, базові знання клітинної біології потрібні для розуміння систем органів тіла і того, як вони функціонують. Спеціалізація клітин різних органів надзвичайно різноманітна, жодну клітину не можна назвати типовою для цілого організму. Та все ж деякі спеціалізовані частини (органели) спільні для більшості клітин. Ці частини показано на рис. 1-4. Багато з них можна відокремити ультрацентрифугуванням у поєднанні з іншими технологіями. Після гомогенізації клітин та ультрацентрифугування отриманої суспензії спочатку осідають ядра, а згодом - мітохондрії. Швидкісне центрифугування, що збільшує силу тяжіння в 100 000 разів і більше, спричиняє виділення фракції, яка складається з гранул, відомих як мікросоми, за їхнє осідання. До цієї фракції належать такі органели, як рибосоми та пероксисоми.
Клітинна мембрана
Мембрана, що оточує клітину, є надзвичайною структурою. Вона складається з ліпідів та білків і є напівпроникною, тобто одні речовини вона пропускає через себе, а інші - ні. Щоправда, перепускна здатність мембрани може змінюватися, оскільки в ній містяться численні регульовані йонні канали та інші транспортні білки, що здатні змінювати об’єм речовин, які рухаються через мембрану. Таку мембрану звичайно називають плазматичною мембраною. Ядро клітини оточене мембраною подібного типу, органели також оточені або складаються з неї.
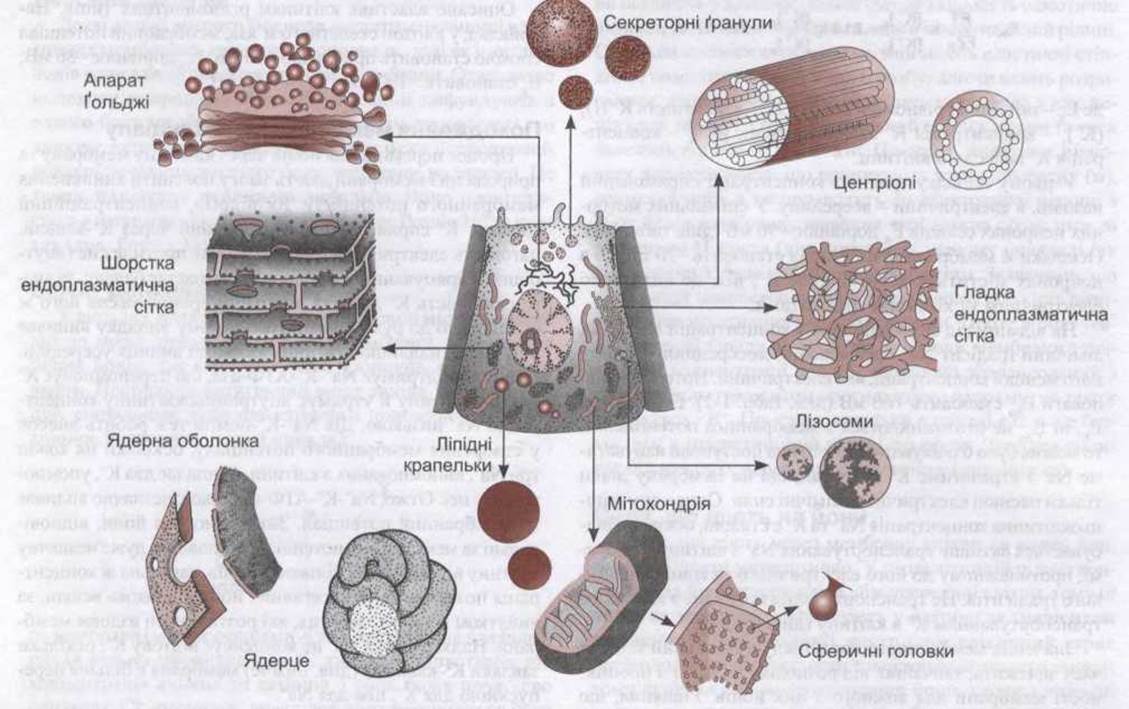
Рис. 1-4. На схемі в центрі зображено гіпотетичну клітину, вигляд через світловий мікроскоп. Навколо неї розташовано різноманітні органели (за Bloom and Fawcett. Відтворено за дозволом з Junqueira LC, Carneiro J, Kelley RO: Basic Histology. 9th ed. McGraw-Hill, 1998).
Незважаючи на те, що хімічний склад та властивості мембран значно залежать від їхнього розташування, можна виділити деякі спільні ознаки. Зокрема, товщина мембрани в середньому становить 7,5 нм (75 одиниць Ангстрема). Складаються біомембрани з білків та ліпідів. Хімія білків та ліпідів описана в Розділі 17. Головними ліпідами є фосфоліпіди, такі як фосфатидилхолін та фосфатидилетаноламін. Фосфоліпідна молекула подібна за формою на прищіпку до білизни (рис. 1-5). Верхній її кінець містить фосфатну ділянку і є порівняно розчинним у воді (полярний, гідрофільний). Хвостові кінці порівняно нерозчинні (неполярні, гідрофобні). Гідрофільні кінці молекул біомембрани перебувають у водному середовищі, яке омиває клітини ззовні і з боку водянистої цитоплазми; гідрофобні кінці сходяться у безводному внутрішньому середовищі мембрани. У прокаріот (клітинах, що не мають ядра, таких як бактерії) мембрани є досить простими, натомість в еукаріот (клітинах, то мають ядро) вони містять різноманітні глікосфінголіпіди, сфінгомієліни га холестерин.
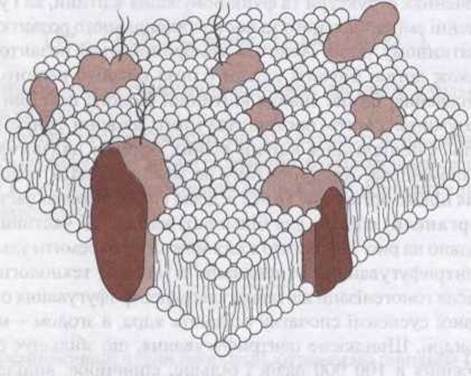
Рис. 1-5. Біологічна мембрана. Кожна фосфоліпідна молекула має два ланцюги жирної кислоти (хвилясті лінії), прикріплені до фосфатної головки (куляста структура). Білки зображено у вигляді затемнених утворів неправильної форми. Багато з них - інтегральні білки, що проходять через мембрану, тоді як периферійні білки прикріплені до внутрішньої (не зображено) та зовнішньої поверхні мембрани, інколи за допомогою глікозилфосфатидилінозитольних (ГФТ) якорів (ліворуч).
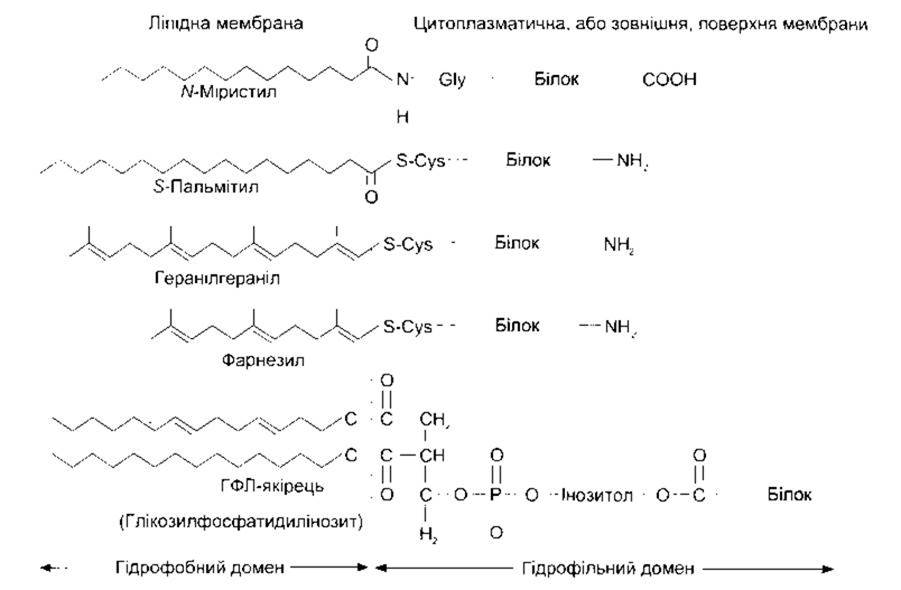
Рис. 1-6. Зчеплення білка з мембранними ліпідами Деякі зчіплюються за допомогою своїх амінокінців, інші - кінцевих карбоксильних груп, а багато - за допомогою глікозильних форм фосфатидилінозиту (ГФЛ-якірців) (відтворено за дозволом з Fuller GM, Shields D Molecular Basis of Medical Cell Biology McGraw Hills, 1998)
До складу мембрани належить багато різних білків. Вони існують як окремі одиниці, багато з них проникають через мембрану (інтегральні білки), інші (периферійні білки) скупчуються з її внутрішнього та зовнішнього боку (див. рис. 1-5). Кількість білків залежить від функції мембрани, однак у середньому вони становлять 50% від маси мембрани; приблизно одна молекула білка припадає на 50 значно менших фосфоліпідних молекул. Білки мембрани виконують багато різних функцій. Деякі з них є молекулами адгезії, що прикріплюють молекули до сусідніх клітин або до базальних мембран. Інші відіграють роль помпи, активно транспортуючи йони через мембрану. Ще інші функціонують як носії, транспортуючи під час дифузії речовини в напрямі зниження електрохімічних градієнтів, або ж є йонними каналами, які в активному стані перепускають йони через мембрану. Роль помп, носіїв та інших каналів у транспортуванні через клітинну мембрану описана нижче.
Білки ще однієї групи діють як рецептори, що зв’язують нейротрансмігери та гормони, спричинюючи фізіологічні зміни всередині клітини. Білки також відіграють роль ензимів, що є каталізаторами реакцій на поверхнях мембрани. Окрім іон), деякі глікопротеїни сприяють дозріванню антитіл і відрізняють клітини господаря від інших як «свої» та «чужі» (див. Розділ 27).
Гідрофобні частини білків, як звичайно, розташовані всередині мембрани, тоді як гідрофільні містяться на поверхнях. Периферійні білки прикріплені до поверхні мембрани різними способами. Один з таких способів - прикріплення глікозильних форм фосфатидилінозиту. Білки, що утримують ці глікозилфосфатидилінозитні (ГФЛ) якірці (рис. 1-6), містять такі ензими, як лужна фосфатаза, різноманітні антигени, низку молекул клітинної адгезії, а також три протеїни, що запобігають лізису клітин за допомогою комплементу (див. Розділ 27). Сьогодні описано понад 40 ГФЛ-зв’язаних білків поверхні клітини. Інші білки ліпідизовані, тобто мають спеціальні прикріплені до них ліпіди (див. рис. 1-6). Вони можуть бути міристильованими, пальмітильованими чи пренильованими, тобто прикріпленими до геранілгеранільних чи форнезильних груп.
Структура білків, особливо ензимів біологічних мембран, різна не лише в різних клітинах, а й навіть у межах однієї. Наприклад, у клітинних та мітохондріальних мембранах містяться різні ензими. У клітинах епітелію ензими клітинної мембрани слизової поверхні відрізняються від ензимів цієї мембрани на бокових поверхнях клітин; тобто клітини поляризовані. Мембрани мають динамічну структуру, і їхні складові постійно відновлюються на різних рівнях. Деякі білки прикріплені до цитоскелета, інші можуть зміщуватися у латеральних напрямах. Наприклад, рецептори рухаються в мембрані і скупчуються в ділянках ендоцитозу (див. нижче). До більшості клітинних мембран прилягає тонкий невизначеної структури шар, у якому містяться фібрили, що у сукупності формують базальну мембрану, або базальну пластину. Базальна мембрана (а якщо узагальнено, то міжклітинний матрикс) складається з багатьох білків, які утримую і ь клітини разом, регулюють їхній розвиток і визначають ріст. До цих білків належать колагени, ламініни (див. нижче), фібронекгин та протеоглікани.
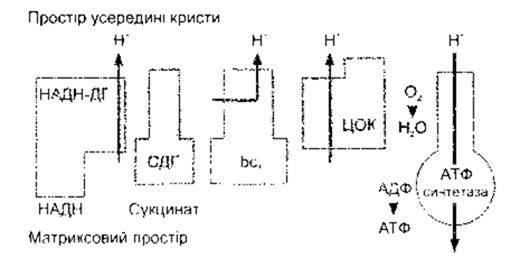
Рис. 1-7. Головні ензими внутрішньої мітохондріальної мембрани, що беруть участь в окисному фосфорилюванні; НАДН- ДГ - НАДН дегідрогеназа; СДГ - сукцинат дегідрогеназа; bс1 - цитохром, ЦОК - цитохром оксидаза (модифіковано з Saraste М* Oxidative phosphorylation at the fin de siede. Science 1999,283 1488)
Мітохондрії
Морфологія мі гохондрій дещо відмінна в різних клітинах, однак, незважаючи на це кожна мітохондрія - це структура витягнутої овальної форми (див. рис. 1-4). Вона складається з зовнішньої та внутрішньої мембран. Внутрішня мембрана має складчасту структуру й утворює кристи. Проміжок між двома мембранами називають простором усередині кристи, а проміжок всередині внутрішньої мембрани - матриксовим простором. Мітохондрії є головним джерелом енергії в клітині. Найчисленніші і найліпше розвинені ці органели в тих частинах клітин, де відбуваються процеси, що супроводжуються затратами енергії. Хімічні процеси в клітинах детально описані у Розділі 17. Зовнішня мембрана кожної мітохондрії вкрита ензимами, що відповідають за біологічне окиснення і забезпечують сировину для хімічних реакцій, що відбуваються всередині мітохондрії. Всередині мітохондрії містяться ензими, які перетворюють продукти метаболізму вуглеводів, білків і жирів у СО2 та воду за допомогою циклу лимонної кислоти. Комплекс ензимів має чотири складники (рис. 1 -7): НАДН дегідрогеназу, сукцинатдегідрогеназу, цитохром bel і цито-хромоксидазу. Під час процесів, каталізованих цими ензимами, відбувається помпування протонів (Н+) з матриксу до простору всередині кристи і формування протонового градієнта. Протони, що дифундують назад за цим градієнтом, рухаються для синтезу аденозинтрифосфату (АТФ) за допомогою АТФ синтетази. АТФ - це енергетично багатий трифосфат, який є головним джерелом енергії для метаболічних процесів не тільки у тварин (див. Розділ 17), а й у бактерій і рослин, які, однак, синтезують його інакше. Поєднання оксидації з формуванням АТФ у мітохондріях називають окисним фосфорилюванням.
АТФ синтетаза це унікальний ензим, утворений кількома субодиницями з основою, яка залучена до внутрішньої мітохондріальної мембрани, шийкою та сферичною головкою, що розміщена в мітохондріальному матриксі. Більша частина шийки й основи фактично обертається під час утворення АТФ.
Майже немає сумніву втому, що колись мітохондрії були автономними мікроорганізмами, які налагодили симбіотичні стосунки і а вкорінилися в спадкові еукаріотичні клітини. Наслідком такого походження є те, що мітохондрії мають власний геном, у якому набагато менше ДНК, ніж у геномі ядра (див. нижче), а 99% білків у мітохондрії є продуктами генів ядра. Однак ДНК мітохондрій відіграє важливу роль у процесі окисного фосфорилювання. Зокрема, мітохондріальна ДНК - це подвійно-ланцюгова спіралеподібна молекула, що містить 16 569 пар основ (порівняйте з понад мільярдом у ДНК ядра). Вона кодує 13 білкових субодиниць, що пов’язані з білками, які кодують гени ядра, щоб утворити чотири ензимні комплекси, а також дві рибосомні РНК та 22 транспортні РНК (див. нижче), необхідні для утворення білків внутрішньомітохондріальними рибосомами.
Мітохондрії потрапляють до зиготи не від сперматозоїда, а з яйцеклітини, тому вони успадковуються винятково по материнській лінії. В мітохондрії нема ефективної системи репарації ДНК, і рівень мутації мітохондріальної ДНК більше ніж у 10 разів перевищує рівень мутації ДНК ядра. З’ясовано також, що значна кількість порівняно рідкісних хвороб спричинені мутаціями в мітохондріальній ДНК. Ці порушення характерні для тканин з високим рівнем метаболізму, унаслідок якого порушується продукування АТФ.
Лізосоми
У цитоплазмі клітини містяться великі, без певної форми структури, оточені мембраною, - лізосоми. Ці структури мають вищу кислотність, ніж решта цитоплазми і можуть містити фрагменти інших компонентів клітини. Лізосомами є також деякі гранули гранулоцитів крові. У кожній лізосомі наявні різноманітні ензими (табл. 1-3), які б призвели до руйнування більшості компонентів клітини, якби не були відокремлені від цитоплазми мембраною лізосоми. Лізосоми виконують функцію травного апарату клітини. Екзогенні речовини, а також бактерії, що їх поглинає клітина, потрапляють в оточені мембраною вакуолі. Вакуолі цього типу (фагоцитарні) можуть зливатися з лізосомами, внаслідок чого вміст вакуолі та лізосоми змішується в межах спільної мембрани. Деякі продукти «травлення» поглинутого матеріалу будуть абсорбовані через стінки вакуолі, а залишки - виведені з клітини (екзоцитоз; див. нижче). Лізосоми також поглинають відпрацьовані компоненти клітини, у яких вони розташовані, утворюючи автофагічні вакуолі. Коли клітина гине, лізосомальні ензими забезпечують автоліз її залишків.
Таблиця 1-3. Ензими, що містяться в лізосомах, та їхні внутрішньоклітинні субстрати
Ензим |
Субстрат |
Рибонуклеаза |
РНК |
Дезоксирибонуклеаза |
ДНК |
Фосфатаза |
Фосфатні ефіри |
Глікозидаза |
Складні вуглеводи, |
глікозиди та полісахариди |
|
Арилсульфатаза |
Сульфатні ефіри |
Колагеназа |
Білки |
Катепсин |
Білки |
Відомо, що у випадку подагри фагоцити поглинають кристали сечової кислоти, а це спричинює позаклітинне вивільнення лізосомних ензимів, які сприяють запальній реакції в суглобах. Якщо лізосомного ензиму бракує від народження, то цитоплазму заповнює матеріал, який за нормальних умов розщеплюють ензими. Це призводить до однієї з лізосомних хвороб накопичення. Наприклад, нестача катепсину К+ спричиняє пікнодисостоз, а нестача глікозиласпарагінази - аспартатглікозамінурію. Таких хвороб описано понад 25. Вони трапляються зрідка, однак супроводжуються такими добре відомими розладами, як хвороба Тей-Сакса.
Пероксисоми
Пероксисоми розміщені в мікросомній фракції клітини. Вони мають 0,5 мкм у діаметрі й оточені мембраною. Ця мембрана містить низку специфічних білків, що відповідають за транспортування речовин у матрикс пероксисоми та навпаки. У матриксі налічують понад 40 ензимів, які у разі взаємодії з ензимами з-поза меж пероксисоми відіграють роль каталізаторів різноманітних анаболічних та катаболічних реакцій. До катаболічних реакцій належить катаболізм довголанцюгових жирних кислот. На пероксисоми треба звернути особливу увагу, оскільки мутація одного з генів, що кодує транспортер пероксисомної мембрани, спричиняє Х-зчеплену адренолейкодистрофію, яка у дитячому віці призводить до смерті. У разі цієї хвороби пошкоджується ß-окиснення довголанцюгових жирних кислот. Автосомна мутація, яка зумовлює ще значніші порушення у транспортуванні через мембрану пероксисоми, призводить до розвитку синдрому Зеллвегера, що спричиняє смерть у ранньому дитинстві.
Кількість пероксисом збільшується завдяки пероксидним проліфераторам, які впливають на проліферативно-активуючі рецептори пероксисом (PPARs - від англ. peroxisome proliferator-activated receptors) у ядрі. Ці рецептори є членами суперродини гормоночутливих факторів ядерної транскрипції, які охоплюють рецептори стероїдних гормонів (див. нижче). Кодування трьох різних ізоформ відбувається за допомогою трьох різних генів, що вже ідентифіковані: PPARoc, PPARy, PPAR5. Препарат троглітазон зв’язується з PPARy і збільшує чутливість клітин до інсуліну (див. Розділ 19). Активація PPARy тaкoж стимулює клітини до диференціації в адипоцити та спричинює інші поширені метаболічні ефекти. Домінантна негативна мутація генів у PPARy збільшує інсулінову резистентність і призводить до цукрового діабету і гіпертензії.
Цитоскелет
Усі клітини мають цитоскелет - систему органел, що не тільки підтримує структуру клітини, а й дає змогу їй змінювати форму та рухатися. Цитоскелет складається з мікротрубочок, проміжних філаментів та мікрофіламентів, а також білків, що утримують та зв’язують їх. Крім того, білки й органели переміщаються вздовж мікротрубочок і мікрофіламентів з однієї частини клітини до іншої, просуваючись уперед завдяки молекулярним двигунам. Мікротрубочки (рис. 1-8, 1-9) - це довгі, порожнисті утвори зі стінками 5 нм завтовшки, що оточують порожнину 15 нм у діаметрі. Вони складаються з двох типів сферичних білкових субодиниць: а- та ß-губуліну. Третя субодиниця - y-тубулін - відіграє роль у створенні з мікрогрубочок центросоми (див. нижче). Субодиниці а та ß утворюють гетеродимери (див. рис. І-8), під час агрегації яких формуються довгі трубочки, що складаються з низки кілець, кожне з яких містить 13 субодиниць. У трубочках також є інші білки, які беруть участь у їхньому формуванні. Процесу самозбирання мікротрубочок сприяє тепло, холод призводить до їхнього розпаду. Кінець, на якому домінує самозбирання, називають плюс-кінцем, а кінець, де переважає дисоціація, - мінус-кінцем. Обидва процеси відбуваються одночасно in vitro.
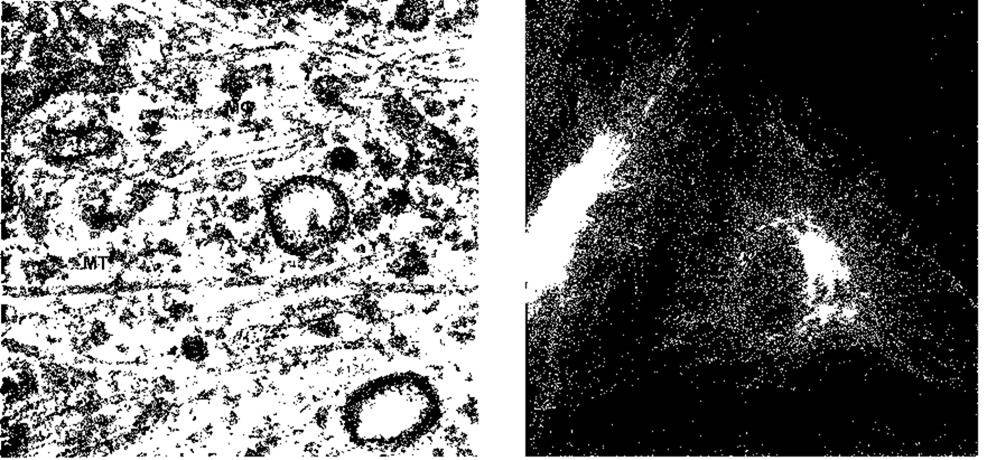
Рис. 1.8. Ліворуч: електронна мікрофотографія цитоплазми фібробласта Видно мікрофіламенти (МФ) та мікротрубочки (МТ) (відтворено за дозволом з Junqueira LC, Carneiro J, Kelley RO: Basic Histology, 9th ed. The McGraw-Hill Companies, Inc. 1998) Праворуч: локалізація мікротрубочок у фібробластах. Клітини оброблені флюоресцентним антитілом до тубуліну, що робить мікротрубочки видимими (відтворено за дозволом з Connolly J et al: Immunofluorescent staining of cytoplasmic and spindle microtubules in mouse fibroblasts with antibody to τ protein Proc Natl Acad Sei USA 1977,74 2437).
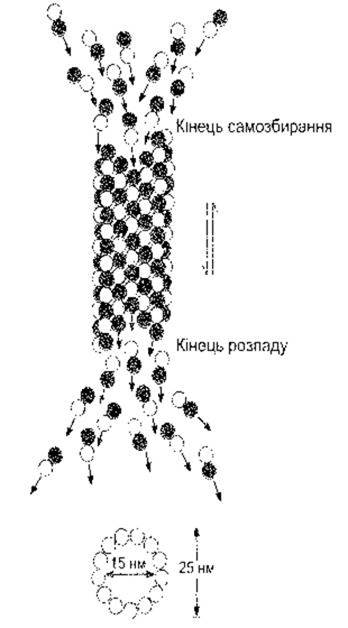
Рис. 1.9. Самозбирання та дисоціація мікротрубочки внаслідок аґреґації та дезаґреґації димерів, що складаються з а- та ß- тубуліну (відтворено за дозволом з Sloboda RD The role of microtubules in cell structure and cell division. Am Sei 1980; 68*290).
Унаслідок постійного самозбирання та дисоціації мікро- трубочки є динамічною частиною цитоскелета. Вони забезпечують транспортування везикул, органел, таких як секреторні гранули та мітохондрії, з однієї частини клітини в іншу, а також утворюють веретено, що рухає хромосоми під час мітозу (див. нижче). Мікротрубочки можуть виконувати транспортування в обох напрямах. Було навіть спостережено, як одна мікротрубочка транспортувала дві структури у протилежних напрямах.
Самозбирання мікротрубочки блокують колхіцин та вінбластин. Протираковий препарат паклітаксел (Таксол), іммобілізуючи мікротрубочки, знерухомлює органели і порушує утворення мітотичних веретен, що призводить до загибелі ракової клітини.
Крім мікротрубочок, клітини також містять проміжні філаменти, що мають 8-14 нм у діаметрі і складаються з різноманітних субодиниць. Деякі з них зв’язують мембрану ядра з мембраною клітини. Ці філаменти утворюють гнучкий каркас клітини і допомагають їй витримати зовнішній тиск. Якщо проміжних філаментів нема, то клітини руйнуються набагато швидше. У людей аномалії проміжних філаментів часто супроводжуються утворенням пухирців на шкірі. Мікрофіламенти (див. рис. 1-8) - це довгі, міцні волокна 4-6 нм у діаметрі. Вони складаються з актину та білка, який під час взаємодії з міозином призводить до скорочення м’яза (див. Розділ 3). Актин, як і його мРНК (див. нижче), наявний у всіх видах клітин. Це найпоширеніший білок у клітинах ссавців, він становить 15% від загальної кількості білків у клітині. Структура актину надзвичайно стабільна; наприклад, 88% амінокислотної послідовності актину дріжджів та кролика є ідентичними. Молекули актину (G-актин) полімеризують in vivo, утворюючи F-актин - довгі ниткоподібні ланцюги, які називають мікрофіламентами. Вони також часто деполімеризують in vivo, причому полімеризація здебільшого відбувається на одному кінці (плюс-кінець, як у мікротрубочках), а деполімеризація - на протилежному (мінус-кінець). Мікрофіламенти прикріплюються до різних частин цитоскелета (рис. 1-10). Багато мікрофіламентів прикріплюються до кінчиків мікроворсинок клітин епітелію слизової оболонки кишки. В значних кількостях вони наявні в ламелоподіях, відростках, які випускають клітини під час руху по поверхнях. Актинові філаменти взаємодіють з рецепторами інтегрину й утворюють фокальні комплекси адгезії (фокальні адгезини, див. нижче), які є місцями для руху на поверхні, де клітина витягується.
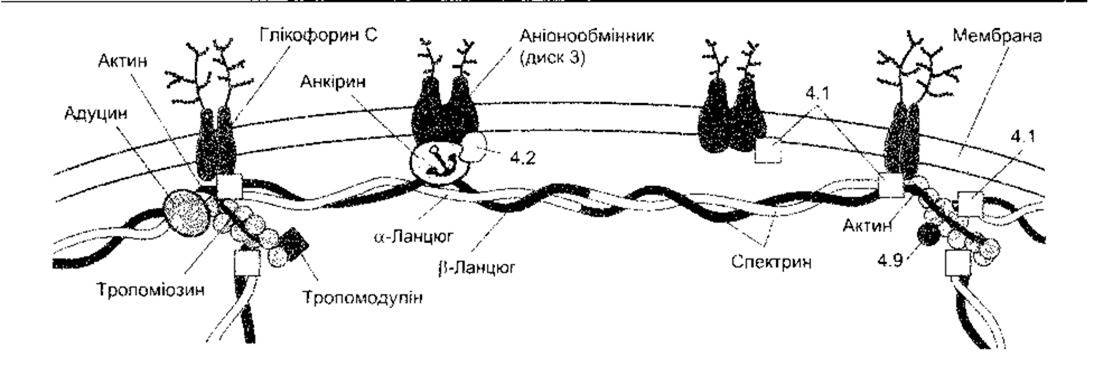
Рис. 1-10. Прикріплення цитоскелета до оболонки еритроцита. Зображено різні білки, що прикріплюють актинові філаменти до мембрани Деякі з них мають номери (4.1, 4.2, 4.9), інші - назви (відтворено за дозволом з Luna EJ, Hitt AL Cytoskeletonplasma membrane interactions. Science 1992,258 955).
Молекулярні двигуни
Молекулярними двигунами, за допомогою яких рухаються білки, органели та інші складові клітини (вантажі) вздовж мікротрубочок і мікрофіламентів до всіх частин клітини, є 100-500 кДа АТФ-ази, що приєднуються до вантажів. Їхні головки формують поперечні містки до волокна і перетворюють АТФ на енергію, що приводить до вигинання цих містків і забезпечує рух молекул АТФ-ази. Типи молекулярних двигунів наведено в табл. 1 -4, а приклади кожного типу показано на рис. 1-11. Сьогодні відомо, що кожен тип є великою надродиною з багатьма формами у тваринному світі.
Звичайна форма кінезину - двоголова молекула (див. рис. 1-9), що рухає частинки та мембрани в напрямі плюс- кінця мікротрубочок. Це відбувається таким способом: одна головка прикріплюється до мікротрубочки і після цього вигинає шийку так, щоб прикріпилася інша головка.
Таблиця 1-4. Молекулярні двигуни

Завдяки цьому відбувається майже безперервний рух. Деякі кінезини пов’язані з мітозом та мейозом, а деякі виконують інші функції, у тім числі забезпечують рух вантажу до мінус-кінця мікротрубочок.
Динеїни мають дві головки, а їхні шийки частково занурені в білковий комплекс (див. рис. 1 -11). Подібну будову має цитоплазматичний динеїн, він рухає частинки та мембрани до мінус-кінця мікротрубочок. Аксонемний динеїн вібрує, він відповідає за рух джгутиків та війок (див. нижче).
Міозини утворюють поперечні містки до актинових філаментів і зміщуються, генеруючи силові імпульси. Це забезпечує переміщення, подібні до рухів, що відбуваються під час скорочення кишкової ворсинки, міграції клітин, скорочень усіх скелетних та інших м’язів людини. Надродину міозину поділяють на 15 класів. Міозин-I і міозин-II зображено на рис. 1-11. Міозин-І зв’язується з актином у клітинних мембранах, тоді як міозин-ІІ (детально описано в Розділі 3) міститься в скелетних м’язах. Усі відомі сьогодні міозини рухаються в напрямі плюс-кінця актинових полімерів, водночас досі не описані міозини, які б рухалися в протилежному напрямі. З актином зв’язуються різноманітні форми міозину. Молекула міозину містить округлі головки з активністю АТФ-ази та хвостики різної довжини (див. рис. 1-10). Молекули міозину-І мають одну головку. Разом з актином міозин-І часто взаємодіє з клітинними мембранами. Молекули міозину-ІІ мають дві головки і містяться переважно в м’язах, хоча можуть бути і в інших місцях (див. табл. 1-4). Утворення і а рух поперечних містків з молекулами актину, що забезпечує скорочення м’язів, детально описано в Розділі 3.
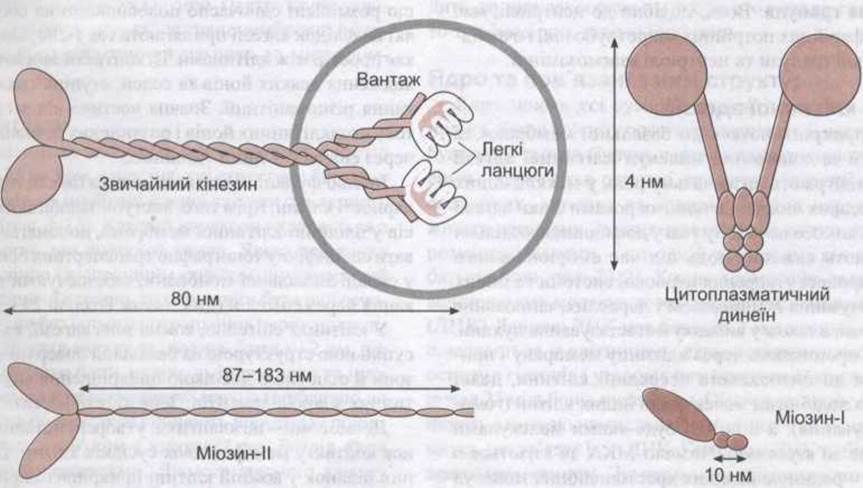
Рис. 1-11. Приклади трьох типів молекулярних двигунів. Звичайна форма кінезу прикріплюється до вантажу (органели, що зв'язана з мембраною). Усі двигуни мають рухомі голівки, які гідролізують АТФ і використовують енергію для вигинання голівок на шийках (відтворено за дозволом з Luna EJ, Hitt AL: Cytoskeleton-plasma membrane interactions. Science 1992;258:955).
Центросоми
Біля ядра у цитоплазмі еукаріотичних тваринних клітин міститься центросома. Вона складається з двох центріоль і оточена аморфним перицентріолярним матеріалом. Центрюлі - це короткі циліндри, розташовані біля ядра під прямим кутом один до одного. У стінках кожної центріолі в поздовжньому напрямі групами по три простягаються мікротрубочки (див. рис. 1-4). Таких потрійних груп налічують дев’ять, і вони розміщені через однакові інтервали.
Центросоми є центрами організації мікротрубочок (ЦОМ), що містять у-губулін. Мікротрубочки самоорганізуються з у-тубуліну в перицентріолярному матеріалі. Під час поділу клітини центросоми розділяються на дві, ці пари розходяться, щоб утворити полюси мітотичного веретена, яке складається з мікротрубочок. У багатоядерних клітинах центросоми розташовані біля кожного ядра.
Війки
Відростки клітини бувають різних видів. Справжні війки - це рухомі відростки, що їх використовують одноклітинні організми для руху у воді, а багатоклітинні - для переміщення слизу та інших речовин по поверхні різноманітних епітеліїв. Вони нагадують центрюлі, оскільки мають у стінці дев’ять пар мікротрубочок. Окрім того, у них є ще пара центральних мікротрубочок, а кожна з дев’яти периферійних структур нараховує не три, а дві мікротрубочки. Кожна війка прикріплена до структури, яку називають базальна гранула. Вона, подібно до центріолі, має дев’ять периферійних потрійних мікротрубочок, і очевидно, що базальні гранули та центріолі взаємозамінні.
Молекули клітинної адгезії
Клітини прикріплюються до базальної мембрани та одна до одної за допомогою молекул клітинної адгезії (МКА), що відіграють визначальну роль у міжклітинних зв’язках, описаних нижче. Останніми роками білки адгезії привертають до себе посилену увагу дослідників, оскільки вони відіграють важливу роль під час ембріонального розвитку, у процесі утворення нервової системи та інших тканин, утримування тканин разом у дорослих, загоювання запалень та ран, а також у випадку метастазування пухлин. Багато з них проникають через клітинну мембрану і прикріплюються до цитоскелета всередині клітини, деякі зв’язуються з подібними молекулами інших клітин (гомофільне зв’язування), а інші - з будь-якими молекулами (гезерофільне зв’язування). Чимало МКА зв’язуються з ламінінами - родиною великих хрестоподібних молекул з численними рецепторними доменами у складі позаклітинного матриксу.
Номенклатура МКА дещо хаотична частково внаслідок швидкого збільшення їхньої кількості, а частково через інтенсивне використання акронімів в інших галузях сучасної біології. Та все ж МКА можна розділити на чотири головні родини: інтрегрини, гетеродимери, що зв’язуються з різними рецепторами; молекули адгезії суперродини IgG - імуноглобулінів, одна частина з яких зв’язується гетерофільно, інша - гомофільно; кадгерини - Са2 -залежні молекули, що сприяють міжклітинній адгезії під час гомофільних реакцій; селектини, що мають подібні до лектинів домени, які зв’язують вуглеводи. Функції МКА у складі гранулоцитів та тромбоцитів описані в Розділі 27, а їхнє значення в загоюванні запалень та ран - у Розділі 33.
МКА не лише прикріплюють клітини до сусідніх клітин, а також передають сигнали з клітини в клітину. Клітини, що гублять контакт з позаклітинним матриксом за посередництвом інтегринів, мають вищий рівень апоптозу (див. нижче), ніж прикріплені, а взаємодія між інтегринами та цигоскелетом забезпечує клітинний рух.
Міжклітинні зв’язки
Між клітинами тканин розрізняють два види з’єднань: з’єднання, за допомогою яких клітини прикріплюються одна до одної та до навколишніх тканин, та з’єднання, що дають змогу переносити йони й інші молекули з однієї клітини до іншої. До з’єднань, за допомогою яких клітини прикріплені одна до одної та які надають тканинам міцності й стабільності, належить щільний контакт, відомий також як зона злипання. Десмосома та зона адгезії (рис. 1-12) утримують клітини разом, а напівдесмосома та фокальна адгезія прикріплюють клітини до базальних мембран. Щільні контакти між епітеліальними клітинами необхідні також для транспортування йонів через епітелій. З’єднання, через яке відбувається перенесення молекул, називають щілинним контактом.
Щільні контакти переважно оточують апікальні краї клітин епітелію, зокрема слизової оболонки кишки, стінок ниркових канальцівта судин. Вони складаються з виступів, що розміщені одночасно половинками на обох клітинах, які внаслідок адгезії прилягають так тісно, що майже зникає простір між клітинами. Ці контакти забезпечують проходження деяких йонів та солей, ступінь такого перепускання різноманітний. Значна частина від загального потоку позаклітинних йонів і розчинених речовин проходить через епітелій у цих з’єднаннях.
Іншою функцією щільних контактів є підтримання полярності клітин. Крім того, виступи запобігають рухові білків у площині клітинної мембрани, допомагають утримувати специфічну топографію транспортних білків і каналів у складі апікальної мембрани, забезпечуючи транспортування через епітелій (див. також Розділи 25 і 38).
У клітинах епітелію, кожна зона адгезії, як звичайно, є суцільною структурою на базальній поверхні замикальної зони й основною ділянкою прикріплення внутрішньоклітинних мікрофіламентів. Зона адгезії містить кадгерини.
Десмосоми - це клаптики, утворені потовщенням ділянок контакту мембран двох сусідніх клітин. До потовщених ділянок у кожній клітині прикріплені проміжні філаменти, деякі розташовані паралельно до мембрани, інші розходяться від неї радіально. Між потовщеннями двох мембран у міжклітинному просторі міститься філаментоподібний матеріал, у якому є кадгерини та інші білки.
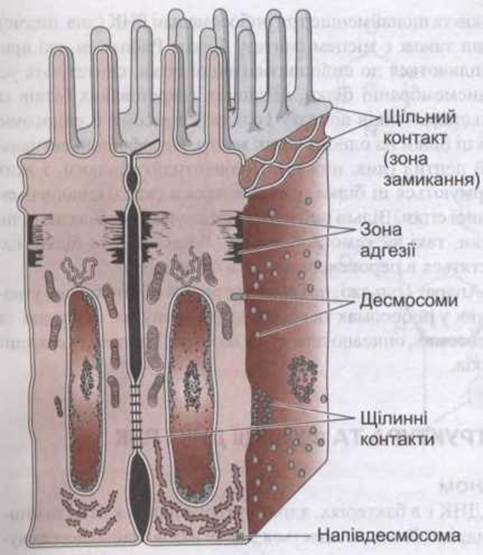
Рис. 1-12. Міжклітинні зв'язки в слизовій оболонці тонкої кишки. Різноманітні типи десмосом не деталізовані.
Напівдесмосоми нагадують половинки десмосом, що прикріплюють клітини до базальної мембрани і з’єднані всередині клітини з проміжними філаментами. Однак вони містять не кадгерини, а інтегрини. Фокальні адгезини також прикріплюють клітини до їхніх базальних пластин. Як описано вище, вони є лабільними структурами, що з’єднані з акгиновими філаментами всередині клітини і відіграють важливу роль під час руху клітини. Ці структури утворюють щільні ділянки у місцях, де трансмембранні інтегрини прив’язують позаклітинний матрикс до мікрофіламентів.
Щілинні контакти
У місцях щілинних контактів міжклітинний простір звужується від 25 до 3 нм, а шестикутні структури білкових груп - конексонів - у мембрані кожної клітини прилягають одна до одної (рис. 1-13). Кожний конексон складається з шести субодиниць, що оточують канал. Якщо цей канал розташувати в лінію з відповідним каналом, що утворений конексоном сусідньої клітини, то можливим буде рух речовин між клітинами без їхнього потрапляння через позаклітинну рідину. Діаметр каналу становить близько 2 нм, що дає змогу перепускати йони, цукри, амінокислоти та інші розчинені речовини з молекулярною масою приблизно до 1000. Отже, щілинні контакти сприяють швидкому поширенню потенціалу з клітини в клітину (див. Розділ 4) та обміну хімічними чинниками. Діаметр кожного каналу регулює внутрішньоклітинний Са2+; підвищення концентрації Са2+ приводить до того, що субодиниці, які утворюють канал, зближаються, зменшуючи діаметр каналу. Діаметр можуть регулювати зміни pH та різниця потенціалів.
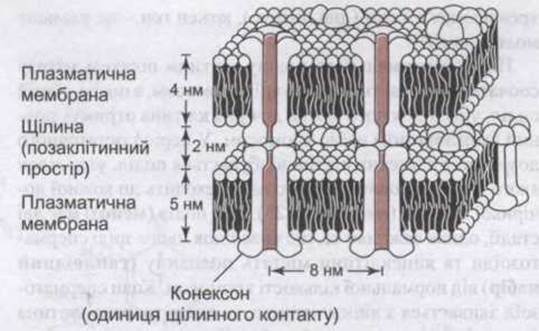
Рис. 1-13. Щілинне з’єднання. Зверніть увагу на те, що кожен конексон складається з шести субодиниць і кожен конексон у мембрані однієї клітини прилягає до конексону в мембрані сусідньої, утворюючи канал, через який речовини можуть потрапляти з однієї клітини в іншу, не потрапляючи до ПКР (відтворено за дозволом з Kandel ER, Schwartz JH, Jessell TM [editors]: Priciples of Neural Science, 4th ed. McGraw-Hill, 2000).
У гризунів ізоформи конексонів кодовані щонайменше 13 різними генами. У людей є щонайменше стільки ж генів різних ізоформ. Відмінності в характерних для тієї чи іншої тканини ізоформах дуже значні. У мишей яйцеклітина з’єднана з клітинами гранульози щільними контактами, тому миші, у яких відсутній один тип конексону, не здатні до овуляції та повного мейозу. З мутацією конексонів пов’язані багато захворювань у людей, зокрема, Х-зчеплена хвороба Шарко-Марі-Тута, периферійна нейропатія, а ще гетеро і актів, що супроводжується численними порушеннями, а також неможливістю відновити нормальну ліво-праву асиметрію. Невідомо, як саме патологія конексонів призводить до цих захворювань; що ж стосується гетеротаксії, то тут, імовірно, задіяні інші гени.
Ядро та пов’язані з ним структури
Ядро мають усі еукаріотичні клітини, що здатні до поділу. Якщо клітину розрізати навпіл, то її частина, де не буде ядра, загине. Значну частину ядра становлять хромосоми - структурні одиниці, що несуть повний набір усіх спадкових, видових та індивідуальних характеристик живого організму. За винятком статевих клітин, хромосоми розміщені парами - по одній хромосомі від кожного з батьків (див. рис. 23-2). Кожна хромосома складається з велетенських молекул дезоксирибонуклеїнової кислоти (ДНК) Ланцюг ДНК має близько 2 м довжини, однак він поміщається в клітинному ядрі, оскільки намотаний на основу з гістонів і утворює нуклеосому. В кожному ядрі є понад 25 мільйонів нуклеосом. Структуру хромосом порівнюють з низкою намистин. Намистини - це нуклеотиди, а нитка, що зв’язує їх, - ДНК. Комплекс ДНК та білків називають хроматином. Під час поділу клітини витки молекули ДНК навколо гістонів послаблюються, очевидно, внаслідок ацетилювання гістонів, і пари хромосом стають видимими, тоді як у період між поділами в ядрі можна розрізнити лише клубки хроматину. Первинними одиницями спадковості в хромосомах є гени (див. нижче), кожен ген - це елемент молекули ДНК.
Під час нормального поділу клітини шляхом мітозу спочатку відбувається дублікація хромосом, а потім - їхній поділ, унаслідок чого кожна дочірня клітина отримує повний (диплоїдний) набір хромосом. У період остаточного дозрівання статевих клітин відбувається поділ, унаслідок якого лише половина хромосом переходить до кожної дочірньої клітини (див. Розділ 23). Цей поділ (мейоз) має дві стадії, однак важливо те, що внаслідок цього зрілі сперматозоїди та яйцеклітини містять половину (гаплоїдний набір) від нормальної кількості хромосом. Коли сперматозоїд зливається з яйцеклітиною, то новоутворена клітина (зигота) відновлює диплоїдний набір хромосом, отримуючи по половині від кожного з батьків. Хромосоми підлягають процесу рекомбінації, внаслідок чого материнські та батьківські гени змішуються.
Ядро більшості клітин містить ядерце (див. рис. 1-4), набір з гранул, багатий на рибонуклеїнову кислоту (РНК). У деяких клітин в ядерці є кілька таких структур. Ядерця найпомітніші та найчисленніші в клітинах, що ростуть. Вони є місцем синтезу рибосом - структур цитоплазми, в яких синтезуються білки (див. нижче).
Усередині ядро має скелет з філаментів, що прикріплені до ядерної мембрани, чи оболонки (див. рис. 1-4), яка оточує ядро. Ця мембрана подвійна, а простір між двома її шарами називають перинуклеарною цистерною. Мембрана перепускає лише йони та малі молекули, однак у ній є комплекси ядерних пор. Кожний комплекс утворений з близько 100 білків, організованих у формі тунелю, через який відбувається транспортування білків і мРНК. Тут зосереджено багато транспортних шляхів; виділено і схарактеризовано білки, які називають імпортери і експортери. Білок Ran відіграє організаційну роль. Більшість сучасних досліджень присвячено детальній інтерпретації питань транспортування у ядро та у протилежному напрямі.
Ендоплазматична сітка
Ендоплазматична сітка - це лабіринт з послідовно з’єднаних трубочок у цитоплазмі клітини (див. рис. 1-4). Стінки трубочок складаються з мембрани. В шорсткій, або гранулярній, ендоплазматичній сітці гранули, відомі як рибосоми, прикріплені до цитоплазматичного боку мембрани. Натомість у гладкій, або ж аґранулярній, ендоплазматичній сітці цих гранул нема. Вільні рибосоми також містяться у цитоплазмі. Гранулярна ендоплазматична сітка забезпечує синтез білків та первинних ділянок поліпептидних ланцюгів з утворенням дисульфідних зв’язків. Агранулярна ендоплазматична сітка є місцем синтезу стероїдів у клітинах секреції стероїдів та місцем детоксифікації в інших клітинах. Як саркоплазматична сітка (див. Розділ 3), вона відіграє важливу роль у скелетних та серцевих м’язах.
Рибосоми
У клітинах еукаріот рибосоми мають від 22 до 32 нм довжини. Кожна рибосома складається з великих та малих субодиниць, які називають, на підставі їхнього осідання в ультраценгрифузі, відповідно, субодиниці 60S та 40S. Рибосоми є складними структурами і містять багато різних білків та щонайменше три рибосомальні РНК (див. нижче). Вони також є місцем синтезу білків. Рибосоми, які прикріплюються до ендоплазматичної сітки, синтезують усі трансмембранні білки, більшість секретованих білків та більшість білків апарату Ґольджі, лізосоми й ендосоми. Всі ці білки на одному кінці мають гідрофобний сигнальний пептид (див. нижче). Поліпептидні ланцюги, з яких формуються ці білки, утворюються в складі ендоплазматичної сітки. Вільні рибосоми синтезують цитоплазматичні білки, такі як гемоглобін (див. Розділ 27), та білки, що містяться в пероксисомах та мітохондріях.
Апарат Ґольджі, що відіграє роль в обміні білків, утворених у рибосомах та секреторних гранулах, везикулах та ендосомах, описано нижче - у контексті синтезу та секреції білків.