БИОТЕХНОЛОГИЯ РАСТЕНИЙ И БИОБЕЗОПАСНОСТЬ - А. П. Ермишин - 2015
ГЛАВА 10. НАПРАВЛЕНИЯ ПРАКТИЧЕСКОГО ИСПОЛЬЗОВАНИЯ ТРАНСГЕННЫХ РАСТЕНИЙ
Сорта трансгенных растений стали уже обычными в сельскохозяйственном производстве большого количества стран на всех континентах. Динамика роста посевных площадей, занятых под ними, показана на рис. 10.1. Очевидно, что имеет место постоянный и весьма существенный ежегодный прирост. Если брать за точку отсчета 1996 г., первый год действительно значимого коммерческого использования ГМО, то речь идет об 1,7 млн га. Уже в 1997 г. эта площадь увеличилась более чем в 6 раз (11 млн га). Быстро расширялся и ассортимент выращиваемых культур. К гербицидоустойчивым сое и кукурузе добавились хлопчатник, рапс, картофель и др. В пределах каждой из названных культур фигурируют формы, толерантные к разным гербицидам, а также устойчивые к насекомым, вирусам, с улучшенными качественными характеристиками. В 2013 г. общая площадь «трансгенного клина» составила внушительную цифру 175,2 млн га, т. е. она увеличилась более чем в 100 раз.
Рис. 10.1. Рост посевных площадей, занятых в мире под трансгенными культурами (http://www.isaaa.org)
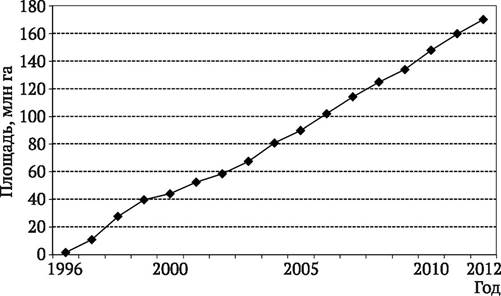
О перспективах выращивания генно-инженерных сортов свидетельствуют цифры, характеризующие их долю в общей площади под конкретной культурой, занятой в мире в 2009 г. Для сои она составляет более 3/4, для хлопчатника и кукурузы - около половины, рапса - 1/5. В отдельных странах доля ГМО по этим культурам еще выше. Так, в США в 2012 г. доля ГМО в производстве кукурузы составила 88 %, сои - 93 %, хлопчатника - 94 %. Практически 100 % выращиваемой в Аргентине сои является трансгенной, а в Бразилии доля трансгенной сои составляла 89 %.
Важно отметить, что прибыль от использования ГМ-культур получают не только компании, которые их разрабатывают и внедряют, но и производители сельскохозяйственной продукции на основе ГМО. В частности, отмечается постоянный устойчивый рост числа фермерских хозяйств, выращивающих трансгенные культуры. В 2006 г. трансгенные культуры выращивали 10,3 млн фермерских хозяйств в 22 странах, в 2009 г. - 14 млн в 25 странах, в 2013 г. - 18 млн в 27 странах. При этом большинство из них, начав выращивать ГМО, не отказываются от этого в последующие годы, поскольку экономические и другие показатели от использования трансгенных сортов их вполне устраивают.
Кроме финансовой прибыли выращивание ГМО несет ощутимые социальные и экологические выгоды. Сокращение обработки полей пестицидами и отказ от вспашки уменьшают интенсивность эксплуатации сельскохозяйственной техники и соответственно расход топлива и выбросы углекислого газа в атмосферу. Только в 2012 г. за счет использования трансгенных культур снижение выбросов в атмосферу углекислого газа составило 24,6 млрд кг, что эквивалентно сокращению числа автомобилей на дорогах на 11,8 млн штук. Благодаря использованию менее вредных для окружающей среды гербицидов снижается химическая загрязненность воды и почвы. Предотвращается эрозия почвы, поскольку использование генетически модифицированных растений, толерантных к гербицидам, позволяет перейти на щадящий беспахотный метод обработки почвы. Это, а также использование сортов с избирательной устойчивостью к насекомым-вредителям в условиях снижения интенсивности применения инсектицидов увеличивает биоразнообразие. На полях, занятых трансгенными сортами, отмечено увеличение численности популяций птиц, полезных насекомых. В силу того, что устойчивые к насекомым-вредителям растения кукурузы меньше поражаются грибными болезнями, меньше страдают от грибных токсинов как производители кукурузы, так и ее потребители. Использование передовых технологий позволяет фермерам снизить трудозатраты, исключить вредные для здоровья технологические процессы. Это выливается не только в возможность получения дополнительной прибыли, но ив увеличение свободного времени, улучшение состояния здоровья.
Рассмотрим основные направления практического использования генетической инженерии растений.
10.1. Трансгенные сорта сельскохозяйственных растений, толерантные к гербицидам
Среди всех трансгенных культур толерантные к гербицидам формы составляют подавляющее большинство. Так, в 2009 г. в мире под ними было занято 83 млн га, или 62 % площади, засеянной генно-инженерными сортами. Зарегистрированы и допущены к использованию гербицидоустойчивые трансгенные линии сои, кукурузы, хлопчатника, рапса, сахарной свеклы, турнепса, льна, люцерны, риса, пшеницы, табака, цикория, полевицы, гвоздики.
Эта ситуация объясняется следующими факторами. Во-первых, толерантность к гербицидам - важный для сельскохозяйственной культуры признак, позволяющий существенно снизить издержки производства за счет более эффективного контроля над сорными растениями. Во-вторых, благодаря относительно простому характеру генетического контроля этого признака, хорошей изученности соответствующих генов получать толерантные к гербицидам ГМО намного проще, чем, скажем, устойчивые к засухе или засолению. И, наконец, не следует забывать, что первые генно-инженерные исследования в основном финансировались крупнейшими транснациональными компаниями, специализирующимися на производстве гербицидов. Естественно, они были заинтересованы, прежде всего, в создании сортов растений, в наибольшей степени подходящих к их продукции.
В генетической инженерии толерантных к гербицидам растений наиболее широкое распространение получили две концепции. Первая предполагает использование трансгенов, которые представляют собой мутацию мишени (фермента, на который действует гербицид), вторая - использование трансгенов, белковые продукты которых способны дезактивировать гербицид.
Механизм толерантности к гербицидам по типу мутации мишени связан с изменением последовательности аминокислот в той области молекулы фермента-мишени, в которой происходит его связывание с гербицидом. В результате гербицид «не узнает» свою мишень, фермент сохраняет свою активность, а организм становится толерантным к действию гербицида.
Типичный пример ГМО с мутацией мишени - трансгенная соя линии GTS 40-3-2, толерантная к гербициду глифосату (RoundUp Ready-соя, или сокращенно RR-соя; RoundUp - коммерческое название препарата глифосата фирмы Monsanto). Ее появление в производстве в 1994 г. произвело настоящую революцию в технологии возделывания культуры. Культурная соя развивается на ранних этапах вегетации весьма медленно, конкурентоспособность взрослых растений также невысока. Это означает, что без применения гербицидов получить приемлемый урожай этой важной сельскохозяйственной культуры практически невозможно.
Гербицид глифосат относится к гербицидам тотального действия. Его мишенью в растении является фермент 5-енолпирувил-шикимат-3-фосфат синтаза (EPSPS), который играет важную роль в синтезе ароматических аминокислот (тирозина, фенилаланина и триптофана). Под действием гербицида у неустойчивых к нему растений наблюдаются симптомы азотного голодания, и они в течение двух недель погибают (рис. 10.2). Глифосат считается гербицидом, относительно безопасносным для здоровья человека и окружающей среды. Его мишень имеется только у растений, грибов и бактерий и отсутствует у животных. Кроме того, глифосат относительно быстро (приблизительно в течение недели) разрушается после попадания на растения или почву.
Рис. 10.2. Трансгенная соя RoundUp Ready, толерантная к гербициду глифосату (показан процесс ручной химической обработки посевов, на снимке справа - посевы через неделю после обработки гербицидом: сорняки в междурядьях и между растениями в рядах полностью уничтожены, а соя продолжает рост) (http://www.omkamra.hu/soya/ и http://www.aei.org/)

У некоторых бактерий обнаружены гены, кодирующие EPSPS и несущие точковую мутацию, вызывающую замену одной аминокислоты в области фермента, в которой происходит его связывание с гербицидом глифосатом. Поэтому гербицид не способен дезактивировать такой мутантный фермент, и бактерия устойчива к его действию. Выделено и клонировано несколько генов EPSPS с мутацией мишени: aro A от бактерий рода Aerobacter; smI от Salmonella; epsps cp4 от Agrobacterium. В подавляющем большинстве выращиваемых в мире трансгенных коммерческих сортов сои встроен последний из названных мутантных генов (т. е. ген epsps от почвенной бактерии Agrobacterium tumefaciens CP4). Он нашел широкое применение и для создания аналогичных сортов других культур.
На основе трансгенной линии GTS 40-3-2, используемой в качестве источника мутантного EPSPS гена, с помощью традиционной селекции выведено более тысячи различных сортов толерантной к глифосату сои, которые выращивают на разных континентах на более чем 70 млн га. Такие сорта сои отличаются от обычных тем, что у них образуется два типа одного и того же фермента EPSPS. Первый - нативный, который может связываться гербицидом, и второй - продукт привнесенного от бактерии гена, который не чувствителен к его действию. Наличие последнего делает эти сорта устойчивыми к действию глифосата, поскольку он сохраняет их жизнеспособность после обработки посевов гербицидом. Тот факт, что бактериальный EPSPS способен выполнять функции растительного аналога, говорит об их значительном сходстве, в том числе и в аспекте безопасности для здоровья человека.
Механизм мутации мишени также использован при создании трансгенных растений, толерантных к сульфонилмочевинным гербицидам (триасульфурону, метилсульфурон метину и др.). Для этого используют мутантные гены als фермента ацетолактасинтазы арабидопсиса, табака, кукурузы, выделенные с помощью технологии клеточной селекции (см. гл. 6). Мутантный gm-hra ген ацетолактасинтазы сои получен с помощью генно-инженерных методов путем направленных замен в сайте связывания с гербицидом кодонов двух аминокислот по аналогии с известной мутацией als гена табака, приводящей к появлению толерантности к гербицидам.
Для получения трансгенной сои, толерантной к гербициду имидозолинону, использован мутантный ген арабидопсиса csrt-2 большой субъединицы фермента ацетогидроксиацидсинтазы. Устойчивость по механизму мутации мишени обусловлена заменой аминокислоты серина на аспарагин в позиции 653.
Второй механизм толерантности к гербицидам связан с выработкой у устойчивых организмов ферментов, способных дезактивировать гербицид, например, путем присоединения к нему какого-либо химического радикала (ацетильной группы, нитрата и т. д.) или его гидролиза на компоненты, не обладающие токсическим действием на растения. Типичный пример использования этого механизма - трансгенные сорта, толерантные к гербициду глюфозинату аммония (фирменные названия препарата - «Liberty», «Basta», «Finale»). Мишенью гербицида в растении служит фермент глутамин синте- таза, который катализирует образование глутамина из глутаминовой кислоты и аммония (благодаря этому происходит связывание избыточного азота в форме аммония путем образования аминокислоты). Ингибирование глутамин синтетазы под действием глюфозината приводит к накоплению в тканях растений токсического аммония, что вызывает их гибель.
Глюфозинат (фосфинотрицин, биалофос) способны продуцировать некоторые природные штаммы Streptomyces. Помимо фитотоксичности он обладает способностью подавлять рост некоторых бактерий, т. е. является антибиотиком. Бактериальные штаммы, устойчивые к глюфозинату, как выяснилось, образуют фермент фосфинотрицин-ацетилтрансферазу (PAT). Дезактивация гербицида происходит в результате его ацетил-CoA ацетилирования с помощью РАТ. В генетической инженерии растений используют два гена, кодирующих этот фермент: ген bar устойчивости к биалофосу (биалофос содержит фосфинотрицин и два остатка L-аланина) от Streptomyces hygroscopicus и ген pat от Streptomyces viridochromogenes.
Механизм дезактивации гербицида использован также при создании трансгенных растений, толерантных к оксиниловым гербицидам (бромок- синилу и иоксинилу). Эти гербициды применяют против двудольных сорных растений, у которых они вызывают ингибирование функции фотосистемы II, что выражается в блокировании электронного потока во время световой реакции фотосинтеза. Инсерция в геном растений гена bxn нитрилазы от Klebsiella pneumonia ssp. ozaenae обеспечивает гидролиз гербицида на нетоксичные для растений компоненты. Бактериальная нитрилаза имеет высокую степень гомологии с нитрилазами, которые вырабатывают многие злаковые растения (кукуруза, пшеница, ячмень и др.), благодаря чему они обладают естественной толерантностью к оксиниловым гербицидам.
В целях получения трансгенных растений, толерантных к гербициду гли- фосату, помимо мутантных генов типа epsps (мутация мишени) используют также модифицированные бактериальные гены, белковые продукты которых обладают способностью к детоксикации этого гербицида. В частности, нашли применение ген gox глифосатоксидазы и ген goxvглифосатоксидоректу- зы от Ochrobactrum antropi, ген gat глифосатацетилтрансферазы от Bacillus licheniformis. Эти гены нередко присутствуют в одной кассете с геном epsps, что обеспечивает максимальный эффект.
10.2. Трансгенные сорта сельскохозяйственных растений, устойчивые к насекомым-вредителям
Повышение эффективности контроля численности насекомых-вредителей сельскохозяйственных культур является одной из важнейших проблем растениеводства. Для этих целей чаще всего используют либо химические, либо биологические пестициды (препараты, полученные на основе микроорганизмов, вырабатывающих токсичные для насекомых вещества). Использование последних предпочтительнее с точки зрения безопасности для здоровья человека и окружающей среды.
Среди биопестицидов широкое распространение получили препараты бактерий Bacillus thuringiensis, которые применяют с 1920-х гг. Накопленный опыт и разнообразие выведенных штаммов послужили основой для создания трансгенных растений, обладающих инсектицидными свойствами, обусловленными вставкой в их геном специфических генов этих бактерий.
Bacillus thuringiensis - аэробные, грамположительные, спорообразующие бактерии. Впервые открыты в 1901 г. японским биологом S. Ishivata при изучении причины гибели шелкопрядов. В 1911 г. E. Berliner в Германии повторно изолировал эти бактерии из мертвых личинок мучной моли и охарактеризовал их как энтомопатогены, вызывающие гибель насекомых. Он назвал их В. thuringiensis по области в Германии (Тюрингии), где они были выделены. В 1915 г. E. Berliner сообщил о наличии у спор В. thuringiensis кристаллов, однако их роль в патогенезе долгое время была не известна. Только в 1950-х гг. (T. Angus, 1953; C. Hannay, P. Fitz-James, 1955) было установлено, что инсектицидная активность В. thuringiensisсвязана прежде всего с характерными для них параспоральными кристаллическими дельта-эндотоксинами, которые получили название «кристаллические протеины» (Cry-протеины, Bt-токсины). Это открытие, а также все более широкое использование в растениеводстве инсектицидных препаратов на основе В. thuringiensis, вызвали значительный интерес к этим бактериям, изучению структуры Bt-токсинов, механизма их действия.
Cry-протеины обладают специфической инсектицидной активностью против Lepidoptera (чешуекрылых), Coleóptera (жесткокрылых), Diptera (двукрылых), а также некоторых других насекомых (перепончатокрылых, равнокрылых, прямокрылых и пухоедов), клещей и нематод. Эти токсины образуются во время формирования спор и имеют размер от 60 до 130 кДа. Отдельная бактериальная клетка может синтезировать приблизительно 10 млн молекул эндотоксинов, которые формируют один или несколько кристаллов. Кроме кристаллических токсинов В. thuringiensis образуют и другие пестицидные белки. Так называемые вегетативные инсектицидные протеины (VIP, открыты в 1996 г.) синтезируются некоторыми штаммами в течение вегетативного роста. Они не формируют параспоральные кристаллы и, очевидно, секретируются из бактериальной клетки. Специфическим инсектицидным действием обладают также цитолитические протеины (Cyt-протеины) В. thuringiensis, которые формируют кристаллические формы, но в отличие от дельта-эндотоксинов имеют небольшую молекулярную массу (20 кДа) и образуются в вегетативной фазе. Отмечено, что отдельные штаммы В. Thuringiensis могут образовывать несколько Cry-токсинов (которые могут входить в состав одного кристалла), что увеличивает их круг хозяев.
Современная классификация инсектицидных протеинов В. thuringiensis (Cry-протеинов, VIP и Cyt-протеинов) основана на степени филогенетического сходства их аминокислотных последовательностей (F. Crickmore и др., 1998). Так, если последовательности имеют менее 45 % сходства, они приписываются к одной группе (например, Cryl, Cry2, Cry3 и т. д.). При наличии менее 75 % сходства они приписываются к одной подгруппе (CrylA, CrylB, CrylC и т. д.). Если токсины обладают менее 95 % сходства, они приписываются к одной суб-подгруппе (CrylAa, CrylAb, CrylAc и т. д.). При выявлении более 95 % сходства токсины являются разными аллелями одного гена. В 2014 г. в номенклатуру инсектицидных протеинов В. thuringiensis включено около 750 генов cry, 28 генов vip и16 генов cyt (www.btnomenclature.info).
Механизм действия Cry-протеинов включает в себя: растворение кристалла в кишечнике насекомого, протеолитическое расщепление протоксина протеазами кишечника, закрепление токсина на рецепторе клеток кишечника и интеграцию токсина в апикальную мембрану, образование ионных каналов в клетках эпителия, осмотический шок и лизис клеток (рис. 10.3). Кристаллы состоят из молекул Cry-протеинов, которые представляют собой неактивные протоксины. При их попадании в кишечник насекомого они растворяются в щелочных условиях (рН 7,5-8,0), характерных для пищеварительной системы насекомых. Протоксины становятся активными токсинами за счет действия протеаз кишечника (например, y Lepidoptera это трипсины или химотрипсинподобные ферменты). Под воздействием протеаз протоксины уменьшаются в размере почти в два раза. Активированный токсин соединяется со специфическими рецепторами, которые находятся на апикальных клетках эпителия кишечника чувствительных насекомых. Далее происходит плотное закрепление токсина на рецепторе, интеграция токсина в апикальную мембрану эпителиальных клеток и образование ионных каналов или ячеек в мембране. Клетки испытывают осмотический шок, происходит их лизис. В результате насекомое перестает питаться, наступает обезвоживание организма, и оно погибает. Механизм действия VIP и Cyt-протеинов схож с таковым для Cry-белков. Однако их гены не имеют гомологии с генами cry и у них другие специфические рецепторы в пищеварительном тракте насекомых. Cyt-протеины оказывают синергический эффект на токсичность некоторых Cry-белков.
Рис. 10.3. Механизм действия Сrу-протеинов
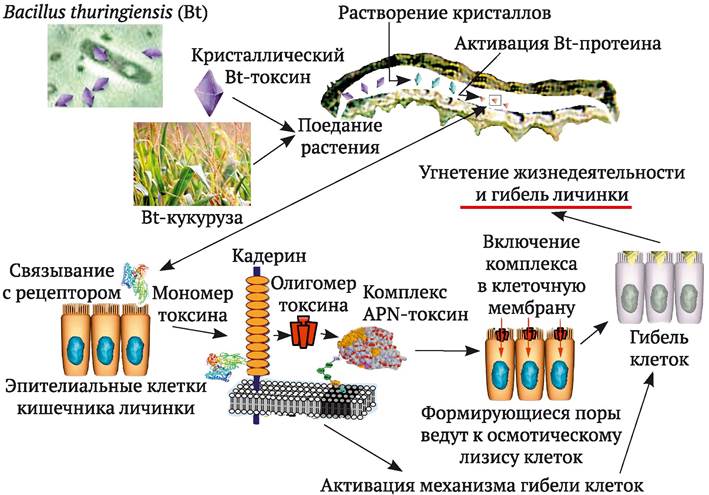
Характерной особенностью Cry-токсинов является их высокая избирательность. Bt-протеин, выделенный от одного определенного штамма бактерии, как правило, токсичен по отношению к определенному виду или видам насекомых одного порядка, например Coleóptera (жуков), и не действует на других насекомых, например Lepidoptera (бабочек), Heminoptera (пчел) и т. д. Избирательность обусловлена специфическим механизмом токсичности Bt-протеина: он может прикрепляться только к рецепторам чувствительных к данному токсину насекомых. Существует отдельная база данных по специфичности действия токсинов В. thuringiensis против насекомых и других вредителей растений (по отношению к каким видам вредителей активны и к каким не активны определенные Bt-протеины, степень их токсичности) (www.btnomenclature.info).
Начиная с 1960-х гг., после открытия инсектицидной активности кристаллических протеинов В. thuringiensis, биопрепараты на основе Bt-токсинов стали весьма широко использоваться в сельском и лесном хозяйстве для борьбы с насекомыми-вредителями. К их несомненным достоинствам следует отнести прежде всего полную безопасность для здоровья человека (не токсичны, не вызывают аллергии), а также для окружающей среды (высокая избирательность действия, легко смываются с листьев, быстро разрушаются под действием ультрафиолетовых лучей, не способны накапливаться в растении и почве). Обладая отмеченными достоинствами, биопрепараты имеют существенный недостаток, снижающий их эффективность: они способны защитить растение только на очень короткое время.
Решение этой проблемы стало возможным благодаря использованию генетической инженерии. Поскольку у многих трансгенных сортов Bt-протеины образуются во всех тканях и присутствуют там постоянно, то это позволяет растениям защищать себя от вредителей на протяжении всего периода вегетации. При этом трансгенный Bt-протеин высоко эффективен в очень низких концентрациях. Так, в зеленой массе трансгенной кукурузы на площади в1 га в период цветения содержится всего 8-16 г Bt-протеина.
В настоящее время зарегистрировано большое количество устойчивых к насекомым трансгенных линий хлопчатника и кукурузы, а также сои, картофеля и томатов (см. табл. 9.2). Наиболее широкое применение сорта с этим признаком нашли при возделывании первых двух культур благодаря высокой эффективности контроля вредных насекомых. В частности, удалось значительно снизить потери урожая благодаря внедрению трансгенных растений кукурузы, устойчивых к наиболее опасному вредителю этой культуры - огневке кукурузной Ostrinia nubilalis, с которой сложно бороться с помощью традиционных методов (рис. 10.4). Существующие трансгенные сорта хлопчатника обладают устойчивостью к ряду опасных вредителей, относящихся к Lepidoptera: хлопковой совке Helicoverpa zea, совке табачной Heliotis viriscens, моли хлопковой Pectinophora gossipiella, кукурузной листовой совке Spodoptera frugiperda, черной совке (совке помидорной) S. exigua, соевой пяденице Pseudoplusia includes, капустной пяденице Trichoplusia ni. Значительный интерес представляют сорта картофеля, устойчивые к колорадскому жуку Leptinotarsa decemlineata (порядок Coleoptera).
Рис. 10.4. Трансгенная Bt-кукуруза, устойчивая к огневке кукурузной Ostrinia nubilalis: а - личинка огневки, повреждающая стебель кукурузы, неустойчивой к вредителю; б - растения Bt-кукурузы (слева) и немодифицированного аналога (справа) в конце вегетации; в - початки Bt-кукурузы (слева) и немодифицированного аналога (справа) (http://www.nature.com/ и http://ds.casa.colostate.edu/)

В генетической инженерии растений пока использована лишь незначительная часть из известных генов Bt-токсинов (табл. 10.1). Однако их круг постоянно расширяется. Новые гены существенно превосходят своих предшественников по токсичности, числу организмов-мишеней. Например, токсин, кодируемый геном vip3A(а) от В. thuringiensis AB88, активен не только против огневки кукурузной Ostrinia nubilalis, но и по отношению к большой группе вредителей (кукурузной совке Helicoverpa zea, кукурузной листовой совке Spodoptera frugiperda,совке ипсилон Agrotis ipsilon, Striacosta albicosta), которые нечувствительны к продуктам cry-генов, использованных при создании первых устойчивых к насекомым сортов (cry1Ab, cry1Ac, cry9C).
Следует заметить, что при создании трансгенных линий, устойчивых к насекомым-вредителям, как правило, используют модифицированные гены Bt- токсинов (укороченные, содержащие только активную часть гена, с измененным составом нуклеотидов, приближенным к составу, характерному для растительных генов) (см. раздел 9.5). При получении трансгенной линии кукурузы MON 89034, устойчивой к мотылькам Ostrinia ssp и Diatrea ssp, была использована кассета из двух генов: cry2Ab2 и cry1A.105, что позволило существенно повысить эффективность защиты растений от вредителей, сделало маловероятным появление устойчивых к токсинам насекомых. Интересно, что ген crylA.105 является химерным, созданным с помощью генно-инженерных методов и содержащим 4 домена от различных cry-генов (домены I и II - от cry1Ab и cry1Ac, домен III - от cry1F, C-терминальный домен - от cry1Aс).
Таблица 10.1. Гены Bt-токсинов, используемые при создании трансгенных сортов растений, устойчивых к насекомым-вредителям
Гены Bt- токсинов |
Происхождение трансгенов |
Насекомые-вредители, против которых активны Bt-токсины |
cry 1Ab |
B. thuringiensis ssp kurstaki |
Lepidoptera |
cry 1Ac |
B. thuringiensis ssp kurstaki |
Lepidoptera |
cry 1F |
B. thuringiensis var aizavai |
Lepidoptera |
cry 2Ab |
B. thuringiensis ssp kurstaki |
Lepidoptera |
cry 3A |
B. thuringiensis ssp tenebrionis |
Coleoptera |
cry 3Bb1 |
B. thuringiensis ssp kumamotoensis |
Coleoptera |
cry 9C |
B. thuringiensis ssp tolworthi |
Lepidoptera |
cry 34Ab1 |
B. thuringiensis PS149B1 |
Coleoptera |
cry 35Ab1 |
B. thuringiensis PS149B1 |
Coleoptera |
cry 1A.105 |
Химерный ген, содержащий 4 домена разных cry-генов (cry 1Ab, cry 1Ac, cry 1F) |
Lepidoptera |
vip 3A(a) |
B. thuringiensis AB88 |
Lepidoptera |
Все более широкое распространение получают трансгенные события с совмещением (англ. stacked) различных трансгенных признаков. Например, созданы трансгенные линии картофеля с устойчивостью к колорадскому жуку и вирусам картофеля. Половые гибриды F1 между различными трансгенными линиями или двойные межлинейные гибриды кукурузы (F1 х F1; F1 х трансгенная линия) обладают: комплексной устойчивостью к вредителям из порядков Lepidoptera (личинкам огневки кукурузной и др.) и Coleoptera (личинкам жуков Diabrotica ssp, повреждающих корни молодых растений); устойчивостью к насекомым и толерантностью к гербицидам, устойчивостью к насекомым и улучшенными кормовыми свойствами (с повышенным содержанием аминокислоты лизина).
10.3. Трансгенные сорта сельскохозяйственных растений, устойчивые к болезням
Болезни растений, вызванные фитопатогенными вирусами, грибами и бактериями, представляют постоянную и серьезную угрозу сельскохозяйственному производству, так как они являются причиной значительных потерь урожая и снижения качества продукции. Для решения этой проблемы не только широко используют различные химические и биологические средства защиты растений, но также применяют комплекс профилактических, организационно-хозяйственных, агротехнических, семеноводческих подходов.
Наиболее эффективный способ контроля патогенов - выращивание сортов сельскохозяйственных растений с комплексной устойчивостью к болезням и вредителям, особенно к наиболее проблемным для определенной культуры и местности патогенам. Выведение таких сортов относится к приоритетным задачам селекции любой культуры. Устойчивость к отдельным патогенам может определяться единичными генами (так называемыми R-генами), продукты которых (рецепторные киназы) взаимодействуют с продуктами соответствующих генов патогена (AVR-эффекторами), в результате чего запускается механизм защиты растения. R-гены присутствуют в генетическом пуле культурного вида или его диких сородичей. Задача селекционера собрать в сорте как можно больше таких генов, что сделать с помощью методов традиционной селекции весьма сложно и занимает много времени. Применение методов генетической инженерии открывает новые возможности в повышении эффективности создания устойчивых к болезням сортов растений. В частности, появляется возможность использовать в селекции не только R-гены какого-либо вида растений, но и гены его диких сородичей, с которыми есть жесткие репродуктивные барьеры, гены неродственных видов растений, других организмов (вирусов, бактерий, грибов). Также можно в короткие сроки добавлять сорту отдельные гены устойчивости, не изменяя его генотип, что особенно актуально для культур, сорта которых представляют собой гетерозиготы, размножаемые вегетативно (например, картофель). Это открывает возможность эффективно проводить совмещение в сорте нескольких генов устойчивости к какому-либо патогену (так называемое пирамидирование генов устойчивости), что повышает эффективность защиты, сложность преодоления ее патогеном (долговременность).
Перспективность этого подхода продемонстрирована на ряде культур. В частности, удалось получить трансгенные линии риса Oryza sativa, устойчивые к бактериальному ожогу листьев (англ. bacterial blight), возбудителем которого является Xanthomonas oryzae pathovar oryzae (P. Ronald, 1997). Для этого в геном культурного риса был встроен ген Xa21устойчивости к болезни, изолированный у дикого вида риса O. longistaminata, произрастающего в Мали. С помощью метода беккросса этот ген был далее перенесен в ряд коммерческих сортов. От дикого диплоидного вида картофеля из Мексики S. bulbocastanum к сортам культурного картофеля перенесены ценные гены высокой долговременной устойчивости к фитофторозу, наиболее вредоносному заболеванию культуры. При этом продемонстрирована высокая эффективность пирамидирования генов устойчивости (получены трансгенные линии с тремя R-генами) (C. Zhu и др., 2012). Для развития данного направления создана основательная база: идентифицировано, выделено и клонировано большое количество различных R-генов разных видов растений.
Другое направление в создании трансгенных растений, устойчивых к болезням, предполагает использование генов, связанных со стимуляцией неспецифического (т. е. не направленного против определенного патогена) иммунитета растения. Для этого применяют гены так называемых связанных с патогенезом протеинов (англ. pathogenesis relatedproteins - PR-proteins; например, гидролаз клеточных стенок грибов глюконаз и хитиназ), антимикробных пептидов дефензинов, ферментов полифенолоксидаз и пероксидаз, а также фитоалексинов, лизозимов и др.
Современные генно-инженерные технологии создания устойчивых к вирусам сортов растений основаны на использовании известного метода, получившего название перекрестной защиты (англ.: cross protection). Он основан на явлении повышенной устойчивости растений к агрессивным формам какого-либо вируса при условии, что оно было ранее заражено менее вредоносной формой того же самого вида вирусов. Этот метод достаточно широко используют в Японии для защиты томатов от поражения вирусами томатной и огуречной мозаики, в Бразилии для защиты цитрусовых, папайи, кабачков цуккини и т. д.
В 1986 г. Р. Powell Abel с сотрудниками впервые получили устойчивые к мозаичному тобамовирусу растения табака в результате переноса в их генетический материал гена этого вируса, кодирующего образование белка оболочки (англ. coat protein - СР). С тех пор этот подход был успешно апробирован на более чем 30 видах растений с более чем 50 вирусными CP. Позднее оказалось, что аналогичный и даже иногда лучший результат достигается при использовании не CP-трансгенов, а генов, кодирующих другие протеины вирусов (гены ферментов репликазы, РНКазы и др.).
В качестве механизма устойчивости к вирусам рассматривают явление посттранскрипционного замолкания генов (см. раздел 9.3.1). Конститутивная экспрессия в растительных клетках небольшой части генома вирусов (образование иРНК трансгенов) в случае заражения растений вирусами способна запускать систему деградации последовательностей вирусных РНК, аналогичных трансгенным. В результате происходит блокирование транскрипции или трансляции гена-мишени и развитие вирусов в клетках растений не происходит.
Для генетической инженерии вирусоустойчивых форм в целях безопасности используют CP-гены, которые предварительно модифицируют таким образом, чтобы они не могли переноситься от растения к растению, либо выделяют CP-гены из таких естественных «нетрансмиссибельных» штаммов. Также оперируют генами от тех штаммов, что не способны инфицировать растения в естественных условиях, либо манипулируют укороченными СР- генами, которые кодируют образование дефектных, нефункционирующих СР-протеинов. Оказалось, что можно обеспечить защиту от вирусов даже в тех случаях, когда встроен настолько дефектный СР-ген, что образовавшаяся при его считывании мРНК не способна к трансляции, т. е. к синтезу соответствующего СР-протеина.
Из всего разнообразия полученных вирусоустойчивых форм для коммерческого использования допущено сравнительно немного: папайя, устойчивая к вирусу пятнистости (PRSV); цуккини, устойчивые к нескольким вирусам; сорта картофеля с комплексной устойчивостью к колорадскому жуку (благодаря инсерции гена cry 3A от B. thuringiensis) и к одному из вирусов картофеля: игрек вирусу (PVY) или вирусу скручивания листьев (PLRV); слива, устойчивая к покс-вирусу (http:/cera-gmc.org). Особенно большой экономический и социальный эффект был получен в результате внедрения в производство вирусоустойчивых сортов папайи (рис. 10.5). Фактически это позволило спасти целую отрасль сельскохозяйственного производства на Гавайях (США), которая была под угрозой полного уничтожения из-за повсеместного поражения культуры вирусом PRSV (D. Gonsalves, 1998). Плантации были полностью восстановлены. Выращиваемые трансгенные сорта на протяжении уже достаточно длительного периода (с 1998 г.) сохраняют высокую устойчивость к патогену. Их начали внедрять и в других странах.
Рис. 10.5. Трансгенное растение папайи с геном устойчивости к вирусу PRSV (а) и растение немодифицированного аналога, пораженное этим вирусом (б) (https://www.apsnet.org)

10.4. Трансгенные сорта сельскохозяйственных растений, устойчивые к экстремальным факторам среды
В процессе выращивания растения могут подвергаться воздействию различных неблагоприятных факторов среды: недостатку воды или избыточному увлажнению, экстремально высоким или пониженным температурам, засолению и др. Есть местности, в которых эти явления происходят регулярно. Выведение устойчивых к абиотическим стрессам сортов сельскохозяйственных культур с помощью традиционных методов селекции в большинстве случаев неэффективно из-за сложного генетического контроля признаков, связанных с такой устойчивостью.
Этим же объясняется отсутствие значимых достижений в применении для решения данной задачи методов генетической инженерии. Несмотря на многообразие предлагаемых подходов (идет работа над выделением, клонированием и переносом в растения генов, кодирующих образование различных осмопротекторов - ионов, протеинов, аминокислот, сахаров, полиаминов, генов, регулирующих содержание ненасыщенных жирных кислот в мембранах клеток и т. д.), реализован пока только один. В 2011 г. фирмой Моnsanto в США и Канаде зарегистрирована трансгенная линия кукурузы, способная к произрастанию в условиях недостатка влаги (рис. 10.6). Повышенная устойчивость к засухе достигается благодаря инсерции гена csp протеина холодового шока Bacillus subtilis. Этот протеин является РНК-шапероном, который обеспечивает повышенную устойчивость бактерий и растений к абиотическим стрессам, минимизируя нарушения укладки РНК (ее вторичной структуры) при воздействии неблагоприятных факторов среды. В результате клетки сохраняют функциональную активность в стрессовых условиях.
Рис. 10.6. Растения трансгенной кукурузы фирмы «Monsanto», способные сохранять рост в условиях сильной засухи (http://www.nationofchange.org/)

10.5. Трансгенные гетерозисные гибриды сельскохозяйственных растений на основе системы мужской стерильности/восстановления фертильности
Гетерозисные гибриды, полученные в результате скрещивания специально подобранных родительских форм, прочно вошли в нашу жизнь. Такие гибриды превосходят родителей по урожайности, устойчивости к болезням и неблагоприятным факторам среды, выравненности посевов. Получение гибридных семян значительно сложнее, чем семян обычных сортов. Главная проблема - необходимость полностью исключить попадание пыльцы материнских форм на пестик собственного цветка. Чтобы упростить процедуру получения гибридных семян, применяют специальные генетические подходы для селекции мужски стерильных линий, которые используют в скрещиваниях в качестве материнских форм, не опасаясь самоопыления. С середины 30-х гг. XX в. для этих целей стали использовать цитоплазматическую мужскую стерильность (ЦМС), возникновение которой обусловлено специфическим взаимодействием генов ядра и чужеродной цитоплазмы клетки. Однако не для всех культур удалось создать адекватные системы ЦМС, да и сама система размножения таких линий оставалась весьма сложной и не всегда эффективной.
Генетическая инженерия внесла весомый вклад в решение этой проблемы. Для создания мужски стерильных трансгенных линий растений было предложено использовать ген barnaseот бактерии Bacillus amyloliquefaciens, который кодирует образование фермента РНКазы. Благодаря тканеспецифическому промотору (например, РТА29 от табака) этот фермент образуется у трансгенного растения только в одном месте (пыльнике) и только в одно время (во время цветения). Деградация РНК в тканях пыльника приводит к блокаде синтеза белка и в конечном счете - к образованию нежизнеспособной пыльцы. Ген barnase скооперирован в одной генетической конструкции с геном устойчивости к глюфозинату аммония, что позволяет отбирать мужски стерильные линии до момента цветения с помощью обработки посевов гербицидом (сохраняют жизнеспособность только растения, несущие трансгены). Ген толерантности к гербициду у этих линий выполняет несколько функций. Во-первых, он является селективным геном для отбора трансформированных клеток на этапе создания линий. Во-вторых, он обеспечивает растениям толерантность к гербициду - хозяйственно-ценный признак, необходимый для контроля сорняков при выращивании трансгенных линий и гибридов на их основе. В-третьих, наличие толерантности к гербицидам необходимо для размножения стерильных линий и их отбора перед проведением скрещиваний в целях получения гибридов (из-за мужской стерильности линии можно поддерживать только в виде гетерозигот по трансгенным признакам).
Если опылять растения трансгенной мужски стерильной линии пыльцой, специально подобранной по комбинационной способности линии, несложно получить гибридные семена, поскольку самоопыление материнских форм исключено. Однако само гетерозисное потомство получится мужски стерильным, что нежелательно. Поэтому в качестве опылителя используют такую же линию, но несущую трансген barstar от B. amyloliquefaciens. Этот ген кодирует образование фермента-ингибитора РНКаз, благодаря чему у гибридов восстанавливается фертильность пыльцы. Так же, как и у стерильных линий, ген barstar совмещен с геном толерантности к гербициду глюфозинату аммония.
Используя систему трансгенных линий с бактериальными генами стерильности и восстановления фертильности, был создан ряд коммерческих гибридов рапса, кукурузы и цикория. При получении мужски стерильных трансгенных линий кукурузы фирмы Pioneer Hi-Bred был использован ген dam от E. coli фермента ДНК аденин метилазы (DAM).
10.6. Трансгенные сорта сельскохозяйственных растений с улучшенными качественными характеристиками
В предыдущих разделах рассмотрены примеры сортов растений, целью генетической модификации которых были признаки, направленные на улучшение их технологических свойств. Их использование позволяет прежде всего повысить эффективность сельскохозяйственного производства. Однако для обычного потребителя продукции растениеводства больший интерес представляют трансгенные сорта, обладающие какими-либо новыми, по сравнению с традиционными сортами, свойствами, в частности, с улучшенными качественными характеристиками.
У сортов культурных растений могут присутствовать гены, связанные с биосинтезом токсинов, аллергенов, антипитательных соединений. Существующие сорта часто не имеют функционирующих генов, необходимых для проявления специфических вкусовых характеристик и аромата продуктов, генов, связанных с образованием в растениях ценных для здоровья человека физиологически активных соединений, витаминов, антиоксидантов. Генетическая инженерия дает возможность улучшать сорта путем тканеспецифического изменения активности определенных генов с помощью добавления дополнительных их копий, что в результате может привести к изменению качественных характеристик того продукта, в генетическом контроле биосинтеза которого задействованы данные гены. Благодаря этому появляется возможность направленно улучшать питательные или ослаблять антипитательные свойства продуктов, а также изменять их технологические характеристики.
Перечень некоторых идентифицированных генов растений, которые используют в генетической инженерии для улучшения качественных признаков сортов, приведен в табл. 10.2. В частности, C. Rommens (2007) были получены интрагенные растения картофеля с генами Ppo полифенолоксидазы, дикиназы R1 и PhL фосфорилазы L, объединенными под одним клубнеспецифическим промотором. Снижение активности первого из этих генов предотвращало послеуборочное потемнение мякоти клубней, а двух других - уменьшало деградацию крахмала при холодном хранении картофеля и в результате - накопление редуцирующих сахаров. Полученный из таких клубней картофель фри не обесцвечивался, имел улучшенный запах и при его жарке образовывалось значительно меньше канцерогена акриламида. Среди официально допущенных к использованию в хозяйственной деятельности ГМО такого типа - сорт табака с пониженным содержанием никотина (благодаря инсерции в антисмысловой ориентации гена табака никотинат-нуклеотид фосфорилазы (карбоксилирующей)).
Таблица 10.2. Примеры качественных признаков растений, модифицированных путем переноса или изменения экспрессии кодирующих их генов (C. Rommens, 2007; сокращенная версия)
Признак |
Растение |
Целевой ген (гены) |
Методический подход |
Повышенное содержание флаваноидов |
Картофель |
Chi |
Повышенная экспрессия гена в клубнях |
Повышенное содержание каротиноидов и флаваноидов |
Томаты |
Det 1 |
Снижение активности гена в плодах |
Повышенное содержание ксантофилла |
Томаты |
Lcy + Chy |
Повышенная экспрессия гена в плодах |
Повышенное содержание витамина С |
Земляника |
GalUR |
Конститутивная повышенная экспрессия |
Повышенное содержание витамина Е |
Соя |
Vte3 + Vte4 |
Повышенная экспрессия гена в семенах |
Пониженный глике- мический индекс |
Картофель |
Sbe I + Sbe |
Снижение активности гена в клубнях |
Повышенная термостабильность масла |
Соя |
Fad3 |
Снижение активности гена в семенах |
Удлиненный срок хранения |
Томаты |
Pg, Acc-оксидаза, Acc-синтаза |
Снижение активности гена в плодах |
Усиленный аромат |
Томаты |
Aadc1A |
Конститутивная повышенная экспрессия |
Пониженное образование акриламида при тепловой обработке |
Картофель |
R1 + PhL, Asn1 + Asn2, Apg1 |
Повышенная экспрессия гена в клубнях |
Пониженное содержание аллергенов |
Арахис, томаты, соя, яблоня |
Ara h2, Ltpg1 или Ltpg2, Gly m Bd30 K, Mal d1 |
Конститутивная повышенная экспрессия |
Явление замолкания генов было использовано при создании трансгенного картофеля с измененным качеством крахмала. Картофельный крахмал содержит две формы этого полисахарида: ветвистый - амилопектин и неветвистый - амилозу. В некоторых технологиях, например, при производстве писчей бумаги, в текстильной промышленности, предпочтение отдают крахмалу, который содержит в основном амилопектин. Однако снизить уровень амилозы с помощью существующих технологий достаточно сложно и дорого. В геном ГМ-картофеля Amflora была добавлена трансгенная конструкция, содержащая дополнительную копию гена картофеля, ответственного за синтез амилозы (ген gbss - granule-bound starchsyntase) в антисмысловой ориентации. Результатом этой вставки стало замолкание имеющегося и встроенного генов, снижение синтеза соответствующего фермента. Поэтому крахмал, выделенный из клубней Amflora, практически не содержит амилозу.
С помощью генетической инженерии можно получать также картофель, клубни которого, напротив, содержат в основном амилозу. Амилозный крахмал образует высокопрочные гели, благодаря чему он представляет интерес для кондитерской промышленности, для получения специальных пленок и покрытия продуктов, например, при обжаривании. Повышенное содержание амилозы, как установлено, улучшает некоторые свойства крахмала, важные для здорового питания. Так называемый устойчивый крахмал (с высоким содержанием амилозы) практически не переваривается в тонком кишечнике. В толстом кишечнике он ферментируется бактериями, образуя соединения, которые снижают риск раковых и сердечно-сосудистых заболеваний. Продукты, содержащие устойчивый крахмал, имеют низкий гликемический индекс (медленное увеличение содержания сахара в крови в процессе переваривания пищи), улучшенное качество волокон, что делает их ценными для диетического питания, в частности, для людей больных диабетом. Получены трансгенные формы картофеля с повышенным содержанием амилозы, измененной морфологией крахмальных гранул, длиной ветвей и увеличенным содержанием фосфора.
Одним из первых трансгенных событий, официально допущенных к использованию в хозяйственной деятельности (1992), были томаты «FLAVR SAVR» с удлиненным периодом хранения плодов. Обычно в ходе созревания плоды томатов постепенно теряют упругость, становятся мягкими и загнивают. Причиной этого является образование фермента полигалактуроназы, который деградирует пектин, находящийся в межклеточном пространстве плода. При создании трансгенного сорта была использована антисмысловая конструкция с геном PG полигалактуроназы томата. У полученного сорта образуется меньше этого фермента, благодаря чему спелые помидоры в течение продолжительного времени сохраняют товарный вид.
Другой подход в получении сортов томатов с удлиненным сроком созревания основан на снижении активности одного из генов, связанных с синтезом гормона созревания этилена путем добавки таких трансгенов, как АСС синтазы 1 -аминоциклопропан-1 -карбоксиловой кислоты томатов, ACCd 1-аминоциклопропан-1-карбоксиловой кислоты деаминазы от Pseudomonas chlororaphis, sam-k S-аденозилметионин гидролазы от бактериофага Т3 E. coli. Поскольку у таких томатов этилен в период созревания практически не образуется, они длительное время остаются зелеными, благодаря чему лучше хранятся. Чтобы помидоры покраснели, их необходимо поместить в газовую камеру, содержащую этилен, либо обработать веществами (этиленопродуцентами), которые при разрушении выделяют этот газ. Аналогичным образом были получены имеющие удлиненный период созревания и хранения дыни (путем инсерции гена sam-k) и гвоздики (встроена дополнительная копия собственного гена ACC-синтазы).
Свойства растительного масла в значительной степени определяются составом и соотношением жирных кислот, которые входят в состав триглицеридов, составляющих 95-98 % липидов масличных плодов и семян. Жирные кислоты различаются по длине цепи (количеству атомов углерода), количеству и месту двойных связей, положению в молекуле триглицерида. Масло с высоким содержанием ненасыщенных жирных кислот, например, олеиновой (С18:1, т. е. имеющей 18 атомов углерода и одну двойную связь), линолевой (С18:2) и линоленовой (С18:3), при комнатной температуре жидкое, а масло, содержащее много насыщенных жирных кислот, например, лауриновую (С12:0), миристиновую (С14:0), пальмитиновую (С16:0), - твердое, или имеющее осадок. Полиненасыщенные жирные кислоты (имеющие две и более двойных связей) очень важны для здоровья человека. Они вовлечены в синтез структурных компонентов клеточных мембран, метаболизм холестерина, оказывают нормализующее действие на стенки кровеносных сосудов, повышая их эластичность и снижая проницаемость. Их нехватка вызывает тромбоз коронарных сосудов. В связи с этим масла с высоким содержанием ненасыщенных жирных кислот (льняное, соевое, рапсовое) обязательно должны быть в рационе питания. Однако с технологической точки зрения они имеют ряд недостатков (прежде всего, это нестойкость при термической обработке), которые делают их непригодными для некоторых важных направлений промышленного использования.
В ассортименте допущенных к использованию трансгенных сортов имеется ряд форм масличных культур с измененным составом жирных кислот. Среди них следует назвать сою, в геном которой встроили дополнительную копию генаgm-fad2-1 фермента омега-6 десатуразы, в результате чего ее собственный ген десатуразы «замолчал». Это привело к снижению в соевом масле уровня полиненасыщенных жирных кислот линолевой и линоленовой и компенсационному увеличению уровня мононенасыщенной олеиновой кислоты до 80 %. В немодифицированной сое ее уровень был всего 23 %. Полученное масло в отличие от обычного стабильно при нагревании (что позволяет использовать его для промышленной жарки продуктов) всегда остается в более привлекательном для потребителя жидком виде (не загустевает).
При создании трансгенного рапса с измененным составом жирных кислот был использован более традиционный для генетической инженерии подход горизонтального переноса генов от неродственных видов. В генетический материал рапса был встроен ген bay TE тиоэстеразы от калифорнийского лаврового дерева Umbellularia californica. В результате трансгенный сорт стал способным образовывать масло, в котором появились не свойственные для рапса насыщенные лауриновая и миристиновая жирные кислоты. Такое масло приблизилось по качеству к пальмовому и кокосовому маслам, что расширило возможности его использования: для производства кондитерских изделий, маргаринов, спредов, разрыхлителей теста, для промышленной жарки продуктов.
Большой резонанс в обществе вызвала разработка швейцарских ученых, посвященная созданию так называемого «Золотого риса» (англ. golden rise) (рис. 10.7). Им удалось перенести в растения риса генетическую конструкцию, содержащую необходимые для биосинтеза каротина (провитамина А) гены: фитоиндесатуразы и ликопин β-циклазы от желтого нарцисса и каротиндесатуразы от бактерий Erwinia sрр. В результате растения риса стали способными синтезировать в зерне каротин, концентрация которого достигала 1,6-2 мкг на грамм сырой массы. Потребление такого риса призвано уменьшить дефицит витамина в рационе жителей Юго-Восточной Азии, что является одной из причин ослабленного зрения детей. Достигнутого уровня для этой цели оказалось недостаточно. В связи с этим была получена усовершенствованная версия «Золотой рис-2», в которой ген фитоиндесатуразы нарцисса был заменен на аналогичный ген кукурузы, что позволило увеличить уровень каротина в зерне в двадцать раз (I. Рате и др., 2005).
Рис. 10.7. Обычный длиннозерный рис, выращиваемый в штате Калифорния (США) (а, Б) и трансгенный «Золотой рис», растения которого способны накапливать в зерне каротин (в) (http://ucce.ucdavis.edu)

10.7. Трансгенные сорта сельскохозяйственных растений с улучшенными кормовыми свойствами
Если посмотреть на площади, занятые под отдельными трансгенными культурами, то можно отметить, что на четыре культуры - сою, кукурузу, хлопчатник и рапс - приходится около 98 %. Нетрудно заметить, что это культуры, урожай которых в основном используют для производства кормов и на технические цели. С помощью генетической инженерии удалось существенно увеличить их продуктивность, прежде всего за счет решения проблем, связанных с контролем сорняков и насекомых-вредителей. Однако известно, что не только количество, но и качество кормов является важным фактором повышения эффективности животноводства. Вместе с тем для продукции важнейших кормовых культур, каковые представляют собой соя и кукуруза, характерным является несбалансированность белков по отдельным аминокислотам, особенно незаменимым (триптофану, лизину, треонину и метионину). Так, у кукурузы, как и у большинства злаковых, низкий уровень лизина и триптофана. Несмотря на высокую продукцию белка и высокое его качество у сои, она имеет недостаточный уровень метионина. Использование традиционных методов селекции для повышения продукции незаменимых аминокислот у названных сельскохозяйственных культур оказалось неэффективным. Наиболее значимые результаты достигнуты с применением генно-инженерных подходов.
Так, была получена трансгенная кукуруза с повышенным содержанием в зерне незаменимой аминокислоты лизина за счет инсерции в ее геном гена cordapA от Соrynabacteriumglutamicum. Этот ген кодирует один из ферментов (cDHDPS), регулирующих синтез лизина. Аналогичный фермент и соответствующий ген имеется и у кукурузы. Но его активность зависит от концентрации конечного продукта - лизина. Благодаря тому, что у трансгенных растений появляется дополнительный, бактериальный ген cDHDPS, активность которого в меньшей степени подвержена ингибированию конечным продуктом, удается существенно повысить выработку лизина по сравнению с обычными, немодифицированными растениями кукурузы.
Другой интересный пример повышения кормовой ценности культуры - создание в Китае трансгенной кукурузы с повышенным содержанием фермента фитазы. Благодаря новому признаку повышается усвоение фосфора из произведенного из такой кукурузы корма, что не только позволяет улучшить рост животных, но и снизить загрязнение окружающей среды за счет уменьшения содержания фосфатов в отходах животноводства.
10.8. Трансгенные сорта сельскохозяйственных растений для производства биотоплива
Увеличение производства таких культур, как кукуруза и рапс, благодаря выращиванию трансгенных сортов, позволяет экономически обоснованно рассматривать вопрос производства альтернативного топлива - из зерна, богатого углеводами, или дешевого растительного масла. Генетическая инженерия позволяет также повысить и эффективность производства биотоплива за счет использования соответствующим образом модифицированных сортов растений. В этом смысле большой интерес представляет кукуруза с геном термостабильной альфа-амилазы.
Первым этапом производства спирта этанола, который может быть использован в качестве топлива для автомобилей, является гидролиз крахмала, содержащегося в зерне кукурузы. Этот процесс происходит под действием фермента амилазы. Интактная амилаза зерна кукурузы быстро дезактивируется при повышенной температуре. Поэтому обычно в производстве спирта применяют препараты фермента, для которых характерна высокая устойчивость к повышенным температурам, выработанные с помощью микроорганизмов. Наличие бактериального гена термостабильной альфа-амилазы (от Тhermococcales sрр) у трансгенной кукурузы решает названную проблему.
10.9. Использование трансгенных растений для производства лекарств и вакцин
Идея использовать трансгенные растения в качестве биореакторов для производства различных ценных для фармакопеи соединений так называемых рекомбинантных протеинов постоянно привлекает внимание ученых. Преимущества таких «биофабрик» очевидны. Можно производить редкие и дорогие вещества в практически неограниченных количествах. При этом не стоит проблема их тщательной очистки как в случае с ГМ-микроорганизмами. Возможности растений по сравнению с микроорганизмами для биосинтеза специфических для высших организмов веществ намного шире, поскольку они к ним ближе в эволюционном плане. Отсутствуют риски переноса скрытых инфекций, характерных для традиционных методов производства некоторых препаратов путем выделения из сырья животного происхождения (трупного материала, из органов животных или донорской крови).
Большой интерес представляет использование трансгенных растений для получения съедобных вакцин для повышения устойчивости людей или животных к опасным заболеваниям. Этот подход особенно актуален для стран, в которых существующая инфраструктура и отсутствие средств лимитируют хранение, перемещение и применение традиционных вакцин. В основе метода достаточно простая схема. В генетический материал растения переносят небольшой фрагмент ДНК какого-либо патогена (чаще всего вируса). В результате в плодах трансгенного растения образуется определенный протеин, характерный для патогена (сам по себе он не может вызвать заболевание). При поедании этот протеин выступает в качестве чужеродного агента - антигена, к которому организм вырабатывает благодаря естественному механизму иммунитета соответствующие антитела. Используя описанную стратегию, удалось получить: трансгенные растения бананов, при употреблении плодов которых индуцируется образование антител к вирусам папилломы; растения картофеля, в клубнях которых содержится способный вызывать иммунный ответ поверхностный антиген вируса гепатита В.
Трансгенные растения также могут синтезировать в плодах антитела - большие сложные протеины с выраженной способностью распознавать и связывать специфические молекулярные мишени. Данный подход, в частности, был реализован при создании трансгенного табака CaroRX, растения которого являются продуцентами моноклональных антител к поверхностному протеину Streptococcus mutans - бактерии, вызывающей кариес зубов. Связывание антител с поверхностью бактерий препятствует их прикреплению к зубной эмали. Планируется использование этого продукта в качестве добавки в зубные пасты и жидкости для ополаскивания ротовой полости в целях профилактики.
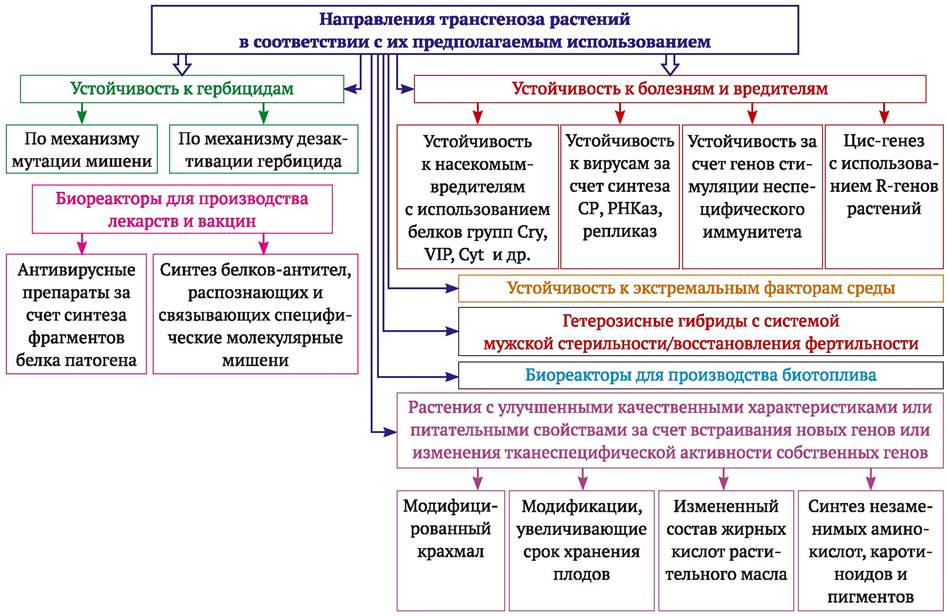
Рассмотренные направления практического использования генетической инженерии для улучшения растений даны на рис. 10.8.
Рис. 10.8. Направления использования генетической инженерии для улучшения растений
Заключение
Среди трансгенных культур подавляющее большинство составляют толерантные к гербицидам формы. Зарегистрированы и допущены к использованию гербицидоустойчивые трансгенные линии сои, кукурузы, хлопчатника, рапса, сахарной свеклы, турнепса, льна, люцерны, риса, пшеницы, табака, цикория, полевицы, гвоздики. В генетической инженерии толерантных к гербицидам растений наиболее широкое распространение получили две концепции. Первая предполагает использование трансгенов, которые представляют собой «мутацию мишени» (фермента, на который действует гербицид), вторая - трансгенов, белковые продукты которых способны дезактивировать гербицид. Механизм мутации мишени применен при создании трансгенных растений, толерантных к глифосату, сульфонилмочевинным гербицидам (триасульфурону, метилсульфурон метину и др.), имидозолинону. Механизм дезактивации гербицида использован при создании трансгенных растений, толерантных к глюфозинату аммония, оксиниловым гербицидам (бромоксинилу и иоксинилу), а также глифосату.
Для создания трансгенных растений, обладающих устойчивостью к насекомым, использованы гены бактерии Bacillus thuringiensis, прежде всего гены, кодирующие параспоральные кристаллические дельта-эндотоксины (Cry-протеины, Bt-токсины). Cry-протеины обладают специфической инсектицидной активностью против Lepidoptera (чешуекрылых), Coleóptera(жесткокрылых), Díptera (двукрылых), а также некоторых других насекомых (перепончатокрылых, равнокрылых, прямокрылых и пухоедов), клещей и нематод. Кроме кристаллических токсинов В. thuringiensis образуют и другие пестицидные белки: вегетативные инсектицидные протеины (VIP), цитолитические протеины (Cyt-протеины). Механизм действия Cry-протеинов включает в себя: растворение кристалла в кишечнике насекомого, протеолитическое расщепление протоксина протеазами кишечника, закрепление токсина на рецепторе клеток кишечника и интеграцию токсина в апикальную мембрану, образование ионных каналов в клетках эпителия, осмотический шок и лизис клеток. Механизм действия VIP и Cyt-протеинов схож с таковым для Cry-белков. Однако их гены не имеют гомологии с генами cry и у них другие специфические рецепторы в пищеварительном тракте насекомых. Характерной особенностью Cry-токсинов является их высокая избирательность, обусловленная специфическим механизмом токсичности Bt-протеина: он может прикрепляться только к рецепторам чувствительных к данному токсину насекомых.
В генетической инженерии растений пока использована лишь незначительная часть из известных генов Bt-токсинов. Однако их круг постоянно расширяется. При создании трансгенных линий, устойчивых к насекомым- вредителям, как правило, используют модифицированные гены (укороченные, содержащие только активную часть гена, с измененным составом нуклеотидов, приближенным к составу, характерному для растительных генов). Новые гены существенно превосходят своих предшественников по токсичности, числу организмов-мишеней. Зарегистрировано большое количество устойчивых к насекомым трансгенных линий хлопчатника и кукурузы, а также сои, картофеля и томатов.
Применение методов генетической инженерии открывает новые возможности в повышении эффективности создания устойчивых к болезням сортов растений за счет использования в селекции R-генов диких сородичей, с которыми есть жесткие репродуктивные барьеры, генов неродственных видов растений. Появляется возможность в короткие сроки добавлять сорту отдельные гены устойчивости, не изменяя его генотип, эффективно проводить совмещение в сорте нескольких генов устойчивости к какому-либо патогену (так называемое пирамидирование генов устойчивости), что повышает эффективность защиты, сложность преодоления ее патогеном (долговременность). Другое направление в создании трансгенных растений, устойчивых к болезням, предполагает использование генов, связанных со стимуляцией неспецифического (т. е. не направленного против определенного патогена) иммунитета растения. Для этого применяют гены так называемых связанных с патогенезом протеинов (например, гидролаз клеточных стенок грибов глюконаз и хитиназ), антимикробных пептидов дефензинов, ферментов полифенолоксидаз и пероксидаз, а также фитоалексинов, лизозимов и др.
Современные генно-инженерные технологии создания устойчивых к вирусам сортов растений основаны на использовании известного метода, получившего название перекрестной защиты (англ. cross protection): повышенной устойчивости растений к агрессивным формам какого-либо вируса при условии, что оно было ранее заражено менее вредоносной формой того же самого вида вирусов. В 1986 г. Р. Powell Abel с сотрудниками впервые получили устойчивые к мозаичному тобамовирусу растения табака в результате переноса в их генетический материал гена этого вируса, кодирующего образование белка оболочки (англ. coat protein - СР). Позднее оказалось, что аналогичный и даже иногда лучший результат достигается при использовании не CP-трансгенов, а генов, кодирующих другие протеины вирусов (гены ферментов репликазы, РНКазы и др.). В качестве механизма устойчивости к вирусам рассматривают явление посттранскрипционного замолкания генов. Из полученных вирусоустойчивых форм для коммерческого использования допущены: папайя, устойчивая к вирусу пятнистости (PRSV), цуккини, устойчивые к нескольким вирусам, сорта картофеля с комплексной устойчивостью к колорадскому жуку и одному из вирусов картофеля (PVY или PLRV), слива, устойчивая к покс-вирусу.
Выведение устойчивых к абиотическим стрессам сортов сельскохозяйственных культур с помощью традиционных методов селекции в большинстве случаев неэффективно из-за сложного генетического контроля признаков, связанных с такой устойчивостью. Несмотря на многообразие предлагаемых подходов создания устойчивых к стрессам трансгенных форм, до коммерческого использования доведена только трансгенная линия кукурузы, способная к произрастанию в условиях недостатка влаги. Повышенная устойчивость к засухе достигается благодаря инсерции гена csp протеина холодового шока Bacillus subtilis, который минимизирует нарушения укладки РНК (ее вторичной структуры) при воздействии неблагоприятных факторов среды.
Генетическая инженерия внесла весомый вклад в решение проблемы получения гетерозисных гибридов на основе использования явления мужской стерильности. Для создания мужски стерильных трансгенных линий растений было предложено использовать ген barnase от бактерии Bacillus amyloliquefaciens, который кодирует образование фермента РНКазы. Благодаря тканеспецифическому промотору этот фермент образуется у трансгенного растения только в пыльниках. Ген barnase скооперирован в одной генетической конструкции с геном устойчивости к глюфозинату аммония, что позволяет отбирать мужски стерильные линии до момента цветения с помощью обработки посевов гербицидом. Для восстановления фертильности гибридов в качестве опылителей используют линии с геном barstar от Bacillus amyloliquefaciens, кодирующим образование фермента-ингибитора РНКаз. Используя систему трансгенных линий с этими бактериальными генами, был создан ряд коммерческих гибридов рапса, кукурузы и цикория.
Генетическая инженерия дает возможность улучшать сорта растений путем тканеспецифического изменения активности определенных генов с помощью добавления дополнительных их копий, что в результате может привести к изменению качественных характеристик того продукта, в генетическом контроле биосинтеза которого задействованы данные гены. Благодаря этому появляется возможность направленно изменять технологические свойства, улучшать питательные или ослаблять антипитательные свойства продуктов.
В геном ГМ-картофеля «Amflora» была добавлена трансгенная конструкция, содержащая дополнительную копию гена картофеля, ответственного за синтез неветвистой формы крахмала - амилозы. Результатом этой вставки стало замолкание имеющегося и встроенного генов, снижение синтеза соответствующего фермента. Поэтому крахмал, выделенный из клубней «Amflora», практически не содержит амилозу, что является ценным свойством для его использования в промышленности, например, при производстве бумаги.
Для создания трансгенного сорта томатов «FLAVR SAVR» с удлиненным периодом хранения плодов была встроена дополнительная копия гена полигалактуроназы. У полученного сорта образуется меньше этого фермента, благодаря чему спелые помидоры в течение продолжительного времени сохраняют товарный вид. Другой подход в получении сортов с удлиненным сроком созревания основан на снижении активности одного из генов, связанных с синтезом гормона созревания этилена. Поскольку у таких томатов этилен в период созревания практически не образуется, они длительное время остаются зелеными, благодаря чему лучше хранятся. Аналогичным образом были получены имеющие удлиненный период созревания и хранения дыни и гвоздики.
В ассортименте допущенных к использованию трансгенных сортов имеется ряд форм масличных культур с измененным составом жирных кислот. В геном сои встроили дополнительную копию гена фермента омега-6 десатуразы, в результате чего в соевом масле снизился уровень полиненасыщенных жирных кислот линолевой и линоленовой и произошло компенсационное увеличение уровня мононенасыщенной олеиновой кислоты. Полученное масло, в отличие от обычного масла, стабильно при нагревании, всегда остается в более привлекательном для потребителя жидком виде. При создании трансгенного рапса с измененным составом жирных кислот был использован более традиционный для генетической инженерии подход горизонтального переноса генов от неродственных видов. В генетический материал рапса был встроен ген тиоэстеразы от калифорнийского лаврового дерева. В результате трансгенный сорт стал способным образовывать масло, в котором появились не свойственные для рапса насыщенные лауриновая и миристиновая жирные кислоты, что расширило возможности его использования: для производства кондитерских изделий, маргаринов, спредов, разрыхлителей теста, для промышленной жарки продуктов.
Большой резонанс в обществе вызвала разработка швейцарских ученых, посвященная созданию так называемого «Золотого риса» (англ. «Golden rise»). Им удалось перенести в растения риса генетическую конструкцию, содержащую необходимые для биосинтеза каротина (провитамина А) гены: фитоин- десатуразы и ликопин β-циклазы от желтого нарцисса и каротиндесатуразы от бактерий Erwinia spp. В результате растения риса стали способными синтезировать в зерне каротин. Потребление такого риса призвано уменьшить дефицит витамина в рационе жителей Юго-Восточной Азии, что является одной из причин ослабленного зрения детей.
Трансгенная кукуруза с повышенным содержанием в зерне незаменимой аминокислоты лизина была получена путем инсерции бактериального гена одного из ферментов, регулирующих синтез лизина. Вследствие того, что активность встроенного гена в меньшей степени подвержена ингибированию конечным продуктом, удается существенно повысить выработку лизина, что существенно повышает кормовую ценность зерна.
Благодаря выращиванию трансгенных сортов, увеличение производства таких культур, как кукуруза и рапс, позволяет экономически обоснованно рассматривать вопрос производства альтернативного топлива - из зерна, богатого углеводами, или дешевого растительного масла. Генетическая инженерия позволяет также повысить и эффективность производства биотоплива за счет использования соответствующим образом модифицированных сортов растений. Зарегистрирована трансгенная линия кукурузы с геном термостабильной альфа-амилазы, из зерна которой можно получать этиловый спирт без применения микробных препаратов фермента.
Большой интерес представляет использование трансгенных растений для получения съедобных вакцин для повышения устойчивости людей или животных к опасным заболеваниям. В генетический материал растения переносят небольшой фрагмент ДНК какого-либо патогена (чаще всего вируса), кодирующий протеин, который может выступать в качестве антигена, присутствующего в плодах. При употреблении плодов в пищу организм вырабатывает благодаря естественному механизму иммунитета антитела к этому антигену. Трансгенные растения также могут синтезировать в плодах антитела с выраженной способностью распознавать и связывать специфические молекулярные мишени.
Контрольные вопросы
1. В чем заключается механизм толерантности к гербицидам типа мутации мишени? Приведите примеры трансгенных растений с мутацией мишени.
2. Объясните, каким образом обеспечивается толерантность к гербициду глюфозинату аммония у трансгенных растений.
3. Какие инсектицидные протеины вырабатывают бактерии Bacillus thuringiensis, представляющие интерес для получения трансгенных растений, устойчивых к насекомым-вредителям?
4. Опишите механизм действия на насекомых, кристаллических протеинов. Чем обусловлена избирательность их действия?
5. С какой целью и каким образом получают трансгенные растения с совмещенными признаками (stacked traits) устойчивости к насекомым-вредителям? Приведите примеры.
6. Какие методические подходы используют для получения трансгенных растений, устойчивых к болезням?
7. Какое явление лежит в основе механизма устойчивости к вирусам у трансгенных растений?
8. Какой ген был использован при получении трансгенной кукурузы, устойчивой к недостатку влаги?
9. Какие трансгенные линии включает в себя система для получения гетерозисных гибридов?
10. Для чего необходим ген толерантности к гербициду у мужски стерильных трансгенных линий для получения гибридных семян?
11. Каким образом с помощью генетической инженерии изменяют качественные характеристики крахмала?
12. Какие подходы используют для получения трансгенных растений с удлиненными сроками созревания и хранения плодов?
13. Чем отличается от обычного масло трансгенных линий рапса с измененным составом жирных кислот?
14. Каким образом удалось повысить содержание лизина в зерне трансгенных линий кукурузы?