БИОТЕХНОЛОГИЯ РАСТЕНИЙ И БИОБЕЗОПАСНОСТЬ - А. П. Ермишин - 2015
ГЛАВА 11. ОСНОВЫ БЕЗОПАСНОСТИ ГЕННО-ИНЖЕНЕРНОЙ ДЕЯТЕЛЬНОСТИ
11.1. Базовые принципы и методология оценки риска генно-инженерной деятельности
Использование на практике достижений генетической инженерии имеет два важных аспекта. С одной стороны, очевидно, что она может в значительной мере содействовать решению мировых проблем благосостояния людей, касающихся в первую очередь насущных потребностей в продуктах питания, эффективного ведения сельского хозяйства и совершенствования здравоохранения. С другой стороны, генетическая инженерия - революционная технология, которая открывает немыслимые ранее возможности направленной модификации генетического материала. В связи с этим возникает вопрос, насколько безопасны генетически модифицированные организмы для здоровья человека и окружающей среды?
Принимая во внимание второй аспект, при использовании достижений современной биотехнологии определяющим стал принцип принятия мер предосторожности, появившийся в 1970-х гг. как скептическая реакция экологического общественного движения на возможность научной оценки риска и предотвращения вредных последствий применения сложных технологий. По сути, принцип означает, что перед лицом научной неопределенности или отсутствия необходимых знаний лучше ошибиться в сторону избыточности мер безопасности, чем ошибиться в оценке риска. В настоящее время этот принцип содержат более 20 международных законов, договоров, протоколов и конвенций, в том числе основной международный договор, регулирующий отношения, связанные с ГМО, - Картахенский протокол по биобезопасности к Конвенции о биологическом разнообразии. Приведенные в нем формулировки принципа принятия мер предосторожности не требуют доказательства абсолютной безопасности технологии, но предполагают ее ограничение в случае, если уровень научной неопределенности относительно потенциального риска является значительным, а возможности управления риском - недостаточными.
При наличии обоснованных научных предположений о том, что новый процесс или продукт может быть опасным, он не должен внедряться до тех пор, пока не будут получены доказательства того, что риск невелик, управляем и преимущества технологии его «перевешивают». Применение принципа предосторожности в этом смысле должно продемонстрировать не абсолютным образом, но выше уровня обоснованных сомнений, что предлагаемая заявителем генно-инженерная деятельность безопасна.
Таким образом, одним из главных международных требований, связанных с развитием и применением современной биотехнологии в науке и производстве, является обеспечение в соответствии с принципом принятия мер предосторожности безопасности любой генно-инженерной деятельности (проведение исследований, полевых и других испытаний ГМО), а также безопасность ГМ-продуктов, помещаемых на рынок. Под биобезопасностью в данном контексте понимается система мероприятий, направленных на предотвращение или снижение до безопасного уровня неблагоприятных воздействий ГМО на здоровье человека и окружающую среду при осуществлении генно-инженерной деятельности. В основе биобезопасности лежит научно обоснованная, всесторонняя и адекватная оценка риска возможных вредных воздействий ГМО на здоровье человека и состояние окружающей среды, и разработка мер его предупреждения.
11.1.1. Понятия «риск», «фактор риска», «оценка риска»
В широком понимании риск - это вероятность нежелательного события. Риск нежелательного события связан с какими-то определенными особенностями используемых человеком веществ или совершаемых действий. Каждое вещество и деятельность являются потенциальными факторами риска. Одни вещества и виды деятельности способны вызывать сразу ряд неблагоприятных событий различного рода, в то время как другие могут вызывать единичные или немногочисленные виды таких событий. Фактор риска - это свойственная веществу или какой-либо деятельности (процессу) потенциальная способность причинять вред (вызывать нежелательное событие). Фактор риска является функцией неблагоприятных свойств объекта (деятельности, процесса) и условий их проявления. Если понятие «фактор риска» обозначает лишь причину (сущность) потенциального неблагоприятного события, то понятие «риск» обозначает расчетную вероятность реализации этого события с теми или иными масштабами его последствий. В соответствии с этим риск можно определить в виде следующего математического выражения:
риск = вероятность негативного воздействия фактора риска х величина последствий воздействия.
Процедура оценки риска в данном контексте должна дать ответы на три вопроса:
1. Что представляет опасность (возможность вредного воздействия - идентификация факторов риска)?
2. Насколько вероятно, что это произойдет (вероятность, что воздействие осуществится)?
3. Какова будет величина последствий, если данное событие случится (масштаб последствия этого вредного воздействия)?
В генно-инженерной деятельности термин «фактор риска» используют при определении потенциально возможных прямых и опосредованных неблагоприятных воздействий ГМО или продуктов, изготовленных из ГМО (включающих компоненты ГМО), на здоровье человека и (или) окружающую среду, обусловленные эффектом вставки рекомбинантной ДНК, функционирования трансгенов и передачей трансгенов от ГМО другим организмам. Под прямым воздействием понимается воздействие ГМО на здоровье человека и среду, не требующее анализа цепи взаимосвязанных событий. Под непрямым - опосредованное воздействие ГМО на здоровье человека и окружающую среду, которое осуществляется через цепь взаимозависимых событий. В частности, оно может проявляться вследствие взаимодействия ГМО с другими организмами, переноса генетического материала от ГМО другим организмам, изменений порядка эксплуатации объектов хозяйственной деятельности и управления ими, обусловленных высвобождением ГМО, и т. д. Немедленное воздействие ГМО на здоровье человека и окружающую среду наблюдается непосредственно в период осуществления генно-инженерной деятельности. Оно также может быть прямым и непрямым. Отдаленное воздействие становится очевидным в виде прямого или непрямого воздействия после окончания данной генно-инженерной деятельности.
Несмотря на различие подходов к организации оценки риска генно-инженерной деятельности в разных странах, ее сущность (методология) похожа в своих главных чертах. В Картахенском протоколе по биобезопасности к Конвенции о биологическом разнообразии рекомендована следующая методика проведения оценки риска (этапы оценки риска):
1) выявление любых новых генотипных и фенотипных характеристик, связанных с живым измененным организмом, который может оказать неблагоприятное воздействие на биологическое разнообразие в вероятной потенциальной принимающей среде, с учетом рисков для здоровья человека;
2) оценка степени вероятности фактического возникновения таких неблагоприятных последствий с учетом интенсивности и характера воздействия живого измененного организма на вероятную потенциальную принимающую среду;
3) оценка последствий в том случае, если такое неблагоприятное воздействие действительно будет иметь место;
4) оценка совокупного риска, вызываемого живым измененным организмом, на основе оценки вероятности возникновения и выявленных последствий неблагоприятного воздействия;
5) вынесение рекомендации относительно того, являются ли риски приемлемыми или регулируемыми, включая, если это необходимо, определение стратегий для регулирования таких рисков.
При этом оценка риска должна базироваться на следующих принципах:
✵ оценку риска следует проводить на научной основе, ясным, адекватным способом, базирующимся на подходящих предмету рассмотрения научных и технических данных;
✵ оценку риска необходимо проводить на основе индивидуального подхода, последовательно, шаг за шагом, подразумевая, что требуемая информация меняется в зависимости от типа, рассматриваемого ГМО, способа его предполагаемого использования и потенциальной среды высвобождения;
✵ риски, связанные с ГМО или содержащими их продуктами, должны рассматриваться в контексте рисков, существующих при использовании
интактных (немодифицированных) реципиентных организмов в потенциальной принимающей среде;
✵ в случае поступления новой информации о ГМО и его воздействиях на здоровье человека и окружающую среду результаты оценки риска могут быть пересмотрены для определения, изменилась ли степень риска и есть ли необходимость в изменении системы управления риском.
11.1.2. Природа рисков для здоровья человека и окружающей среды, связанных с генетически модифицированными организмами
Для лучшего понимания природы рисков, связанных с ГМО, уместно напомнить, что из себя представляют генетически модифицированные организмы и чем они отличаются от обычных, немодифицированных. В Картахенском протоколе по биобезопасности содержится следующее их определение: живой измененный организм означает любой живой организм, обладающий новой комбинацией генетического материала, полученной благодаря использованию современной биотехнологии (Картахенский протокол по биобезопасности, ст. 3).
Таким образом, какой-либо трансгенный сорт растения отличается от исходного тем, что в его геном к существующим генам добавлен относительно небольшой фрагмент ДНК, в котором записана информация об одном-двух новых генах и их регуляторных элементах. Активность этих добавленных генов в организме выражается в биосинтезе одного-двух новых для организма протеинов (ферментов или структурных белков). Поскольку генетическая инженерия может оперировать любыми генами, существующими в природе, а не только генами от организмов, состоящих в эволюционном родстве с отдельными видами культурных растений, как это делается в традиционной селекции, то продукты привнесенных генов (ферменты, протеины) могут выглядеть в генетически модифицированном организме как необычные, несвойственные, чужеродные для данного вида, которые в природе у него не встречаются. Соответственно именно продукты трансгенов являются наиболее существенными факторами рисков, связанных с ГМО.
К факторам риска не относят добавленный фрагмент ДНК: нет никаких научно обоснованных указаний на токсичность для человека ДНК трансгенов perse. Люди ежедневно съедают в среднем 0,1-1 г ДНК в составе различных продуктов. Поэтому ДНК трансгена не является новым, особенным компонентом в рационе человека и присутствует в нем в чрезвычайно малом количестве. Десятилетия исследований не выявили токсического воздействия трансгенной ДНК на организм человека и других млекопитающих. Нет достоверных сведений о случаях вставки трансгенной ДНК, поступившей в организм с продуктами питания, в геном человека. Защитные механизмы млекопитающих (гидролитическое разрушение ДНК в процессе переваривания, исключение чужеродной ДНК из генома реципиента в ходе репаративных процессов, препятствие экспрессии встроенных генов вследствие их целевого метилирования и др.) противодействуют встраиванию чужеродной ДНК в геном человека
и ее экспрессии. Таким образом, вероятность вредного влияния на здоровье человека, обусловленного потреблением трансгенной ДНК, минимальна.
Что касается рекомбинантных протеинов, то не во всех ГМО они абсолютно чужеродные, несвойственные для определенного вида растений соединения. Во-первых, существует достаточно большая группа трансгенных сортов растений, которые получены благодаря генетическим манипуляциям с их собственными генами (см. гл. 9, табл. 9.2; гл. 10).
Во-вторых, многие весьма отдаленные в эволюционном плане организмы имеют большое количество идентичных путей метаболизма, и соответственно состав и строение ферментов, которые обеспечивают их реализацию, также идентичны. В качестве примера можно привести фермент EPSPS (см. раздел 10.1), который является ключевым в биосинтезе ароматических аминокислот у всех растений, грибов, бактерий. Бактериальный EPSPS, образующийся у трансгенной сои, толерантной к гербициду глифосату, успешно выполняет соответствующие функции в растительном организме после обработки растений гербицидом, когда растительный EPSPS сои дезактивирован. При оценке безопасности таких близких по функциональной активности генов обращают внимание не столько на сам белок - продукт трансгена, сколько на возможное изменение отдельных путей метаболизма трансгенного растения из-за повышения концентрации одного из их компонентов. В случае EPSPS при оценке безопасности генетически модифицированной сои принималось во внимание, что этот фермент катализирует реакцию, не лимитирующую конечную скорость синтеза ароматических аминокислот, поэтому, как и ожидалось, показатели их синтеза у ГМО не отличались от таковых у исходных растений.
В-третьих, последние научные данные, полученные в результате секвенирования геномов человека, некоторых животных и растений, существенно расширили наши представления о сходстве и отличиях генов разных систематических групп и вероятности их переноса от одной отдаленной систематической группы к другой (горизонтальный перенос генов). Оказалось, что в геноме арабидопсиса присутствует около сотни генов, встречающихся в геноме человека. Таким образом, в природе происходит обмен генетической информацией между отдаленными видами. Тем не менее любой ученый, планируя добавить растению, микроорганизму или животному какой-либо новый ген, должен тщательно изучить сам этот ген, а также продукт его активности и убедиться в их безопасности.
Вторая основная группа рисков связана с самим фактом вставки трансгенов в генетический материал организма. Вместе с проявлением целевых признаков генетической модификации (преднамеренный эффект) в результате вставки чужеродной ДНК в ГМО могут проявляться дополнительные признаки или предсуществующие признаки могут претерпеть изменения (непреднамеренный эффект). Непреднамеренные эффекты генетической модификации (НЭГМ) теоретически могут возникать в результате случайного встраивания последовательностей ДНК в геном растения, вызывающего прекращение экспрессии или изменение уровня экспрессии ранее активных генов, начало экспрессии ранее «молчавших» генов. Кроме того, такие эффекты могут быть следствием изменения особенностей метаболизма у реципиентного организма. Одни НЭГМ могут быть частично предсказуемыми на базе знаний о процессе трансформации, месте встраивания трансгена, функциях его продуктов (включая влияние на метаболизм). Другие НЭГМ являются непредсказуемыми (область научной неопределенности).
НЭГМ могут быть опосредованы как плейотропным действием встроенного гена, так и свойствами самой встроенной конструкции, в том числе ее нестабильностью и возможным действием на соседние гены. Встраивание в геном чужеродного генетического материала может сопровождаться перестройками в структуре введенной генетической конструкции и генома растения-хозяина. Экспрессия трансгенов может различаться в зависимости от копийности вставки, ее структуры, особенностей области встраивания вставки в геном и др. В связи с этим каждое конкретное генно-модифицированное растение характеризуется определенным уровнем экспрессии и наследования привнесенного генетического материала, вероятностью появления НЭГМ. Не случайно один из важнейших принципов биобезопасности - это индивидуальный подход: проводят тщательную оценку безопасности для здоровья человека и окружающей среды каждого конкретного трансгенного события (линии).
Наконец, третья основная группа рисков, связанных с ГМО, основана на неблагоприятных эффектах, вызванных переносом трансгенов другим организмам: вертикальным переносом генов от ГМО немодифицированным растениям того же вида или диким сородичам культурного вида, горизонтальным переносом генов, например, селективных генов устойчивости к антибиотикам, от генетически модифицированного растения микроорганизмам пищеварительного тракта. Гены и их продукты, безвредные у ГМО, могут оказаться опасными в другой генетической и экологической среде. Так, приобретение болезнетворными бактериями пищеварительного тракта устойчивости к антибиотикам может существенно затруднить лечение болезней, которые они способны вызывать.
11.2. Возможные неблагоприятные воздействия ГМ-растений на здоровье человека, методы их оценки и способы предупреждения
Среди потенциальных рисков для здоровья человека, связанных с использованием ГМО, рассмотрим следующие.
1. Синтез новых для реципиентного организма белков - продуктов трансгенов, которые могут быть токсичными и/или аллергенными. Токсический (аллергенный) потенциал исходного организма-хозяина может возрасти в результате генетической модификации по ряду причин. Во-первых, токсичным (аллергенным) для человека может быть сам продукт трансгена (например, если он принадлежит к белкам, не являющимся компонентами традиционных для производства продуктов питания организмов и не имеющим истории безопасного потребления). Во-вторых, в результате встраивания трансгена возможно увеличение уровня продуцируемых естественных токсических веществ и антагонистов питательных веществ реципиентного растения, что в свою очередь может привести к росту уровня их потребления и к возрастанию вероятности неблагоприятного воздействия на здоровье людей. В-третьих, токсический потенциал исходного растения может вырасти вследствие изменения его метаболизма и аккумуляции у него токсичных метаболитов.
2. Изменение активности отдельных генов живых организмов под влиянием вставки чужеродной ДНК, в результате которого может произойти ухудшение потребительских свойств продуктов питания, получаемых из этих организмов. Например, в генетически модифицированных продуктах может быть повышенный по сравнению с реципиентными организмами уровень каких-либо антипитательных веществ, превышающий установленные пределы безопасности, или пониженный уровень питательных веществ.
3. Горизонтальная передача трансгенов другим организмам, в частности маркерных генов устойчивости к антибиотикам от ГМО микроорганизмам пищеварительного тракта. Наличие и экспрессия в ГМО генов устойчивости к антибиотикам, которые необходимы для отбора трансформированных клеток, вызывают серьезные опасения и являются предметом научных дискуссий. Если горизонтальный перенос селективных генов происходит с относительно высокой частотой, он может негативно сказаться на эффективности традиционной антибиотикотерапии человека и домашних животных.
Как видим, обусловленные ГМО риски для здоровья человека в основном связаны с потреблением продуктов, полученных из них или произведенных ими. Стратегия и методы оценки качества традиционных продуктов питания и оценка безопасности новых продуктов (изготовленных по новым технологиям, с применением новых пищевых добавок и пр.) хорошо отработаны и показали высокую эффективность. Многие из них могут быть использованы и для оценки безопасности ГМ-продуктов.
11.2.1. Методы оценки качества и безопасности традиционных продуктов питания
В большинстве случаев оценка качества и безопасности традиционных продуктов заключается в анализе возможных неблагоприятных воздействий на здоровье человека пищевых добавок (красителей, эмульгаторов, консервантов и др.) и пищевых загрязнителей (остатков пестицидов, лекарственных ветеринарных средств, гормональных препаратов, микотоксинов и др.).
На первом (подготовительном) этапе проводится предварительная оценка потенциала токсичности загрязнителей. Оцениваемые потенциально опасные пищевые загрязнители идентифицируются аналитическими лабораторными методами; исследуются их физико-химические свойства. Главной составляющей этого этапа оценки риска является первичная токсикологическая оценка исследуемых агентов в остром эксперименте на модельных животных (в основном на грызунах). Острая токсичность определяется неблагоприятными эффектами, регистрируемыми у лабораторных животных после однократного принудительного скармливания им исследуемых загрязнителей. Для скармливания используют химически чистые оцениваемые вещества в различных дозировках (максимальные дозы могут быть 2000-5000 мг/кг). По результатам острого эксперимента определяются показатель токсичности загрязнителя LD50, являющийся статистически рассчитанной дозой вещества, которая при однократном скармливании может вызвать гибель 50 % животных. Он выражается в единицах массы оцениваемого вещества в пересчете на массу тела животного (мг/кг) и определяет, способен ли оцениваемый пищевой компонент вызывать острую токсическую реакцию организма. Кроме того, в тесте на острую токсичность вещества проводят обязательные наблюдения над животными, оценивают изменения веса тела, кожных покровов, шерсти, слизистых оболочек, состояния кровеносной, респираторной и центральной нервной систем, поведенческих и соматомоторных реакций.
На втором (основном) этапе оценки безопасности традиционных продуктов питания в серии испытаний определяется характер токсикодинамики идентифицированных агентов (биологический механизм токсического воздействия) и их токсикокинетика (характер химического, биохимического превращения в организме). Экспериментально установленная на втором этапе исследований зависимость «доза - эффект» определяет вероятность неблагоприятного воздействия исследуемого загрязнителя при обычном для данной популяции людей уровне его потребления (т. е. токсикологический потенциал исследуемого агента). Оценка принятого уровня потребления продукта включает в себя измерение среднесуточного объема потребления, частоты потребления и продолжительности потребления. Учитывая все вышеназванные параметры, оценивают риск неблагоприятного воздействия токсичного агента.
Оценка риска токсичности на данном этапе осуществляется в ходе субхронического эксперимента на лабораторных животных. Субхронический эксперимент моделирует реальную ситуацию потребления оцениваемого агента человеком и потому имеет наибольшее значение среди других тестов. Он предоставляет исследователю обширную информацию о точках приложения токсикантов (биологических «мишенях»), характере их неблагоприятного воздействия. При необходимости исследуются также специфические неблагоприятные эффекты токсинов: их генотоксичность, канцерогенность и мутагенность, репродуктивная, онтогенетическая токсичность и иммунотоксичность.
В субхроническом эксперименте проводят принудительное скармливание вещества животным ежедневно в течение 28-90 дней. Используют ряд доз, каждая группа животных получает только одну определенную дозу испытуемого вещества. Уровень доз выбирают по имеющимся предварительным данным его токсичности. Наивысшая дозировка должна вызывать явный токсический эффект, но не приводить к массовой гибели животных. Понижая дозировку, в тесте определяют пороговую дозу вещества, которая не вызывает регистрируемого неблагоприятного воздействия, - так называемый показатель NOAEL (от англ. no observed adverse effect level). Токсический эффект вещества определяют на основании ряда показателей: изменения веса тела животного, уровня потребления пищи и воды, характера токсической реакции в зависимости от дозы вещества, данных анализа крови и гистологических исследований, уровня смертности и др.
Результаты испытания токсичности пищевых компонентов в острых и хронических тестах на животных экстраполируются далее на человека (условно третий этап оценки). Оценка токсичности в итоге сфокусирована на определении уровня дневного потребления исследуемого агента человеком (с учетом веса тела), которое не оказывает вредного воздействия на здоровье (так называемая приемлемая доза дневного потребления (англ. acceptable daily intake, ADI)). Показатель ADI рассчитывают, исходя из установленной в эксперименте величины NOAEL с учетом коэффициента безопасности. В большинстве случаев в применении к человеку для определения ADI используется коэффициент 100 (ADI = NOAEL/100): предполагается, что человек приблизительно в десять раз имеет более высокую чувствительность к токсинам, чем животные, кроме того, допускаются различия (до десяти раз) в чувствительности между отдельными индивидуумами.
Следует отметить, что риск, связанный с потреблением продуктов питания, не определяется исключительно их загрязнением токсическими веществами или утратой ими качества (например, вследствие неправильного хранения). Абсолютно безопасных продуктов питания не существует. Даже традиционные продукты с продолжительной историей употребления в пищу могут содержать те или иные естественные для них компоненты, оказывающие неблагоприятные эффекты на здоровье человека (природные токсины, аллергены, антагонисты питательных веществ (антинутриенты), вещества с потенциальным мутагенным и канцерогенным действием и др.). Вероятность их неблагоприятного воздействия на человека определяется многими факторами: их содержанием в продуктах питания, взаимодействием с другими компонентами продукта, состоянием защитных систем индивида, экзогенными средовыми факторами, объемом продукта в пищевом рационе и многими другими. К настоящему времени идентифицированы и достаточно полно исследованы как экзогенные, так и многие естественные компоненты пищевых продуктов, которые оказывают вредный или положительный эффекты на здоровье человека. Естественные для продуктов питания потенциально опасные для здоровья человека вещества также не могут игнорироваться при оценке пищевой безопасности, как и эффекты различного рода контаминантов.
Несмотря на это, продукты и пищевое сырье, которые получены с использованием традиционных технологий, имеющих длительную историю применения, не представляют собой объекты скрупулезного и исчерпывающего исследования их безопасности и питательной ценности. Например, сорта растений, созданные методами традиционной селекции, не являются объектом испытаний острой и хронической токсичности в тестах на лабораторных животных. Исключением служат продукты, предназначенные для кормления грудных и малолетних детей. Относительная безопасность традиционных продуктов питания гарантируется длительной историей их безопасного использования человеком.
11.2.2. Применение концепции существенной эквивалентности для оценки безопасности ГМО и ГМ-продуктов питания
Как указывалось, выше, полученные путем традиционной селекции организмы не являются объектом скрупулезного анализа потенциальной токсичности, аллергенности, хотя известно, что они могут содержать ряд вредных соединений. При этом на основании длительного исторического опыта допускается, что новая комбинация генов, созданная в процессе традиционной селекции организмов, используемых для производства продуктов питания, и определяющая ряд новых для них признаков, не будет представлять угрозы для здоровья человека. Принимая во внимание данное допущение, а также методические проблемы, возникающие при исследовании цельных новых продуктов питания (ГМО как целого), в основу оценки их безопасности положена концепция существенной эквивалентности, разработанная экспертами OECD и дополненная FAO/WHO. Согласно определению OECD, концепция существенной эквивалентности предусматривает, что традиционные продукты или пищевое сырье могут служить базой для сравнения при оценке безопасности или питательной ценности новых продуктов, в том числе производных ГМО. Данный сравнительный подход предусматривает, что: 1) традиционные продукты не являются абсолютно безопасными; 2) в случае, если новые продукты питания или их компоненты эквивалентны по существенным характеристикам традиционным продуктам или пищевым компонентам, их можно использовать таким же образом, не ожидая вредных дополнительных эффектов для здоровья человека.
Следовательно, безопасность нового продукта должна рассматриваться не вообще, а по отношению к традиционному аналогу. Определение «традиционный аналог» в приложении к ГМО или ГМ-продуктам означает близкородственный организм, его компонент или сходные продукты, для которых имеется значительный опыт безопасного потребления в качестве пищи. Лучший аналог для определения существенной эквивалентности - исходный для генетической модификации организм (родительская, практически изогенная линия). Однако такой аналог не всегда доступен. В этом случае OECD рекомендует использование нескольких генетически близких контрольных образцов (других сортов того же вида растений, близких штаммов микроорганизмов, пород животных) или сходных продуктов, уже присутствующих на товарном рынке, чтобы определить, являются ли выявленные различия следствием естественной вариации либо следствием генетической модификации.
Существенная эквивалентность ГМО и аналога устанавливается путем демонстрации того, что значимые для оценки пищевой безопасности характеристики ГМО и новых продуктов сходны с таковыми у традиционных аналогов. Таким образом, анализ существенной эквивалентности предполагает прежде всего композиционный анализ ГМО (нового продукта) и его аналогов. При этом исследуются ключевые компоненты сравниваемых организмов (продуктов), которые наиболее важны для здоровья человека: питательные вещества и их антагонисты; токсичные вещества, аллергены и др. Среди ключевых питательных веществ выделяют главные (жиры, белки, углеводы) и минорные (минералы, витамины); к антагонистам питательных веществ относятся в основном ингибиторы определенных ферментов. Под ключевыми токсинами подразумевают известные природные соединения и вещества, присутствующие в оцениваемом сырье или продуктах, обладающие существенной для здоровья человека токсической потенцией (например, гликоалкалоиды в картофеле).
Для идентификации в новых продуктах и исходном сырье отличных от аналогов признаков, влияющих на уровень безопасности и питательную ценность пищевых продуктов, тщательному анализу подвергается информация, касающаяся характеристик исходного организма, от которого взят ген, предназначенный для трансгеноза, а также характера генетической модификации. Далее проводят сравнительный анализ генетически модифицированного организма и исходного (немодифицированного) организма. Для этого сопоставляют агрономические показатели, продукты встроенных генов, состав ключевых химических компонентов (в том числе питательных и антипитательных), профиль основных метаболитов, эффекты переработки исходного сырья.
Новый продукт (сорт растений) может быть:
✵ эквивалентным (равноценным) по существенным признакам выбранному аналогу;
✵ эквивалентным аналогу, за исключением одного (нескольких) существенного, хорошо определяемого признака;
✵ не эквивалентным аналогу по существенным признакам.
В двух последних случаях проводится тщательная оценка безопасности отличных от исходного аналога признаков ГМО по таким показателям, как потенциальная токсичность, потенциальная аллергенность, возможность переноса генов устойчивости к антибиотикам микроорганизмам пищеварительного тракта, вероятность потенциального ухудшения пищевой ценности и усвоения питательных веществ.
11.2.3. Оценка потенциальной токсичности новых для организма-хозяина продуктов трансгенов
С точки зрения здоровья человека явление токсичности может быть охарактеризовано как причина заболевания химической этиологии (отравление) и как фактор, вызывающий повреждение тканей (типовой патологический процесс), вследствие которого возникает соответствующее патологическое состояние.
Чужеродные гены переносят в трансформируемый организм для передачи ему желательных признаков. Фенотипическое проявление данных признаков обусловлено синтезом новых для организма-реципиента соединений белковой и небелковой природы. Такими синтезируемыми в результате вставки трансгена соединениями могут быть традиционные компоненты продуктов питания: белки, жиры, углеводы, витамины, которые являются новыми только в контексте определенных исходных организмов и ГМО. Кроме того, продуктами трансгенов могут быть целевые белки, не являвшиеся ранее компонентами продуктов питания и соответственно не имеющие длительной истории безопасного употребления человеком. Новыми по отношению к реципиенту могут быть также метаболиты, образовавшиеся в ГМО в результате активности трансгенного фермента. Оценка потенциальной токсичности продуктов трансгенов подразумевает следующее:
✵ определение химической природы, функций новых синтезирующихся соединений, а также их концентрации в продукте питания с учетом естественной вариации;
✵ анализ информации о характере генетической модификации и ГМО для получения уверенности в том, что гены донора, отвечающие за синтез известных токсичных и антипитательных веществ, не экспрессируются в ГМО;
✵ если новое соединение является традиционным пищевым компонентом с известными биологическими функциями (например, каротин в «Золотом рисе») и его концентрация в продукте не превышает обычных пределов варьирования, специальные тесты на токсичность могут не проводиться. В других случаях такие тесты необходимы;
✵ в случае новых, не имевших истории употребления в пищу белков, оценка их потенциальной токсичности сфокусирована на определении следующих характеристик: уровня сходства их аминокислотной последовательности с аминокислотной последовательностью известных токсичных белков; уровня их физико-химической стабильности. В отдельных случаях (см. ниже) для оценки токсичности белков необходимы тесты на модельных животных;
✵ потенциальная токсичность небелковых соединений оценивается на индивидуальной основе в зависимости от их биологической функции и доли в обычной диете. В данном случае необходимо исследование метаболизма, токсикокинетики, субхронической токсичности, хронической токсичности, канцерогенности, репродукционной токсичности и др.
Наиболее часто продуктами трансгенов коммерчески используемых ГМО являются определенные белки. Поэтому процедура оценки их потенциальной токсичности ниже рассматривается более подробно. Известно, что существует ряд важных различий в токсическом воздействии на человека белков и промышленных химикатов небелковой природы. Белки обычно не токсичны в острых экспериментах на модельных животных, и нет известных случаев, чтобы они демонстрировали хроническую токсичность, например, обладали мутагенным, канцерогенным эффектами. Отдельные белковые токсины хорошо изучены и высокоспецифичны. Белки, в отличие от химикатов, обычно быстро перевариваются в желудочно-кишечном тракте человека и теряют свою активность. Они также не обладают способностью к биоаккумуляции (накоплению), как некоторые вредные химические вещества. С учетом данных особенностей оценка токсического потенциала трансгенных белков несколько отличается от вышеуказанной процедуры оценки токсичности промышленных и иных загрязнителей пищевых продуктов. Она призвана дать ответы на следующие вопросы:
✵ Каково предполагаемое количество оцениваемого белка в обычном рационе человека?
✵ Вызывает ли оцениваемый новый белок регистрируемые неблагоприятные (токсические) эффекты, когда употребляется в пищу в количествах, значительно превышающих установленные дозы потребления?
✵ Переваривается ли новый оцениваемый белок в желудочно-кишечном тракте человека?
✵ Разрушается ли новый оцениваемый белок в процессе переработки продуктов питания?
Оценка содержания нового белка в обычной диете человека необходима для дальнейшего анализа его потенциальной токсичности (неблагоприятные токсические эффекты в большинстве случаев зависят от дозы токсичного агента). Данные о вероятном потреблении исследуемого агента собирают в зависимости от специфики питания разных групп населения: национальных групп, возрастных групп, кормящих матерей и др. Такая оценка может быть достаточно сложной, поскольку ГМО относительно редко употребляются в пищу сами по себе, а чаще служат компонентами разнообразных продуктов питания. Потребляемое количество трансгенных белков, как правило, минимально по сравнению с общим количеством потребляемого белка. Однако даже оно теоретически может вызвать неблагоприятные для здоровья человека реакции.
Базовым элементом изучения структуры белков, кодируемых встроенным геном, является оценка их соответствия известным последовательностям аминокислот, прежде всего белкового продукта, заявляемого трансгена (при встраивании в геном возможно изменение структуры ДНК вставки). Для этого обязательным является осуществление сиквенса ДНК белок-кодирующей части трансгена. Полученная информация применяется также для оценки гомологии аминокислотной последовательности белкового продукта трансгенной вставки с известными токсинами и аллергенами, для чего используют соответствующую информацию международных баз данных (табл. 11.1). Желательно проводить секвенирование экспрессируемой части встроенной ДНК. Из трансгенного растения выделяют мРНК, получают на ее основе кДНК, затем проводят амплификацию фрагмента кДНК с праймерами, специфичными для трансгенной вставки или отдельных ее частей (метод ОТ-ПЦР; см. раздел 9.6), продукты амплификации элюируют из геля и секвенируют. Анализ результатов секвенирования проводят с помощью специальных компьютерных программ, например пакета программ Chromas Pro Version 1.5. Степень идентичности полученных последовательностей последовательностям, включенным, например в базу данных NCBI (англ. National Centre for Biotechnology Information - Национального центра биотехнологической информации США), осуществляют при помощи пакета программ NCBI Standard Nucleotide BLAST (http://www.ncbi.nlm.nih.gov/tools/primer-blast/).
Таблица 11.1. Международные электронные базы данных для оценки токсичности и аллергенности пептидов
Название базы данных |
Интернет-адрес |
По токсичности белков |
|
SuperToxic: Database of toxic compaunds (Structural bioinformatics grup, Charite, Berlin) |
http://bioinformatics.charite.de/supertoxic |
Drug-Induced Toxicity Related Proteins |
http://bioinf.xmu.edu.cn/databases/ADR/ index.html |
EMBL-EBI (InterPro protein sequence analysis & classification) |
http://www.ebi.ac.uk/interpro/databases. html |
PhytAMP |
http://phytamp.pfba-lab-tun.org/ |
PepBank |
http://pepbank.mgh.harvard.edu/ |
По аллергенности белков |
|
Allermatchtm databases |
http://www.allermatch.org/database.html |
SDAP - Structural Database of Allergenic Proteins |
http://fermi.utmb.edu/SDAP/ |
University of Nebrasca-Lincoln Allergen- online |
http://www.allergenonline.org/ databasebrowse.shtml |
Allergen nomenclature (IUIS Allergen nomenclature Sub-Committee) |
http://www.allergen.org/ |
Для оценки токсичности инструментальными методами обычно используются очищенные с помощью рутинных биохимических методов исследуемые белки ГМО либо идентичные им по структуре белки, полученные методом микробиологического синтеза. Исследования включают ряд специальных тестов, характер и количество которых определяются в каждом конкретном случае. В частности, новые белки проходят тест на устойчивость к перевариванию ферментами желудочно-кишечного тракта, на стабильность в среде с низкой рН, на устойчивость к термообработке. Относительная устойчивость к этим факторам указывает на возможность длительного сохранения биологической активности, поступившего с пищей трансгенного белка в организме человека (в том числе на его потенциальную токсичность). Если доказано структурное сходство оцениваемого трансгенного белка с известными токсинами и (или) его устойчивость к деструктивным физико-химическим условиям среды, то в таком случае требуется его дальнейшая токсикологическая оценка. Негативные результаты предварительных тестов указывают на то, что вероятность токсичности данного белка очень мала. Однако даже при негативном результате предварительных исследований оценка токсичности может быть продолжена.
Дополнительные исследования потенциальной токсичности осуществляются, если:
1) уровень продукции оцениваемых белков в ГМО достоверно больше, чем уровень продукции аналогичных природных белков;
2) оцениваемые белки имеют известный уровень токсичности (пусть даже не по отношению к человеку, например, Bt-протеин) или являются природными агентами с антибиологическими функциями (например, PR (от англ. pathogenesis related) - белки, сверхпродукция которых в растениях обусловливает их устойчивость к болезням и вредителям);
3) новый белок не имел истории безопасного употребления в пищу (например, GFP (от англ. green fluorescent protein) - маркерный флюоресцирующий белок для выявления трансформированных организмов);
4) предварительные тесты показали высокий уровень устойчивости новых белков к физико-химической деградации.
Дальнейшие исследования токсичности проводятся на индивидуальной основе в зависимости от конкретного оцениваемого белка. Обычно они вклю-
чают в себя традиционные для токсикологических анализов тесты: определение токсичности в острых и субхронических (10-90-дневных) экспериментах по скармливанию очищенного белка лабораторным животным с определением показателей LD50, ADI, NOAEL. Хронические испытания применяются редко, так как известные токсичные белки действуют обычно через острый механизм при низких дозах, а хроническая токсичность каких-либо белков не доказана. Токсическое действие белковых агентов по результатам испытаний на модельных животных определяют по таким показателям, как уровень смертности, динамика привеса тела, изменение массы отдельных органов, а также более специфическим параметрам, например уровню пролиферации клеток определенных тканей, уровню иммунной защиты и др. Кроме того, в практике оценки пищевой биобезопасности используется ряд других, узконаправленных тестов: анализ связывания оцениваемого белка с рецепторами клеток желудочно-кишечного тракта млекопитающих; анализ его гемолитического потенциала, иммунотоксичности, эмбриотоксичности и др.
Поскольку при исследовании токсичности ГМО и новых продуктов питания используется комплексный подход, прямые испытания токсичности продукта в опытах по его принудительному скармливанию лабораторным животным являются наиболее доказательными. Если испытуемый ГМО эквивалентен аналогу за исключением экспрессии продуктов трансгена, то в экспериментах по скармливанию лабораторным животным используется очищенный трансгенный белок, дозировку которого можно варьировать без нарушения общего баланса питания. В данном случае постановка эксперимента аналогична принятым испытаниям на токсичность пищевых добавок и контаминантов продуктов питания.
В ряде случаев представляется целесообразной дополнительная оценка риска токсичности с использованием цельных продуктов. Испытание цельных продуктов в тестах на модельных животных проводят тогда, когда новые продукты питания составляют значительную долю в пищевом рационе определенных групп населения, и в случаях, когда не было длительной истории употребления в пищу белковых или иных продуктов трансгенов. Кроме того, такие тесты оправданы, когда трансгенный белок влияет на пути метаболизма ГМО или если высок уровень научной неопределенности относительно его потребления. Для субхронических испытаний безопасности цельного продукта питания на модельных животных рекомендован 90-дневный тест. В нем применяется максимально возможная дозировка оцениваемого продукта, не нарушающая пищевой баланс животных. При этом используемая доза не должна быть ниже средней дневной нормы потребления оцениваемого продукта человеком.
11.2.4. Оценка риска потенциальной аллергенности ГМ-продуктов
Пищевая аллергия - это неблагоприятная для человека иммунологическая реакция, развивающаяся в ответ на попадание в организм определенных экзогенных веществ - аллергенов. Пищевой аллерген - компонент продуктов питания, который стимулирует развитие неблагоприятной иммунной реакции у страдающих пищевой аллергией индивидов. Тот или иной продукт может содержать от одного до целого ряда аллергенов, которые в подавляющем большинстве случаев являются белками.
Различают несколько типов неблагоприятных иммунных реакций на пищевые белки. Наиболее встречаемый тип пищевой аллергии относится к типу I, который сопровождается выработкой в организме антител с особой клеточной аффинностью (способностью связываться с мембранами ряда специализированных клеток). Антитела - специализированные иммунные эффекторные белки сыворотки крови (иммуноглобулины), специфически распознающие чужеродные для организма макромолекулы - антигены (в основном чужеродные белки и белковые комплексы) и участвующие в их элиминации. Антитела продуцируются специализированными клетками иммунной системы в ответ на проникновение в организм чужеродных антигенов. Выделяют 5 классов антител, различных по своей структуре, которые совместно с другими специализированными белковыми и клеточными компонентами иммунной системы участвуют в защите организма от генетически чужеродных веществ.
Аллергическую реакцию типа I определяют, как приобретенную гиперчувствительность организма немедленного типа к относительно безвредным экзогенным веществам - аллергенам (в том числе к безвредным в общем случае компонентам продуктов питания). В отличие от защитных реакций иммунитета аллергическая реакция типа I неблагоприятна для человека и связана с выработкой повышенного количества особого класса антител - IgE, направленных против специфических аллергенов. Ее симптомы могут наступать спустя минуты после контакта компонентов системы иммунитета с аллергеном.
К особенностям IgE-опосредованных аллергических заболеваний можно отнести следующие. Во-первых, только небольшое количество антигенов, обладающих потенциальной способностью вызывать иммунный ответ, являются аллергенами. Во-вторых, далеко не все индивидуумы в одинаковых условиях среды реагируют на контакт с аллергеном. Хотя у всех людей продуцируется какое-то количество антител класса Е, только некоторая часть индивидов становятся чувствительными при попадании в организм чужеродных белков внешней среды и развивают IgE-опосредованный аллергический иммунный ответ. Приобретение чувствительности - сложный процесс, зависящий от природы конкретного человека и времени первого контакта с аллергеном.
По сравнению с другими видами аллергий пищевая IgE-зависимая аллергия встречается довольно редко (у 0,3-8 % детей в зависимости от возраста и у 1-2 % взрослого населения). Дети в большей степени подвержены пищевой аллергии вследствие неполной зрелости их IgE-системы иммунитета и неполной физиологической зрелости. Они обычно «перерастают» пищевую аллергию, особенно на молоко, яйца и соевые бобы. Поэтому среди взрослого населения она распространена в гораздо меньшей степени, чем среди детей.
Более 90 % аллергических реакций, наблюдаемых у детей и взрослых, происходит при употреблении в пищу восьми основных продуктов или групп продуктов. Это коровье молоко, яйца, рыба, морские ракообразные (креветки, крабы), а также моллюски, арахис, соя, орехи (миндаль, грецкие орехи и др.), пшеница (табл. 11.2). Кроме того, еще около 160 других продуктов или пищевых компонентов вызывают аллергическую реакцию только у отдельных людей. Среди них отмечены большинство зерновых, масличных и овощныхпродовольственных культур, а также промышленно изготовленные продукты: пиво, шоколад и пр. Фактически все пищевые аллергены являются белками или гликопротеинами. Однако только очень низкий процент из многих тысяч пищевых белков - аллергены.
Таблица 11.2. Пищевые аллергены растительного и животного происхождения (по D. Metkalfe и др., 1996)
Видовое название растения или животного |
Традиционноеназвание |
Аллерген (систематическое и оригинальное название) |
Молекулярный вес kDa |
Аллергены растительного происхождения |
|||
Arachis hypogea |
Арахис |
Ara h 1 |
|
Bertholletia ecscelsa |
Бразильский орех |
Ber e 1 (2S альбумин) |
|
Brassica juncea |
Горчица листовая |
Braj 1; 2S альбумин |
14 |
Sinapis alba |
Горчица белая |
Sin a 1 (2S альбумин) |
14 |
Glycine max |
Соя |
Глицин (субъединица AlaBx, субъединица А2В1а, субъединица А3В4 и др.), β-конглицинин (α-субъединица, субъединица CG4), соевый лектин (соевый агглютинин), ингибитор трипсина Куница (Kunitz) |
|
Hordeum vulgare |
Ячмень |
Hor v 1; BMAI-1 (α-амилаза/ин- гибитор трипсина) |
15 |
Oriza sativa |
Рис |
RAP (рисовый аллергенный белок), RAG1 (рисовый аллерген 1) |
|
Phaseolus vulgaris |
Фасоль |
PR-1 (белок, связанный с патогенезом - 1) |
|
Triticum aestivum |
Пшеница мягкая |
WGA (зародышевый агглютинин A, D пшеницы) |
|
Triticum durum |
Пшеница твердая |
WGA (зародышевый агглютинин пшеницы) |
|
Аллергены животного происхождения |
|||
Bos taurus |
Крупный рогатый скот |
BSA (бычий сывороточный альбумин), β-лактоглобулин (белок молока), α-лактальбумин (белок молока), казеин (типы α-S1, М-S2, β-) |
|
Gadus callaria |
Треска |
Gad c1; allergen M, β-парваль- бумин |
12 |
Аллергены животного происхождения |
|||
Gallus domesticus |
Домашние куры |
Gal d1 (овомукоид), |
28 |
Gal d2 (овальбумин) |
44 |
||
Gal d4 (лизоцим) |
14 |
||
Metapenaeus ensis |
Креветки |
Met el; тропомиозин |
34 |
Обычно аллергены - это хорошо растворимые белки (водорастворимые альбумины и солерастворимые глобулины) с молекулярной массой 10-80 тыс. дальтон и кислотной изоэлектрической точкой. Большинство аллергенных белков характеризуется стабильностью к перевариванию в желудочно-кишечном тракте и к разным видам переработки (в том числе термической). Эти свойства позволяют им сохранить свою структуру вплоть до попадания в кишечник и преодолевать барьер слизистой ткани кишечника в иммунологически интактной форме. Характерная молекулярная масса и относительная устойчивость к физико-химическим разрушающим воздействиям служат косвенными показателями аллергенного потенциала белков (см. ниже), однако они не имеют абсолютной надежности при оценке риска аллергенности. В частности, существует множество термолабильных или частично термолабильных пищевых аллергенов. Некоторые аллергенные белки имеют молекулярную массу ниже характерной (например, липидопереносящие белки растений - 9 тыс. дальтон; белок кожуры семян сои - 8 тыс. дальтон). В отдельных случаях термообработка может не снижать, а даже увеличивать аллергенность белков, в частности в результате их химического гликозилирования (например, в случае β-лактоглобулина коровьего молока, некоторых белков ракообразных).
Риск того, что в ряде ГМ-продуктов питания (изготовленных из ГМО, включающих ГМО или являющихся ГМО) может возрасти аллергенный потенциал, в значительной степени обоснован. Известно, что многие белковые аллергены обладают биологической активностью, которая может найти применение в трансгенных организмах (может быть целевым эффектом модификации). Например, многочисленные белки с потенциальной антимикробной, антигрибной активностью - известные аллергены. Важные запасные белки семян многих двудольных растений - 2S альбумины - одновременно главные аллергены горчицы, бразильского ореха, грецкого ореха, семян хлопчатника (см. табл. 11.2). В литературе описана попытка переноса гена, ответственного за синтез 2S альбумина, от бразильского ореха растениям сои в целях увеличения у нее содержания аминокислоты метионина и улучшения ее кормовых качеств. Однако продуцируемый в трансгенных растениях сои 2S альбумин, составивший значительную часть от общего соевого белка (6 %), оказался аллергенным для чувствительных к бразильскому ореху людей. И хотя этот сорт трансгенной сои предназначался исключительно для кормления животных, он не был допущен к коммерческому использованию. Данный пример весьма показателен в плане того, что существует реальный риск переноса генов, отвечающих за продукцию аллергенов, от организма-донора, обладающего аллергенным потенциалом, организму-реципиенту. Более того, если вероятность привнесения известного аллергенного белка в ГМО можно относительно просто проконтролировать, то сложнее оценить вероятный аллергенный потенциал новых для исходного организма трансгенных белков, у которых не было длительной истории употребления в пищу (например, GFP, Bt-протеина и др.).
Диагноз пищевой аллергии ставят пациенту, исходя из точной истории воспроизведения аллергических реакций при употреблении определенных продуктов и отсутствия данных реакций при исключении этих продуктов из его рациона. Потенциальный риск аллергенности новых продуктов питания состоит в том, что люди, чувствительные к аллергену - продукту трансгена, - не смогут идентифицировать данный провоцирующий аллергию компонент, если он будет включен в ряд продуктов питания. В этом случае будет сложно установить первопричину аллергической реакции, так как аллергию, вероятно, будут вызывать не сходные пищевые источники аллергена.
В процессе генно-инженерной модификации в исходный организм-хозяин включаются один или несколько трансгенов, ответственных за продукцию очень небольшой фракции (обычно менее 0,4 %) белка относительно общего содержания белка ГМО. Тем не менее, как указывалось выше, этого может быть достаточно для развития пищевой аллергии у чувствительных к ней людей. До настоящего времени не зафиксировано случаев аллергических реакций у людей от употребления новых продуктов питания или их трансгенных источников, высвобожденных для обращения на товарном рынке. Однако существует определенная вероятность того, что в процессе генетической модификации может быть увеличен аллергенный потенциал ГМО и соответствующих продуктов питания.
Теоретически такое увеличение аллергенного потенциала продуктов питания может произойти вследствие двух событий. Во-первых, экспрессия трансгенов, переданных исходному организму вследствие генетической модификации, может привести к продукции не свойственных ему ранее аллергенных белков (т. е. молекулярные продукты трансгенов могут быть аллергенами). Во-вторых, вероятно, что природный аллергенный потенциал организма-хозяина может быть увеличен вследствие непреднамеренных эффектов генетической модификации. Различные пищевые культуры, такие как арахис, авокадо, пшеница, характеризуются значительной вариабельностью количества аллергенов, и их уровень может подвергнуться дальнейшему изменению в результате генетической модификации. Кроме того, есть вероятность, что присущие организму-хозяину неаллергенные ранее белки после генетической трансформации станут аллергенными (например, вследствие гликозилирования).
Эксперты ряда международных организаций (ILCI - Allergy and Immunology Institute; IFBC - International Food Biotechnology Council; FAO/WHO) разработали систему оценки риска аллергенности новых продуктов питания и исходных ГМО, включающую ряд связанных анализов. Ниже приведена процедура оценки аллергенности, принятая экспертами FAO/WHO(рис. 11.1).
Рис. 11.1. Оценка риска аллергенности ГМ-пищевых продуктов. Последовательность тестов и решений, предложенная экспертами FAO/WHO (FAO/WHO, 2001; http://www.fao.org/es/csn/gm/biotech-e.htm)
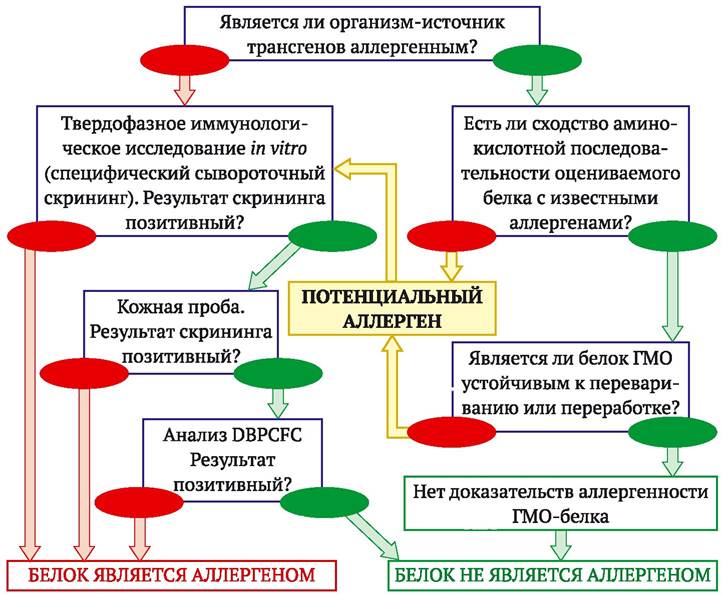
Процедура оценки риска начинается с характеристики аллергенного потенциала источника трансгенов (потенциальной аллергенности донорного организма). Протеин - продукт трансгена, который никогда не вызывал аллергической реакции при употреблении в пищу и не будет с большой вероятностью вызывать ее при экспрессии в трансгенном организме. Исходя из этого, на первом этапе оценки риска по имеющейся информации устанавливают: является ли источник трансгенов общепризнанным (главным) или минорным аллергеном, либо он не является известным аллергеном. Если источник трансгена принадлежит к указанным выше восьми главным или 160 минорным аллергенным источникам, то итоговый ГМО и соответствующие пищевые продукты признаются аллергенными, пока не доказано обратное.
После установления аллергенного потенциала организма-донора следующий шаг принятой процедуры - сравнение аминокислотной последовательности всех новых белков - продуктов трансгенов из аллергенных и неаллергенных источников с аминокислотной последовательностью известных аллергенов. В настоящее время идентифицирована аминокислотная последовательность более 200 аллергенов и созданы специальные компьютерные базы данных для сравнения структуры целевых белков ГМО и аллергенов (см. табл. 11.1). Цель сравнения аминокислотной последовательности - установление факта, является ли новосинтезируемый белок сходным по структуре с известными аллергенами. Структурное сходство считается установленным, если обнаружена 35 % идентичность последовательностей случайных фрагментов из 80 аминокислот или полная идентичность 6 последовательных аминокислот у сравниваемых белков (вероятный минимальный линейный эпитоп).
Позитивный результат структурного сравнительного анализа свидетельствует о том, что оцениваемый белок с большой вероятностью - аллерген, и ГМО не может высвобождаться для обращения на товарном рынке. Чтобы доказать обратное, требуются дальнейшие специфические иммунологические исследования. Структурное сходство с известными аллергенами может рассматриваться как существенное и в случае менее чем 35 % идентичности сравниваемых белков, если испытуемый белок принадлежит к семействам белков, содержащим ряд известных аллергенов. Примерами могут быть липокалины, напины (2S альбумины семян), парвальбумины и др. Если рассматриваемый белок принадлежит к таким семействам, он с большой вероятностью может быть аллергеном для человека. Негативный результат структурного анализа свидетельствует о том, что оцениваемый белок не относится к известным аллергенам и не обладает перекрестной реактивностью с известными аллергенами.
Кроме сравнительного анализа аминокислотной последовательности на первых этапах исследования проводится также физико-химический тест на устойчивость проверяемых белков к протеазам желудочно-кишечного тракта (тест на разрушение пепсином). Выше уже отмечалось, что аллергенами являются белки, в основном устойчивые к разрушению реагентами желудочно-кишечного тракта (иначе они не могут достигнуть в нативном состоянии реактивных тучных клеток слизистой кишечника). Стандартная процедура оценки протеолитической активности пепсина предусматривает обработку целевого белка раствором пепсина. Негативный результат теста говорит о том, что исследуемый белок лишь с небольшой (но требующей внимания) вероятностью может быть аллергеном. Напротив, устойчивость оцениваемых белков к разрушению пепсином в подходящих условиях показывает, что они могут быть аллергенами.
В совокупности предварительные непрямые тесты на аллергенность позволяют с определенной вероятностью судить о том, является ли оцениваемый белок аллергеном. Положительный результат свидетельствует о том, что с большой вероятностью тестируемые белки могут быть аллергенными (но это не обязательно так).
Отрицательный результат непрямых тестов не служит абсолютным доказательством того, что тестируемые белки не обладают аллергенным потенциалом. Поэтому после предварительной характеристики структурных и физико-химических особенностей исследуемых белков процедура оценки риска продолжается. Она предусматривает проведение специфических иммунологических исследований, окончательно устанавливающих, являются ли тестируемые белки аллергенами. Для белков, ведущих свое происхождение от известных аллергенных источников или имеющих структурную гомологию с известными аллергенами, процедура оценки риска рекомендует проведение так называемого специфического сывороточного скрининга. Это тесты in vitro на реактивность трансгенного белка со специфическими IgE из сыворотки крови людей, чувствительных к белкам организма-донора (из ДНК которого выделен трансген). Данные исследования показывают, распознаются ли анализируемые белки антителами IgE из сыворотки крови людей, чувствительных к аллергенам донора. Анализ in vitro может установить факт присутствия и количество аллергенного белка в исследуемых продуктах питания и в определенной степени показать изменение аллергенных свойств белка.
Стандартными, применяемыми для иммунологических исследований in vitro являются тесты твердофазной иммунологической диагностики - радио- аллергосорбентный анализ (RAST) и иммуноферментный анализ (ELISA). Например, в случае теста RAST сыворотка чувствительных индивидов инкубируется с испытуемым потенциальным аллергеном (экстрактом пищевых продуктов), закрепленным на подходящем твердофазном носителе. Аллерген-специфичные IgE связываются с закрепленным на носителе аллергеном и могут определяться при использовании меченных радиоактивным иодом антител против IgE человека.
Для получения достоверных оценок риска в тестах in vitro критической является доступность сыворотки крови достаточного количества индивидов, чувствительных к определенному аллергену. Анализ по возможности должен проводиться с 25 пробами сыворотки людей, страдающих пищевой аллергией. Испытания с использованием минимум восьми соответствующих сывороток необходимы для достижения 99 % достоверности того, что испытуемый белок не является главным аллергеном. Соответственно 24 сыворотки необходимы для достижения такой же достоверности в случае минорных аллергенов. При наличии, по крайней мере, 14 индивидуальных сывороток негативный результат специфического сывороточного скрининга с вероятностью более 99,9 % свидетельствует о том, что испытуемый белок не относится к главным аллергенам. В аналогичных условиях негативный результат с вероятностью более 95 % свидетельствует о том, что испытуемый белок не относится к минорным аллергенам, вызывающим аллергическую реакцию, по крайней мере, у 20 % чувствительных индивидов. Если тест in vitro дает положительный результат, ГМО или соответствующий продукт признаются аллергенными. При негативном результате теста (в совокупности с данными об отсутствии структурной гомологии испытуемого белка с известными аллергенами и отсутствии устойчивости к протеазам желудочно-кишечного тракта) трансгенный белок с большой вероятностью не будет аллергеном.
В случае клинического анализа аллергенности трансгенных белков in vivo обычно используется кожный тест (SPT - англ. skin prick test). Экстракты нужной концентрации, выделенные из организма-реципиента, донора и ГМО (пищевых продуктов, полученных на их основе), вводятся в эпидермальный слой кожи чувствительных индивидов. В течение 15 мин после введения регистрируется локальная аллергическая реакция, проявляющаяся покраснением тестовой зоны (наподобие следа от укуса комара). Если реакции за этот промежуток времени не наблюдается, испытуемые продукты с большой вероятностью не содержат пищевых аллергенов. Критическим для данного метода является изготовление экстрактов с адекватным содержанием потенциального аллергена. На результаты SPT также оказывают влияние способы приготовления испытуемых продуктов (например, нагревание может как разрушить, так и создать новые антигенные детерминанты у аллергена).
Процедура оценки потенциальной аллергенности более проста и надежна, если аллергенный потенциал рассматриваемых белков - продуктов трансгенов - уже известен ко времени испытаний. В этой ситуации доступна сыворотка чувствительных индивидов для специфического скрининга in vitro - метода с хорошей доказательной базой. Гораздо сложнее проводить оценку трансгенных белков, если они не имели истории употребления в пищу и соответственно нет никакой информации об их аллергенном потенциале. В данном случае сыворотки крови людей, содержащие специфические к испытуемому белку IgE, недоступны. На первый план здесь выходят указанные выше непрямые методы оценки потенциальной аллергенности: сравнительный анализ аминокислотной последовательности испытуемых белков с известными аллергенами и их физико-химическая характеристика. При этом к результатам таких испытаний, не являющихся собственно иммунологическими, следует относиться с определенной осторожностью. Обычно для «новых» с точки зрения питания человека белков производится полная процедура оценки риска, в том числе иммунологические испытания на добровольцах.
11.2.5. Оценка риска, обусловленного возможностью горизонтального переноса маркерных генов устойчивости к антибиотикам к микроорганизмам пищеварительного тракта
В рамках оценки риска ГМО для здоровья человека наряду с другими факторами риска обязательно проводится и оценка риска переноса маркерных генов устойчивости к антибиотикам и гербицидам (если они присутствуют в ГМО) микроорганизмам пищеварительного тракта. Данное требование и критерии оценки соответствующего риска включены в принятую на международном уровне процедуру оценки безопасности ГМО и новых пищевых продуктов (FAO/WHO, 2003).
Антибиотики - органические вещества, образуемые живыми организмами (в основном бактериями, грибами) и обладающие антимикробными свойствами. Это одна из главных составляющих современной лекарственной терапии. Горизонтальный перенос селективных маркерных генов патогенным бактериям может стать причиной появления устойчивых к определенным антибиотикам генотипов и тем самым снизить эффективность лечения заболеваний человека и домашних животных.
В природе известны несколько механизмов горизонтального переноса генов (ГПГ), которые могут обеспечить проявление новых признаков у организма-реципиента. Среди них конъюгация и трансдукция, которые играют существенную роль в обмене генетической информацией между прокариотическими организмами (в основном между бактериями). Для оценки риска ГПГ при использовании ГМ-растений более важен другой механизм — так называемая естественная трансформация. Он предусматривает активный перенос свободной внеклеточной ДНК в цитоплазму бактериальной клетки. Фрагмент одноцепочечной ДНК, захватываемый бактериальной клеткой, теоретически может интегрироваться в бактериальный геном вследствие гомологичной рекомбинации или образования автономного репликативного элемента (плазмиды). Специфика генетической инженерии растений такова, что трансгены относительно часто содержат последовательности нуклеотидов, гомологичные прокариотическим, что существенно увеличивает вероятность их интеграции в бактериальный геном.
Перенос фрагментов ДНК от трансгенных растений микроорганизмам кишечника вследствие употребления ГМ-продуктов питания теоретически маловероятное событие, так как для того чтобы оно произошло, необходимо сочетание следующих факторов:
✵ маркерный ген ГМО, участвующий в трансформации бактерии, должен быть в виде свободных линейных фрагментов ДНК;
✵ ДНК маркерного гена должна избежать деградации нуклеазами желудочно-кишечного тракта;
✵ ДНК маркерного гена должна избежать конкуренции за транспорт в бактериальную клетку с другой ДНК, содержащейся в пище;
✵ реципиентные бактерии должны быть компетентными для трансформации;
✵ ДНК маркерного гена должна избежать ферментативной рестрикции внутри бактериальной клетки;
✵ маркерный ген может встроиться в ДНК реципиента вследствие редких репаративных или рекомбинационных событий. Для этого должна иметь место гомология маркерного гена или прилегающих к нему районов ДНК с ДНК хромосомы или плазмиды болезнетворной бактерии пищеварительного тракта;
✵ для экспрессии встроенного маркерного гена в бактериях необходимо, чтобы маркерный ген попал в «сферу действия» бактериальных регуляторных последовательностей (в эукариотических ГМО активность трансгена регулируется эукариотическими промоторами, не функционирующими в прокариотах).
Несмотря на теоретически низкую вероятность ГПГ, осуществлялись многочисленные эксперименты, имеющие целью на практике оценить частоту горизонтального переноса маркерных генов. Процесс естественной трансформации бактерий генетическим материалом высших растений был обнаружен исключительно в оптимизированных лабораторных условиях и при непременном требовании гомологичной рекомбинации. Это означает, что маркерный ген устойчивости к антибиотикам может быть перенесен из ГМО в бактериальные клетки, если тот же самый ген или гены, включающие фрагменты с идентичной последовательностью нуклеотидов, заранее присутствуют в данных клетках. В случае, когда гомологии ДНК у живых организмов не наблюдается, ГПГ маловероятен даже в оптимизированных лабораторных условиях.
Вероятность ГПГ оценивалась также в модельных системах, имитирующих условия желудочно-кишечного тракта человека. Показано, что ДНК ГМ-растений быстро (в течение нескольких секунд) разрушается в тонком кишечнике, но сохраняется относительно продолжительное время (минуты) в нижней части подвздошной кишки и в толстом кишечнике, где теоретически возможен ГПГ. Расчет вероятности ГПГ канамицин-устойчивости из трансгенных томатов микрофлоре толстого кишечника человека представила американская агрофирма «Саlgenе». Он показал, что употребление в пищу 250 г трансгенных томатов (3 мг ДНК, 10 копий гена nptII на геном) может увеличить долю микроорганизмов, несущих ген nptII, лишь на 2,4 х 10-15 %. При этом факт трансформации не означает еще функционирования гена, что требует дополнительных процессов рекомбинации и отбора. Частота трансформации бактерий пищеварительного тракта линейным фрагментом трансгенной ДНК оценивается разными исследователями как 1:1017-1018.
Кроме вероятности неблагоприятного воздействия какого-либо фактора для оценки риска важен параметр величины его последствий. Известно, что значительная доля микроорганизмов желудочно-кишечного тракта человека уже является устойчивой к тем или иным антибиотикам независимо от генно-инженерной деятельности. Доля устойчивых форм растет вместе с ростом масштаба применения антибиотиков в медицинской практике. Например, в отношении канамицина имеются данные, что из 1014 бактерий пищеварительного тракта 102 уже имеют природную устойчивость к нему. Широкая распространенность бактерий, устойчивых к канамицину, неомицину и другим антибиотикам, гены устойчивости к которым используют в генно-инженерных исследованиях, ограничивает применение этих препаратов в медицинской практике. В настоящее время они если и используются, то преимущественно в ветеринарии.
Бактерии с природной устойчивостью к антибиотикам являются частью микрофлоры пищевых продуктов. Экспериментально продемонстрировано, что на поверхности семян сои, кукурузы как трансгенных, так и не трансгенных сортов, с высокой частотой представлены бактерии с различным фенотипом устойчивости к антибиотикам. Вероятность горизонтального переноса генов устойчивости к антибиотикам микрофлоре кишечника от естественной микрофлоры, загрязняющей продукты питания, гораздо выше, чем ГПГ от ГМО.
Принимая во внимание крайне низкую вероятность горизонтального переноса маркерных генов устойчивости к антибиотикам, применяемым в современной генно-инженерной практике, и его незначительные последствия, можно констатировать, что риск ГПГ маркерных генов для здоровья человека приближается к нулю.
11.2.6. Процедура оценки безопасности ГМ-продуктов питания
Оценка пищевой безопасности ГМ-продуктов представляет собой последовательный, шаг за шагом, процесс анализа информации и данных исследований, относящихся к изучаемой проблеме. Процедура оценки риска начинается с анализа процесса генетической модификации. Собирается и анализируется имеющаяся информация об исходных организмах и ГМО. Особенно важна информация о тех признаках исходных организмов, которые представляют угрозу здоровью человека: об уровне их токсичности, аллергенности. Значима также информация о порядке и истории безопасного употребления в пищу исходных для модификации организмов, о принятых методах их переработки и влиянии на токсичность конечных продуктов. Кроме того, анализируется информация о способе трансформации (генетической модификации), о полном составе введенной конструкции ДНК, включая селективные гены устойчивости к антибиотикам, о целевых кодируемых признаках и их экспрессии. На указанном этапе анализа важно показать, что гены организма-донора, ответственные за продукцию токсических и антипитательных веществ, не входили в состав трансгенной конструкции.
Для определения непреднамеренных эффектов модификации весьма важна информация о том, затронула ли вставка трансгена уникальные кодирующие последовательности ДНК организма-хозяина или регуляторные последовательности (что может привести к изменению экспрессии генов исходного организма). С этой точки зрения желательно также получить сведения об открытых рамках считывания во вставленной конструкции и прилегающих районах генома реципиентного организма, которые могут инициировать синтез новых, нецелевых продуктов. В результате анализа указанной информации на данном этапе оценки риска устанавливается вероятность переноса от организма-донора генов, отвечающих за синтез потенциально опасных для здоровья человека веществ; определяется природа новых белков - продуктов трансгенов и порядок их экспрессии; устанавливается вероятность непреднамеренных эффектов модификации (возможность изменения исходного потенциала токсичности, аллергенности).
Далее следует этап инструментального (практического) анализа безопасности ГМО и гМ-продуктов. Он включает, во-первых, сравнительный анализ состава ключевых компонентов (композиционный анализ) и оценку метаболитов. Данный этап очень важен как для анализа существенной эквивалентности ГМ и традиционных продуктов, так и для собственно анализа риска выявленных отличий в составе компонентов и метаболитов ГМО. Проводимые исследования должны быть сфокусированы на доказательстве того, что уровень продукции компонентов, характеризующих исходный потенциал токсичности, аллергенности, питательной ценности, существенно не изменился в результате непреднамеренных эффектов модификации. Кроме того, данные этого этапа оценки риска показывают возможные изменения путей метаболизма и характера аккумуляции метаболитов, представляющих угрозу для здоровья человека.
Дальнейшим шагом оценки риска является инструментальная оценка биобезопасности экспрессирующихся в ГМО целевых продуктов трансгенов, которая заключается в определении их вероятной токсичности и аллергенности. Проводимые здесь исследования должны быть сконцентрированы на химической природе и функциях новых синтезируемых веществ; на доказательстве того, что гены донора, определяющие синтез неблагоприятных для здоровья продуктов, не перенесены в ГМО. Если продукты трансгенов не являются известными веществами с длительной историей безопасного употребления в пищу или уровень их экспрессии достоверно превышает таковой у аналога, то проводятся принятые исследования токсичности, включая эксперименты на животных.
Для оценки риска существенна также оценка изменения питательной ценности (питательного профиля) исходных организмов вследствие генноинженерной модификации. Такое изменение может быть следствием как преднамеренных (направленных на улучшение питательной ценности), так и непреднамеренных эффектов. Оценка данного фактора риска проводится на основании результатов композиционного анализа, показывающих характер изменения ключевых макро- и микропитательных веществ. В процессе оценки устанавливаются возможные последствия таких изменений для здоровья человека (если они идентифицированы). Для этого вначале рассчитывается наиболее вероятный и максимальный уровень потребления ГМ-продуктов питания в составе общего пищевого рациона анализируемой популяции людей. Затем проводится расчет возможных неблагоприятных эффектов в результате изменения их питательной ценности. При этом во внимание принимаются физиологические особенности и особенности метаболизма специфических групп населения - грудных детей, подростков, взрослых людей, кормящих матерей и т. д. Кроме вышеуказанных рисков при оценке пищевой биобезопасности, оценивается риск, связанный с использованием маркерных генов устойчивости к антибиотикам.
11.3. Оценка риска возможных неблагоприятных эффектов ГМО на окружающую среду
Негативное влияние хозяйственной деятельности человека на окружающую природную среду, к сожалению, неоспоримо. Использование новых технологий, в том числе генно-инженерных биотехнологий, может стать как источником новой опасности для окружающей среды, так и методом сбережения природных ресурсов, улучшения и восстановления естественных и подверженных деятельности человека экосистем. Чтобы максимально извлечь выгоды использования ГМО и при этом избежать возникновения неблагоприятных эффектов, необходимо четко представлять, какая опасность для окружающей среды может возникать в каждом конкретном случае.
11.3.1. Экологические риски, связанные с высвобождением и распространением ГМО в окружающей среде
Выделяют следующие источники неблагоприятных последствий высвобождения ГМО для окружающей среды (экологические риски):
1. Появление новых более агрессивных сорняков в результате генетической модификации или переноса трансгенов, способствующих повышению агрессивности вида, диким родственным видам.
2. Миграция и последующая интрогрессия трансгенов в природные популяции организмов в результате вертикального (обмен генетической информацией между растениями) или горизонтального (обмен генетической информацией между растениями и бактериями) переноса генов.
3. Воздействие продуктов трансгенов на организмы, не являющиеся мишенью их запланированного действия.
4. Появление живых организмов, резистентных или толерантных к продуктам трансгенов.
5. Влияние трансгенных вирусных ДНК (РНК) на естественную эволюцию вирусов путем транскапсидации, синергизма, рекомбинации.
6. Сокращение биологического (генетического) разнообразия в результате изменения естественных биоценозов, вытеснения местных сортов, преобладания в агропроизводстве монокультуры.
Рассмотрим влияние представленных рисков, связанных с высвобождением ГМО, на изменения в окружающей среде, значимость для появления и проявления определенных рисков различных факторов в зависимости от объекта и характера модификации, характеристики среды высвобождения и особенностей управления рисками.
11.3.2. Появление новых сорняков в результате генетической модификации или переноса трансгенов диким родственным видам
Сорняки (сорные растения) - это растения, произрастание которых на определенных участках нежелательно. Нежелательное действие сорняков может проявляться в ухудшении условий выращивания культурных растений, снижении их урожая или его качества. Сорняками могут быть дикие растения (травянистые и древесные, а также водоросли), которые проникают на возделываемые поля или другие используемые человеком территории (сенокосы, пастбища, зеленые насаждения, придорожные полосы, взлетно-посадочные полосы аэродромов, стадионы, водные каналы и многие другие). Сорняками могут стать и культурные растения, которые каким-либо образом попадают в посевы другой, основной, культуры и приводят к снижению массы или качества ее урожая. Чаще всего это растения-предшественники, выращиваемые на поле в предыдущую вегетацию.
С экологической, природоохранной точки зрения, сорняками также можно считать любые растения, не свойственные данному биоценозу, которые, конкурируя с эндемичными видами, способствуют сокращению их численности и исчезновению с данной территории. Как частный случай проявления сорных характеристик в естественных биоценозах, затрагивающий и экономические интересы человека, может рассматриваться проникновение быстрорастущих древесных растений из древесных промышленных насаждений в природный или восстанавливаемый лес. Например, сорными могут быть некоторые виды тополя (Populas, включая осину P. trémula L.), березы (Betula), клена (Acer), выращиваемые для переработки на целлюлозу. Имея преимущества в скорости роста и развития, они подавляют рост сеянцев или саженцев многих ценных медленно растущих деревьев, постепенно засоряя лес и снижая его продуктивность.
Характерные признаки сорных растений перечислены в так называемом перечне Бейкера (табл. 11.3). Даже одного из приведенных в этом списке признаков достаточно, чтобы предоставить растению дополнительные экологические преимущества и позволить ему успешно конкурировать с другими (основными) видами растений. Как правило, сорные растения обладают одновременно несколькими признаками из этого перечня. Эти признаки способствуют реализации одной из двух основных стратегий сохранения и распространения потенциальных сорных растений в окружающей среде, или позволяют им использовать обе стратегии сразу.
Таблица 11.3. Признаки растений, характерные для сорняков (по Н. Вакег, 1965)
№ п/п |
Признаки |
1 |
Семена прорастают в различных условиях среды |
2 |
Семена длительное время сохраняют жизнеспособность |
3 |
Растения быстро проходят фазы вегетации до цветения |
4 |
Растения образуют семена в течение длительного времени в ходе вегетации (до тех пор, пока позволяют условия произрастания) |
5 |
Растения самосовместимы, но не являются строгими самоопылителями |
6 |
Пыльца при перекрестном опылении переносится неспециализированными насекомыми или ветром |
7 |
Растения формируют очень много семян в благоприятных условиях среды |
8 |
Растения образуют семена в широком диапазоне условий среды |
9 |
Растения адаптированы к рассеиванию семян и пыльцы как на большие расстояния, так и на короткие |
10 |
Если растения многолетние, то способны очень хорошо размножаться вегетативно; способны к регенерации из фрагментов растения |
11 |
Если растения многолетние, то растения очень хрупкие в области стебля, расположенного на уровне почвы, что предохраняет их от легкого извлечения из почвы |
12 |
Растения приспособлены к конкуренции с другими видами с помощью специальных средств: формирования розеток; роста, подавляющего соседние растения; образования токсичных веществ |
Первая стратегия - выживаемость. Она проявляется в способности растений сохраняться в агросреде или природной среде даже в случае направленной борьбы с ними и препятствовать росту основной культуры или последующих культур (в случае сохранения растений предшествующей культуры). Одно из проявлений выживаемости - способность растений формировать так называемый банк семян. Банк семян - это набухшие семена, которые, не теряя жизнеспособности, могут сохраняться в почве на протяжении нескольких сезонов вегетации, иногда в течение многих лет. На небольшом участке, прилегающем к обрабатываемому полю, в почве в виде банка семян может одновременно находиться до 30 видов сорных растений, способных стать источниками засорения полей при благоприятных условиях и при отсутствии конкуренции со стороны уже растущих сорняков. Отсутствие конкуренции обеспечивается самим человеком в ходе борьбы с сорняками, уже растущими на полях.
Вторая стратегия - инвазивность. Она представляет собой способность сорных растений быстро распространяться в окружающей среде, осваивать новые места обитания, включая не только окультуренные участки, но и природные экосистемы. После выхода за пределы возделываемых участков, одичавшие культурные растения в первую очередь будут захватывать территории, прилегающие к окультуренным участкам, или участкам, периодически используемым человеком. Однако существует вероятность проникновения новых видов в дикие и даже охраняемые экосистемы.
Инвазивность - более опасная стратегия как для сельскохозяйственного производства, так и сохранения первозданных природных ландшафтов. В первом случае инвазивность может стать источником как первичного, так и вторичного засорения (возвращение сорняка на поле через некоторое время после его уничтожения). Во втором случае она может привести к изменениям в сложившихся природных популяциях и экосистемах. Не следует забывать, что растительные сообщества являются местом обитания и основанием пищевой пирамиды для животных и микроорганизмов, включая почвообразующие. Появление нового, быстро размножающегося вида способно привести к каскадным и иногда необратимым последствиям для отдельных популяций и экосистемы в целом.
Практически любая генетическая модификация, направленная на повышение адаптивных свойств растений - устойчивости к абиотическим стрессам (холоду, засухе, засолению почв, гербицидам) или биологическим стрессовым факторам (вредителям, болезням), может предоставить ГМО новые экологические преимущества по сравнению с исходными видами или природными популяциями. Она делает их способными значительно превысить обычные (естественные) лимиты популяционного роста. Адаптивные преимущества могут быть связаны и с изменением некоторых агрономических показателей, например, ускорением развития растения на стадии проростка или более быстрым созреванием семян и плодов.
Трансгенные признаки, направленные на изменение биохимических показателей, за счет совместного или каскадного действия генов или в результате приобретения ГМО нового биохимического статуса могут в конечном счете привести к нежелательному популяционному росту. Например, улучшение качества крахмала клубней картофеля (трансгенный картофель с безамилозным крахмалом) содействует повышению их холодостойкости и, как следствие, дает клубням шанс успешной перезимовки в поле, что может стать проблемой на полях стран с относительно мягкими зимами. Превращение в сорняк подсолнечника (Helianthus annus L.) в южных районах России и Украины связано с селекцией (традиционной!) этой теплолюбивой, по сути тропической, культуры как на устойчивость к холоду, так и на повышение масличности семян. Теоретически не только увеличение масличности, но и изменение биохимических показателей синтезируемых растениями масел может предоставить семенам дополнительное преимущество как на стадии покоя (перезимовка), так и на стадии прорастания: ускорить темпы прорастания или расширить возможности их прорастания в неблагоприятных условиях.
Генно-инженерная модификация может способствовать появлению свойств сорняков у растений, ранее не обладавших таковыми. Появление названных признаков вероятнее всего будет связано с повышением адаптивных характеристик семян этих растений (расширение условий среды, в которых возможно прорастание, изменение периода покоя и более длительное сохранение жизнеспособности семян). Генно-инженерная модификация может также сказаться на повышении агрессивности растений вида, уже являющегося потенциальным сорняком, либо усилить агрессивность аборигенного вида. На территории Беларуси к таким видам относятся, например, вика (Vica sativa L.), клевер белый и клевер луговой (Trifolium repens L. и T. pratense L.), люцерна (Medicago sativa L.), некоторые древесные культуры, например, тополь черный или осокорь (Populus nigra L.), осина (P. tremula L.) (рис. 11.2). Сорняком может стать интродуцированный вид, который не являлся таковым в стране интродуцирования, например, картофель или подсолнечник, но которые относятся к сорнякам в стране происхождения. Поэтому при планировании генно-инженерной модификации видов, которые уже стали потенциальными сорняками или имеют родственные виды-сорняки в природе, надо проявлять максимальную осторожность. В то же время существуют виды, которые в силу своей экзотичности и крайней доместикации не могут представлять реальной опасности при любой адаптивной модификации. Для Беларуси - это соя (Glicine max Merr.) и кукуруза (Zea mays L.).
Рис. 11.2. Аборигенные для Беларуси виды растений, генно-инженерная модификация которых может вести к повышению их агрессивности в качестве сорных растений: а - люцерна (Medicago sativa L.); б - вика (Vica sativa L.); в - клевер белый (Trifolium repens L.); 2 - клевер луговой (T. pratense L.); д - тополь черный, или осокорь (Populus nigra L.); e - осина (P. tremula L.)

Яркий пример потенциально сорного растения - рапс масличный (Brassica napus L.). Он обладает пятью из приведенных в табл. 11.3 двенадцати признаков растений-сорняков. Это типичный представитель хозяйственно важных растений, способных уменьшать урожай и качество урожая следующих за ним сельскохозяйственных культур, например, зерновых. Рапс является одновременно ценной масличной культурой и ценным сидератом, включаемым в севооборот с зерновыми и зернобобовыми культурами и позволяющим за счет быстрого роста очищать поля от сорняков. Усилению этого свойства помогает генно-инженерная модификация, делающая растения рапса толерантными к гербицидам. В настоящее время устойчивость к гербицидам и улучшение биохимических свойств масла - основные направления генноинженерных модификаций этой сельскохозяйственной культуры. Трансгенный рапс, толерантный к гербицидам, входит в четверку основных трансгенных культур (после сои, кукурузы и хлопчатника).
Как показал опыт выращивания толерантного к гербицидам рапса в западных регионах Канады и исследования, проведенные в США, трансгенная устойчивость к гербицидам может нести потенциальную угрозу повышения агрессивности вида. До недавнего времени казалось несложным контролировать агрессивность рапса как на полях, так и на участках временного использования или защитных полосах (границах полей, придорожных полосах и др.) путем применения гербицида, по отношению к которому у растений устойчивость отсутствует. Однако уже доказано явление обмена трансгенами устойчивости к гербицидам между различными линиями ГМ-рапса. Обнаружены формы, обладающие всеми используемыми трансгенами этого признака, что делает выращивание рапса в качестве сидерата экономически невыгодным - вместо культуры, помогающей бороться с сорняками, в результате межсортовой гибридизации получился суперсорняк (англ. superweed), только усложнивший жизнь фермерам.
Рапс масличный считается самоопыляющейся культурой, что должно служить целям предупреждения нежелательной спонтанной гибридизации, однако более 10 % семян рапса способны формироваться в результате перекрестного опыления. Как показали специально проведенные эксперименты в Канаде и в Великобритании с участием трансгенного рапса сортов «Roundup Ready» (толерантный к глифосату) и «Liberty Link» (толерантный к глюфозинату), стандартного расстояния для изоляции различных генотипов в 40 м может оказаться недостаточно. В эксперименте, проведенном на 11 изолированных полях, был зафиксирован перенос генов (пыльцы) на расстояние до 800 м.
Как правило, дикие сородичи культурных растений обладают более высокой экологической стабильностью, повышенным, по сравнению с культурными родственниками, иммунитетом к различным заболеваниям, т. е. дикие сородичи культурных растений изначально более экологически конкурентоспособны. Появление у них дополнительных адаптивных генов (трансгенов), позволяющих изменить конкурентные взаимоотношения с другими видами экосистемы, способны значительно повысить их инвазивность и/или выживаемость и привести к резкому популяционному росту.
Если такие растения - сорняки агрокультуры, появление у них новых адаптивных генов, например, устойчивости к гербицидам, вредителям, может сделать малоэффективным химический или биологический методы борьбы с ними и превратить такие растения в трудно управляемый источник засорения агросреды - суперсорняк. Сохранение трансгенов в природной популяции (за пределами агросреды) сделает проблему борьбы с такими суперсорняками не только дорогостоящей, но и долговременной за счет вторичного засорения полей. Поэтому выявление, учет и изучение характеристик сорняков (выживаемость, инвазивность) возможных кандидатов на спонтанную гибридизацию с трансгенными растениями - один из основных вопросов анализа экологических рисков, связанных с высвобождением трансгенных растений. В настоящее время, например, прекращены генно-инженерные работы в отношении культурного сорго (Sorghum bicolor (L.) Moench.). Основание - доказанное образование жизнеспособных гибридов при спонтанной гибридизации культурного сорго с сорго алеппским (S. halepense (L.) Pers.), одним из наиболее опасных сорных растений, широко распространенным практически во всех тропических и субтропических регионах планеты, а также с рядом других сорных видов сорго, произрастающих в тропиках.
Несмотря на достаточно высокую теоретическую вероятность повышения инвазивности растений в связи с переносом адаптивных трансгенов в природные экосистемы, экспериментальные данные, как правило, не подтверждают теоретические выкладки. Это связано со сложностью самого процесса проникновения нового объекта в сложившуюся экосистему, являющуюся достаточно стабильным образованием. Инвазивность может проявиться только по истечении довольно большого времени (при условии высокой выживаемости нового вида) и/или при многочисленных случаях интродукции. При соблюдении севооборота и сортосмены эти условия выполняться не могут. Поэтому первоначально выдвинутые опасения, как правило, оказываются преувеличенными. Кроме того, некоторые важные трансгенные признаки, прежде всего толерантность к гербицидам, вообще не дают преимуществ за пределами агросреды, где гербициды не применяются. Мониторинг за уровнем инвазивности в природные экосистемы трансгенных толерантных к гербицидам сортов рапса, картофеля, сахарной свеклы и кукурузы, проводившийся в течение 10 лет в 12 различных местах обитания, не выявил у них каких-либо инвазивных преимуществ по сравнению с сортами, полученными традиционными методами. У рапса уровень инвазивности трансгенных линий был даже ниже, чем у традиционных сортов.
11.3.3. Миграция и последующая интрогрессия трансгенов в природные популяции в результате вертикального или горизонтального переноса генов
Предполагается, что в случае передачи адаптивного трансгенного признака дикому виду, родственному ГМО, его возможности в проявлении адаптивных свойств могут измениться, что будет иметь определенные экологические последствия. Сложившаяся природная популяция, длительно существующая на определенной территории, представляет собой достаточно стабильное образование, приспособленное к данным условиям среды и существующим экологическим связям внутри экосистемы. Привносимые человеком трансгенные признаки можно разделить на несколько категорий по степени вредоносности для благополучия вида в природной экосистеме. Они могут быть нейтральными, вредными и проявляющими себя по-разному в зависимости от уже имеющегося уровня адаптивности реципиентных видов, уровня природного биологического контроля реципиентного вида и тех селективных преимуществ, которые трансгены могут этому виду предоставить.
Трансгены, имеющие нейтральный эффект для адаптивности, могут распространяться в природных популяциях в результате миграции генов, не предоставляя этим популяциям дополнительных преимуществ (например, маркерные гены устойчивости к антибиотикам). Трансгены с вредоносным эффектом, как правило, приводят к негативному отбору особей, несущих такие гены. В результате чего количество особей, несущих трансгены в природной популяции, не может увеличиваться или будет сокращаться. Это многие признаки, ассоциированные с доместикацией, включая гены, вызывающие мужскую стерильность, улучшающие качество волокна или древесины, замедляющие созревание плодов и некоторые другие. Трансгены, обеспечивающие устойчивость к гербицидам или вредителям, варьируют по своим адаптивным возможностям в зависимости от инвазивности реципиентного организма и уровня природного контроля его распространения в окружающей среде. Если численность популяции зависит от устойчивости особей к вирусам, грибным заболеваниям или насекомым-вредителям, то трансгены, предоставляющие такую устойчивость, например, гены Bt-протеина, обеспечат популяции дополнительные адаптивные преимущества. Но в отсутствие экологического давления вредителей, трансгены устойчивости становятся нейтральными. То же относится и к генам устойчивости к гербицидам. В природных популяциях они являются нейтральными, но, попав к сорнякам культурных насаждений, могут значительно усложнить их контроль с помощью гербицидов. Трансгены, повышающие толерантность видов к неблагоприятным факторам среды или изменяющие характер их роста и развития, могут привести к значительному адаптивному сдвигу и иметь существенное значение для развития их адаптивных возможностей. Например, устойчивость к холоду или засолению может расширить зоны обитания реципиентного вида. Но в отсутствие стрессового фактора такие гены будут, скорее всего, нейтральными.
Когда речь идет об экологических рисках, связанных с высвобождением ГМО, под миграцией (потоком) гена (англ. gene flow), как правило, понимают рассеивание генетического материала какого-либо организма, в частности ГМО, в виде пыльцы и семян. Такое рассеивание - это проявление инвазивности. Особенности распространения пыльцы (преимущественное самоопыление или необходимость перекрестного опыления для завязывания семян, способ переноса пыльцы ветром или животными, дальность, на какую может распространяться пыльца) и семян (как далеко и какими способами) определяют инвазивные возможности ГМО. Они могут влиять на вероятность проникновения трансгенов в дикие популяции, расширяя территорию попадания чужеродного генетического материала. Но даже распространение большого количества пыльцы и семян еще не означает стабильной передачи родственным видам трансгенов.
В природе существует множество барьеров (географических, физиологических и генетических), препятствующих свободной гибридизации между видами и позволяющих им сохранять свою индивидуальность. Хотя в некоторых случаях эти барьеры преодолеваются и такие события, достаточно редкие, могут привести к появлению новых видов. Применение молекулярно-генетических методов при изучении происхождения видов показало, что случаи преодоления межвидовых барьеров происходят чаще, чем это представлялось раньше, однако все равно остаются из разряда редких событий, и в большей степени связаны с эффективной гибридизацией между подвидами, чем с гибридизацией между видами.
Чтобы гибридизация между трансгенными растениями и растениями родственного вида произошла, необходимо выполнение одновременно ряда условий. Во-первых, должны совпадать или перекрываться сроки их цветения. Во-вторых, расстояние между ними должно позволять пыльце первого, не потеряв опыляющей способности, достигнуть цветка второго. В- третьих, должны быть преодолены генетические презиготные и постзиготные межвидовые барьеры (см. раздел 8.1).
Если гибридизация между видами произошла, и сформировалось гибридное растение, межвидовые гибриды, за редким исключением, представляют собой слабые растения с низкими адаптивными возможностями, как правило, стерильные или с пониженной фертильностью. Такие отдельные индивидуумы не способны обеспечить стабильное включение и функционирование трансгенов в популяции дикого вида. Стабильное включение гена в новый генетический пул, обеспечивающее его длительное существование в этом пуле, называют интрогрессией гена. Случаев доказанной интрогрессии в природе гораздо меньше доказанных случаев спонтанной межвидовой гибридизации.
Процесс интрогрессии достаточно сложен и включает ряд циклов формирования гибридного потомства и/или беккроссирования гибридов пыльцой одного из родителей (F1, F2, BС1, ВС2 и т. д.). Все эти поколения могут присутствовать в популяции и обмениваться генами. Может потребоваться много лет и поколений, пока трансгены стабильно не закрепятся в генетическом окружении дикого вида. Вероятность интрогрессии повышается, если будет наблюдаться постоянное поступление трансгенов в дикую популяцию (например, от многолетней трансгенной культуры) и размеры популяции реципиента невелики. При отсутствии стабильного поступления трансгена в течение нескольких поколений, его включение в дикую популяцию маловероятно. Таким образом, севооборот и сортосмена однолетних трансгенных культур препятствуют интрогрессии трансгенов. Тогда как сохранение семян трансгенных растений в «банке семян» будет ей способствовать.
Вероятность устойчивой интрогрессии трансгена в популяции родственного вида значительно увеличится, если он будет доминантным и не ассоциированным с вредными для вида аллелями или признаками, а напротив, будет давать селективные преимущества. Способствует интрогрессии локализация трансгена в общем (гомологичном) для трансгенного организма и организма-реципиента геноме, гомологичной для этих организмов хромосоме, или хромосоме, не претерпевшей перестроек по сравнению с гомологичной хромосомой дикого вида.
По степени вероятности интрогрессии генов к диким родственным видам сельскохозяйственные культуры принято разделять на три категории - культуры высокого риска, среднего риска и низкого риска интрогрессии (иногда добавляют группу растений крайне низкого риска интрогрессии).
К группе высокого риска относят виды, которые могут не только выращиваться как сельскохозяйственные культуры, но одновременно могут встречаться как свободноживущие природные популяции, представляющие серьезную опасность в качестве сорных растений и легко скрещивающиеся с дикими родственными видами. Как отмечалось выше, одной из культур высокой степени риска в Европе признается рапс масличный (Brassica napus L.) (в США его рассматривают как культуру средней степени риска). С одной стороны, он довольно часто покидает поля и может выживать в природной окружающей среде. Кроме того, он обладает свойствами сорняка. С другой стороны, являясь подобно пшенице аллополиплоидным видом (рис. 11.3), он способен эффективно скрещиваться с шестью видами из рода Brassica (B. rapa, B. oleraceae, B. nigra, B. kaber, B. juncea., B. adpressa), одним видом рода Ra- phanus (Raphanus raphanistrum L.) и одним видом рода Erucastrum (Erucastrum gallicum (Willd.) Shulz). Некоторые из них известны как достаточно опасные сорняки. Гибриды в этих скрещиваниях, как правило, образуются, когда рапс является материнской формой, а количество гибридов, формирующихся в полевых условиях, крайне мало (с частотой 2-5 х 10-5), поэтому утечка трансгенов посредством пыльцы от рапса к большинству из перечисленных видов маловероятна. Однако доказана интрогрессия генов (в том числе трансгенов толерантности к гербицидам и Bt-протеина) посредством пыльцы от Brassica napus к виду Brassica rapa L. Растения последнего, выращиваемые в культуре как репа и турнепс, также известны как серьезные сорняки и довольно легко выживают в природе. В связи с высокой агрессивностью как сорняка и высокой вероятностью интрогрессии генов от рапса к сорному виду Brassica rapa в США были отозваны разрешения на коммерциализацию трансгенных сортов рапса с устойчивостью к насекомым, болезням и стрессам.
Рис. 11.3. Геномные родственные связи между шестью видами рода Brassica
К категории средней степени риска миграции трансгенов относят виды, которые имеют свободно живущих представителей своего же вида, не представляющих большой опасности в качестве сорняков или имеющие не представляющие опасности как сорняки родственные виды, принадлежащие к тому же роду, что и культурная форма. Как правило, такие растения представляют умеренный (регулируемый) риск в качестве сорных растений в агросреде, но могут вызвать определенные экологические проблемы как в агросреде, так и за ее пределами. Возможные экологические эффекты миграции генов для этой группы определяют, исходя из конкретной ситуации. Среди культур средней степени риска называют люцерну (Medicago sativa ssp. sativa) и подсолнечник (Helianthus annuus), имеющих свободноживущих представителей этих видов, а также свеклу сахарную и столовую (Beta vulgaris ssp. vulgaris L.), которые скрещиваются не только со свободноживущими представителями своего вида, но и с представителями подвида Beta vulgaris ssp. maritima (L.) Arcang (в некоторых регионах Западной Европы). В условиях Беларуси подсолнечник и свекла причислены к растениям низкого риска.
К категории среднего риска могут быть отнесены и некоторые многолетние плодовые культуры, такие как земляника садовая (Fragaria х ananassa Dushesne ex Rozier), слива (Prunus domestica L.), ежевика (Rubus fruticosus Focke.) и малина (Rubus idaeus L.). У этих культур имеется достаточно много диких и культурных видов, с которыми возможна свободная гибридизация. Многолетний характер выращивания этих культур повышает вероятность интрогрессии генов к диким видам и сортам того же вида. Однако уровень и основные векторы интрогрессии для перечисленных выше плодовых культур в настоящее время еще окончательно не определены, поэтому сложно предсказать реальные экологические последствия интрогрессии адаптивных трансгенных признаков к их диким родственным видам и свободно живущим представителям.
К категории низкого уровня риска относят культуры, вероятность интрогрессии генов которых к диким видам очень мала, но тем не менее существует (к группе растений крайне малого риска относят те, для которых нет молекулярно-генетического подтверждения интрогрессии генов от культурного вида к диким представителям). Несмотря на это, в соответствии с принципом принятия мер предосторожности предусматривается возможность эволюционной важности редких случаев интрогрессии трангсгенов и их экологических последствий. К этой категории относят кукурузу (Zea mays ssp. mays L.), хлопчатник (Gossipium hirsutum L.) и рис (Oryza sativa L.). Для условий Центральной и Восточной Европы, в том числе Беларуси, хозяйственное значение имеет только кукуруза, которая не имеет здесь родственных видов и не представляет какой бы то ни было инвазивной опасности. Поэтому кукуруза в наших условиях может быть отнесена к культурам крайне низкого риска или вовсе не представляющим риска интрогрессии наравне с соей (Glycine max Merr.), ячменем (Hordeum vulgare L.), фасолью (Phaseolus vulgaris L.), картофелем (Solanum tuberosum L.) и рядом других культур.
В том случае, когда вероятность интрогрессии трансгенов реально существует, необходимо особое внимание уделить изучению возможных изменений адаптивных характеристик популяции организмов-реципиентов, прежде всего тех, которые могут повлиять на ее неконтролируемый рост и связанные с ним экологические последствия как негативные, так и позитивные.
Для того чтобы предотвратить интрогрессию чужеродного генетического материала в природные популяции или снизить до минимума связанные с интрогрессией чужеродных генов последствия, необходимо либо предотвратить перенос генетического материала от селекционных форм в природные популяции, либо блокировать действие генов при их попадании к диким родственным видам.
В первом случае могут помочь различные методы предотвращения распространения пыльцы и семян. Чтобы предотвратить переопыление трансгенными сортами нетрансгенных, что считается нежелательным при использовании приемов органического земледелия, и, безусловно, нежелательно при поддержании сортовой чистоты семян, предлагается использование защитных (изоляционных) полос из нетрансгенных растений той же культуры вокруг полей с трансгенными растениями. Посадки трансгенных растений одного сорта лучше всего проводить крупными блоками, избегая пестроты посевов небольшими участками трансгенных и нетрансгенных культур одного вида.
В качестве эффективного метода предотвращения переноса трансгенов с пыльцой рассматривается придание трансгенным растениям, предназначенным для коммерческого использования, признака мужской стерильности (МС). МС-растения не способны формировать пыльцу, или формируют пыльцу, не способную к результативному опылению. Еще один метод, позволяющий предотвратить распространение трансгенов с пыльцой, - получение транспластомных растений за счет трансгенеза органелл, в частности хлоропластов, имеющих у высших покрытосемянных растений, как правило, материнское наследование.
Для предупреждения интрогрессии трансгенов в случае, когда невозможно избежать их утечки с пыльцой или семенами, предлагаются генетические методы, предотвращающие передачу трансгенов от ГМО к организму-реципиенту или его потомству. Разработка методов сайт-специфического встраивания генов в определенные участки генома позволит получать ассоциации трансгенов с группами сцепления, которые редко передаются потомству при реком- биногенезе. Такие группы сцепления выявлены в геномах подсолнечника, кукурузы, хлопчатника. Очевидно, редко вступающие в рекомбинацию участки генома могут быть выявлены у большинства хозяйственно важных культур.
При трансгенезе аллополиплоидных видов (в том числе рапса, пшеницы, риса, хлопчатника и др.) рекомендуется перенос трансгена в геном, не встречающийся у родственных видов, интрогрессия признака которым нежелательна. У рапса, например, более безопасна инкорпорация трансгенов в геном С, свойственный виду B. oleracea, чем в геном A, полученный рапсом от B. rapa.
Нежелательная миграция трансгенов также может быть минимизирована благодаря использованию трансгенных конструкций, в которых трансген, предоставляющий виду дополнительные адаптивные преимущества, сцеплен с генами, отвечающими за доместикационные признаки, такие, например, как укороченный период покоя семян или уменьшение их рассеивания.
Миграция трансгенов в природные популяции благодаря горизонтальному переносу генов. Известен природный механизм передачи бактериальной ДНК посредством Тi-плазмиды от почвенных бактерий из рода Agrobacterium двудольным растениям с последующим встраиванием ДНК плазмиды в геном растений. Обратный процесс передачи генетического материала от растений к бактериям в природе до сих пор не зафиксирован, хотя сделан ряд успешных попыток осуществления этого процесса в лабораторных условиях. Эта разновидность горизонтального переноса генов вызывает опасения из- за распространенности растительных ГМО и их тесного контакта с почвенными микроорганизмами. Существует мнение, что это повышает опасность передачи их маркерных генов устойчивости к антибиотикам, нежелательных с точки зрения биобезопасности для здоровья человека и домашних животных, почвенным микроорганизмам. В свою очередь, такие бактерии могут с помощью ГПГ передавать трансгены болезнетворным микроорганизмам.
Возможность трансформации бактерий ДНК растений подтверждена экспериментально. В частности, была осуществлена трансформация почвенной бактерии Аcinetobacter sp ВD413, содержавшей нефункционирующий ген nptII с делецией 10 пар нуклеотидов посредством ДНК, имеющей функционально активный ген nptII устойчивости к антибиотику канамицину из гомогената тканей картофеля, табака, свеклы, томата и рапса масличного. Такая трансформация приводила к полному восстановлению функции гена у бактериальных клеток, что говорит о возможности передачи маркерных признаков устойчивости к антибиотикам от трансгенных растений к почвенным бактериям и доказывает возможность рекомбинации комплементарных участков ДНК бактерий и минерализованных растений. Однако частота такой рекомбинации была очень низкой (К. Smalla и др., 2000).
Первым условием успешной трансформации бактериальных клеток ДНК растений является наличие в почве долгоживущей свободной ДНК. Новые данные изменили ранее сложившееся мнение о быстрой деградации в почве высокомолекулярной ДНК. Показано, что ДНК может стабилизироваться, адсорбируясь на частицах глины, полевого шпата, кварца, гуминовых кислот, и таким образом сохраняться в течение нескольких недель, а то и месяцев. Трансформирующую способность она может сохранять, по меньшей мере, в течение нескольких дней. Продлению жизни ДНК в почве способствует медленное разрушение целлюлозных клеточных стенок растений.
Несмотря на достаточно продолжительную жизнь ДНК в почве, вероятность трансформации в природных условиях оценивается большинством авторов как очень низкая. Если ее и удается фиксировать, то только в стерильной почве. В нестерильной почве трансформация бактерий свободной растительной ДНК не обнаружена. Компетентность бактерий к трансформации не является конститутивным признаком и ее появление лимитировано многими факторами, как эндогенными (физиологический статус бактерий), так и средовыми (температурой, питательным и механическим составом почвы и т. д.). Конкуренция с другими организмами почвы, очевидно, негативным образом сказывается на компетенции бактериальных клеток к трансформации. Предполагается, что вероятность природной трансформации в нестерильной почве составляет не более 1:1010-1011 (по мнению некоторых авторов, еще ниже - 1:1017).
11.3.4. Неблагоприятные воздействия ГМО на организмы, не являющиеся мишенью привнесенного признака
Одним из наиболее значимых неблагоприятных для окружающей среды эффектов ГМО считается отрицательное влияние продуктов трансгенов на организмы, не являющиеся мишенью трансгенного признака. Организмами-немишенями называют все организмы, на которые непосредственно не нацелено воздействие трансгенного организма, связанное с генно-инженерной модификацией. Возникновение эффекта в первую очередь может быть вызвано использованием в хозяйственной деятельности растений, обладающих пестицидными свойствами в результате генно-инженерных модификаций, вызывающих у них синтез, например, Bt-токсинов.
Несмотря на высокую специфичность действия Bt-токсинов, невозможно полностью исключить вероятность их неблагоприятного воздействия на непаразитарных представителей из тех же семейств, что и насекомые-мишени, а также для насекомых, являющихся полезными в качестве опылителей или напрямую используемых человеком (шелковичные черви Antnaea perngicuerin и Bombyx mori).
Побочное нежелательное действие Bt-токсинов на организмы-немишени известно в связи с использованием распыляемых бактериальных препаратов на основе Bacillus thuringiensis.Возможно также попадание Bt и других токсинов трансгенного происхождения на кормовую базу нейтральных и полезных насекомых и других беспозвоночных животных. Во-первых, в случае если ген токсичности экспрессируется в пыльце, то токсин может распространяться с пыльцой сельскохозяйственных ГМ-растений. Во-вторых, возможно попадание Bt-протеинов в почву с остатками трансгенных растений или выделениями их корней. В данном случае могут пострадать беспозвоночные животные почвы и ризосферы растений, обеспечивающие минерализацию почвы и ее плодородие. Например, возможно негативное действие Bt- токсинов на земляных червей и ногохвосток. Несмотря на довольно быстрое разложение Bt-протеинов в почве (период полураспада от 2 до 10 дней в зависимости от почвенных условий), они, подобно ДНК, могут довольно долго сохранять активность в связанном состоянии при образовании конгломерата с глиной или гуминовыми кислотами. Так, в почвах, содержащих каолин, Bt- протеины сохраняли уровень токсичности, достаточный для уничтожения модельного насекомого бражника табачного (Manduca sexta L.) в течение шести месяцев. При повышении кислотности почв этот период еще увеличивался.
Кроме прямого ненаправленного действия токсина, связанного с его непосредственным потреблением полезными и нейтральными животными, возможно опосредованное нежелательное действие токсина через взаимоотношения хищничества или паразитарности. Опасения, касающиеся возможности такого негативного воздействия токсинов трансгенных растений на популяции полезных насекомых, питающихся насекомыми-мишенями трансгенного признака, например, популяции златоглазки (Chrysoperla carnea Stephens) и божьей коровки (Hippodamia convergents Guerin-Meneville), неоднократно высказывались научной общественностью.
В связи с развитием направления генетической инженерии, связанного с приданием растениям функций биореакторов (синтез растениями вакцин, алкалоидов, витаминов, гормонов и других физиологически активных и фармацевтических веществ), спектр организмов-немишеней может расшириться за счет теплокровных животных, случайно потребивших такие растения. Опасность нецелевого действия трансгенов возрастает, если они попадают в результате миграции в популяции свободноживущих растений за пределы охраняемых от нежелательного посещения животными территорий или при переопылении других сортов не биофармацевтического назначения этой же сельскохозяйственной культуры, что превращает в организмы-немишени человека и сельскохозяйственных животных. Неслучайно к посадкам таких растений предъявляются особые требования по изоляции и предотвращению возможности переопыления с посадками растений пищевого или кормового назначения.
С точки зрения выявления и оценки потенциальных последствий риск, связанный с нецелевым воздействием продукта трансгена, является, пожалуй, одним из наиболее сложных. С одной стороны, может оказаться сложным учесть и выявить всех участников пищевой цепочки, которые могут подвергнуться действию токсина, включая все возможные взаимоотношения хищничества и паразитизма. С другой стороны, множество факторов биотического и абиотического свойства, которые практически невозможно воссоздать в лаборатории и даже в условиях ограниченного полевого эксперимента, могут повлиять на вероятность, интенсивность и специфику проявления токсического эффекта. При проявлении отдаленных эффектов, связанных с участием нескольких посредников между первоначальным действием токсина и конечной непредвиденной мишенью, может пройти несколько лет и генераций организмов, подверженных действию селективного фактора, в той или иной степени. Поэтому окончательное суждение о нецелевом действии токсина и его последствиях может быть составлено только после длительного мониторинга за объектом наблюдений или рядом связанных между собой объектов в условиях широкомасштабного эксперимента в различных условиях окружающей среды, отражающих в максимально возможном объеме условия известных мест обитания организмов-немишеней.
Агентством по защите окружающей среды США (US EPA) разработана система оценки нецелевого действия факторов, вызванных действием трансгенов (рис. 11.4). На первом этапе устанавливают наличие фактора риска, т. е. токсичности (происхождение токсина, характер его действия) и уровень токсичности, который может привести к возникновению неблагоприятных последствий (особенности экспрессии гена), а также выявляют круг предполагаемых организмов-немишеней. Наличие токсических эффектов определяют на основании лабораторных тестов по скармливанию продукта трансгена, например, определенного типа Bt-токсина, кодируемого встроенным геном, ряду организмов, которые могут оказаться в числе организмов-немишеней. Следуя принципу принятия мер предосторожности, в лабораторном остром эксперименте, как правило, используют повышенные дозы предполагаемого токсина, употребляемого в виде очищенного вещества. Если обнаружен поражающий эффект очищенного токсина, проводят лабораторные и полевые тесты с использованием посредника-медиатора действия токсина, например, пыльцы, которая может быть его переносчиком, или зараженных токсином личинок либо яиц организма-мишени, а также определяют летальную дозу токсина (LD50) и дозу, вызывающую ингибирование роста и развития организма (сублетальный эффект ЕС50).
Рис. 11.4. Схема оценки экологического риска воздействия ГМО на организмы-немишени, используемая Агентством по охране окружающей среды США (US ЕРА)
Поскольку наибольшую сложность вызывает определение круга возможных организмов-немишеней, US EPA предлагает для оценки новых видов токсинов биологического происхождения использовать стандартные наборы организмов. Для Bt-токсинов это птицы (несмотря на отсутствие подтвержденных сведений о Bt-токсичности в отношении теплокровных животных); водные животные (рыбы, обитающие на рисовых плантациях, или способные контактировать с пыльцой и другими частями Bt-растений и Bt- микроорганизмами); водные беспозвоночные, например, дафнии (Daphnia); почвенные животные - черви и ногохвостки (Collembola) и полезные насекомые. Среди тестируемых полезных насекомых должны быть обязательно представлены насекомые-опылители на примере медоносной пчелы (Apis mellifera L.) (тест проводят на личинках и взрослых особях) и еще три вида насекомых, принадлежащих к различным отрядам, в которых встречаются виды-паразиты или хищники, питающиеся насекомыми-вредителями. Это могут быть представители следующих групп: паразитарные двукрылые и ги- меновые (например, Brachymeria intermedia Walker - паразит домашней мухи), хищные жесткокрылые (обычно божьи коровки Hippodamia convergents, Adalia bipunctata L. или Coccinella septempunctata L.), полужесткокрылые, сетчатокрылые (обычно златоглазки), а также хищные клещи.
На втором этапе выявляют экологические условия, в которых действует фактор риска, и которые определяют вероятность возникновения неблагоприятных последствий, связанных с использованием ГМО. Эти факторы касаются биологии и экологии самих ГМО (характеристика фактора стресса), организмов-немишеней (характеристика объекта потенциального риска) и среды их обитания (экологические факторы воздействия, такие как база питания организма-немишени и др.).
На третьем этапе проводят предварительную оценку степени риска с учетом всех экологических условий действия фактора риска и дают окончательную оценку возможности использования ГМО с учетом поражающего эффекта фактора риска, факторов неопределенности и условий предполагаемого регулирования риска.
Одним из примеров наиболее полного и последовательного исследования нецелевого влияния трансгенных сельскохозяйственных растений на организмы-немишени может служить оценка влияния выращивания Bt-кукурузы на численность популяции бабочки Монарх (Donaus plexippus L), отряд Lepidop- tera, проведенное группой ученых из США и Канады (рис. 11.5). Основанием для исследования стали разногласия, возникшие в среде научной общественности по поводу истинных причин существенного сокращения численности этого вида насекомых, популяции которого населяют регионы так называемого «кукурузного пояса» США, а также южную часть Канады и Мексику.
Рис. 11.5. Бабочка-данаида Монарх (Danaus plexippus L.) - объект оценки риска в качестве организма, не являющегося мишенью Bt-токсина трансгенной кукурузы:
а - растение ваточника (Asclepia tuberosa L.), основного источника питания личинок Монарха; б - кладка яиц на листьях ваточника; в - личинка, выходящая из яйца; г - гусеница бабочки; д - взрослое насекомое

В 1999 г. появилось сообщение американских энтомологов (J. Losey и др., 1999) о выявленном токсическом эффекте пыльцы трансгенной кукурузы на рост и развитие гусениц бабочки. Выводы делались на основании данных лабораторного теста на токсичность с использованием ручного напыления пыльцы трансгенной кукурузы Bt11 (ген cry1Ab) на листья одного из видов ваточника, которым в природе питается бабочка. Это сообщение было сразу же взято на вооружение противниками выращивания трансгенных культур. Однако в ответ на эту статью и обвинения в адрес трансгенной кукурузы были высказаны также обоснованные сомнения по поводу правильности постановки самого эксперимента и правильности выводов о негативном влиянии Bt-кукурузы на численность бабочки, сделанные при отсутствии каких-либо данных экологических исследований. В результате US EPA выделило грант на изучение проблемы и создало группу из специалистов-биологов различного профиля для изучения всех аспектов проблемы согласно принципам и методам, применяемым этим учреждением.
На первом этапе анализа применили методику острого эксперимента по скармливанию гусеницам бабочки искусственного питания с добавлением очищенного кристаллического токсина четырех типов (Cry1Ab, Cry1Ac, Cry9C и Cry1F); листьев ваточника (Asclepias spp), опыленных чистой пыльцой ряда гибридов Bt-кукурузы (на основе линий Bt11, 176 и Mon810, вырабатывающих токсин Cry1Ab; линии Cbh351, вырабатывающей токсин Cry9C; линии Dbt418, вырабатывающей токсин Cry1F) и листьев ваточника, опыленных пыльцой, загрязненной остатками вегетативных тканей кукурузы. Учитывали летальный и сублетальный эффекты на разных стадиях развития гусеницы.
В эксперименте с добавлением чистого токсина было показано полное отсутствие неблагоприятных воздействий при использовании токсинов Cry9C и Cry1F. Действительное токсическое влияние при скармливании листьев, опыленных чистой пыльцой, было выявлено только в случае трансгенной линии 176. Причем эффект проявлялся при малых дозах нанесения пыльцы, сопоставимых с реально возможными при переносе пыльцы с кукурузы на растения ваточника в природе. В других случаях использования гена cry1Ab (линии Btll иMon810) токсическое влияние наблюдали только в случае, если пыльца была загрязнена остатками вегетативных тканей растения, чего, как правило, не бывает при естественном распространении пыльцы. На основании результатов проведенного исследования было сделано заключение о возможном токсическом влиянии для гусениц бабочки в природных условиях только гибридов кукурузы, происходящих от линии 176. К 2001 г. этой кукурузой было засеяно менее 2 % площадей, занятых всей трансгенной кукурузой США, и перерегистрация ее для дальнейшего использования не предполагалась.
Эксперимент выявил ряд сложностей, с которыми может быть связана реальная оценка токсичности пыльцы на основе только лабораторного теста, и показал необходимость проведения экологических полевых экспериментов для оценки реальных последствий воздействия пыльцы Bt-кукурузы на развитие гусеницы и численность бабочки. Полевой эксперимент проводили на различных участках в разных штатах США и Канады, отражающих наиболее типичные места обитания бабочки Монарх в различных климатических зонах. Кроме токсического влияния изучали плотность оседания пыльцы на растениях ваточника, растущих внутри кукурузных полей и по их краям, влияние климатических факторов (ветер, дождь) на распространение и сохранность пыльцы на листьях, предпочтения гусениц в питании в пределах растения.
Эксперимент подтвердил токсическое сублетальное влияние пыльцы гибрида кукурузы, происходившего от линии l76, и его отсутствие для гибридов, бравших начало от кукурузы Bt 11 и Mon 810. В случае гибрида от линии 176 была установлена худшая выживаемость и развитие личинок, которые питались на растениях ваточника, растущих внутри кукурузных полей, по сравнению с выживаемостью тех, что кормились за пределами поля. Это объяснялось большей плотностью оседания пыльцы на ваточнике внутри полей. Средняя плотность оседания пыльцы для всех гибридов кукурузы оказалась примерно одинаковой и составляла 127 пыльцевых зерен на 1 см2 листа. Токсическое влияние для линии 176 было заметно при плотности пыльцы около 67 зерен на 1 см2. Как показали лабораторные тесты, для того чтобы выявить токсичность Bt 11 и Моn810, плотность пыльцы должна превышать 1000 зерен на 1 см2 листа, что в природных условиях практически нереально (на 95 % листьев ваточника плотность пыльцы не превышала 600 зерен на 1 см2). Количество пыльцы на сорных растениях резко уменьшалось при выпадении дождей. Было показано, что личинки предпочитают кормиться на верхушечных листьях ваточника, тогда как максимальное количество пыльцы наблюдалось на среднем ярусе листьев этих растений. Даже в случае питания гусениц на полях кукурузы линии 176 сублетальное влияние было ниже, чем для гусениц, питавшихся на полях нетрансгенной кукурузы, обработанных химическим инсектицидом λ-цихалотрином. Таким образом, в полевом эксперименте была подтверждена полная безопасность большинства используемых гибридов Сrу1Аb Вt-кукурузы. Даже если токсическое воздействие проявлялось, оно было ниже того, которое наблюдалось при выращивании нетрансгенной кукурузы, обрабатываемой химическими инсектицидами.
На втором этапе полевых исследований изучали экологические условия воздействия стрессового фактора. Были определены численность и плотность популяций бабочки в различных регионах «кукурузного пояса» (штаты Миннесота, Айова, Мэриленд и Висконсин в США и Онтарио - в Канаде), зависимость численности бабочки от количества зарослей ваточника. Определены предпочтения бабочек в откладывании яиц между растениями, растущими внутри и снаружи кукурузных полей, характер распределения популяций ваточника и их численность в разных регионах выращивания кукурузы. Кроме этого была проведена оценка вероятности перекрывания во времени в разных климатических регионах двух важных с точки зрения интенсивности токсического действия кукурузы фенологических событий - периода откладывания яиц и развития гусениц бабочки и максимума пыления кукурузы.
Было установлено, что бабочка привязана к растениям ваточника, расположенным внутри или вокруг полей кукурузы весь период своего развития. Численность бабочек на одно растение ваточника практически одинакова как в агросреде, так и в неокультуренных (природных) местах произрастания ваточника. В регионах большей плотности кукурузных полей и редко встречающихся природных зон предпочтение бабочками явно отдается агросреде, так как это основные места произрастания ваточника, являющегося кормовой базой бабочек и их личинок. В менее освоенных регионах явного предпочтения не наблюдалось. При обитании в агросреде бабочки предпочитали растения ваточника, растущие внутри полей, что, очевидно, объяснялось меньшей конкуренцией бабочек с другими видами насекомых и животных.
При изучении перекрывания по времени максимального пыления кукурузы (максимального увеличения плотности пыльцы) и периодов развития бабочки оказалось, что в южных штатах, где бабочка чаще селится внутри кукурузных полей, основная часть особей успевает пройти стадию личинки и развиться до взрослого состояния до начала интенсивного пыления кукурузы. В северных регионах периоды пыления кукурузы и личиночной стадии бабочки совпадали, но именно в этих регионах у бабочек больше возможностей селиться за пределами агросреды. Таким образом, было показано, что основное влияние на численность бабочек оказывает кормовая база, т. е. наличие зарослей ваточника, а оно в свою очередь в наибольшей степени определяется применяемыми в том или ином регионе методами ведения сельскохозяйственного производства (применение вспашки, гербицидов, выбор основной сельскохозяйственной культуры).
В результате проведенных исследований экспертная группа сделала следующие обобщенные выводы:
1. Экспрессия Bt токсинов в пыльце большинства коммерческих гибридов кукурузы очень мала. Поэтому лабораторный и полевой тест показывают отсутствие токсических воздействий при плотности пыльцы, обычной при пылении кукурузы.
2. Только часть бабочек использует заросли ваточника внутри и возле кукурузных полей. При этом наблюдается различное и ограниченное перекрывание периода основного пыления кукурузы и активного периода размножения и развития бабочек. Поэтому токсичность пыльцы не может радикальным образом повлиять на численность вида бабочки.
3. С учетом площадей, занимаемых трансгенной Вt-кукурузой, уровня токсичности и экспозиции действия токсина (плотность и время действия пыльцы) риск воздействия трансгенной кукурузы на численность популяции бабочки Монарх можно признать крайне незначительным. По расчетам экспертов при существовавшем в 2000-2001 гг. уровне использования гибридов на основе линии 176, риску токсического действия пыльцы этих гибридов могли подвергнуться не более 0,8 % популяции бабочки, обитающей в регионе «кукурузного пояса».
4. Основной причиной сокращения численности бабочки Монарх в США следует признать сокращение ее природного ареала в связи с интенсивным сельскохозяйственным производством и связанным с ним сокращением численности ваточника, на котором бабочка кормится и размножается.
11.3.5. Появление живых организмов, резистентных или толерантных к продуктам трансгенов
Практика показывает, что использование устойчивых к болезням и вредителям сортов и новых химических препаратов защиты растений сопровождается процессом адаптации к ним патогенов. Адаптация основана на генетических изменениях в популяциях патогенов под действием селективного давления, оказываемого выращиванием устойчивых растений и применением пестицидов. Как правило, контроль численности приобретших резистентность популяций патогена проводить гораздо сложнее и обходится он дороже, чем контроль исходных популяций.
Наиболее ярко процесс приобретения и развития устойчивости к пестицидам прослеживается у насекомых-вредителей, которые используют разнообразные адаптационные стратегии развития устойчивости. Они могут приспосабливать свое пищеварение к безопасному перевариванию вторичных токсичных метаболитов растений-хозяев или развить механизм детоксикации или нейтрализации токсинов. У них может появиться новое пищевое поведение, они могут сменить свои пищевые предпочтения или полностью перейти на питание новым видом растения.
Использование трансгенных растений имеет более короткую историю по сравнению с химизацией сельского хозяйства. Однако уже имеются примеры приобретения комплексной устойчивости к гербицидам у трансгенного рапса и передачи устойчивости нетрансгенным сортам. Как растение предшествующей культуры рапс с комплексной устойчивостью к гербицидам может представлять немалую проблему для контроля над сорняками при выращивании последующей культуры. Вероятность интрогрессии генов толерантности к гербицидам от рапса к его диким сорным сородичам усугубляет проблему развития устойчивости к гербицидам при участии этой трансгенной культуры.
В настоящее время известно несколько видов насекомых, развивших устойчивость к распыляемым бактериальным препаратам Вt-токсинов. В отличие от быстро разрушающихся на свету бактериальных препаратов, постоянно действующие в течение сезона летальные или полулетальные дозы Вt- токсинов трансгенных растений обеспечивают более длительное и сильное селективное давление на популяцию вредителя, что может стать источником ускорения процесса приобретения или закрепления у него устойчивости. Поэтому уже сейчас стоит подумать о мерах, которые могут уменьшить потенциальную адаптацию вредителей к трансгенным растениям с Вt-устойчивостью.
Как показывает история использования пестицидов, полностью исключить постепенную адаптацию к ним патогенов практически невозможно. Поэтому вопрос стоит не об абсолютном предотвращении процесса адаптации, а максимальном замедлении и уменьшении его вредоносного эффекта. В настоящее время в мире используются пять ключевых стратегий, на которых в той или иной степени основаны предлагаемые программы менеджмента развития резистентности.
Первая стратегия получила название стратегии гена. Она нацелена на уничтожение гетерозиготных особей, появившихся в результате скрещивания чувствительных и резистентных особей из популяции вредителя. Согласно теории полурецессивного характера резистентности насекомых, устойчивость особей варьирует в зависимости от количества аллелей резистентности у каждого из индивидуумов. В соответствии с этой моделью гетерозиготные особи имеют промежуточную устойчивость по сравнению с родителями и могут выжить при минимальной экспозиции токсина. Увеличение токсического эффекта до критической отметки, убивающей всех гетерозиготных особей, способно радикальным образом снижать вероятность возникновения резистентной популяции. Наиболее надежным средством реализации этой стратегии применительно к инсектицидным трансгенным растениям является получение растений, в которых экспрессия Вt-генов была бы достаточной для уничтожения гетерозиготных особей на протяжении всего периода вегетации.
Вторая стратегия заключается в периодической или полной замене источника токсичности или комбинировании источников токсичности. Очевидно, что смертность в популяции вредителя или сорняка в результате одновременного действия разных механизмов воздействия токсинов будет препятствовать их адаптации. Например, кроме разных генов cry от Bacillus thuringiensis, наличие которых предоставляет возможность для комбинирования, предлагается ряд других источников токсичности различного происхождения: ингибиторы протеиназ, амилаз, лектины, хитиназы и др. Эффект может достигаться смешением при посадке семян, принадлежащих различным генетическим линиям, использованием гибридов между линиями, экспрессирующими различные токсины, или сменой линий в севообороте, созданием ГМ-линий, содержащих несколько разных генов токсичности, которые могут действовать одновременно или один за другим. Эта стратегия реализована, в частности, путем создания гибридов между трансгенными линиями, несущими разные гены Bt- токсичности, или гибриды с разными генами толерантности к гербицидам (что позволяет комбинировать или чередовать применение разных гербицидов).
Третья стратегия - поддержание чувствительности популяции к определенному типу токсина (уменьшение селективного давления). Идея этой стратегии состоит в сохранении и поддержании в популяции определенного количества особей, гомозиготных по гену чувствительности к токсину, которые могут передать потомству гены чувствительности, и таким образом препятствовать отбору на резистентность. Сохранение чувствительных особей осуществляется путем создания так называемых «островков безопасности» - растений, не несущих гены токсичности. «Островки безопасности» могут создаваться за счет мозаичных посадок трансгенных и нетрансгенных форм в коммерческих посевах в пропорции, позволяющей не снижать урожайность культуры за счет поражения вредителем и в то же время сохранять популяцию чувствительных особей вредителя. Для большинства культур рекомендуется пропорция 80 % трансгенных и 20 % - нетрансгенных растений. Тканеспецифическая экспрессия гена токсичности, или экспрессия гена токсичности на определенных этапах развития растений (временное лимитирование действия гена токсичности), также могут нести функции «островков безопасности».
Четвертая стратегия - прогнозирование появления резистентных форм и мониторинг за развитием резистентности. Предварительная оценка популяций вредителя на вероятность развития ими резистентности и изучение процесса адаптации к токсину должны помочь выявить появление резистентности популяций на ранних этапах и таким образом упростить дальнейший контроль над этим нежелательным явлением. Мониторинг предусматривает периодический отбор проб особей из популяций вредителя и их изучение с помощью недорогих диагностических средств или в специальных лабораториях с более сложным оборудованием. Этот подход, хорошо себя зарекомендовавший в развитых странах с достаточно большим опытом выращивания трансгенных растений, пока мало доступен развивающимся странам из-за своей высокой стоимости и необходимости создания специальных структур для осуществления мониторинга.
Пятая стратегия - неукоснительное выполнение условий эксплуатации в каждом конкретном случае использования трансгенных растений. Эта стратегия имеет самое широкое применение и действует одновременно со всеми другими. Основная идея - использование трансгенных растений с устойчивостью к вредителям, которое осуществляется по результатам предварительной оценки риска возникновения резистентности и с учетом требований по всемерному предотвращению этого риска. Оценка производится по принципу индивидуального подхода в соответствии с условиями конкретного региона использования ГМО и с учетом опыта более ранних случаев появления резистентности патогенов к подобного рода пестицидам (токсинам).
Элементы, которые необходимо учитывать при оценке вероятности развития резистентности к токсину: 1) особенности культуры, оказывающие влияние на развитие адаптации к токсину у организма-мишени; 2) особенности биологии вредителя: количество видов растений-хозяев вредителя, способность вида-вредителя к развитию резистентности к токсину; 3) возможность и выгодность использования подходящих генно-инженерных технологий на основании полученных данных о характере культуры и ее вредителя. По результатам оценки определяют, может ли быть использована та или иная генно-инженерная модификация для решения проблемы устойчивости данной культуры в данном регионе, выбирается стратегия поддержания чувствительности популяций патогена к токсину.
11.3.6. Влияние трансгенных вирусных ДНК (РНК) на естественную эволюцию вирусов
Получение трансгенных растений с устойчивостью к вирусным заболеваниям - одно из наиболее ценных достижений современной генно-инженерной биотехнологии. Однако, несмотря на неоспоримые преимущества, практическое использование вирусоустойчивых растений может быть связано с определенными экологическими рисками. В качестве фактора риска рассматривают вероятность взаимодействия продуктов трансгенов вирусного происхождения с природными вирусами по типу синергизма, транскапсидации или рекомбинации. Эти взаимодействия теоретически могут привести к повышению активности вирусов, выражающейся как в усилении их поражающего действия, так и расширении первоначального видового состава их потенциальных носителей. Фактором риска в отношении некоторых групп трансгенных растений является также возможная миграция гена вирусоустойчивости к представителям диких родственных видов, появление резистентности или толерантности которых к вирусам может стать фактором неконтролируемого увеличения их численности.
Повышение активности вирусов может быть вызвано фенотипическими изменениями во взаимодействии вирусов между собой и их кумулятивным действием на растение-носитель или иметь в своей основе генетические изменения вирусной РНК при ее рекомбинации с РНК трансгенного устойчивого к вирусам растения.
При синергизме два или более различных вирусов могут одновременно заражать растение. При этом комбинированное действие этих вирусов имеет больший поражающий эффект, чем тот, который был бы при заражении каждым из вирусов в отдельности. В случае взаимодействия вирусов с трансгенным растением существует вероятность эффекта синергизма при взаимодействии РНК или протеинов, являющихся продуктами трансгена, и вирусом другого типа (не родственного трансгену), заражающего трансгенное растение. До настоящего времени не было зафиксировано ни одного случая синергизма у трансгенных растений, однако такие взаимодействия между вирусами, одновременно заражающими одно растение, неоднократно наблюдались у нетрансгенных растений, например, при одновременном заражении картофеля вирусами Х (PVX) и Y (PVY).
При транскапсидации происходит замена капсидной белковой оболочки одного типа вируса на капсидную оболочку другого. Если первый вирус мог распространяться от растения к растению посредством растительноядных насекомых (например, тлей, жуков), то передача его капсидной оболочки второму вирусу, не имевшему такой способности, приводит у второго вируса к ее появлению. Таким образом, транскапсидация рассматривается как способ расширения числа потенциальных носителей вирусов, которые раньше были ограничены в выборе хозяина из-за невозможности переноса растительноядными насекомыми. В случае с трансгенными вирусоустойчивыми растениями РНК вируса, заражающего трансгенное растение, может приобрести новую белковую оболочку (энкапсидироваться), кодируемую трансгеном этого растения.
Несмотря на теоретическую возможность транскапсидации и синергизма при участии вирусных генов трансгенных растений, осуществление этих событий в естественных условиях представляется маловероятным. Кроме того, синергизм и транскапсидация у сельскохозяйственных культур могут иметь только кратковременный фенотипический эффект, прекращающийся вместе с окончанием вегетации трансгенного растения. Эффекты, которые могут последовать для трансгенных растений от реализации синергизма или транскапсидации, не могут превышать тех, что имеют место при заражении вирусами нетрансгенных чувствительных к вирусам растений.
Рекомбинация вирусной РНК со встроенными участками генома растений вирусного происхождения гораздо чаще, по сравнению с двумя предыдущими явлениями, рассматривается в качестве реального источника неблагоприятных последствий для окружающей среды в литературе, касающейся безопасности использования растений с трансгенным признаком устойчивости к вирусам. Была выявлена возможность рекомбинации между РНК вируса мозаики цветной капусты (СаМV) с РНК трансгенных растений со встроенными генами вирусов хлорозной пятнистости вигны (ССМV) и кустистой карликовости томата (ТБSV). Показано также восстановление двигательной функции белка у дефектного по этому признаку штамма СаМV, после его инокуляции в трансгенные растения рапса с экспрессией гена СаМУ ORFVI, кодирующего двигательный протеин, необходимый для систематического заражения растений вирусом мозаики цветной капусты. Следовательно, нельзя исключить вероятность случаев рекомбинации как между РНК вирусов, принадлежащих к одной или разным группам, так и вероятность рекомбинации РНК вирусов с участками РНК, являющимися продуктами транскрипции встроенных генов вирусного происхождения трансгенных растений.
Если такая рекомбинация возможна, возникает вопрос, может ли рекомбинация между РНК трансгенного происхождения и РНК инфицирующего вируса стать причиной возникновения новых штаммов вируса с более сильными, чем у исходного штамма, поражающими свойствами? К настоящему времени нет ни одного экспериментального подтверждения такого увеличения патогенности. Наличие рекомбинации между природными вирусами, одновременно заражающими растение, позволяет говорить о том, что трансгенные растения, экспрессирующие гены вирусного происхождения, не представляют новой опасности повышения вирулентности вирусов и по своему влиянию на процесс эволюции вирусов.
11.3.7. Сокращение биологического разнообразия в результате изменения естественных биоценозов при выращивании трансгенных растений
Биологическое разнообразие - не только основа стабильного существования жизни на Земле, но и источник богатейших ресурсов для жизнедеятельности человека. Генетическое разнообразие является основой и неотъемлемой частью биологического разнообразия. Под генетическим разнообразием понимается вариация генов или аллельного разнообразия генов внутри популяции (элементарной единицы эволюции) и вида. Генетическое разнообразие имеет жизненно-важное значение для существования популяции и вида в целом, поскольку позволяет им адаптироваться к изменяющимся условиям окружающей среды и выживать как в имеющихся на данный момент, так и новых условиях существования. Таким образом, генетическое разнообразие - фундамент видового разнообразия и стабильности экосистем.
Биологическое и генетическое разнообразие рассматриваются как всемирное достояние человечества, а в любой стране мира - как национальное достояние, использование и эксплуатация которого должно регулироваться государственными законами (Конвенция о биологическом разнообразии, принцип 2). Потенциал биоразнообразия, которым человечество может пользоваться без ущерба для окружающей среды для своего стабильного существования и развития, еще до конца не изучен, используется лишь частично, и порой весьма нерационально. Достижения биотехнологии и, в частности, генетической инженерии, во многом способствуют более полному, разнообразному и рачительному использованию биоресурсов за счет придания уже применяемым человеком формам дополнительных адаптивных свойств, новых полезных качеств, повышения их продуктивности. Одновременно они делают доступными для использования новые виды, не находившие применение раньше в силу каких-то своих биологических особенностей или из-за кажущейся бесполезности. Эти методы позволяют добиться качественного изменения сельскохозяйственного производства, снижая его экстенсивность, зависимость от экологически опасной химизации и энергонасыщенности, при этом не снижая общего количества урожая. В развивающихся странах применение современных технологий должно способствовать снижению экстенсивности сельского хозяйства и тем самым сохранению природных экосистем. В развитых странах уход от экстенсивных технологий способствует превращению части территорий, ранее занятых под сельскохозяйственные посевы, в рекреационные зоны, лесные насаждения и другие, более естественные и богатые в биологическом плане ландшафты. Таким образом, использование достижений генетической инженерии способствует сохранению и восстановлению биологического разнообразия в природе.
Однако часто высказываются опасения по поводу того, что достижения генетической инженерии могут оказывать и противоположный эффект на развитие природных и агробиологических экосистем и биологическое, прежде всего генетическое, разнообразие в целом. Выделяют пять источников опасности ГМО для генетического (биологического) разнообразия. С первыми тремя мы уже знакомились раньше. Это основные факторы риска высвобождения ГМО в окружающую среду:
✵ возможная повышенная инвазивность и агрессивность некоторых ГМО, которая может привести к подавлению и вытеснению тех же, что и ГМО, видов, а также других видов экосистемы, не способных конкурировать с ГМО за жизненное пространство или пищевую базу;
✵ нецелевое действие ГМО с токсическими свойствами, которое может привести к уменьшению численности не только вредителей, но и нейтральных и полезных видов, привести к нарушениям экологических связей с участием этих видов (прерывание пищевой цепи, исчезновение опылителя, нарушение биологического контроля численности вредителей);
✵ последствия миграции трансгенов от ГМО к их диким родственным видам.
Источниками опасности снижения видового и генетического разнообразия, которые связаны не столько с использованием ГМО, сколько с естественным стремлением людей к получению максимальной прибыли при производстве сельскохозяйственной продукции, являются:
✵ использование в агропроизводстве монокультуры, которое приводит, с одной стороны, к уменьшению разнообразия биоценозов в агросреде и соответственно к уменьшению видового разнообразия организмов, обычно обитающих в биотопах агросреды. С другой стороны, монокультура становится источником снижения генетического разнообразия, которое может стать причиной снижения адаптивных возможностей культуры и стать источником селективного прессинга в популяциях ее вредителя;
✵ использование ограниченного количества наиболее экономически выгодных сортов и вытеснение местных сортов и рас, являющихся источниками многих селекционно-ценных признаков, что ведет к снижению генетического разнообразия и потере многих ценных аллелей и генов, которые впоследствии могли бы быть востребованы при улучшении существующих сельскохозяйственных культур.
Если первые два источника теоретически могут привести к уменьшению численности и потере каких-либо биологических видов (к снижению биологического видового разнообразия), то миграция трансгенов не приводит к снижению видового разнообразия экосистемы и не обязательно сказывается на численности вида-реципиента трансгенного признака. Однако она приводит к изменению существующего генетического разнообразия в популяции-реципиенте родственного вида и может отразиться на его адаптивных свойствах.
Как правило, в связи с миграцией трансгенов высказываются опасения, что их присутствие у дикого вида может привести к снижению аллельного разнообразия в локусе, к которому принадлежит трансген, или в локусах, взаимодействующих с трансгеном. В первую очередь может произойти потеря редких аллелей, не имеющих большого адаптивного значения для популяции при стабильных условиях окружающей среды, не подверженных резким изменениям. Но при возникновении таких резких изменений в условиях существования (например, появлении нового не эндемичного патогена или хищника, влиянии антропогенных факторов и др.), именно эти редкие аллели могут оказаться фактором выживания популяции. Таким образом, потеря аллельного разнообразия, несмотря на преимущества, которые могут быть связаны с приобретением популяцией трансгенов, при изменении условий окружающей среды в будущем может негативно отразиться на адаптивных способностях популяции и вида в целом.
Как показывают примеры изучения генетического разнообразия в популяциях диких видов, подверженных интрогрессии генов со стороны культурных родственников, миграция трансгенов необязательно ведет к уменьшению аллельного разнообразия диких популяций. Так, при изучении интрогрессии генов от сахарной свеклы (Beta vulgaris ssp. vulgaris L.) к популяциям дикого вида свеклы морской (В. vulgaris, ssp. maritima (L) Arcang.) у последней наряду с новыми генами были выявлены все редкие аллели, присущие данному подвиду. При этом генетическое разнообразие в популяциях, взаимодействовавших с культурным видом, было выше, чем в изолированных популяциях В. maritima.
Несмотря на неоднократно высказывавшиеся опасения, нет ни одного доказанного случая негативного влияния ГМО на видовое разнообразие и стабильность развития природных экосистем (в агросистемах неблагоприятные явления более вероятны). Не нашли подтверждения и опасения по поводу снижения генетического разнообразия в природных популяциях родственных ГМО видов. Возможно, это объясняется недостаточным объемом знаний в этой области. Однако эксперименты по изучению взаимодействия ГМО с природными экосистемами продолжаются, ведется постоянный мониторинг за вновь высвобождаемыми и вновь создаваемыми ГМО.
Второе объяснение отсутствия выявленных неблагоприятных экологических последствий выращивания ГМ-растений - строгое регулирование генноинженерной деятельности во всем мире. Если какие-то признаки опасности ГМО для окружающей среды имеют место, то либо запрещается высвобождение ГМО, либо приостанавливается его использование. Могут также вводиться специальные требования по регулированию рисков, которые позволяют минимизировать воздействие ГMО на окружающую природную среду.
Для большинства современных ГМ-растений, которые, как правило, являются однолетними сельскохозяйственными культурами, характерно кратковременное воздействие их на окружающую среду и ограниченное взаимодействие с природными экосистемами. В будущем разнообразие ГМО будет расширяться. Уже сейчас имеются примеры удачных генетических модификаций многолетних, в том числе древесных культур, некоторых видов рыб и других животных аквакультуры, использование которых приведет к более тесному и длительному контакту ГМО с природными экосистемами. Однако подход к экологической безопасности таких объектов гораздо строже.
Если первые три источника снижения биологического и генетического разнообразия можно рассматривать скорее в теоретическом контексте, то неблагоприятные последствия использования монокультуры и ограниченного сортового разнообразия мы имеем возможность наблюдать в действительности. История существования этих источников неблагоприятных последствий для окружающей среды столь же продолжительна, как и история развитого сельскохозяйственного производства. «Вина» трансгенных культур в развитии этих нежелательных процессов состоит не столько в их происхождении, сколько в успешности при конкурировании с уже используемыми в производстве сортами растений, созданными методами традиционной селекции.
Монокультура ведет к увеличению опасности развития болезней и численности вредителей. Снижение генетического разнообразия за счет предпочтения немногих сортов еще более увеличивает эту опасность и в результате приводит к снижению адаптивных возможностей популяции сельскохозяйственной монокультуры. В историю вошли трагические последствия эпифитотии фитофтороза картофеля 1845 г., поразившей практически всю Европу и США. Особенно сильно пострадала Ирландия - страна, где картофель был основной культурой и источником пищи населения. Он представлял собой потомство первой интродукции в Европу картофеля южноамериканского происхождения, имевшего узкую генетическую базу, который оказался беззащитным перед новым патогеном, проникшим в Европу из Северной Америки. В результате голода, вызванного гибелью посадок картофеля, численность населения Ирландии сократилась почти на 2,5 млн человек из-за высокой смертности и вынужденной эмиграции.
Имеются примеры и более близких в историческом плане событий, связанных с монокультурой. Например, в 1970 г. шестая часть посевов кукурузы в США (в том числе половина посевов в южных штатах) погибла из-за поражения невероятно размножившимся грибным патогеном Helminthosporium maydis (другое название Bipolaris mayáis), вызывающего пятнистость листьев и початков. А в Индонезии в конце 1970-х гг. из-за нашествия свинушек (Delphacidae Leach.), цикадовидных насекомых из отряда равнокрылых, полностью погибли плантации риса (основной культуры этой страны), которые были представлены практически одним единственным сортом. Это событие стало одной из основных причин голода в индонезийской провинции Ломбук.
Как показало изучение аллельного разнообразия кукурузы, из 163 идентифицированных аллелей, принадлежащих к 23 локусам 34 различных мексиканских рас кукурузы, только 11 % аллелей присутствует во всех расах. Они же есть и у 30 наиболее популярных инбредных линий кукурузы, которые являются родительскими формами практически всех гибридов, выращиваемых в США, 60 % аллелей встречаются с очень малой частотой (порядка 0,01). В элитных инбредных линиях сохраняются не более двух из этих редких аллелей. Ежегодно аллельное богатство, предоставляемое местными расами и сортами, безнадежно теряется. Так, по сообщениям FAO к 1996 г. в связи с распространением современных интенсивных сортов исчезло более тысячи местных рас основных сельскохозяйственных культур.
Наибольшее разнообразие местных форм и рас наблюдается в центрах происхождения и генетического разнообразия сельскохозяйственных растений.
За редким исключением (например, в случае пшеницы), центры происхождения сельскохозяйственных культур представляют собой места их наибольшего генетического разнообразия. Большинство сельскохозяйственных растений имеют лишь один или небольшое число центров генетического разнообразия. Н. И. Вавилов (1935) выделял восемь таких центров, семь из которых сегодня территориально совпадают с регионами развивающихся стран мира.
Опасность, связанная с ГМ-сортами сельскохозяйственных культур, заключается в том, что они представляют несомненный интерес для увеличения объема сельскохозяйственной продукции развивающихся стран. Слабая законодательная база и отсутствие инфраструктуры в области биобезопасности в подавляющем большинстве этих стран не могут должным образом защитить от вытеснения местные сорта и расы. В результате они могут быть потеряны из-за своей экономической неконкурентоспособности. Свою лепту в снижение генетического разнообразия могут внести также последствия миграции трансгенов и потенциальное повышение инвазивности некоторых трансгенных культур.
Мировое сообщество, международные организации, имеющие отношение к биобезопасности (в том числе FAO, UNIDO, UNEP, CBD, OECD и некоторые другие), одну из основных задач видят в помощи странам в создании национальных систем биобезопасности, которые позволили бы защитить их биологическое (генетическое) разнообразие и сделать его доступным для мирового использования.
11.3.8. Процедура оценки экологических рисков использования ГМО
На первом этапе оценки риска возможных неблагоприятных эффектов ГМО на окружающую среду выявляют факторы риска и определяют их вероятные последствия. Определение факторов риска проводится на основании данных о ГМО и условиях их высвобождения. Они включают данные научной литературы об объекте модификации, характере модификации и экологической системе предполагаемого высвобождения, и ее компонентах, данные о характере модификации и ГМО, а также сведения о последствиях более ранних случаев высвобождения подобных ГМО и/или высвобождения ГМО в подобных данному случаю условиях. Результатом первого этапа оценки риска является построение так называемой концептуальной модели вероятных взаимоотношений ГМО с окружающей средой и вероятных экологических последствий таких взаимоотношений.
Второй этап - анализ поведения ГМО в окружающей среде, его взаимоотношений с окружающей средой. Он опирается на ранее полученные сведения о ГМО и условиях его высвобождения и на результаты специально проводимых исследований: лабораторных тестов, ограниченных полевых испытаний (англ. small-scale field test), экологических исследованиях по всем направлениям взаимодействий, определенных в концептуальной модели. Анализ состоит из двух блоков. Первый блок - характеристика воздействия, оказываемого ГМО на окружающую среду. Она основана на изучении предполагаемых воздействий ГМО на отдельные элементы окружающей среды или экологическое поведение ГМО в модельных условиях. Это могут быть, например, тесты на токсичность в отношении организмов, не являющихся мишенями трансгенных признаков, определение территории возможного распространения пыльцы и семян, способность эффективно скрещиваться с другими видами, тестирование семян на выживаемость, на скорость прорастания или продолжительность периода покоя, конкурентоспособность (агрессивность) по отношению к другим видам и т. д. Второй блок - оценка воздействия, оказываемого ГМО на окружающую среду. Она включает в себя масштабные исследования, позволяющие оценить воздействие ГМО на окружающую среду с учетом реальных природных условий, в которых они будут существовать и использоваться. Эти исследования учитывают особенности агротехники выращивания ГМО, масштабность их высвобождения и длительность использования.
Третий этап - оценка риска на основании всех полученных данных о ГМО с учетом выявленных факторов неопределенности. Она показывает степень вероятности возникновения неблагоприятных последствий использования ГМО, исходя из характера и интенсивности их воздействия по каждому из выявленных факторов риска, и совокупный риск, который может представлять модифицированный организм.
Четвертый этап - принятие решения о высвобождении ГМО. На основании полученных данных принимается решение о целесообразности высвобождения ГМО. Также разрабатывается план управления риском и план мониторинга высвобождения ГМО.
11.4. Биобезопасность в системе международных отношений. Регулирование безопасности генно-инженерной деятельности в Республике Беларусь
До тех пор, пока имеется элемент научной неопределенности относительно возможных неблагоприятных эффектов генно-инженерной деятельности для здоровья человека и окружающей среды, она в соответствии с принципом принятия мер предосторожности должна регулироваться на государственном уровне. В большинстве развитых стран мира принято и эффективно функционирует специальное законодательство, касающееся биобезопасности, а также созданы соответствующие компетентные органы, которые претворяют его в жизнь. Несмотря на возможные отличия, структура биобезопасности отдельных государств включает в себя ряд основных компонентов. Во-первых, к ним относится законодательная база, регулирующая генно-инженерную деятельность. Во-вторых - административная система, исполняющая, контролирующая законный порядок осуществления генно-инженерной деятельности. В-третьих - система обоснованного принятия решений, которая базируется на адекватной оценке и предупреждении риска генно-инженерной деятельности (управление риском). И, наконец, механизм информирования и участия общественности в принятии решений о разрешении определенной генно-инженерной деятельности и контроле над их исполнением.
Вопросы безопасности генно-инженерной деятельности, регулирования межгосударственных отношений в сфере биобезопасности были в центре внимания крупных международных организаций, начиная с 80-х гг. XX в. На Венской встрече 1986 г. государств - участников Совещания по безопасности и сотрудничеству в Европе было положено начало деятельности Европейской экономической комиссии (EEC), связанной с разработкой руководящих принципов безопасности в области биотехнологии. На 21 сессии ЕЕС (сентябрь 1994 г.) были обобщены материалы по биобезопасности (законы и постановления, инструкции, поступившие от правительств 30 стран, а также ряда международных организаций. Организация по экономическому сотрудничеству и развитию (OECD) финансировала сотрудничество стран- членов этой организации в области безопасности в биотехнологии. Эксперты из 25 стран подготовили две важнейших публикации: первая имела название «Аспекты безопасности при работе с рекомбинантными ДНК», а вторая была посвящена планированию и проведению экспериментов при контролируемом высвобождении генетически измененных растений и микроорганизмов в окружающую среду.
Важной вехой в процессе разработки международных руководящих принципов безопасности в биотехнологии была публикация «Добровольного кодекса поведения при высвобождении организмов в окружающую среду», подготовленного неформальной группой экспертов из четырех организаций ООН: UNIDO, UNEP, WHO и FAO. В «Повестке дня на XXI век», принятой на конференции ООН по окружающей среде и развитию (UNCED) в Рио-де-Жанейро в 1992 г., глава 16 непосредственно посвящена экологически безопасному использованию биотехнологий. В частности, в этой главе признается, что, хотя сами по себе биотехнологии не в состоянии разрешить все фундаментальные проблемы окружающей среды и развития, они могут внести весомый вклад в обеспечение устойчивого развития путем повышения эффективности производства продуктов питания и кормов, систем здравоохранения и природоохранной деятельности. Однако общество в целом сможет получить максимальную выгоду от использования биотехнологий только в том случае, если они будут разрабатываться и применяться с соблюдением принципов предосторожности. В связи с этим ставится задача обеспечить безопасность при разработке, применении, передаче биотехнологий и их обмене на основе международных договоренностей относительно принципов оценки и учета факторов риска.
Проблема обеспечения безопасности в области биотехнологии рассматривается в рамках Конвенции о биологическом разнообразии. В подпункте g) статьи 8 содержится призыв к Сторонам конвенции устанавливать или поддерживать средства регулирования, контроля или ограничения риска, связанного с использованием и высвобождением живых измененных организмов, являющихся результатом современной биотехнологии и способных оказывать неблагоприятное воздействие на сохранение и устойчивое использование биологического разнообразия. В 2000 г. странами - Сторонами Конвенции о биологическом разнообразии принят Картахенский протокол по биобезопасности, основная цель которого - это содействие обеспечению надлежащего уровня защиты в области безопасной передачи, обращения
и использования живых измененных организмов, являющихся результатом современной биотехнологии, способных оказывать неблагоприятное воздействие на сохранение и устойчивое использование биологического разнообразия, с учетом также рисков для здоровья человека и с уделением особого внимания трансграничному перемещению (Картахенский протокол, ст. 1). Картахенский протокол вступил в силу 11 сентября 2003 г. В настоящее время он является основным международным договором, регулирующим межгосударственные отношения в области биобезопасности. Его Сторонами являются 166 стран (по состоянию на май 2014 г.). Республика Беларусь присоединилась к Картахенскому протоколу 6 мая 2002 г.
Основное положение Протокола состоит в требовании использовать процедуру заблаговременного обоснованного согласия до первого трансграничного перемещения ГМО, предназначенных для преднамеренного высвобождения в окружающую среду страны импорта. Это означает, что любое юридическое или физическое лицо, имеющее намерение ввезти в страну генетически модифицированный организм (например, семена сельскохозяйственных культур, предназначенные для посева), должно заблаговременно информировать об этом компетентные органы страны импорта, предоставив соответствующую информацию о ГМО, месте и времени его высвобождения. Ввоз ГМО осуществляется только в случае получения экспортером разрешения страны импорта, которое выдается после тщательного анализа рисков возможных неблагоприятных последствий высвобождения ГМО для здоровья человека и окружающей среды.
Живые организмы, попавшие в окружающую среду, не признают границ между государствами. Поэтому имеется возможность для непреднамеренного трансграничного перемещения ГМО. В связи с этим Стороны Протокола берут на себя обязательство принятия мер по регулированию рисков возможных неблагоприятных последствий высвобождения ГМО в окружающую среду. В число таких мер входит прежде всего выдвижение требования относительно проведения оценок рисков до первого высвобождения в окружающую среду ГМО, созданных в стране. Кроме того, в Протоколе подробно описаны действия Сторон в случае непреднамеренного высвобождения ГМО, которые могут оказать значительные неблагоприятные воздействия на здоровье человека и окружающую среду как в самой стране, так и в соседних странах при перемещении в них таких ГМО.
Каждая Сторона принимает необходимые правовые, административные и другие меры для выполнения своих обязательств, предусмотренных в рамках Протокола. Речь идет, в частности, о разработке и принятии соответствующего законодательства, регулирующего безопасность генно-инженерной деятельности, создании административных структур (или наделении соответствующими полномочиями уже существующих), ответственных за реализацию этого законодательства. Таким образом, присоединение к Картахенскому протоколу какой-либо страны не только обеспечивает возможность урегулирования вопросов, связанных с экспортом и импортом ГМО, но и создает предпосылки для создания национальной системы биобезопасности, которая является важнейшим атрибутом эффективного и безопасного использования достижений современных биотехнологий, развития генетической инженерии как одного из наиболее перспективных научных направлений.
11.4.1. Государственное регулирование безопасности генно-инженерной деятельности в Республике Беларусь
Развитие генно-инженерных биотехнологий в научных исследованиях, появление на рынке продуктов, полученных из генно-инженерных организмов, выполнение международных обязательств в области биобезопасности обусловили необходимость разработки и создания национальной системы биобезопасности в Республике Беларусь.
Для выбора модели государственного регулирования биобезопасности большое значение имеет адекватная оценка преимуществ и возможных неблагоприятных эффектов использования достижений современной биотехнологии. В Беларуси взяли за основу научно обоснованное, подтвержденное на практике представление о генетической инженерии как новом методе селекции, позволяющем существенно расширить возможности традиционной селекции за счет использования всего разнообразия ценных генов, существующих в природе. К модели государственного регулирования биобезопасности предъявлялись следующие требования. Во-первых, она должна обеспечить безопасность человека и окружающей среды при осуществлении генно-инженерной деятельности и использовании ее результатов, одновременно создавая благоприятные условия для развития генетической инженерии как одного из приоритетных научных направлений. Во-вторых, при формировании системы биобезопасности государство должно избегать существенного изменения действующего законодательства, создания новых государственных структур, которые лягут дополнительным бременем на республиканский бюджет и рядового налогоплательщика. Предполагалось использовать уже существующие структуры, наделив их, если в этом есть необходимость, соответствующими полномочиями. В-третьих, в новом законодательстве в области биобезопасности важно использовать нормы и процедуры, которые можно выполнить с минимальными затратами ресурсов и средств, а сами процедуры должны быть простыми и понятными для граждан. В-четвертых, общество имеет право получать полную и достоверную информацию о результатах генно-инженерной деятельности и осуществлять общественный контроль. Поэтому в создаваемой системе биобезопасности должен быть предусмотрен механизм информирования и участия общественности в принятии решений в этой области.
В основу концепции государственного регулирования безопасности генно-инженерной деятельности положен имеющийся опыт ряда ведущих стран, существующее законодательство Республики Беларусь и сложившаяся в стране система государственного управления, ее обязательства по международным соглашениям. Важнейшие ее положения нашли отражение в Законе Республики Беларусь «О безопасности генно-инженерной деятельности», который был принят 9 января 2006 г.
Закон Республики Беларусь «О безопасности генно-инженерной деятельности» (далее - Закон) устанавливает правовые и организационные основы обеспечения безопасности генно-инженерной деятельности и направлен на охрану здоровья человека и окружающей среды, выполнение Республикой Беларусь международных обязательств в области безопасности генно-инженерной деятельности. Он включает преамбулу и 7 глав, в которых содержится 29 статей.
Прежде всего необходимо отметить, что в Законе впервые для Беларуси раскрыто содержание важнейших понятий, которые имеют значение для правильного формирования и развития нормативно-правовой базы в этой области отношений (ст. 1). Приведем наиболее важные из них:
✵ генно-инженерная деятельность - деятельность, связанная с созданием генно-инженерных организмов, высвобождением их в окружающую среду для проведения испытаний, использованием в хозяйственных целях, ввозом в Республику Беларусь, вывозом из Республики Беларусь и транзитом через ее территорию генно-инженерных организмов, их хранением и обезвреживанием;
✵ безопасность генно-инженерной деятельности - состояние защищенности, достигаемое посредством выполнения мер, направленных на предотвращение или снижение до безопасного уровня возможных вредных воздействий генно-инженерных организмов на здоровье человека и окружающую среду при осуществлении генно-инженерной деятельности;
✵ генно-инженерный организм (генетически измененный (модифицированный, трансгенный) организм) - живой организм, содержащий новую комбинацию генетического материала, полученного с помощью генетической инженерии;
✵ генетическая инженерия - технология получения новых комбинаций генетического материала путем проводимых вне клетки манипуляций с молекулами нуклеиновых кислот и переноса созданных конструкций генов в живой организм, в результате которого достигаются включение и активность их в этом организме и у его потомства;
✵ использование генно-инженерных организмов в хозяйственных целях - выращивание (культивирование) и (или) разведение сортов генно-инженерных растений, пород генно-инженерных животных и штаммов непатогенных генно-инженерных микроорганизмов для производства сельскохозяйственной и микробиологической продукции.
В Законе закреплено, что его положения не распространяются на отношения, связанные с применением генетической инженерии к человеку, его органам и тканям, с обращением с фармацевтическими препаратами, продовольственным сырьем и пищевыми продуктами, кормами для животных, полученными из генно-инженерных организмов или их компонентов (ст. 2). Они регулируются специальным законодательством о здравоохранении.
В ст. 3 Закона сформулированы основополагающие принципы, на которых построена система биобезопасности в Республике Беларусь:
✵ принятие мер предосторожности при осуществлении генно-инженерной деятельности;
✵ научно обоснованный, интегрированный и индивидуальный подходы при оценке риска возможных вредных воздействий генно-инженерных организмов на здоровье человека и окружающую среду;
✵ независимость государственной экспертизы безопасности генно-инженерных организмов;
✵ доступ к информации в области безопасности генно-инженерной деятельности.
Важным для функционирования предлагаемой модели государственного регулирования является закрепление в качестве объектов данной сферы отношений генно-инженерных организмов, а также права на осуществление генно-инженерной деятельности. В качестве субъектов этой деятельности могут выступать государственные органы, осуществляющие государственное регулирование и контроль, физические и юридические лица, занимающиеся генно-инженерной деятельностью, эксперты, проводящие государственную экспертизу безопасности генно-инженерных организмов, граждане и общественные объединения, осуществляющие общественный контроль в области биобезопасности (ст. 4).
Указанные выше принципы положены в основу системы обеспечения безопасности генно-инженерной деятельности (ст. 5), которая согласно Закону достигается путем:
✵ принятия (издания) нормативных правовых актов, утверждения и введения в действие технических нормативных правовых актов в области безопасности генно-инженерной деятельности и их реализации;
✵ выдачи специально уполномоченными республиканскими органами государственного управления в области безопасности генно-инженерной деятельности разрешений на ввоз, вывоз или транзит условно патогенных и патогенных генно-инженерных организмов, а также разрешений на высвобождение непатогенных генно-инженерных организмов в окружающую среду для проведения испытаний;
✵ проведения аккредитации замкнутой системы для осуществления работ второго, третьего и четвертого уровней риска генно-инженерной деятельности;
✵ проведения государственной регистрации сортов генно-инженерных растений, пород генно-инженерных животных и штаммов непатогенных генно-инженерных микроорганизмов;
✵ осуществления учета генно-инженерных организмов в соответствии с законодательством;
✵ установления и соблюдения требований безопасности генно-инженерной деятельности;
✵ планирования и выполнения мероприятий по обеспечению безопасности генно-инженерной деятельности;
✵ проведения государственной экспертизы безопасности генно-инженерных организмов;
✵ осуществления контроля в области безопасности генно-инженерной деятельности;
✵ установления ответственности за нарушение требований законодательства о безопасности генно-инженерной деятельности;
✵ осуществления иных мер безопасности генно-инженерной деятельности в соответствии с законодательством.
Всякая модель государственного регулирования конкретной деятельности требует наделения достаточными полномочиями государственных органов в целях создания целостной управленческой системы. В ст. 6 Закона закреплен перечень государственных органов, наделенных компетенций в данной области отношений, а в ст. 7-11 определены основные функции государственного управления, которые они обязаны осуществлять в силу закона. Порядок реализации предоставленных законом полномочий подробно регламентируется в статьях о регулировании отдельных направлений генно-инженерной деятельности. Система республиканских органов государственного управления, осуществляющих надведомственные полномочия в области генно-инженерной деятельности, включает в себя Министерство природных ресурсов и охраны окружающей среды, Министерство здравоохранения, Министерство сельского хозяйства и продовольствия. Дополнительные права и обязанности в этой сфере возлагаются на названные министерства также в связи с решением Совета Министров о выполнении международных обязательств республики (постановление Совета Министров Республики Беларусь № 734 от 5 июня 2002 г. «О мерах по реализации положений Картахенского протокола по биобезопасности к Конвенции о биологическом разнообразии»).
В гл. 3 Закона определены обязанности лиц, осуществляющих генно-инженерную деятельность, а также сформулированы требования безопасности при осуществлении отдельных видов генно-инженерной деятельности. При проведении работ с генно-инженерными организмами установлены следующие уровни риска генно-инженерной деятельности:
✵ первый уровень риска - работа с непатогенными генно-инженерными организмами;
✵ второй уровень риска - работа с условно патогенными генно-инженерными организмами;
✵ третий уровень риска - работа с патогенными генно-инженерными организмами, способными вызывать опасные инфекционные заболевания и распространять инфекцию, для которых имеются эффективные меры профилактики и лечения;
✵ четвертый уровень риска - работа с патогенными генно-инженерными организмами, которые являются возбудителями особо опасных инфекционных заболеваний, обладающих способностью быстро распространяться, и для которых неизвестны эффективные меры профилактики и лечения.
Индивидуальные предприниматели имеют право осуществлять генноинженерную деятельность только первого уровня риска, т. е. деятельность, связанную с непатогенными генно-инженерными организмами. Генно-инженерная деятельность второго, третьего и четвертого уровней риска осуществляется исключительно государственными юридическими лицами.
Законом определены требования безопасности при осуществлении следующих основных видов генно-инженерной деятельности, сложившихся в мировой практике: а) осуществление генно-инженерной деятельности в замкнутой системе, т. е. в научно-исследовательских лабораториях (ст. 14); б) высвобождение генно-инженерных организмов в окружающую среду для проведения испытаний, т. е. для оценки и отбора полезных и безопасных для человека улучшенных сортов растений и пород животных на специально обустроенных участках (ст. 15); в) использование полученных сортов генно-инженерных растений, пород генно-инженерных животных и штаммов непатогенных генно-инженерных микроорганизмов в хозяйственных целях (ст. 16); г) перемещение различных генно-инженерных организмов через границу Республики Беларусь, т. е. ввоз, вывоз и транзит, например семян сельскохозяйственных культур, клубней картофеля и др. (ст. 18). Также сформулированы требования безопасности при транспортировке и обезвреживании генно-инженерных организмов (ст. 17 и19).
Отдельная глава Закона посвящена организации государственной экспертизы безопасности генно-инженерных организмов, которая проводится в целях определения допустимости их высвобождения в окружающую среду для проведения испытаний или использования в хозяйственных целях на основе идентификации генно-инженерных организмов и изучения материалов по оценке риска возможных вредных воздействий генно-инженерных организмов на здоровье человека и окружающую среду. В соответствии с Законом государственной экспертизе подлежат непатогенные генно-инженерные организмы при их первом высвобождении в окружающую среду для проведения испытаний и при государственной регистрации сортов генно-инженерных растений, пород генно-инженерных животных и штаммов непатогенных генно-инженерных микроорганизмов, предназначенных для использования в хозяйственных целях. В ст. 21 подробно описывается процедура осуществления государственной экспертизы безопасности генно-инженерных организмов.
Значительное внимание в Законе уделено вопросам информационного обеспечения в области безопасности генно-инженерной деятельности, а также учету и государственной статистической отчетности в этой области. Как показывает мировая практика, без отлаженного механизма обмена информацией между отдельными органами государственного управления, международными организациями решение проблемы обеспечения биобезопасности оказывается неэффективным. Ответственным за информационное обеспечение в области безопасности генно-инженерной деятельности определен Институт генетики и цитологии НАН Беларуси, на который ранее были возложены обязанности Национального координационного центра биобезопасности, а также координационного центра, ответственного за связь с секретариатом Картахенского протокола по биобезопасности.
В Законе закреплено право граждан и общественных объединений на получение полной, своевременной и достоверной информации в области безопасности генно-инженерной деятельности. Специально уполномоченные республиканские органы государственного управления в этой области, а также юридические лица и индивидуальные предприниматели, осуществляющие генно-инженерную деятельность, обязаны, в соответствии с Законом, по просьбе заинтересованных граждан и общественных объединений предоставлять информацию в области безопасности генно-инженерной деятельности.
Организация контроля в области безопасности генно-инженерной деятельности рассматривается в шестой главе Закона. Государственный контроль в области безопасности генно-инженерной деятельности осуществляется в целях проверки соблюдения нормативных правовых актов и технических нормативных правовых актов, а также выполнения мероприятий по обеспечению безопасности этой деятельности. Ведомственный контроль в этой области осуществляется республиканскими органами государственного управления, местными исполнительными и распорядительными органами и иными организациями в целях обеспечения выполнения подведомственными им организациями требований законодательства о безопасности генно-инженерной деятельности и охраны окружающей среды. Юридические лица и индивидуальные предприниматели, осуществляющие генно-инженерную деятельность, организуют и осуществляют производственный контроль в целях проверки соблюдения требований безопасности генно-инженерной деятельности, установленных нормативными правовыми актами и техническими нормативными правовыми актами в области безопасности генно-инженерной деятельности. Общественный контроль в области безопасности генно-инженерной деятельности осуществляется гражданами и общественными объединениями в соответствии с законодательством.
Седьмая глава определяет порядок вступления Закона в силу: это должно произойти через шесть месяцев после его официального опубликования. За этот срок Совет Министров согласно ст. 29 обязан обеспечить приведение актов законодательства Республики Беларусь в соответствие настоящим Законом, а также обеспечить принятие нормативных правовых актов, необходимых для его реализации.
Настоящий закон в совокупности с актами действующего законодательства, а также рядом правовых документов (более двадцати), разработанных в его развитие, составляет основу нормативно-правовой базы национальной системы биобезопасности. В частности, в целях государственного регулирования биобезопасности при создании, испытании и использовании в хозяйственных целях новых сортов генно-инженерных растений, используются, помимо названного Закона, следующие нормативные документы. При осуществлении работ по созданию генетически модифицированных организмов следует учитывать Требования безопасности к замкнутым системам при осуществлении работ первого уровня риска генно-инженерной деятельности и субъектам, осуществляющим создание генно-инженерных организмов, которые утверждены постановлением Министерства природных ресурсов и охраны окружающей среды Республики Беларусь (Минприроды). Для оценки биобезопасности ГМО необходимо использовать Инструкцию о порядке проведения оценки риска возможных вредных воздействий генно-инженерных организмов на здоровье человека, утвержденную постановлением Главного государственного санитарного врача Республики Беларусь, и Инструкцию о порядке проведения оценки риска возможных вредных воздействий генноинженерных организмов на окружающую среду, утвержденную Минприроды.
Порядок выдачи разрешений на высвобождение непатогенных генноинженерных организмов в окружающую среду для проведения испытаний определен постановлением Совета Министров Республики Беларусь. Вопросы, касающиеся проведения государственной экспертизы безопасности генноинженерных организмов, конкретизированы в таких актах законодательства, как Положение о порядке проведения государственной экспертизы безопасности генно-инженерных организмов и примерных условиях договоров, заключаемых для ее проведения (утверждено Советом Министров Республики Беларусь), и Положение об экспертном совете по безопасности генно-инженерных организмов Министерства природных ресурсов и охраны окружающей среды Республики Беларусь (утверждено Минприроды). Требования безопасности к опытным полям, на которых проводятся испытания ГМО при их первом высвобождении в окружающую среду, а также порядок проведения
испытаний регламентированы соответствующими нормативными правовыми актами Минприроды.
Следует обратить внимание на прил. 2 к Положению о порядке проведения государственной экспертизы безопасности генно-инженерных организмов и примерных условиях договоров, заключаемых для ее проведения, в котором содержится перечень информации об оценке риска и мерах по предупреждению риска ГМ-растений для здоровья человека и окружающей среды. Эту информацию (см. приложение к пособию) заявитель обязан собрать и предоставить в экспертный совет в виде досье ГМО, по результатам изучения которого и выдается (или не выдается) разрешение на высвобождение ГМО в окружающую среду для проведения испытаний. Этот документ фактически определяет основное содержание исследований по оценке риска ГМО, предусмотренных законодательством Беларуси.
Порядок государственной регистрации сортов генно-инженерных растений, а также пород генно-инженерных животных и штаммов непатогенных генно-инженерных микроорганизмов установлен Советом Министров Республики Беларусь. Государственную регистрацию осуществляет Министерство сельского хозяйства и продовольствия (Минсельхозпрод) путем внесения соответствующих сведений в Государственный реестр сортов генно-инженерных растений, пород генно-инженерных животных и штаммов непатогенных генно-инженерных микроорганизмов. Порядок ввоза и вывоза семян ГМО определен в Инструкции о порядке выдачи разрешений на ввоз в Республику Беларусь и вывоз за ее пределы семян, утвержденной Минсельхозпродом.
В законодательстве Республики Беларусь закреплены конкретные нормы, предполагающие информирование и участие общественности в принятии решений, касающихся биобезопасности, реализация которых осуществляется с помощью Национального координационного центра биобезопасности. Специалисты центра проводят большую работу в средствах массовой информации по разъяснению политики государства в этой области, предоставлению объективной, научно обоснованной информации по актуальным вопросам современной биотехнологии, в том числе относительно потенциальных рисков генно-инженерной деятельности и их предупреждению. На веб-сайте Национального координационного центра биобезопасности (www.biosafety. оrg.bу) представлена не только официальная информация по законодательству и вопросам, касающимся принятия решений в области биобезопасности, но и много образовательных материалов. В Беларуси создана правовая база для информирования потребителей о пищевых продуктах, полученных из ГМО, посредством соответствующей маркировки. В соответствии с постановлением Совета Министров «О некоторых вопросах информирования потребителей о продовольственном сырье и пищевых продуктах» создана сеть аккредитованных лабораторий, а также утвержден перечень сырья и продуктов, подлежащих контролю на наличие генетически модифицированных составляющих.
Таким образом, вступившее в силу в 2006 г. специальное законодательство Республики Беларусь в области безопасности генно-инженерной деятельности, а также соответствующие акты действующего законодательства и международные договоры, к которым присоединилась Республика Беларусь, четко регламентируют вопросы биобезопасности от создания генно-инженерных организмов до их официального допуска к использованию в хозяйственных целях. При этом предусмотрена многоступенчатая, с каждым этапом все более сложная и скрупулезная процедура испытаний ГМО на предмет их безопасности для здоровья человека и окружающей среды. В результате для использования в хозяйственных целях допускаются только те сорта ГМ-растений, относительно которых получены убедительные доказательства их безопасности.
Разработка технологий получения ГМО, внедрение их в нашу повседневную жизнь в виде прежде всего новых, более эффективных сортов сельскохозяйственных растений, новых лекарств, методов лечения болезней, инициировали появление фактически новой науки - биобезопасности, призванной обеспечить получение максимальной выгоды от использования ГМО при их обязательной безопасности для здоровья человека и окружающей среды. За сравнительно короткий срок были сформулированы базовые концепции, принципы биобезопасности, разработаны и внедрены эффективные методы оценки риска генно-инженерной деятельности. Эти принципы и методы закреплены в ряде международных документов, актах законодательства многих стран, что делает их применение обязательным для любого нового ГМО, который предполагается использовать на благо человечества. Методы оценки риска генно-инженерной деятельности постоянно совершенствуются, расширяется опыт и объем знаний в этой области. Благодаря широкому использованию принципа принятия мер предосторожности в виде государственного регулирования процессов создания, испытания и использования ГМО, разработке и применению научных подходов и методов оценки рисков, связанных с ГМО, удалось добиться того, что к настоящему моменту не зафиксировано ни одного документально подтвержденного случая неблагоприятных эффектов генно-инженерной деятельности на здоровье человека и окружающую среду. Это делает весьма оптимистичным прогноз относительно дальнейшего расширения масштабов использования генно-инженерных биотехнологий.
Заключение
Генетическая инженерия открывает новые, немыслимые ранее возможности модификации генетического материала клетки и получения в результате генетически модифицированных организмов, обладающих свойствами, которые невозможно получить с помощью методов традиционной селекции. В связи с этим при осуществлении генно-инженерной деятельности (создании, испытании и использовании ГМО в практической деятельности) применяется принцип принятия мер предосторожности, суть которого состоит в ограничении такой деятельности в случае, если уровень научной неопределенности относительно ее потенциального риска для здоровья человека и окружающей среды является значительным, а возможности управления риском - недостаточными.
Для того чтобы принять решение относительно возможности безопасного осуществления генно-инженерной деятельности, проводится оценка ее риска для здоровья человека и состояния окружающей среды. В отношении генноинженерной деятельности термином «риск» определяют потенциально возможные прямые и опосредованные неблагоприятные воздействия ГМО или продуктов, изготовленных из ГМО (включающих ГМО), на здоровье человека и(или) окружающую среду, обусловленные эффектом вставки рекомбинантной ДНК, функционирования трансгенов и передачей трансгенов от ГМО другим организмам. Вероятность осуществления таких воздействий и размеры соответствующего ущерба в совокупности определяют величину риска генно-инженерной деятельности.
Методология оценки риска основана на следующих принципах: она должна проводиться на научной основе, с применением индивидуального подхода, последовательно, шаг за шагом; риски, связанные с ГМО или содержащими их продуктами, должны рассматриваться в контексте рисков, существующих при использовании интактных реципиентных организмов в потенциальной принимающей среде; в случае поступления новой информации о ГМО и его эффектах на здоровье человека и окружающую среду результаты оценки риска могут быть пересмотрены.
Основными факторами риска для здоровья человека продуктов, изготовленных из ГМО или включающих компоненты из ГМО (ГМ-продуктов), являются: синтез новых для реципиентного организма белков - продуктов трансгенов, которые могут быть токсичными и/или аллергенными, изменение активности отдельных генов живых организмов под влиянием вставки чужеродной ДНК, в результате которого может произойти ухудшение потребительских свойств продуктов питания, получаемых из этих организмов, перенос трансгенов микроорганизмам пищеварительного тракта, обусловливающий их устойчивость к лекарственным препаратам, применяемым для лечения человека и животных (например, маркерных генов устойчивости к антибиотикам). Базовой концепцией оценки риска ГМ-продуктов является концепция существенной эквивалентности. В ее рамках исследуется качественный и количественный состав ключевых компонентов ГМО и подходящего аналога (немодифицированного организма или традиционных продуктов питания). Отличительные признаки рассматриваются в качестве факторов риска, которые изучают в рамках процедуры оценки пищевой безопасности ГМ-продуктов.
При оценке пищевой безопасности ГМ-продуктов принимают во внимание информацию о происхождении ГМО (прежде всего, о токсическом и аллергенном потенциале родительских видов), характере генно-инженерной модификации, данные молекулярно-генетического анализа белковых продуктов встроенных генов. Инструментальная оценка биобезопасности экспрессирующихся в ГМО целевых продуктов трансгенов заключается в определении их вероятной токсичности и аллергенности. Проводимые исследования сконцентрированы на химической природе и функциях новых синтезируемых веществ, на доказательстве того, что гены донора, определяющие синтез неблагоприятных для здоровья продуктов, не перенесены в ГМО. Если продукты трансгенов не являются известными веществами с длительной историей безопасного употребления в пищу или уровень их экспрессии достоверно превышает таковой у аналога, то проводятся принятые исследования токсичности, включая эксперименты на животных.
Основные источники неблагоприятных последствий высвобождения ГМО для окружающей среды (экологические риски): появление новых более
агрессивных сорняков в результате генетической модификации или переноса трансгенов, способствующих повышению агрессивности вида, диким родственным видам; миграция и последующая интрогрессия трансгенов в дикие популяции в результате вертикального или горизонтального переноса генов; воздействие продуктов трансгенов на организмы, не являющиеся мишенью их запланированного действия; появление живых организмов, резистентных или толерантных к продуктам трансгенов; влияние трансгенных вирусных ДНК (РНК) на естественную эволюцию вирусов путем транскапсидации, синергизма, рекомбинации; сокращение биологического (генетического) разнообразия в результате изменения естественных биоценозов, вытеснения местных сортов, преобладания в агропроизводстве монокультуры.
На первом этапе оценки риска возможных неблагоприятных эффектов ГМО на окружающую среду выявляют факторы риска на основании данных о ГМО и условиях их высвобождения. В результате этого строится концептуальная модель вероятных взаимоотношений ГМО с окружающей средой и вероятных экологических последствий таких взаимоотношений. Второй этап - анализ поведения ГМО в окружающей среде, его взаимоотношений с окружающей средой. Он опирается на ранее полученные сведения о ГМО и об условиях их высвобождения, и на результаты специально проводимых исследований: лабораторных тестов, ограниченных полевых испытаний, экологических исследований по всем направлениям взаимодействий, определенных в концептуальной модели. Анализ состоит из двух блоков. Первый блок - характеристика воздействия, оказываемого ГМО на окружающую среду. Для этого проводят, например, тесты на токсичность в отношении организмов, не являющихся мишенями трансгенных признаков, определение территории возможного распространения пыльцы и семян, способность эффективно скрещиваться с другими видами, тестирование семян на выживаемость, на скорость прорастания или продолжительность периода покоя, конкурентоспособность (агрессивность) по отношению к другим видам и т. д. Второй блок - оценка воздействий, оказываемых ГМО на окружающую среду. Она включает проведение масштабных исследований, позволяющих оценить воздействие ГМО на окружающую среду с учетом реальных природных условий, в которых они будут существовать и использоваться. Эти исследования учитывают особенности агротехники выращивания ГМО, масштабность их высвобождения и длительность использования. Третий этап - оценка риска на основании всех полученных данных о ГМО с учетом выявленных факторов неопределенности. Она показывает степень вероятности возникновения неблагоприятных последствий использования ГМО, исходя из характера и интенсивности их воздействия по каждому из выявленных факторов риска, и дает оценку совокупного риска, который может представлять модифицированный организм.
До тех пор, пока имеется элемент научной неопределенности относительно возможных неблагоприятных эффектов генно-инженерной деятельности для здоровья человека и окружающей среды, она, в соответствии с принципом принятия мер предосторожности, должна регулироваться на государственном уровне. В большинстве развитых стран мира принято и эффективно функционирует специальное законодательство, касающееся биобезопасности, вопросы биобезопасности занимают важное место в системе международных отношений.
В 2000 г. принят Картахенский протокол по биобезопасности, основная цель которого - содействие обеспечению надлежащего уровня защиты в области безопасной передачи, обращения и использования живых измененных организмов, являющихся результатом современной биотехнологии. Картахенский протокол вступил в силу 11 сентября 2003 г. Его Сторонами являются 166 стран (по состоянию на май 2014 г.). Республика Беларусь присоединилась к Картахенскому протоколу 6 мая 2002 г. Основное положение Протокола состоит в требовании использовать процедуру заблаговременного обоснованного согласия до первого трансграничного перемещения ГМО, предназначенных для преднамеренного высвобождения в окружающую среду страны импорта. Это означает, что любое юридическое или физическое лицо, имеющее намерение ввезти в страну ГМО, должно заблаговременно информировать об этом компетентные органы страны импорта, предоставив соответствующую информацию о ГМО, месте и времени его высвобождения. Ввоз ГМО осуществляется только в случае получения экспортером разрешения страны импорта, которое выдается после тщательного анализа рисков возможных неблагоприятных последствий высвобождения ГМО для здоровья человека и окружающей среды.
Развитие генно-инженерных биотехнологий в научных исследованиях, появление на рынке продуктов, полученных из генно-инженерных организмов, обусловили необходимость разработки и создания национальной системы биобезопасности в Республике Беларусь. 9 января 2006 г. принят Закон Республики Беларусь «О безопасности генно-инженерной деятельности», который устанавливает правовые и организационные основы обеспечения безопасности генно-инженерной деятельности и направлен на охрану здоровья человека и окружающей среды, выполнение Республикой Беларусь международных обязательств в области безопасности генно-инженерной деятельности. В совокупности с актами действующего законодательства, а также рядом правовых документов (более двадцати), разработанных в его развитие, этот Закон составляет основу нормативно-правовой базы в области биобезопасности.
Контрольные вопросы
1. Почему в генно-инженерной деятельности используется принцип принятия мер предосторожности? В чем состоит его суть?
2. Что означает «риск генно-инженерной деятельности»?
3. Какие этапы включает процедура оценки риска генно-инженерной деятельности?
4. Назовите базовые концепции и принципы осуществления оценки риска генно-инженерной деятельности.
5. Какие факторы риска для здоровья человека связывают с ГМО, которые используют для производства продуктов питания?
6. Чем различаются подходы, применяемые при оценке безопасности традиционных и ГМ-продуктов питания?
7. В чем заключается суть концепции существенной эквивалентности ГМО традиционному аналогу? Какие традиционные аналоги используют при определении существенной эквивалентности?
8. Как осуществляют оценку токсичности протеинов-продуктов трансгенов?
9. Назовите методические подходы, применяемые при оценке аллергенности пищевых продуктов, в частности, ГМ-продуктов.
10. Что такое непреднамеренные эффекты генетической модификации? В чем они выражаются, как их выявляют и оценивают?
11. Насколько опасны для здоровья человека эффекты горизонтального переноса селективных генов устойчивости к антибиотикам от ГМ-продуктов микроорганизмам пищеварительного тракта?
12. Какие генетические особенности ГМ-растений позволяют предполагать у них потенциальные неблагоприятные воздействия на окружающую среду?
13. Какие растения могут стать опасными сорняками в результате генно-инженерной модификации?
14. Добавление каких признаков может повысить сорный потенциал ГМ- растений?
15. Чем опасна миграция трансгенов от ГМО в популяции родственных диких видов?
16. Какова вероятность переноса трансгенов от ГМ растений почвенным микроорганизмам? Какими могут быть последствия такого переноса?
17. Каким образом продукты трансгенов могут оказывать воздействие на организмы, не являющиеся их мишенью? Какие экологические последствия могут иметь такие воздействия?
18. Что не учли американские энтомологи I. Е. Losey с сотрудниками (1999), сделав заключение о токсичности пыльцы трансгенной кукурузы для гусениц бабочки Монарх?
19. Какие стратегии используют для предупреждения появления организмов, толерантных к продуктам трансгенов?
20. Какие экологические последствия может иметь транскапсидация вирусных частиц в клетках устойчивых к вирусам ГМ-растений?
21. Каким образом выращивание ГМ-растений может оказывать неблагоприятное воздействие на биологическое разнообразие?