БИОТЕХНОЛОГИЯ РАСТЕНИЙ И БИОБЕЗОПАСНОСТЬ - А. П. Ермишин - 2015
ГЛАВА 5. КЛОНАЛЬНОЕ РАЗМНОЖЕНИЕ РАСТЕНИЙ IN VITRO. СОХРАНЕНИЕ ГЕНЕТИЧЕСКИХ КОЛЛЕКЦИЙ IN VITRO
Использование методов культуры клеток, тканей и органов растений in vitro открывает новые возможности для вегетативного размножения и поддержания генетических коллекций. Сельскохозяйственные или декоративные растения размножают вегетативным способом в том случае, если они имеют специальные органы для такого типа размножения (клубни, луковицы, клубнелуковицы, столоны) или у них растянутый ювенильный период, что удлиняет сроки получения урожая, затрудняет селекционную оценку отдельных генотипов (древесные и кустарниковые культуры).
Сорта, породы вегетативно размножаемых растений - это, как правило, сложные гетерозиготы, нередко полиплоиды. Воспроизвести их генотип путем семенного размножения практически невозможно. Вегетативное размножение позволяет получить большое количество особей одного ценного для селекции и хозяйственной деятельности генотипа, что является его главным преимуществом по сравнению с семенным размножением. Кроме того, с помощью вегетативного размножения можно значительно быстрее получить урожай от растений, которые медленно развиваются. Например, сделав прививку в крону взрослого дерева яблони, можно уже через год-два получить плоды интересующего нас сорта.
Однако вегетативное размножение имеет ряд недостатков. Коэффициент размножения при естественном вегетативном размножении, как правило, не такой высокий, как при семенном размножении. Так, при размножении семенного картофеля от одного растения получают лишь 4-10 клубней, которые можно использовать на посадку. В то же время с одного растения пшеницы можно собрать более ста семян. Семенные клубни, луковицы намного крупнее обычных семян. Для их хранения нужны большие помещения, в которых должна поддерживаться определенная температура, влажность, что нередко связано со значительными затратами энергии. Сорта вегетативно размножаемых культур в ходе вегетации накапливают разнообразные инфекции, которые передаются последующим поколениям. Если бактериальные и грибные инфекции можно искоренить с помощью соответствующих химических препаратов, то болезни растений, вызванные вирусами и вироидами, практически не поддаются лечению. В связи с этим семеноводство вегетативно размножаемых культур намного сложнее и более дорогостоящее, чем у культур, размножаемых семенами. Некоторые виды вегетативного размножения, проводимого с участием человека (прививки, отводки и другие), весьма трудоемки, носят выраженный сезонный характер, когда в короткий период времени необходимо выполнить очень большой объем работ.
Поддержание генетических коллекций вегетативно размножаемых культур также связано со значительными затратами. Они во многих случаях требуют ежегодной высадки. Для этого вспахиваются большие площади, вносятся удобрения, проводится полный комплекс агротехнических мероприятий по уходу за растениями, организуется охрана посадок, проводится уборка и сортировка, закладка на хранение собранных клубней, луковиц. Особые требования предъявляются к поддержанию растений в здоровом состоянии, выбраковке тех из них, что поражены вирусными болезнями. Значительные сложности могут возникнуть с сохранением отдельных образцов, если они не приспособлены к условиям выращивания. Например, образцы диких видов картофеля, представляющие значительный интерес для селекции как источники ценных генов устойчивости к болезням и вредителям, могут не образовывать клубни в условиях длинного дня, характерного для умеренных широт.
Осуществление вегетативного размножения в условиях in vitro позволяет существенно повысить его эффективность, устранить многие из перечисленных недостатков. Современные технологии клонального размножения растений in vitro обеспечивают очень высокий коэффициент размножения. Так, от одного пробирочного растения картофеля за год можно получить более ста тысяч растений. Большим преимуществом этой технологии является то, что с ее помощью можно эффективно размножать те растения, которые с трудом размножаются традиционными методами. Все работы можно проводить круглогодично, для их проведения не требуются большие площади. Особенно важно, что при размножении растений в пробирках не возникает угрозы их повторного заражения вирусными и другими болезнями (при условии, что исходное маточное растение здорово). В целом применение технологии клонального размножения растений in vitro экономически значительно более выгодно по сравнению с традиционными технологиями вегетативного размножения и дает возможность получать семенной материал более высокого качества.
5.1. Использование культуры апикальных меристем для получения свободного от патогенов посадочного материала
Цель вегетативного размножения - получить от маточного растения больше здоровых растений за как можно более короткий срок. При этом важно, чтобы эти новые растения в максимальной степени воспроизводили генотип и фенотип маточного растения, прежде всего его характеристики, имеющие практическое значение. Традиционное вегетативное размножение в подавляющем большинстве случаев по своей сути - это размножение стеблевыми почками (пазушными, спящими, «глазками» клубней). Это неслучайно, поскольку именно особые свойства апикальных меристем, которые находятся в стеблевых почках, обеспечивают сохранение генотипа маточного растения в процессе размножения, а также возможность получения здоровых растений.
Меристемы формируются в процессе развития зиготического зародыша. Одни клетки меристемы (инициальные) задерживаются в недифференцированном состоянии и, делясь, обеспечивают непрерывный рост растения. Другие клетки постепенно дифференцируются, образуя постоянные ткани (покровные, проводящие, механические и другие). В отличие от клеток специализированных тканей, инициальные клетки апикальных меристем характеризуются высокой цитогенетической стабильностью: на протяжении всей жизни растения они, как правило, сохраняют генотип зиготы.
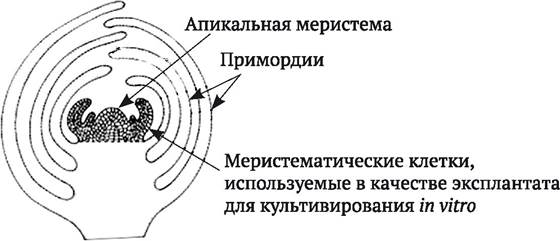
Другое важное свойство меристемных тканей - отсутствие в них или крайне низкие концентрации вирусных частиц даже у пораженных вирусами растений. Причем титр вирусов в клетках специализированных тканей тем выше, чем дальше они находятся от апикальных меристем. Как правило, апикальная меристема стебля состоит из конуса нарастания, а также одного или двух листовых зачатков (примордий) (рис. 5.1). Средний диаметр дистальной ее части составляет около 200 μм, высота - от 20 до 150 μм. В более нижних слоях дифференцирующиеся клетки меристемы образуют прокамбий, дающий начало пучкам проводящей системы. Такая особенность строения апикальной меристемы исключает проникновение в нее вирусных частиц путем быстрого транспортирования по проводящей системе, правда, допускает возможность медленного распространения через плазмодесмы, соединяющие клетки меристемы. Кроме того, считается, что высокая метаболическая активность интенсивно делящихся клеток меристемы препятствует репликации вирусных частиц. Такой же эффект может оказывать высокая концентрация ауксинов в меристемных клетках.
Рис. 5.1. Строение стеблевой почки
В 1952 г. Ж. Морель и С. Мартэн разработали методику оздоровления растений георгинов с помощью культуры in vitro апикальных меристем размером около 100 μм. С тех пор этот метод с разной степенью эффективности нашел применение для широкого круга вегетативно размножаемых растений. Было установлено, что культура меристем позволяет оздоровить растения не только от вирусов, но и бактериальной, грибной инфекции, вироидов и микоплазм. Более поздние исследования, проведенные с использованием электронного микроскопа, показали возможность присутствия вирусных частиц и в меристемных клетках. Однако во многих случаях, особенно на начальных этапах заражения, меристемные ткани длительное время остаются свободными от инфекции.
Таким образом, стеблевые меристемы наиболее подходящий эксплантат для введения предназначенных к вегетативному размножению растений в культуру in vitro, поскольку в наибольшей степени обеспечивают сохранение генотипа маточного растения и возможность получения здоровых растений.
Первым этапом промышленного размножения является отбор самых продуктивных клонов маточных растений, в наибольшей степени соответствующих описанию сорта, древесно-кустарниковой породы или выделяющихся по комплексу положительных характеристик (например, так называемые плюс-деревья). Отобранные визуально здоровые маточные растения до введения в культуру дополнительно проверяют на наличие основных вирусов с использованием различных методов: биотестов (заражения растений-индикаторов, т. е. особо чувствительных к патогену), электронной микроскопии, иммуноферментного анализа (ИФА) - ELISA (от англ. enzyme linked immunosorbent assay). В последнее время находят применение методы, основанные на анализе нуклеиновых кислот патогенов: электрофорез, in situ гибридизация в сочетании с применением различных меток (например, NASH - nucleic acid spot hybridization), варианты ПЦР-анализа (например, RT-PCR - reverse transcription polymerase chain reaction).
Культуру in vitro апикальных меристем получают, вычленяя в условиях асептики под бинокулярным микроскопом верхнюю часть конуса нарастания стебля размером около 200 μм и помещая его на агаризованную питательную среду (см. рис. 5.1). В питательную среду, помимо цитокининов и ауксинов, добавляют небольшое количество гиббереллина. Культивирование проводят на свету. Чем больше листовых зачатков имеет эксплантат, тем легче он приживается на питательной среде, лучше идет регенерация из него проростков. Однако если стоит задача получить свободные от вирусов растения-регенеранты от больных растений или есть подозрение, что какие-либо вирусы не были выявлены при оценке маточных растений, размер эксплантата должен быть как можно меньше. Эффективность оздоровления зависит не только от размера эксплантата, но и вида вируса. Так, путем культивирования апикальной меристемы картофеля удалось получить 70 % растений-регенерантов, свободных от Y-вируса картофеля (PVY), и только 10 % растений без Х-вируса (PVX).
Для повышения эффективности оздоровления от вирусной инфекции с помощью культуры меристем маточные растения перед вычленением эксплантатов подвергают термотерапии - продолжительному воздействию повышенных температур. Термотерапию проводят в климатических камерах при температуре 37 °С и относительной влажности 90 %; при освещенности растений около 5 тыс. люкс; при фотопериоде 16 ч. В течение первой недели растения постепенно адаптируют к повышенным температурам, ежедневно повышая ее на два градуса с 25 до 37 °С. Продолжительность термотерапии разная в зависимости от вида растений и вирусов. Например, для оздоровления гвоздики достаточно 10-12-недельного воздействия теплом.
Применение термотерапии в сочетании с культурой меристем дало возможность получить более 70 % свободных от вирусов растений-регенерантов хмеля, 90 % растений земляники, 25 % растений черной и красной смородины, 50 % малины, более 80 % растений картофеля. Показана эффективность термотерапии для лечения болезней, вызванных микоплазмами.
Однако большинство видов растений плохо переносят повышенные температуры при повышенной влажности: нередко растения погибают задолго до окончания теплового воздействия. Многие вирусы устойчивы к термотерапии (например, из вирусов картофеля только вирус скручивания листьев РLRV чувствителен к повышенной температуре). Сама процедура весьма дорогостоящая, требует специального оборудования.
Интересно, что в отдельных случаях весьма эффективным методом оздоровления посадочного материала является не тепловая, а холодовая обработка растений. Так, освобождение от вироида веретеновидности клубней картофеля (pSTV) было достигнуто благодаря выдерживанию в течение 6 месяцев пораженных клубней в холодильнике с последующим получением культуры меристем.
Другой способ, применяемый для освобождения растений от вирусов в сочетании с культурой меристем, - хемотерапия (также используется термин «химиотерапия»). Он заключается в добавлении в питательную среду, на которой культивируют апикальные меристемы, различных веществ, обладающих противовирусной активностью. Чаще всего для этого используют синтетические аналоги пуриновых и пиримидиновых оснований: цианогуанозин, 2-тиоурацил, Д-рибофуранозил-1,2,4-триазол-карбоксимид (коммерческое название - виразол), а также интерферон, ридостин (рибонуклеат натрия), биназу (микробную рибонуклеазу), фенолкарбоновые кислоты: салициловую, галловую, сиреневую, кофейную, феруловую, кумаровую. Положительные эффекты хемотерапии отмечены для ряда древесных и кустарниковых культур (черешни, сливы, малины, смородины), некоторых цветочных культур. Применение хемотерапии дает возможность повысить эффективность оздоровления растений от вирусов с помощью культуры меристем с 40 до 80-100 %.
Применение термо- или хемотерапии позволяет увеличить размер меристемного эксплантата без потери эффективности оздоровления, что увеличивает приживаемость эксплантатов на питательной среде и в результате дает возможность получить больше здоровых растений-регенерантов.
5.2. Клональное размножение растений in vitro
Вегетативное размножение растений с использованием методов культуры клеток, тканей и органов растений in vitro называют клональным размножением растений in vitro. Термином «клон» (от греч. веточка, побег, отпрыск) первоначально обозначали группу растений, прежде всего фруктовых деревьев, полученных от одного растения-производителя (маточного) с помощью методов вегетативного размножения. Позже клоном стали называть не только всю такую группу, но и отдельные ее особи (кроме маточного), а процесс их получения клонированием. В настоящее время термин «клон» в биологии используют более широко, например, ранее в пособии фигурировало понятие «клеточный клон», означающее потомство от митотического деления отдельной клетки. Клонируют высших животных (овца Долли), молекулы ДНК (молекулярное клонирование) и даже отдельные гены. Для обозначения процесса клонирования растений in vitro используют и такие термины, как «микроклональное размножение», «клональное микроразмножение», или просто «микроразмножение» (от англ. micropropagation). Очевидно, первая часть терминов «микро-» обязана своим появлением микроскопическим размерам эксплантатов при получении культуры апикальных меристем - первого этапа клонального размножения растений in vitro.
5.2.1. Методы клонального размножения растений in vitro
На практике используют следующие методы микроразмножения растительных организмов:
✵ активация развития уже существующих меристем (апекса стебля, пазушных и спящих почек стебля);
✵ индукция адвентивных почек у эксплантата или в каллюсной культуре;
✵ соматический эмбриогенез.
Активация развития уже существующих в растении меристем основана на снятии апикального доминирования. Апикальное доминирование - подавление роста боковых почек растительного побега при наличии верхушечной почки. Снять его у пробирочных растений можно двумя путями: удалением верхушечной почки или добавлением в питательную среду цитокининов.
Первый из этих методов предполагает разделение пробирочных растений на черенки, содержащие, как правило, одну пазушную меристему. Черенки высаживают на питательную среду, удалив полностью или частично листовую пластинку. Через некоторое время пазушная меристема активируется, образуется один или несколько проростков. Одновременно происходит укоренение черенка. В результате за сравнительно короткое время (при размножении картофеля через 3-4 недели) получается пробирочное растение, которое можно черенковать и начинать новый цикл клонирования (рис. 5.2). Один из черенков при таком размножении содержит не пазушную, а терминальную почку. Она также активируется при посадке черенка на питательную среду и за те же сроки формирует пробирочное растение.
Рис. 5.2. Клональное размножение картофеля путем черенкования пробирочных растений (за счет активации пазушных и терминальной почки): 1 - черенок, содержащий пазушную почку после посадки на питательную среду; 2 - активация пазушной или терминальной почки, начало укоренения; 3 - укорененное пробирочное растение через три недели после посадки черенка на питательную среду, его можно разделить на 4 черенка и начать следующий цикл клонирования; 4 - растение через месяц после черенкования, возможный коэффициент размножения - 8

При втором методе использование цитокининов для снятия апикального доминирования делает возможным развитие пазушных почек без удаления верхушечной почки. При этом из почек эксплантата и побегов, тронувшихся в рост из верхушечной и пазушных почек эксплантата, формируется конгломерат побегов (аксиллярное ветвление) (рис. 5.3). Когда они достигнут определенной длины (1-2 см), их отделяют от эксплантата и переносят на свежую питательную среду, содержащую цитокинины для следующего цикла размножения, или на среду с ауксинами (в некоторых случаях без регуляторов роста) для укоренения и последующей высадки в грунт. При размножении некоторых культур, прежде всего, древесных и кустарниковых, подросшие побеги укореняют ex vitro, применяя для этого специальные субстраты. Это позволяет уменьшить стоимость продукции.
Рис. 5.3. Клональное размножение in vitro лекарственного растения Picrorhiza kurroa путем индукции аксиллярного ветвления на питательной среде с кинетином. Образуется конгломерат побегов, которые можно отделить для последующего размножения in vitro или укоренения и высадки в грунт: а-г - разные варианты состава и консистенции питательной среды (по H. Sood, R. Chanhan, 2009)

Микроразмножение путем активации меристем является наиболее эффективным методом размножения растений. По сравнению с другими способами он в наибольшей степени обеспечивает сохранение генотипа исходного маточного растения, так как полученные клоны происходят непосредственно из меристематических клеток, для которых характерна высокая цитогенетическая стабильность.
На основе этого метода разработаны и применяются на практике технологии размножения овощных и технических культур (картофель, томаты, огурец, перец, тыква, спаржа, сахарная свекла, хмель, табак, топинамбур, стахис и др.), плодовых и ягодных культур (яблоня, слива, вишня, груша, виноград, малина, смородина, крыжовник и др.), древесных растений (тополь, ива, ольха, береза, рябина, секвойя, туя, можжевельник и др.), культур промышленного цветоводства (гвоздика, хризантема, роза, гербера, орхидея), тропических и субтропических растений (рододендрон, азалия, камелия, чай и др.).
Метод клонального размножения растений in vitro путем индукции адвентивных почек основан на свойстве тотипотентности растительной клетки. Суть его заключается в том, что эксплантаты разных частей и органов растений, не содержащие стеблевых почек, способны их образовывать in vitro при наличии факторов, индуцирующих стеблевой органогенез. В качестве эксплантатов могут быть сегменты листовых пластинок и черешков, молодых соцветий, чешуй и донца луковиц, клубнелуковиц, корневые черенки, боковые и интеркалярные меристемы и другие органы и ткани. Стеблевые почки возникают de novo как в эпидермальных, так и супэпидермальных слоях эксплантата. Поскольку они появляются в «необычном» для растения месте, их называют адвентивными (добавочными).
Имеется ряд растений, для которых формирование адвентивных почек - естественный способ вегетативного размножения. Например, малина и ежевика размножаются стеблевыми почками, возникающими на корнях. Бегонию, узамбарские фиалки (сенполии) и некоторые другие декоративные растения размножают преимущественно листовыми черенками. В культуре in vitro благодаря использованию соответствующих регуляторов роста (см. гл. 3) этот процесс можно значительно интенсифицировать, более того, можно добиться массового образования адвентивных почек у растений, которые в условиях in vivo их практически не образуют.
Индукция адвентивных почек из тканей эксплантата - наиболее распространенный метод микроразмножения луковичных цветочных растений (лилий, нарциссов, гиацинтов, тюльпанов) - из луковичных чешуй, сегментов базальной части донца луковиц, эксплантатов листьев; земляники садовой - из основания побегов, регенерированных в культуре меристем (рис. 5.4); представителей рода Brassica (капусты цветной, кочанной, брюссельской, брокколи) - из сегментов гипокотиля, семядолей, листьев; салата цикорного - из сегментов листовых пластинок; петуний - из сегментов корней; глоксиний, сенполий, стрептокарпуса, эхинапсуса - из сегментов листовых пластинок.
Рис. 5.4. Микроклональное размножение земляники Fragaria х ananassa Duch. путем индукции адвентивных почек из основания побегов, регенерированных в культуре меристем (по M. Biswas и др., 2009)

Полученные с помощью данного метода растения-регенеранты не всегда в полной мере воспроизводят генотип исходного маточного растения, так как цитогенетическая стабильность клеток специализированных тканей не такая высокая, как у клеток меристемных тканей. Длительно размножаемые вегетативным способом растения могут накапливать соматические мутации, в результате чего они становятся химерными. Некоторые декоративные пестролистные растения являются генетическими химерами. Образование адвентивных почек из измененных клеток приводит к образованию генетически отличных растений-регенерантов. Тем не менее опыт показывает, что при использовании этого метода размножения в большинстве случаев вариация растений-регенерантов не выходит за рамки естественного уровня.
Адвентивные стеблевые почки могут образовываться и в каллюсной культуре in vitro (стеблевой органогенез). Быстро растущие каллюсные культуры, сохраняющие высокую способность к органогенезу, дают дополнительные возможности для ускорения микроразмножения. Однако генетическая нестабильность каллюсных клеток может приводить к получению растений- регенерантов, имеющих существенные генетические отличия от исходного маточного растения (сомаклональная изменчивость) (рис. 5.5). Такие растения могут представлять селекционный интерес, но для размножения растений в коммерческих целях изменчивость - это весьма существенный недостаток. Тем не менее данный метод имеет право на жизнь в отдельных случаях, когда другие методы неэффективны, или для культур с невысокой сомаклональной изменчивостью (амариллис, эписции, драцены, томаты, спаржа, некоторые древесные породы).
Рис. 5.5. Размножение орхидеи рода Phalaenopsis (a-в) в культуре in vitro посредством регенерации из адвентивных почек в каллюсной культуре (по A. Hussain и др., 2012); пример сомаклональной вариабельности у орхидеи Doritaenopsis при регенерации из адвентивных почек (г-е) (по S. Y. Park и др., 2009): a - каллюс с массой развивающихся адвентивных почек; б - массовая регенерация побегов; в - укоренение побегов на безгормональной среде; г - цветок исходного клона Doritaenopsis, от которого был взят эксплантат (нормальный цветок); д и е - сомаклональные варианты с измененными формой и размером цветка, полученные при регенерации из адвентивных почек

Все сказанное относится и к методу клонального размножения растений in vitro, основанному на индукции соматического эмбриогенеза из тканей эксплантата или каллюсных клеток в суспензионной культуре. Вместе с тем некоторые положительные характеристики метода выводят его в число наиболее перспективных. Технологии массового получения соматических эмбриоидов и их адаптации к условиям ex vitro разработаны для ряда важных культур. Эти технологии включают, среди прочего, возможность использования биореакторов (см. гл. 4) и механизированное производство искусственных семян путем инкапсуляции эмбриоидов, благодаря чему появляется возможность существенно уменьшить трудозатраты (как при размножении, так и переносе растений в условия ex vitro) и стоимость продукции.
Идею инкапсуляции соматических эмбриоидов в целях получения искусственных семян высказывал Т. Мурасиге еще в 1970-е гг. Она была реализована на практике в начале 1980-х: применительно к высушенным соматическим эмбриоидам моркови (S. Kitto, J. Janik, 1982) и влажным (не подвергавшимся подсушиванию) эмбриоидам люцерны (K. Redenbaugh и др., 1984). Наибольшее распространение получила вторая из названных технологий, которая заключается в инкапсуляции соматических эмбриоидов в различные гелеобразные субстанции на основе агара, альгината, карбоксиметилцеллюлозы, каррагинана, гельрита, пектата натрия и др. Лучшие результаты были достигнуты при использовании альгината.
Альгиновая кислота представляет собой природный полисахарид из волокон водорослей, состоящий из двух мономеров: маннуроновой и гиалуроновой кислот (в разных соотношениях). Длинные цепи этих кислот могут перекрестно сшиваться в трехмерные цепи, которые своими карбоксильными группами связывают ионы двухвалентных металлов. Натриевая соль альгиновой кислоты хорошо растворима в воде, образуя вязкие растворы, благодаря чему ее используют в пищевой промышленности в качестве загустителя и стабилизатора. Для получения искусственных семян альгинат натрия растворяют в питательной среде, в которой выращивались соматические эмбриоиды, и в отдельные капли этого раствора помещают по одному эмбриоиду с помощью специальных приспособлений, оборудованных пипетками. Капли альгината с эмбриоидом внутри образуют в растворе нитрата кальция (или хлористого кальция) круглые плотные капсулы в результате замещения ионов Na+ на ионы Са2+. Плотность капсул зависит от количества замещенных ионов (обычно коплексование производят с 1-5 % раствором альгината натрия в 100 мМ растворе нитрата кальция в течение 20-30 мин, после чего капсулы промывают водой или питательной средой) (рис. 5.6).
Рис 5.6. Искусственные семена орхидей (соматические эмбриоиды, инкапсулированные в альгинатный гель) (а) и полученные из них проростки (б) (по G. Saipгasad, 2001)

Соматические эмбриоиды в отличие от зиготических зародышей не содержат эндосперма. Чтобы восполнить данный недостаток, все необходимые питательные вещества добавляют в матрикс капсулы. Это обеспечивает жизнеспособность эмбриоида в течение сравнительно длительного времени (6 месяцев и более) при хранении при температуре 4 °С, а также способность к прорастанию при высеве капсул в грунт. Кроме того, в матрикс вводят фунгициды, пестициды, антибиотики, повышающие сохранность капсул, активированный уголь, который улучшает дыхание эмбриоидов. В отдельных случаях (при инкапсуляции семян некоторых орхидей) туда вводят микоризы, необходимые для успешного прорастания семян и развития проростков.
Для улучшения качества искусственных семян проводят синхронизацию развития эмбриоидов (с помощью фильтрации через сита разного размера, центрифугирования, автоматического сепарирования), практикуют специальный режим подращивания эмбриоидов перед инкапсуляцией. Этот режим включает подращивание эмбриоидов в жидкой питательной среде с добавлением осмотика (10 % маннитола) на свету (около 300 люкс, фотопериод 16 ч). За это время их размер увеличивается в 3-4 раза, возрастает содержание хлорофилла. Затем их неделю подсушивают на фильтровальной бумаге на свету (содержание воды в них снижается до 80-90 %), после чего культивируют на питательной среде с 2 % сорбитола, 0,01 мг/л 6-БАП и 0,01 мг/л ГК-3 при повышенной концентрации углекислого газа в воздухе (2 %) две недели, в течение которых эмбриоиды переходят на автотрофное питание. Инкапсулированные эмбриоиды, подготовленные описанным способом, имеют высокую для искусственных семян всхожесть - около 50 %.
В целом именно низкая всхожесть искусственных семян является основным сдерживающим фактором их широкого использования. Существенный недостаток метода - возможная сомаклональная изменчивость полученных растений. Тем не менее эту технологию применяют для размножения ряда ценных культур: орхидей (дендробиумов, цимбидиумов, фаленопсисов, спатоглоссисов), известного индийского лекарственного растения нима (Azaridirachta indica), сандалового дерева (Santalum album), люцерны, хлопчатника. Для размножения масличной пальмы (Elaeis guineensis) индукция соматического эмбриогенеза - единственный приемлемый метод вегетативного размножения.
5.2.2. Проблемы перевода растений-регенерантов из условий in vitro в условия ex vitro
Растения, полученные в результате клонального размножения in vitro, формируются в условиях, существенно отличающихся от тех, что имеют место при выращивании их в грунте: высокий уровень неорганического и органического питания, сахароза в качестве источника углеводов, присутствие в среде экзогенных регуляторов роста, высокая влажность, недостаточное освещение и пониженный газообмен. Эти особенности микроклимата весьма благоприятны для быстрого роста и размножения, однако они способствуют появлению у растений структурных и физиологических характеристик, сильно затрудняющих их выживание в условиях ex vitro.
Сформированные при повышенной влажности и гетеротрофном питании листья имеют слабую анатомическую дифференциацию: палисадная ткань отсутствует или слабо развита, мезофилл в основном представлен клетками губчатой паренхимы с большим межклеточным пространством, хлоропласты имеют неорганизованные граны, низкое содержание хлорофилла и протеинов. Ферменты, ответственные за фотосинтез, обладают пониженной активностью. Сосудистая система листьев недоразвита. Многочисленные устьица остаются полностью раскрытыми и не реагируют на стимулы (темнота, СО2, абсцизовая кислота и др.), которые в норме вызывают их закрытие. Защитное восковое покрытие практически отсутствует, а тот воск, который образуется, существенно отличается по химическому составу от воска на листьях растений, выращиваемых в окружающей среде (обладает пониженными гидрофобными свойствами). Стебли пробирочных растений недостаточно лигнифицированы, в них значительно меньше колленхимы и склеренхимы по сравнению с нормальными растениями. Клетки имеют тонкие оболочки, а межклеточное пространство увеличено, сосудистая система недоразвита. У многих растений в условиях invitro не происходит образования корневых волосков.
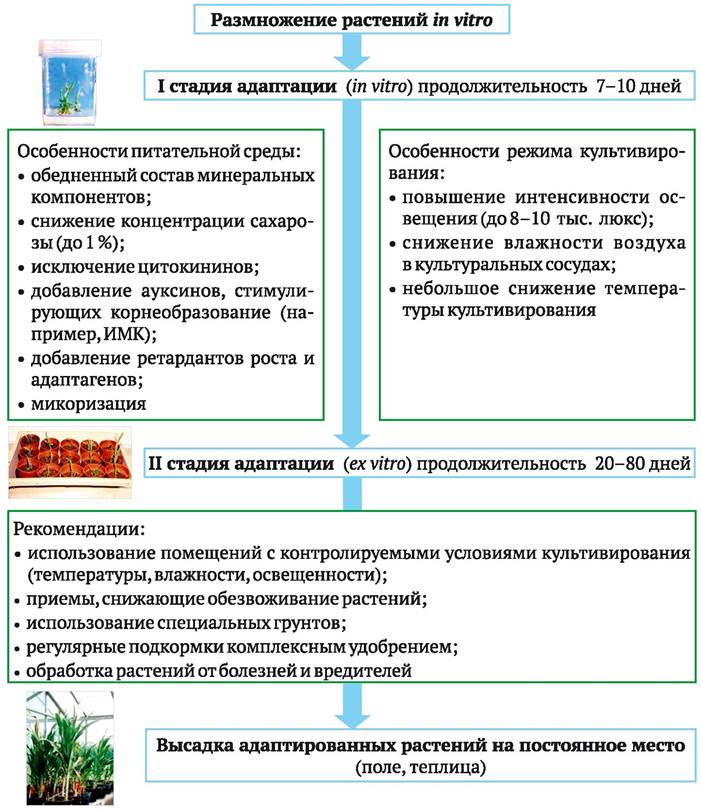
Приведенные особенности анатомии и физиологии пробирочных растений создают значительные трудности в их адаптации к условиям окружающей среды при переносе в условия ex vitro. Нередко после пересадки в грунт наблюдается остановка в росте, опадение листьев и гибель растений, прежде всего из-за нарушения водного баланса. Для уменьшения потерь разработан ряд методических приемов, позволяющих улучшить приживаемость растений. Часть из них применяют в условиях in vitro, а остальные - после высадки растений в грунт.
Последний перед высадкой растений пассаж рекомендуют производить на более бедную по составу минеральных солей питательную среду, например, среду Уайта, концентрацию сахарозы уменьшают до 1 %. Из среды полностью исключают цитокинины, оставляя только ауксины, стимулирующие корнеобразование (например, ИМК). Предлагается повысить интенсивность освещения (до 8-10 тыс. люкс) и немного понизить по сравнению с обычной температуру, при которой производят культивирование. Эффективной является добавка в питательную среду ретардантов роста, а также адаптогенов типа янтарной кислоты, крезацина, Мивала-Агро, которые ингибируют рост стеблей в длину, вызывают утолщение корней, уменьшают листовую поверхность, увеличивают содержание хлорофилла и стимулируют образование воска на листьях. Аналогичный эффект дает снижение влажности воздуха в культуральных сосудах путем использования десикантов, охлаждения нижней части сосудов, а также простым удалением пробок из пробирок за 7-10 дней до высадки растений в грунт. Для ряда древесных культур благоприятный эффект дает микоризация пробирочных растений.
Высадку пробирочных растений в грунт обычно производят весной или в начале лета. Используют теплицы или комнаты с регулируемым режимом освещения, температуры, влажности. Чтобы уменьшить гибель растений из- за обезвоживания, после высадки их в грунт поддерживают высокую влажность воздуха с помощью туманообразующих установок, накрывают посадки неткаными материалами. Представляет интерес применение способа уменьшения испарения воды листьями, предложенного индийскими учеными. Он включает опрыскивание растений в течение адаптационного периода 50 % водным раствором глицерина, или смесью (1:1) парафина и диэтилового эфира.
В качестве грунта для высадки пробирочных растений используют нейтрализованный и обогащенный минеральными солями верховой торф, смесь торфа и песка (3:1), перлит. Хорошие результаты получены при использовании субстратов на основе ионообменных смол, разработанных в Институте физико-органической химии НАН Беларуси. Однако такие субстраты весьма дорогостоящи, что ограничивает их широкомасштабное применение. Укоренившиеся в грунте растения, после того как они тронулись в рост, подкармливают комплексными удобрениями, проводят обработки против болезней и вредителей. После завершения периода адаптации (через 20-30 дней) их пересаживают на постоянное место в теплице или в поле (рис. 5.7).
Рис. 5.7. Приемы, применяемые для адаптации пробирочных растений при переносе их из условий in vitro в условия ex vitro
Проблемы высадки пробирочных растений в грунт связаны не только с адаптацией к условиям выращивания, но также со сложностью и трудоемкостью самой процедуры, невозможностью ее механизации. В условиях промышленного производства стоит задача в короткие сроки высадить в грунт огромное количество пробирочных растений (до 100 тыс. и более). Вместе с тем, чтобы не повредить растения, их необходимо извлекать из пробирок и высаживать в грунт с осторожностью. В решении этих проблем большие перспективы связывают с использованием сформированных in vitro запасающих органов растений: клубней, луковиц, клубнелуковиц (в русскоязычной литературе их называют микроклубнями, микролуковицами, микроклубнелуковицами), а также искусственных семян (инкапсулированных соматических эмбриоидов). Их проще не только высаживать в грунт без всякой адаптации, но и хранить, транспортировать.
Микролуковицы образуются при индукции адвентивных стеблевых почек из сегментов чешуй или донца луковичных растений. Так, разделив чешую луковицы лилии на небольшие сегменты, можно за 35-40 дней получить до 100 микролуковиц.
Микроклубни способны образовывать при определенных условиях культивирования пробирочные растения картофеля (рис. 5.8, а). Спонтанное образование микроклубней происходит, если растение картофеля оставить на питательной среде до ее подсыхания. Чтобы активировать этот процесс, используют питательную среду с цитокининами (3-5 мг/л 6-БАП) и повышенным содержанием сахарозы (6-10 %). Эффективным может быть добавление в питательную среду ретардантов (50-100 мг/л хлорхолинхлорида). Пониженные температуры (15-18 °С), сокращение светового периода до 10 ч или перенос культур в темноту также способствуют клубнеобразованию. Как микроклубни, так и микролуковицы можно получать на жидкой питательной среде в биореакторах, что позволяет уменьшить стоимость их производства. Разные сорта картофеля образуют микроклубни in vitro с различной интенсивностью. Для некоторых сортов эта технология не подходит, поскольку лишь небольшой процент пробирочных растений способен формировать клубни даже в оптимальных условиях. Поэтому способность к образованию микроклубней необходимо оценивать для каждого конкретного сорта и применять эту технологию только к тем, которые обеспечивают высокий выход продукции.
Рис. 5.8. Образование микроклубней пробирочными растениями картофеля (а). Восстановление пробирочных растений из микроклубней после их хранения в холодильнике (б) (слева направо): микроклубень с проснувшейся почкой, далее - разные стадии роста побегов, отделяемые от клубня и используемые для черенкования или укоренения; укоренившееся пробирочное растение, отделенное от микроклубня

Полученные в пробирках микроклубни по своей физиологии во многом напоминают клубни от выращиваемых в грунте растений. В частности, для них характерен продолжительный (3-4 мес., в зависимости от сорта) период покоя. Это весьма полезный признак для сохранения генетических коллекций картофеля. Однако при использовании метода в целях клонального размножения он создает некоторые неудобства, так как сокращает период микроклонирования пробирочных растений: микроклубни должны быть собраны за три месяца до посадки в грунт, чтобы могли пройти период покоя. В связи с этим оптимальным представляется сочетание двух методов микроразмножения картофеля: в начальный период растения размножают стеблевыми черенками (путем индукции пазушных меристем), затем часть полученных пробирочных растений переносят в условия, благоприятные для образования микроклубней, а вторую часть продолжают размножать черенкованием. В результате в грунт высаживают как традиционные пробирочные растения, так и микроклубни, прошедшие период покоя, что позволяет уменьшить трудозатраты.
В Институте генетики и цитологии НАН Беларуси разработана схема производства микроклубней картофеля, которая обеспечивает ритмичность работ и позволяет рационально использовать оборудование и персонал (А. Ермишин, 1994). Схема включает три питомника определенного объема: 1-й питомник - маточных растений (для черенкования); 2-й питомник - «подроста» (здесь из черенков формируются растения, которые затем переносят в условия, оптимальные для образования микроклубней (3-й питомник)). Важнейшая особенность технологии, которая обеспечивает ритмичность работ, - порядок черенкования маточных растений и заполнения питомников. За рабочий день их должно быть расчеренковано ровно столько, чтобы, с одной стороны, выполнялся график заполнения 2-го питомника, с другой - полностью возобновлялся объем 1-го питомника, который должен быть постоянным.
Динамика заполнения питомников показана в приведенной ниже таблице.
Динамика заполнения питомников при производстве микроклубней картофеля (звездочками обозначены объемы дневной выработки)
Время (недели) |
Питомник 1 |
Питомник 2 |
Питомник 3 |
Хранение |
0 |
***** |
|||
3 |
***** |
***** |
||
6 |
***** |
***** |
***** |
|
9 |
***** |
***** |
***** ***** |
|
12 |
***** |
***** ***** ***** |
||
15 |
***** ***** ***** |
***** |
Производственный цикл начинают, имея в питомнике 1 определенное число пробирочных растений. Формула для расчета его объема имеет следующий вид:
А = Rt/W(b-1),
где А - объем питомника 1; R - количество микроклубней, которое надо произвести (план); W - общее количество запланированных рабочих дней, в которые производят черенкование; b - количество черенков с одного маточного растения; t - количество рабочих дней в период времени, необходимый для получения растения, пригодного для черенкования (т. е. способного давать b черенков). Величины b и t определяют опытным путем для каждого конкретного сорта, условий культивирования маточных растений и организации производственного процесса.
Для определения необходимого для реализации плана количества светоустановок, размеров производственных площадей требуются сведения о максимальном объеме питомника 2. Его находят по формуле
F = Re/W,
где F - объем питомника 2; e - количество рабочих дней в течение периода нахождения пробирочных растений в питомнике 2; W - общее количество запланированных рабочих дней.
Таким образом, если ставится задача произвести R = 30 тыс. микроклубней за W = 50 дней при условии, что от каждого маточного растения получают b = 4 черенка, а на период времени, за которое вырастает готовое к черенкованию пробирочное растение, приходится t = 15 рабочих дней, то в начале производственного цикла в питомнике 1 должно быть 3 тыс. маточных растений. При максимальном заполнении питомника 2 его объем составит 9 тыс. растений.
При производстве 30 тыс. микроклубней по традиционной технологии (сначала путем черенкования получают нужное количество растений, затем их переносят в условия, оптимальные для образования микроклубней) потребовалось бы помещение, оборудованное светоустановками на 30 тыс. пробирок (1 микроклубень с одного пробирочного растения). В нашем же примере достаточно установок на 12 тыс. пробирок (3 тыс. - питомник 1 и 9 тыс. - питомник 2), т. е. в 2,5 раза меньше.
В начале производственного цикла по традиционной технологии объемы черенкования небольшие. В завершение же цикла за короткое время должно быть расчеренковано 7,5 тыс. растений (30 тыс.: 4), что очень много, если учесть, что в среднем за рабочий день один сотрудник черенкует 150-200 растений. Предлагаемая технология полностью решает проблему: нагрузка распределена равномерно по всему циклу, дневная выработка стабильна и относительно невелика.
5.2.3. Направления практического использования клонального размножения растений in vitro
Начало клональному размножению растений in vitro и дальнейшее быстрое внедрение этой технологии в промышленное производство семенного и посадочного материала было положено работами Ж. Мореля (1960) на орхидеях. Успех и быстрый прогресс в этом направлении во многом обеспечил удачный выбор объекта исследований. Орхидеи - ценная и очень популярная на Западе цветочная культура. Однако традиционные методы их вегетативного размножения малоэффективны. Семенное размножение орхидей также проблематично. В силу высокой гетерозиготности сортов орхидей их половое потомство не сохраняет свойства родительских форм. Орхидеи имеют очень мелкие семена, у которых отсутствует эндосперм. После прорастания семян из зародыша образуется протокорм - сферическая клубнеобразная структура, которая в дальнейшем дифференцируется в проросток. Для этого во многих случаях необходим симбиоз с определенными грибами. Проростки орхидей развиваются очень медленно: требуется как минимум около 5 лет, чтобы растения достигли фазы цветения. Ж. Морель обнаружил, что в культуре апикальной меристемы стебля цимбидиума формируются протокормы, аналогичные тем, что получаются при прорастании зародыша. Протокормы при определенных условиях культивирования способны за короткое время давать начало нескольким новым протокормам, которые отделяют от исходного протокорма и переносят на свежую питательную среду для последующего размножения или для получения проростков (рис. 5.9). Использование методов культуры invitro также позволило существенно повысить эффективность семенного размножения орхидей. Проращивание семян орхидей на питательных средах в условиях in vitro значительно ускоряет развитие проростков за счет сокращения ювенильной фазы без участия микориз.
Рис. 5.9. Размножение орхидеи Phalaenopsis gigantea путем культивирования in vitro протокорма: а - 150-дневный протокорм, высаженный на питательную среду; б - закладка новых протокормов; в - созревание протокормов в течение 4 недель после высадки эксплантата на среду; 2 - сформировавшиеся побеги орхидеи через 10 месяцев культивирования эксплантата (по R. Murdad и др., 2006)

Естественно, эти технологии микроразмножения были быстро взяты на вооружение производителями посадочного материала орхидей во всем мире. В настоящее время разработаны и широко используются промышленные технологии микроклонального размножения большого числа видов орхидей, а также других ценных цветочных и декоративных культур. Например, в Нидерландах с помощью микроклонирования ежегодно производят несколько десятков миллионов растений.
Второе важное направление практического использования технологии клонального размножения растений in vitro - производство высококачественных семян картофеля. Для этой культуры качество посадочного материала играет решающее значение в получении высоких урожаев. Традиционное семеноводство картофеля основано на отборе здоровых, продуктивных растений какого-либо сорта, в полной мере соответствующих его описанию, и дальнейшему их размножению с применением приемов, которые должны обеспечить сохранение растений в здоровом состоянии (не менее трех фитосанитарных прочисток за сезон, обработка инсектицидами, раннее удаление ботвы и другие). Цикл производства начинают с закладки питомника испытания и отбора исходных клонов. Поскольку коэффициент размножения картофеля невысокий (4-6), то этот питомник должен быть весьма большим, чтобы в течение последующего размножения исходных клонов в течение 4-5 лет получить достаточное количество элитных семян. Состояние здоровья растений в этом питомнике определяют в основном визуально, поскольку из-за большого количества оценить все растения в питомнике с помощью иммуноферментного анализа или других методов детекции вирусов практически невозможно. В питомнике могли остаться внешне здоровые растения, содержащие скрытую вирусную инфекцию. В результате за время размножения исходных клонов несмотря на все усилия по сохранению здоровья растений происходит накопление инфекции, которое снижает качество посадочного материала.
Внедрение технологии микроклонального размножения картофеля позволяет сформировать питомник исходных клонов из растений, с высокой вероятностью свободных от вирусов. Это достигается следующим образом. Производственный цикл начинается с отбора наиболее продуктивных, визуально здоровых растений какого-либо сорта, соответствующих его описанию. Затем отобранные растения анализируют на предмет содержания в их тканях основных вирусов и вироидов с помощью чувствительных методов иммуноферментного анализа или анализа нуклеиновых кислот патогена. Свободные от вирусов растения используют в качестве источника эксплантатов для получения культуры меристем. Для повышения надежности получения меристемной культуры полностью свободных от вирусов клонов рекомендуется использовать термо- и/или хемотерапию. Регенерированные из меристем пробирочные растения дополнительно тестируют на содержание вирусов и вироидов и в случае получения негативной реакции (отсутствия патогенов) начинают микроклональное размножение этих растений путем черенкования, получения микроклубней (производственный цикл начинают в условиях Беларуси в сентябре). Весной следующего года произведенные пробирочные растения и прошедшие период покоя микроклубни высаживают в теплицы, где они в течение летнего сезона формируют так называемые миниклубни. Желательно использовать для выращивания растений теплицы, накрытые марлей или неткаными материалами, которые не допускают перегрева растений в жаркую погоду, предохраняя в то же время их от тлей - переносчиков вирусной инфекции. Также осуществляют необходимый уход за посадками, который включает, среди прочего, регулярную подкормку, химическую обработку растений против возбудителей болезней и вредителей. Полученные миниклубни на следующий год высаживают в поле. Далее растения размножают по традиционной технологии, выполняя полный комплекс мероприятий по сохранению их в здоровом состоянии.
Применение технологии микроклонального размножения картофеля позволяет за короткое время производить большое количество здоровых исходных клонов. Это дает возможность сократить сроки производства элиты, и, следовательно, повысить ее качество благодаря уменьшению продолжительности накопления вирусной инфекции. Например, в Нидерландах и других передовых по производству семян картофеля странах практикуют трехлетний цикл: миниклубни - супер-суперэлита - суперэлита - элита.
Широкое применение нашли технологии микроклонального размножения древесных и кустарниковых культур, причем не только различных плодовых и декоративных, но и культур, применяемых в городском озеленении, лесовосстановлении. Во многом это связано с тем, что данные технологии позволяют получать большое количество здорового посадочного материала определенного генотипа с известными свойствами (сорта, породы, подвои, элитные деревья). Так, лесовосстановление в основном производят с помощью семян от свободного опыления, собранных с лучших по продуктивности элитных, или плюс-деревьев. Однако полученное потомство в силу расщепления не будет обладать всем комплексом положительных характеристик родительских форм. Микроразмножение позволяет воспроизвести генотип таких деревьев в многочисленных клонах. Особенно актуально его применение для культур, которые практически не размножаются с помощью традиционных методов вегетативного размножения, например, масличных пальм. Большой интерес представляет его использование для размножения культур, которые не образуют фертильных семян (например, триплоидного культурного банана Musa х paradisiaca), или размножения двудомных растений (при выращивании папайи из семян только во время цветения выясняется, какой пол имеют отдельные растения; практическое значение имеют женские формы).
Методы микроклонального размножения растений имеют большое значение не только для промышленного производства посадочного материала различных культур. Использование специальных методов микроклонирования и культивирования клеток, тканей, органов растений in vitro дает возможность эффективно поддерживать большие генетические коллекции исходного материала, без которого невозможен успех в современной селекции, сохранять и размножать редкие и исчезающие виды растений, осуществлять обмен и транспортировку коллекционных образцов.
5.3. Сохранение ценного генофонда в условиях in vitro
Наиболее эффективный метод поддержания генетических коллекций - хранение семян при пониженных температурах. Обычная технология, применяемая в генетических банках семян, включает их подсушивание до влажности 5-8 % и последующее хранение при температуре -18 °С, благодаря чему они сохраняют свою жизнеспособность без существенной потери всхожести многие годы.
Однако существует большая группа растений, для которых эта технология не подходит: сорта и породы вегетативно размножаемых культур, стерильные формы, растения, образующие семена, которые быстро теряют всхожесть или не выдерживают высушивания и пониженных температур. Используемые для поддержания генетических коллекций таких растений традиционные методы вегетативного размножения дорогостоящи и малоэффективны. Для повышения эффективности поддержания генетических коллекций этих культур в настоящее время применяют следующие методические подходы:
✵ сохранение коллекций в виде медленно растущих культур пробирочных растений;
✵ криоконсервация тканей или клеточных культур отдельных генотипов.
5.3.1. Сохранение генетических коллекций в виде медленно растущих культур пробирочных растений
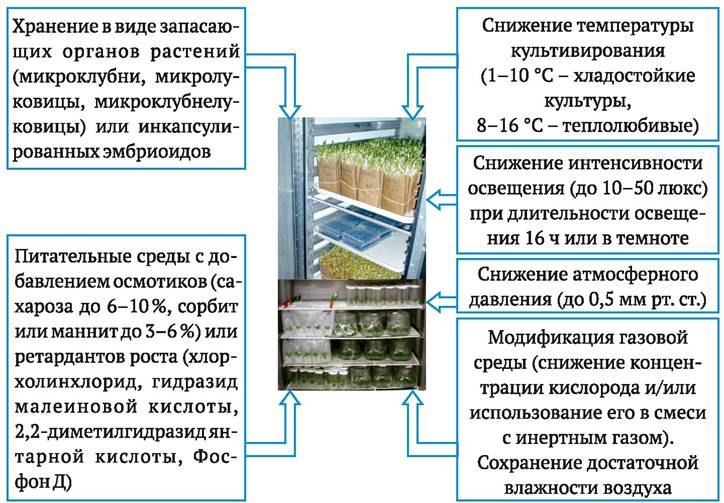
Разработка методов микроклонального размножения позволила решить большинство проблем, связанных с поддержанием генетических коллекций растений. Для этого во многих случаях достаточно производить регулярное черенкование пробирочных растений, полученных в культуре меристем. Однако размножение растений и поддержание коллекций in vitroимеют разные цели. Если в первом случае стоит задача за максимально короткие сроки получить как можно больше клонов определенного генотипа, то во втором случае важно просто сохранить с наименьшими затратами жизнеспособность его пробирочных растений. В целях снижения затрат при поддержании коллекций пробирочных растений используют различные методы замедления их роста, что позволяет увеличить промежутки времени между пересадками (рис. 5.10). Для этого применяют:
✵ пониженную температуру культивирования;
✵ пониженное атмосферное давление или снижение концентрации кислорода в воздушной среде, при которой производят культивирование;
✵ добавление в питательную среду осмотиков или регуляторов роста, замедляющих рост растений;
✵ получение и хранение при пониженных температурах запасающих органов растений (микроклубней, микролуковиц, микроклубнелуковиц) или инкапсулированных соматических эмбриоидов.
Рис. 5.10. Основные приемы повышения эффективности содержания генетических коллекций растений в культуре in vitro
Период без пересадок пробирочных культур можно удлинить до 6-24 и более месяцев путем культивирования пробирочных растений в условиях низких положительных температур (1-10 °С). При этом снижают интенсивность освещения (до 10-50 люкс), оставляя неизменным длительность ежедневного освещения 16 ч, или культивирование производят в темноте. Оптимальную температуру подбирают экспериментально: важно добиться максимального замедления роста без существенной утраты жизнеспособности культур. Как правило, более низкие температуры (1-4 °С) применяют для холодостойких культур, клонирование которых проводят при температуре 20-25 °С. Для теплолюбивых культур (клонирование при температуре около 30 °С) замедление роста достигается путем культивирования растений при температуре 8-16 °С. С помощью данного метода R. H. Mullin, D. E. Schlegel (1976) поддерживали без пересадки коллекцию пробирочных растений садовой земляники Fragaria х ananassa Duch. в течение 6 лет, добавляя в культуры несколько капель свежей питательной среды каждые три месяца.
Снижение роста культур пробирочных растений достигается также благодаря снижению атмосферного давления (до 0,5 мм рт. ст.) и/или модификацией газовой среды путем снижения концентрации кислорода (эти методы позаимствованы из практики сохранения овощей, плодов и срезанных цветов). Для создания гипоксии используют смесь инертного газа (азота) и кислорода в концентрации 1-10 %. Важно при понижении атмосферного давления поддерживать высокую влажность, чтобы не происходило быстрое высыхание питательной среды. Этот метод особо перспективен для сохранения коллекций теплолюбивых растений, не пригодных для хранения при пониженных температурах.
Эффективный метод снижения интенсивности роста пробирочных растений - добавление в питательную среду осмотиков и ретардантов. Для создания осмотического стресса, замедляющего рост культур, применяют повышенные концентрации сахарозы в питательной среде (6-10 %), добавление в питательную среду 3-6 % маннита или сорбита. В качестве ретардантов используют хлорхолинхлорид, гидразид малеиновой кислоты, 2,2-диметилги- дразид янтарной кислоты (В-995), Фосфон Д.
Для сохранения коллекций ряда культур представляется перспективным получение микроклубней, микролуковиц, микроклубнелуковиц, инкапсуляция соматических эмбриоидов или отдельных частей растений в альгинатные капсулы и хранение их при пониженных температурах. Так, микроклубни картофеля можно хранить в стерильных пробирках в холодильнике 6-12 мес. После прохождения периода покоя они прорастают, образуя длинные этиолированные ростки. Их можно по завершении хранения удалить, разрезать клубень пополам и поместить на питательную среду, где из спящих почек при культивировании на свету формируются нормальные пробирочные растения, пригодные для размножения или дальнейшего хранения in vitro (см. рис. 5.8, б).
Эффективным способом хранения растительного материала (соматических эмбриоидов, пазушных почек, сегментов стебля пробирочных растений, корневых культур) при пониженных температурах (1-4 °С) является инкапсуляция в альгинатные шарики. Инкапсуляция позволяет существенно замедлить рост, транспирацию и, в результате, обеспечивает длительное сохранение жизнеспособности культур. Инкапсуляция в сочетании с дегидратацией растительного материала оказывает положительный эффект на сохранность культур при криоконсервации.
5.3.2. Криоконсервация тканей или клеточных культур растений
Криоконсервация - сохранение биологических объектов в замороженном состоянии при сверхнизких температурах (чаще всего при температуре -196 °С в жидком азоте) с возможностью восстановления их функций после размораживания. В принципе, с помощью этого метода они могут храниться бесконечно долго, так как сверхнизкие температуры практически полностью останавливают биохимические процессы в клетках. Криоконсервация нашла широкое применение для хранения культур микроорганизмов, некоторых животных объектов. В частности, невозможно представить современное животноводство без использования для осеменения спермы животных-производителей, которую сохраняют в жидком азоте. Также разработаны методы криоконсервации клеток и тканей растений. Первоначально их применяли для хранения клеточных линий-продуцентов вторичных метаболитов. Позднее появились методы сохранения апикальных меристем, молодых зародышей и соматических эмбриоидов, использование которых дает возможность эффективно поддерживать генетические коллекции.
Низкотемпературное воздействие является смертельно опасным для живых организмов, поскольку способно вызывать необратимые повреждения клеток. Во-первых, образующиеся при быстром понижении температуры кристаллы льда повреждают клеточные органеллы и сами клетки. Во-вторых, при охлаждении клетки могут потерять 80-90 % содержащейся в них воды, что приводит к повышению концентрации внутриклеточных растворов до токсического уровня, разрушению гидратированных комплексов макромолекул, к потере активности биополимеров из-за изменения их третичной и четвертичной структуры.
Разработан ряд методических подходов, применение которых обеспечивает сохранение жизнеспособности клеток при замораживании. Прежде всего, большое значение имеет выбор биологического объекта для криоконсервации. Мелкие, богатые цитоплазмой меристематические клетки растений лучше переносят замораживание, чем крупные, сильно вакуолизированные клетки. В связи с этим для криосохранения клеточных линий продуцентов ВМ суспензии перед замораживанием необходимо часто субкультивировать, отбирать клетки для замораживания в позднюю лаг-фазу или в начале экспоненциального роста.
Большое значение для успеха криоконсервации имеет использование криопротекторов - веществ, защищающих клетки от повреждений при замораживании. Существует большое количество веществ, обладающих криопротекторными свойствами, однако на практике используют лишь некоторые из них. Различают криопротекторы двух типов: проникающие внутрь клетки и непроникающие. Проникающие протекторы (глицерин, пропиленгликоль, этиленгликоль, диметилсульфоксид (ДМСО), аминокислоты: пролин, аспарагин и др.) препятствуют формированию кристаллов льда путем образования водородных связей с молекулами воды. Непроникающие криопротекторы (сахароза, трегалоза, фиколл, альбумин, поливинилпирролидон), как полагают, защищают клетки от осмотических перепадов, связанных с замораживанием, снижают скорость роста кристаллов льда. Непроникающие криопротекторы обычно являются дополнительными компонентами в растворах, проникающих криопротекторов.
Эффективность криоконсервации можно повысить путем прекультивирования подлежащих замораживанию объектов в специфических условиях, позволяющих уменьшить содержание воды в клетках. Так, положительный эффект дает прекультивирование в течение нескольких дней пробирочных растений, апикальные меристемы которых предполагается использовать для криосохранения, на питательных средах, содержащих 2-6 % маннита или сорбита, ДМСО (2,5-10 %), при пониженных температурах (4-6 °С).
Радикальное снижение содержания внутриклеточной воды до минимума достигается при высушивании объектов замораживания в ламинарном потоке воздуха с применением силикагеля. Этот прием используют для криоконсервации соматических эмбриоидов и стеблевых меристем, сегментов культуры «бородатого корня». Он особенно эффективен в сочетании с альгинатной инкапсуляцией (encapsulation/dehydration technique). Меристемы или эмбрио- иды, заключенные в капсулы из альгината кальция, инкубируют в питательной среде, содержащей 0,85 М сахарозы 4-16 ч, подсушивают 3-4 ч в ламинарном потоке воздуха, затем погружают в жидкий азот. Как видим, в качестве единственного криопротектора используется сахароза - одно из наименее токсичных веществ, обладающих криопротекторными свойствами.
Процесс криоконсервации клеток и тканей растений включает следующие этапы: замораживание, хранение, размораживание, рекультивирование (рис. 5.11).
Рис. 5.11. Процесс криосохранения культуры in vitro растений
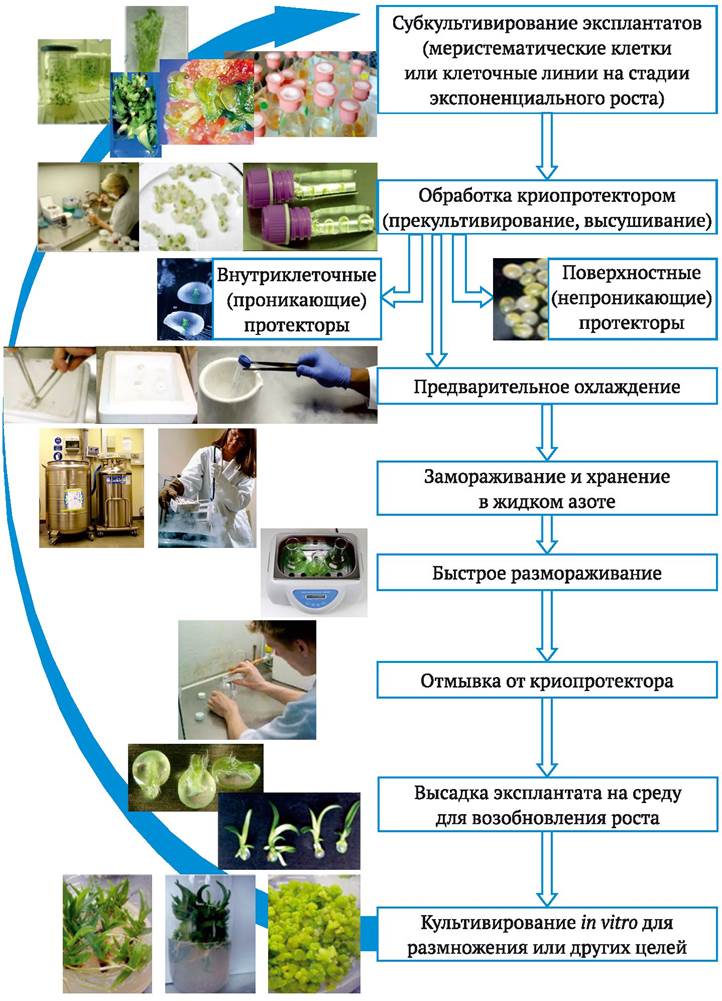
Подготовленные к замораживанию объекты (путем прекультивирования, высушивания, инкапсуляции/дегидратации) обрабатывают, при необходимости, криопротекторами, затем фасуют в стерильные полипропиленовые пробирки с завинчивающимися крышками объемом 1-2 мл и подвергают замораживанию. Хотя в отдельных случаях возможно непосредственное погружение материала в жидкий азот, обычно применяют замораживание по специальной программе. Температуру понижают медленно (0,5-1 °С в мин.) до -35 °С, выдерживают при этой температуре 15-30 мин. и только после этого погружают материал в жидкий азот. Программируемое охлаждение проводят в специальных аппаратах заводского производства.
Хранение материала осуществляют в сосудах, холодильниках для жидкого азота, оборудованных приспособлениями для размещения пробирок в определенном порядке, чтобы была возможность, при необходимости, быстро найти и извлечь нужный образец. Пробирки должны быть постоянно погружены в жидкий азот. Поскольку происходит его испарение, необходимо регулярное (обычно раз в неделю) доливание азота.
Размораживание материала по завершении хранения, в отличие от замораживания, осуществляют быстро: извлеченные из жидкого азота пробирки помещают на водяную баню, нагретую до +37-40 °С. Быстрое размораживание позволяет избежать образования кристаллов льда внутри клеток, которое может происходить при постепенном повышении температуры. Пробирка объемом 1 мл размораживается за 0,5-1 мин. После этого культуры отмывают от криопротекторов (многие из них токсичны), используя питательную среду или 3-10 % раствор сахарозы, и помещают на питательную среду для возобновления роста. Суспензии клеток после криоконсервации высевают на агаризованную питательную среду, затем образовавшийся каллюс ресуспендируют в жидкой питательной среде. Зародыши, эмбриоиды, апикальные меристемы помещают на агаризованную питательную среду, содержащую небольшое количество цитокининов и гиббереллина, на которой происходит регенерация проростков, пригодных для последующего клонирования. Аналогично поступают с инкапсулированными зародышами, соматическими эмбриоидами.
Ниже в качестве примера приведен протокол криоконсервации суспензионной культуры клеток кукурузы по L. Withers, P. King (1979):
1. Активно растущую суспензионную культуру клеток пассируют на питательную среду с10% пролина.
2. Через 3-4 дня промывают клетки в среде без пролина, затем ресуспендируют в свежей питательной среде.
3. Охлаждают суспензию на ледяной бане, добавляют равный объем охлажденной питательной среды, содержащей 20 % пролина (постепенно, в 4 приема в течение 1 ч).
4. Переносят по 1 мл суспензии в стерильные полипропиленовые пробирки объемом 2 мл с завинчивающимися крышками.
5. Помещают пробирки в аппарат для контролируемого снижения температуры и охлаждают их до -30 °С со скоростью 1 градус в минуту.
6. Погружают пробирки в жидкий азот, в котором осуществляют хранение культур.
7. Размораживание пробирок проводят на водяной бане при 40 °С в течение 1-2 мин.
8. Размороженную суспензию высевают на агаризованную питательную среду для восстановления роста культуры.
Аналогичная процедура применяется для криоконсервации стеблевых апексов, только при прекультивировании вместо пролина используют ДМСО (около 10 %).
Заключение
Современные технологии клонального размножения растений in vitro обеспечивают очень высокий коэффициент размножения. Большим их преимуществом является то, что с их помощью можно эффективно размножать те растения, которые с трудом размножаются традиционными методами. Все работы можно проводить круглогодично, для их проведения не требуются большие площади. Особенно важно, что при размножении растений в пробирках не возникает угрозы их повторного заражения вирусными и другими болезнями (при условии, что исходное маточное растение здорово). В целом применение технологий клонального размножения растений in vitro экономически более выгодно по сравнению с традиционными технологиями вегетативного размножения и дает возможность получать семенной материал более высокого качества.
Стеблевые меристемы - наиболее подходящий эксплантат для введения предназначенных к вегетативному размножению растений в культуру in vitro, поскольку в наибольшей степени обеспечивают сохранение генотипа маточного растения и возможность получения здоровых растений. В отличие от клеток специализированных тканей, инициальные клетки апикальных меристем характеризуются высокой цитогенетической стабильностью: на протяжении всей жизни растения они сохраняют генотип зиготы. Другое важное свойство меристемных тканей - отсутствие в них или крайне низкие концентрации вирусных частиц даже у пораженных вирусами растений.
В 1952 г. Ж. Морель и К. Мартэн разработали методику оздоровления растений георгинов с помощью культуры in vitro апикальных меристем размером около 100 цм (G. Morel, C. Martin, 1952). С тех пор этот метод с разной степенью эффективности нашел применение для широкого круга вегетативно размножаемых растений. Было установлено, что культура меристем позволяет оздоровить растения не только от вирусов, но и от бактериальной, грибной инфекции, вироидов и микоплазм.
Для повышения эффективности оздоровления от вирусной инфекции с помощью культуры меристем маточные растения перед вычленением эксплантатов подвергают термотерапии - продолжительному (5-15 нед.) воздействию повышенных температур (37 °С, относительная влажность 90 %; освещенность растений около 5 тыс. люкс, фотопериод 16 ч) или хемотерапии - добавлении в питательную среду, на которой культивируют апикальные меристемы, различных веществ, обладающих противовирусной активностью. Чаще всего для хемотерапии используют синтетические аналоги пуриновых и пиримидиновых оснований: цианогуанозин, 2-тиоурацил, Д-рибофуранозил-1,2,4-триазол-карбоксимид (коммерческое название - виразол), а также интерферон, ридостин (рибонуклеат натрия), биназу (микробную рибонуклеазу), фенолкарбоновые кислоты: салициловую, галловую, сиреневую, кофейную, феруловую, кумаровую.
На практике используют следующие методы клонального размножения растений in vitro:
✵ активация развития уже существующих меристем (апекса стебля, пазушных и спящих почек стебля);
✵ индукция адвентивных почек у эксплантата или в каллюсной культуре;
✵ соматический эмбриогенез.
Активация развития уже существующих в растении меристем основана на снятии апикального доминирования у пробирочных растений путем удаления верхушечной почки или добавления в питательную среду цитокининов. По сравнению с другими методами микроразмножения этот метод в наибольшей степени обеспечивает сохранение генотипа исходного маточного растения, так как полученные клоны происходят непосредственно из меристематических клеток, для которых характерна высокая цитогенетическая стабильность.
Метод клонального размножения растений in vitro путем индукции адвентивных почек основан на свойстве тотипотентности растительной клетки. Суть его заключается в том, что эксплантаты разных частей и органов растений, не содержащие стеблевых почек, способны их образовывать in vitro при наличии факторов, индуцирующих стеблевой органогенез, прежде всего соответствующих регуляторов роста. В качестве эксплантатов могут быть сегменты листовых пластинок и черешков, молодых соцветий, чешуй и донца луковиц, клубнелуковиц, корневые черенки, боковые и интеркалярные меристемы и другие органы и ткани.
Адвентивные стеблевые почки могут образовываться и в каллюсной культуре in vitro (стеблевой органогенез). Быстро растущие каллюсные культуры, сохраняющие высокую способность к органогенезу, дают дополнительные возможности для ускорения микроразмножения. Однако генетическая нестабильность каллюсных клеток может приводить к получению растений- регенерантов, имеющих существенные генетические отличия от исходного маточного растения (сомаклональная изменчивость).
Все сказанное относится и к методу клонального размножения растений in vitro, основанному на индукции соматического эмбриогенеза из тканей эксплантата или каллюсных клеток в суспензионной культуре. Тем не менее отдельные положительные характеристики метода выводят его в число наиболее перспективных. Технологии массового получения соматических эмбриоидов и их адаптации к условиям ex vitro разработаны для ряда важных культур. Эти технологии включают, среди прочего, возможность использования биореакторов и механизированное производство искусственных семян путем инкапсуляции эмбриоидов, благодаря чему появляется возможность существенно уменьшить трудозатраты (как при размножении, так и переносе растений в условия ex vitro) и стоимость продукции.
Особенности микроклимата при выращивании пробирочных растений способствуют появлению у них структурных и физиологических характеристик, сильно затрудняющих выживание в условиях ex vitro. Нередко после пересадки в грунт наблюдается остановка в росте, опадение листьев и гибель растений, прежде всего из-за нарушения водного баланса. Разработан ряд методических приемов, позволяющих улучшить приживаемость растений. Прекультивирование перед высадкой пробирочных растений в грунт включает в себя использование более бедных по составу минеральных солей питательных сред с пониженным содержанием сахарозы, без цитокининов, эффективной является добавка в питательную среду ретардантов роста, адаптогенов. Повышают интенсивность освещения культур (до 8-10 тыс. люкс) и понижают температуру, при которой производят культивирование, добиваются снижения влажности воздуха в культуральных сосудах путем использования десикантов, охлаждения нижней части сосудов, а также простым удалением пробок из пробирок за 7-10 дней до высадки растений в грунт. Для ряда древесных культур благоприятный эффект дает микоризация пробирочных растений. После высадки растений поддерживают оптимальную температуру, создают высокую влажность воздуха, используют специальные субстраты для улучшения укоренения растений.
Проблемы высадки пробирочных растений в грунт связаны не только с адаптацией к новым условиям выращивания, но также со сложностью и трудоемкостью самой процедуры, невозможностью ее механизации. В решении этих проблем большие перспективы связывают с использованием сформированных in vitro запасающих органов растений: клубней, луковиц, клубнелуковиц (в русскоязычной литературе их называют микроклубнями, микролуковицами, микроклубнелуковицами), а также искусственных семян (инкапсулированных соматических эмбриоидов). Их проще не только высаживать в грунт без всякой адаптации, но и хранить, транспортировать.
В настоящее время разработаны и широко используются промышленные технологии микроклонального размножения большого числа видов ценных цветочных и декоративных культур, они нашли широкое применение в производстве высококачественных семян картофеля, посадочного материала древесных и кустарниковых культур (плодовых, декоративных, применяемых в городском озеленении, лесовосстановлении).
Методы микроклонального размножения растений имеют большое значение не только для промышленного производства посадочного материала, но и поддержания генетических коллекций исходного материала в виде культур пробирочных растений и путем криоконсервации тканей или клеточных культур отдельных генотипов.
В целях снижения затрат при поддержании коллекций пробирочных растений используют различные методы замедления их роста, что позволяет увеличить промежутки времени между пересадками. Для этого применяют:
✵ пониженную температуру культивирования;
✵ пониженное атмосферное давление или снижение концентрации кислорода в воздушной среде, при которой производят культивирование;
✵ добавление в питательную среду осмотиков или регуляторов роста, замедляющих рост растений;
✵ получение и хранение при пониженных температурах запасающих органов растений (микроклубней, микролуковиц, микроклубнелуковиц) или инкапсулированных соматических эмбриоидов.
Хранение биологических объектов в замороженном состоянии при температуре -196 °С в жидком азоте позволяет сохранять генетические коллекции бесконечно долго, так как сверхнизкие температуры практически полностью останавливают биохимические процессы в клетках. Разработан ряд методических подходов, применение которых обеспечивает сохранение жизнеспособности клеток при замораживании. Эффективность криоконсервации можно повысить путем прекультивирования подлежащих замораживанию объектов в специфических условиях, позволяющих уменьшить содержание
воды в клетках: выращивание на питательных средах, содержащих 2-6 % маннита или сорбита, при пониженных температурах (4-6 °С), высушивание в ламинарном потоке воздуха в сочетании с альгинатной инкапсуляцией. Большое значение для успеха криоконсервации имеет использование криопротекторов - веществ, защищающих клетки от повреждений при замораживании: глицерина, пропиленгликоля, этиленгликоля, диметилсульфоксида, аминокислот пролина или аспарагина, трегалозы, фиколла, альбумина, поливинилпирролидона, повышенных концентраций сахарозы.
Обычно применяют медленное замораживание (0,5-1 °С в мин.) до температуры -35 °С в специальных аппаратах заводского производства, затем материал погружают в жидкий азот. Размораживание материала по завершении хранения, в отличие от замораживания, осуществляют быстро, помещая на 1-2 мин извлеченные из жидкого азота пробирки на водяную баню, нагретую до +37-40 °С. После этого культуры отмывают от криопротекторов (многие из них токсичны) и помещают на питательную среду для возобновления роста.
Контрольные вопросы
1. Какие преимущества по сравнению с традиционным вегетативным размножением имеет клональное размножение растений in vitro?
2. Какие свойства апикальных меристем стебля делают их наиболее подходящим эксплантатом для получения культуры пробирочных растений в целях микроклонального размножения?
3. Какие методические подходы позволяют повысить эффективность использования культуры меристем для получения свободных от вирусов пробирочных растений?
4. Перечислите вещества с антивирусной активностью, применяемые в хемотерапии.
5. Какие методы используют для клонального размножения растений in vitro?
6. Опишите методику получения искусственных семян с помощью альгината. Для каких целей используют искусственные семена?
7. В чем причины плохой приживаемости пробирочных растений при высадке их в грунт?
8. Какие приемы позволяют улучшить адаптацию пробирочных растений к условиям ex vitro?
9. Приведите примеры эффективного использования технологий микроклонального размножения растений в практической деятельности.
10. Какие приемы используют для замедления роста пробирочных растений при поддержании генетических коллекций?
11. Каким образом сохраняют жизнеспособность биологических объектов при их замораживании в жидком азоте?
12. Назовите криопротекторы, которые используют для сохранения биологического материала растений в жидком азоте.