БИОТЕХНОЛОГИЯ РАСТЕНИЙ И БИОБЕЗОПАСНОСТЬ - А. П. Ермишин - 2015
ГЛАВА 4. ИСПОЛЬЗОВАНИЕ КУЛЬТУРЫ КЛЕТОК РАСТЕНИЙ ДЛЯ ПРОИЗВОДСТВА ХИМИЧЕСКИХ СОЕДИНЕНИЙ
4.1. Вторичные метаболиты, их роль в жизни растений и ценность для человека
Особенностью высших растений является их способность синтезировать разнообразные относительно низкомолекулярные соединения, обладающие биологической активностью: сапонины, кумарины, стерины, каратиноиды, полифенолы, алкалоиды, витамины, хиноны и др. Поскольку их присутствие в растительной клетке не строго обязательно для поддержания жизни, они получили название «вторичные метаболиты» (далее - ВM).
Растения, продуцирующие богатые энергетическими запасами семена, обычно аккумулируют в значительных количествах ВМ, обладающие антипитательными свойствами. Например, многие зернобобовые, наряду с большим содержанием белка, содержат лектины, ингибиторы протеаз, цианогенные гликозиды, танины, изофлаваноиды, олигосахариды. Способность синтезировать эти вещества выработалась и сохранилась в процессе эволюции как фактор защиты растения от травоядных животных, микроорганизмов и вирусов.
Многие ВМ растений обладают лекарственными свойствами и издревле используются для лечения болезней человека, а также в косметике. Это, например, тритерпеновые гликозиды (стероидные сапогенины и сапонины женьшеня, солодки, аралии), изопреноиды тиса (противоопухолевые таксолы), «сердечные» гликозиды (карденолиды наперстянки, строфанта, ландыша); алкалоиды катарантуса, красавки, безвременника, эритроксилона, мака снотворного, барвинка, раувольфии, хинного дерева, табака (атропин, гиосциамин, скополамин, колхицин, кокаин, кодеин, морфин, папаверин, физостигмин, пилокарпин, хинин, хинидин, резерпин, D-тубокурарин и др.). Следует отметить, что в последнее время резко активизировались исследования, направленные на поиск новых эффективных продуцентов натуральных ВМ. Так, паклитаксел (таксол) из тиса Taxus brevifolia как цитотоксическая субстанция для раковых клеток при лейкемии был открыт в результате выполнения специальной программы в США по поиску антиканцерогенных веществ, в ходе которой было протестировано около 110 тыс. веществ от 35 тыс. образцов растений разных видов.
Пиретрины, содержащиеся в цветках растений пиретрумов, хризантем, пижмы, ротенон из корней бобовых используют в качестве экологически без-
опасных инсектицидов. Большинство пряностей, приправ, такие напитки, как чай, кофе и какао, обязаны вкусу и аромату ВМ, содержащихся в растениях, из которых их получают.
Для использования в хозяйственной деятельности ВМ экстрагируют из природного сырья или осуществляют химический синтез ВМ или их аналогов (которые во многих случаях активнее природных ВМ). Однако зачастую уровень ценного ВМ в растении оказывается крайне низким, а его химический синтез дорогостоящий или чрезмерно сложен. Например, для удовлетворения годовой потребности рынка в таксоле пришлось бы экстрагировать кору нескольких сотен тысяч взрослых деревьев тиса. Природные популяции многих растений-продуцентов ценных ВМ немногочисленны, а культивирование затруднительно (женьшень), нередко растения-продуценты характеризуются медленным ростом и длительным жизненным циклом (древесные). В некоторых случаях выращивание продуцентов затруднено из-за неподходящих климатических условий или отсутствия достаточного количества подходящих земельных ресурсов. В связи с этим представляется экономически выгодным использование биотехнологий производства ВМ путем культивирования изолированных клеток растений in vitro. Кроме того, эти технологии дают возможность получать новые ВМ за счет биотрансформации, т. е. химического превращения ВМ в ходе культивирования клеток растений путем гидролиза, окисления, восстановления, гидроксилирования, гидрирования.
4.2. Особенности биосинтеза вторичных метаболитов в культуре клеток растений
Биосинтез ВМ в культуре клеток растений in vitro по сравнению с интактными растениями имеет свои особенности. В растении синтез ВМ, их транспорт и запасание находятся под строгим контролем всего организма, заложенной программой его развития. Имеются специализированные клетки, ткани и органы, в которых накапливаются ВМ. Важнейшим условием получения культуры клеток растений является дедифференцировка, в результате которой специализированные клетки эксплантата могут терять и такое свойство, как способность к синтезу ВМ. Если это свойство сохраняется, то, как правило, биосинтез ВМ в культуре клеток происходит менее интенсивно, чем в интактном растении, спектр синтезируемых ВМ значительно проще.
Характерная особенность культивируемых клеток заключается в том, что их деления, приводящие к увеличению клеточной биомассы, и синтез ВМ разобщены во времени. Накопление ВМ возрастает в фазе замедленного роста клеточной популяции (в конце клеточного цикла) и достигает максимума в стационарной фазе. Некоторые алкалоиды активно синтезируются в фазе максимальной митотической активности, т. е. при экспоненциальном росте, но это - исключение из правил.
Имеет место положительная корреляция между накоплением ВМ и степенью дифференцировки в культуре клеток. Исследования четко показали, что компактные, медленно растущие культуры содержат целевые ВМ в больших количествах, чем рыхлые, быстро растущие культуры. Очевидно механизмы (генетические, эпигенетические) и условия, замедляющие рост клеток и клеточную пролиферацию, одновременно активируют ферменты вторичного метаболизма. В связи с этим для производства некоторых ВМ в культуре клеток in vitroприходится использовать не клеточные суспензии, позволяющие быстро наращивать большие массы клеток, а более медленно растущие каллюсные культуры. Однако следует иметь в виду, что, когда встает вопрос о масштабном промышленном производстве ВМ с помощью культуры клеток растений, прежде всего рассматривают возможность выращивания клеточных суспензий. Суспензионные культуры представляют собой более гомогенную и менее дифференцированную клеточную популяцию, которая растет намного быстрее, чем исходная каллюсная культура. Главное - клеточные суспензии пригодны для непрерывного культивирования в биореакторах большого объема, что является необходимым условием удешевления продукции.
Некоторые ВМ не удалось получить до настоящего времени ни в каллюсной, ни суспензионной культуре клеток, несмотря на усилия многих биотехнологических компаний. Это относится к таким ценным ВМ, как алкалоиды мака Papaver somniferum, тропановые алкалоиды разных видов Solanaceae, димерные индоловые алкалоиды барвинка Catharanthus roseus. Их синтез в культуре клеток начинается только после регенерации из каллюса или в суспензии клеток соответствующего органа растения. Поэтому для таких случаев используется культура органов (стеблей или корней) растений in vitro.
Культуру стеблей получают путем регенерации многочисленных побегов из каллюса или непосредственно из эксплантатов, содержащих апикальные меристемы. Культивирование производят на агаризованных или жидких питательных средах. В некоторых случаях культуры выращивают на свету, что позволяет повысить выход конечного продукта. Культуру стеблей применяют в тех случаях, когда целевые ВМ образуются в надземных органах растений. Так, монотерпеновые эфирные масла не могут синтезироваться в недифференцированных клетках каллюсных или суспензионных культур, поскольку они не имеют тканей, секретирующих масла. В стеблевых культурах их аккумуляция происходит вполне успешно. Хорошие результаты были получены в стеблевой культуре по синтезу таких ВМ, как артемизин из Artemisia annua, обладающий антималярийной активностью. Димерный индольный алкалоид ангидровинбластин, являющийся предшественником противолейкемических алкалоидов барвинка, накапливался в стеблевой культуре in vitro в количествах, сопоставимых с его уровнем в листьях интактных растений. В качестве разновидности стеблевой культуры рассматривают эмбриогенную культуру, которая представляет собой суспензионную культуру клеток, способную при определенных условиях культивирования формировать с высокой частотой соматические эмбриоиды.
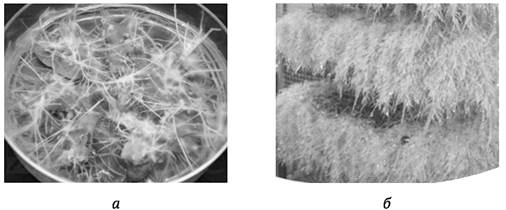
Поскольку именно в корнях многие растения накапливают ВМ, то использование корневых культур in vitro для повышения их выхода - наиболее простое и естественное решение. Имеется два типа корневых культур: обычных корней и «бородатого корня» (англ. hairy root culture) (рис. 4.1). Последнюю получают путем трансформации клеток растений агробактериями A. rhizogenes (механизм агробактериальной трансформации будет рассмотрен в гл. 9). Культура «бородатого корня» в большинстве случаев более эффективна: она значительно быстрее растет по сравнению с культурой обычных корней, не требует добавки в питательную среду синтетических регуляторов роста, поскольку трансформированные клетки способны их сами синтезировать (для культуры обычных корней необходимо присутствие в среде ауксинов). Питательная среда для культуры «бородатого корня» проще и дешевле, не требует оптимизации состава и концентраций регуляторов роста. Отсутствие необходимости использования синтетических регуляторов роста для выращивания культур упрощает процедуру регистрации ВМ в качестве фармацевтического продукта. Главная проблема в использовании культуры «бородатого корня» для производства ВМ обусловлена сложностью трансформации A. rhizogenes клеток ряда важных продуцентов ВМ. Корневые культуры показали высокую эффективность для получения, например, таких важных ВМ, как тропановые алкалоиды пасленовых растений, гинсенозиды женьшеня и другие.
Рис. 4.1. Культура «бородатого корня», выращиваемая на твердой питательной среде (а) и в биореакторе (б)
У растений биосинтез многих ВМ требует участия как корней, так и поверхностных органов. Например, предшественник какого-либо ВМ синтезируется в корнях, а затем транспортируется в стебель или листья, где претерпевает конверсию в конечный продукт. В таком случае культура отдельных органов in vitro будет неэффективной. Решение проблемы предполагает кокулътивацию как корней, так и стеблей одного и того же или разных видов. При этом предшественник может экстрагироваться в питательную среду и попадать через нее в тот орган, где он превращается в конечный продукт. Чтобы усилить этот процесс, применяют механическое повреждение культивируемых органов, в которых синтезируется предшественник. Примером успешной реализации описанного подхода служит кокультивирование «бородатого корня» и культуры стебля белладонны Atropa belladonna(или культуры стебля гибридной дубоизии Duboisia). В корнях белладонны синтезируется гиосциа- мин, для превращения которого в ценный алкалоид скополамин необходим фермент гиосциамин-6β-гидроксилаза (Н6Н). В чистой культуре «бородатого корня» белладонны скополамин практически не образуется из-за низкого уровня Н6Н. Не отмечено образования скополамина и в чистой культуре стеблей. Только при кокультивировании корневой и стеблевой культур удалось достичь весьма существенного уровня биосинтеза скопаламина.
Возможной причиной того, что биосинтез многих ВМ в культуре клеток растений не происходит или очень низок, является отсутствие или недостаточный уровень отдельных ферментов этого биосинтеза. Однако добавление в питательную среду каких-либо промежуточных продуктов биосинтеза может способствовать превращению их в конечный продукт благодаря активности имеющихся в клетке ферментов. Явление химического превращения экзогенных веществ культивируемыми клетками растений или их экстрактами получило название «биотрансформация». Субстрат для биотрансформации может быть натуральным или синтетическим, а конечный продукт - известным по биосинтезу в интактных растениях или новым, специфичным для культивируемых клеток. Биотрансформация субстрата в конечный продукт может осуществляться с помощью одного или нескольких ферментов. Как правило, одноэтапная биотрансформация более эффективная, а выход конечного продукта тем меньше, чем больше клеточных ферментов вовлечено в процесс.
В литературе описано несколько успешных случаев производства ВМ в культуре клеток растений посредством биотрансформации: стоимость конечного продукта была сопоставима или ниже, чем при использовании методов их химического синтеза. Так, в культуре клеток барвинка Catharanthus roseus осуществлен биосинтез арбутина (его используют для обесцвечивания кожи) путем биотрансформации недорогого предшественника - гидрохинона. Клеточные культуры барвинка используют также для получения ценных противораковых агентов винбластина и винкристина путем биотрансформации их предшественника виндолина. Культивируемые клетки наперстянки (Digitalis lanata и D. purpurea) были способны аккумулировать достаточно большое количество сердечных гликозидов дигоксина и/или дигитоксина при добавлении в питательную среду прогестерона, а также, что наиболее важно, они были способны синтезировать более ценный для медицины дигоксин из дигитоксина.
4.3. Селекция и сохранение клеточных культур-продуцентов вторичных метаболитов
Селекцию высокопродуктивных клеточных линий-продуцентов ВМ начинают с выбора вида растений, имеющего наиболее высокое содержание интересующего ВМ. Далее отбирают лучшие по этому показателю растения (генотипы) вида, используемые в качестве источника эксплантатов для получения каллюсной культуры клеток, которую применяют для выделения суспензионной культуры. Наконец, в процессе культивирования суспензии отбирают наиболее продуктивные и стабильные клеточные клоны (линии).
Характерной особенностью клеточных популяций, культивируемых in vitro, является их гетерогенность (см. гл. 3). Значительные различия между клетками имеют место и по показателям биосинтеза ВМ. Так, только 10 % культивируемых клеток барвинка Catharanthus roseus способны активно аккумулировать антоциан. Это означает, что можно, используя культивирование отдельных клеточных агрегатов, отобрать среди них те, что способны стабильно образовывать повышенное количество целевого ВМ. Проще всего отбор продуктивных клеточных линий вести в том случае, когда уровень продукции ВМ можно оценить визуально, например, по интенсивности окраски клеток в зависимости от степени накопления ВМ-пигмента. В этом случае селекцию можно вести уже на уровне каллюсной культуры, последовательно субкультивируя и отбирая наиболее ярко окрашенные сектора каллюса. Если визуальный отбор невозможен, применяют стандартные гистохимические и другие методы количественного определения ВМ на давленных препаратах отдельных клеточных линий.
Эффективность селекции продуктивных клеточных линий можно повысить с помощью мутагенов, отбора на селективных средах (эти методы будут рассмотрены в гл. 6). Большие перспективы имеет применение для этих целей методов генетической инженерии. Выход ВМ в культуре клеток можно существенно улучшить, если известен генетический и биохимический механизм биосинтеза ВМ. Это дает возможность устранять его «узкие места», направлено воздействовать на отдельные его этапы. В настоящее время определены пути биосинтеза ряда ценных ВМ и клонированы отдельные гены, кодирующие ключевые ферменты, что позволяет непосредственно воздействовать на скорость процесса, изменяя активность ферментов с помощью генно-инженерной модификации. Для этих целей удобно использовать агробактериальную трансформацию с помощью A. rhizogenes, решая одновременно две задачи: перенос отдельных генов ферментов, усиливающих биосинтез ВМ, и получение культуры «бородатого корня», которая также позволяет увеличить образование ВМ.
Отбор не только продуктивных, но и стабильных клеточных клонов, оптимизация условий культивирования, как правило, обеспечивают определенный уровень производства ВМ в течение достаточно длительного времени. Однако в силу цитогенетической нестабильности клеточных культур обычным является постепенное снижение продуктивности клеточных линий. В связи с этим встает проблема их сохранения. Она может решаться на разных уровнях. Во-первых, необходимо сохранение растений, которые служили эксплантатами для получения культуры клеток: процесс селекции продуктивных клеточных линий может быть воспроизведен на вновь полученных клеточных культурах. Для сохранения таких растений удобно использовать методы поддержания генетических коллекций растений in vitro, которые будут описаны в следующей главе. Во-вторых, существуют методы длительного сохранения наиболее продуктивных клеточных линий с помощью криоконсервации в жидком азоте. Следует также иметь в виду, что культура органов растений в отличие от каллюсной и суспензионной культуры характеризуется значительно более высокой генотипической и фенотипической стабильностью. Ее легче воспроизвести из растения-донора эксплантатов. В связи с этим, если имеется возможность выбора, то именно такой культуре следует отдавать предпочтение.
4.4. Подходы к увеличению выхода вторичных метаболитов в культуре клеток растений
Применяемые в настоящее время подходы к увеличению выхода ВМ в культуре in vitro путем физиологической регуляции метаболизма клеток растений включают в себя подбор питательных сред (состава и концентраций регуляторов роста, минеральных веществ, витаминов, сахаров, рН), режимов освещения, аэрации (соотношения СО2/О2), температуры, подбор типа и размеров биореактора. Для каждого отдельного случая (вида растений, ВМ) оптимальные условия культивирования могут существенно различаться, поэтому должны подбираться индивидуально.
Эффективное направление в стимулировании синтеза культивируемыми клетками растений ВМ - элиситация (от англ. elicitation). В контексте производства ВМ с помощью культуры клеток растений элиситоры - вещества или другие факторы, способные индуцировать биосинтез ВМ в культуре клеток растений. Применение элиситоров основано на том, что многие ВМ - вещества защитного ответа растительной клетки на действие биотических или абиотических стрессов. Соответственно элиситоры микробного или растительного происхождения (например, экстракты бактериальных клеток, дрожжей, растений, хитин, хитозан) относят к биотическим элиситорам, а физические (например, УФ-облучение, тепловой или холодовой шок) и химические (например, тяжелые металлы, ионы Ca2+) стрессовые факторы определяют, как абиотические элиситоры. Было показано, что элиситоры способны не только индуцировать образование фитоалексинов, но также активировать биосинтетический потенциал различных конститутивных метаболитов культивируемых клеток растений. Эффективность их применения может быть очень высокой. Так, образование секвитерпена госсипола в культуре клеток древовидного хлопчатника Gossypium arboretum удалось увеличить в 100 раз с помощью элиситора, полученного из Verticillum dabliae. Добавление элиситоров в питательную среду при культивировании клеток мака снотворного Papaversomniferum увеличило биосинтез алкалоида сангуинарина в 27 раз.
В результате изучения механизмов иммунитета растений было установлено, что в системе передачи экзогенного сигнала в клетку (англ. signal transduction system), который запускает клеточные процессы защитного ответа, наряду с реактивными формами кислорода, ионами Ca2+, фосфоинозитидами важную роль играет жасмоновая кислота. Выяснилось, что индукция биосинтеза ВМ в культуре клеток растений под действием элиситоров сопровождается быстрой кратковременной аккумуляцией жасмоновой кислоты и ее метилового эфира метил жасмоната (H. Gundlach и др., 1992). Это дало основание использовать данные соединения, а не сами элиситоры для индукции биосинтеза ВМ в культивируемых клетках растений. Высокая эффективность их применения доказана для повышения выхода ВМ широкого круга видов растений.
Результаты, достигнутые с помощью культур органов растений, показали, что для нормального метаболизма клеток необходима их организованность в ткани. Для повышения организованности культивируемых клеток растений in vitro, усиления их дифференцированности представляет интерес использование различных методов иммобилизации клеток, т. е. их фиксации в/на каком-либо носителе в целях повышения выхода ВМ. Существует несколько методов иммобилизации клеток растений:
✵ иммобилизация в инертном субстрате: обволакивание клеток альгинатом, агаром, коллагеном, полиакриламидом;
✵ адсорбция клеток на инертном субстрате. Клетки прилипают к заряженным шарикам из альгината, полистирола, полиакриламида. Примером этого способа иммобилизации также может служить выращивание клеток внутри нейлонового сита, пенополиуретанового матрикса, полых волокон (рис. 4.2);
✵ ковалентное связывание клеток с инертным носителем типа карбоксиметил-целлюлозы.
Наибольшее распространение получили способы иммобилизации растительных клеток путем их встраивания в гранулы полисахаридных гелей природного происхождения на основе желатина, пектина, хитозана, агарозы, альгината кальция и других веществ.
Рис. 4.2. Пример иммобилизации суспензионной культуры марены красильной (Rubia tinctorum L) на инертном субстрате. В качестве субстрата использованы волокнистые материалы природного происхождения: а - волокна люффы; б - волокна сезаля; в - волокна джута. По данным авторов все три субстрата не оказывали негативного влияния на накопление биомассы суспензионной культуры и получение вторичных метаболитов ализарина и пурпурина в культуре in vitro (по P. Nartop и др., 2013)

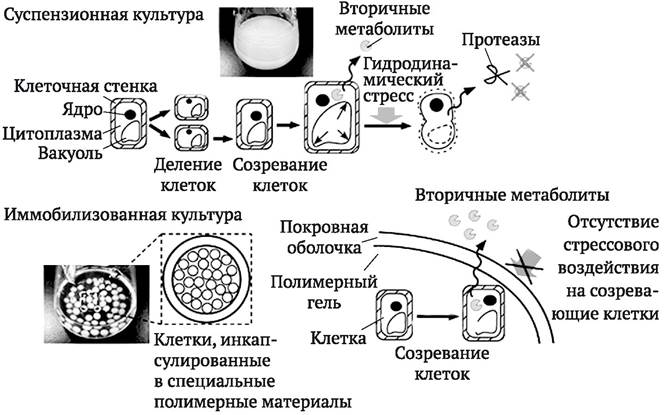
Иммобилизация клеток существенно изменяет их метаболизм. У иммобилизованных клеток наблюдается удлинение стационарной фазы роста. В результате замедления ростовых процессов продукты первичного метаболизма становятся более доступными для процессов вторичного метаболизма. Благодаря этому системы иммобилизованных культур характеризуются стабильностью биосинтеза ВМ в течение длительных промежутков времени. Считается, что процесс иммобилизации инициирует стрессовую реакцию растительной клетки, которая приводит к усилению синтеза ВМ. В качестве стрессового фактора может рассматриваться сама микросреда внутри матрикса. Кроме того, полисахариды (пектин, хитозан, альгинат и др.), используемые в качестве иммобилизующего матрикса, могут действовать как элиситоры. Они же, защищая созревающие клетки от внешних стрессовых факторов, препятствуют их апоптозу и сопутствующему ему выделению гибнущими клетками
в среду для культивирования протеаз. Накопление протеаз приводит к расщеплению и потерям части ВМ, выделяемых клетками в среду. Иммобилизация клеточной культуры внутри матрикса способствует сохранению жизнеспособности клеток и конечному выходу ВМ (рис. 4.3).
Рис. 4.3. Особенности накопления клетками и высвобождения в питательную среду ВМ при использовании обычной суспензионной культуры и иммобилизованной культуры, в частности, с применением инкапсулирования клеток в специальные полимерные материалы
Следует, однако, заметить, что эффективность иммобилизации клеток во многом определяется их способностью секретировать целевой продукт в питательную среду. Иммобилизация может усиливать экскрецию, но для большинства растительных клеток, в отличие от микроорганизмов, это свойство не характерно.
4.5. Промышленное производство вторичных метаболитов в культуре клеток и органов растений
Промышленное производство ВМ в культуре клеток существенно отличается от лабораторного. Прежде всего промышленное производство предполагает использование биореакторов, которые отличаются от лабораторных, не только большими размерами, но содержат различные специальные элементы, обеспечивающие непрерывность технологического цикла, равномерность распределения клеток в реакторе, их аэрацию, контроль температуры, состава питательной среды, ее рН и других факторов, способных оказывать влияние на выход конечного продукта. Разработано и производится большое количество разнообразных биореакторов для микробиологической промышленности. Однако далеко не все они подходят для разных видов культуры клеток растений.
Клетки растений в суспензии (40-200 μм) в десятки, сотни раз крупнее клеток бактерий и грибов, их размеры меняются в процессе онтогенеза. Если в начале экспоненциальной фазы роста они мелкие и плотные, то в стационарной фазе роста они сильно увеличиваются в размерах и вакуолизируются. Чем крупнее становится клетка, тем больше возрастает опасность ее механического повреждения в процессе перемешивания. Особенно подвержены механическим повреждениям культуры стеблей и корней. Клетки растений тяжелее микробных и требуют эффективного перемешивания. Оседание их приводит к появлению «мертвых» зон в сосудах, в которых происходит быстрое накопление и старение клеток.
При культивировании микроорганизмов агрегаты практически не возникают, а культура клеточных суспензий растений в основном состоит из агрегатов разного размера, что значительно увеличивает плотность культуры и затраты на ее перемешивание. Скорость роста культур микроорганизмов значительно выше (время удвоения измеряется часами), чем у растительных клеток (время удвоения измеряется днями). Для начала производственного цикла при культивировании микроорганизмов можно использовать весьма разведенные инокуляты, в случае с растительными клетками плотность инокулята должна быть не менее 5-10 %. Клетки растений in vitro по сравнению с микроорганизмами имеют более низкую интенсивность дыхания, следовательно, система аэрации их культур может существенно отличаться от таковой у микроорганизмов. Наконец, для культуры клеток растений используют значительно более сложные и дорогие питательные среды, чем для культуры микроорганизмов.
Различают два вида систем культивирования клеток: закрытую и открытую. Для закрытой системы характерен периодический (накопительный) режим выращивания. Инокулят клеток помещается в определенный объем среды и в системе биореактора закрыт по всем параметрам, кроме газов, до конца выращивания. В простейшем варианте биореактором служит обыкновенная колба. Открытые (проточные) системы культивирования клеток растений характеризуются поступлением свежей питательной среды, при котором отбирается не только старая питательная среда, но и часть урожая клеток. Питательная среда подается периодически, а старая удаляется. Клетки остаются в системе в течение всего цикла выращивания.
Периодическое (накопительное) культивирование - это самый простой и традиционный способ выращивания клеток. Его применяют в основном в лабораторных условиях. При этом способе культивирования для аэрации и перешивания культур используют качалки, роллеры, на которых располагаются колбы, а также магнитные мешалки (рис. 4.4, д). При масштабировании от небольших по объему культур в колбах до многолитровых биореакторов аэрацию и перемешивание чаще всего осуществляют с помощью различных импеллеров (пропеллеров), которые вращаются внутри реакторов (рис. 4.4, а). Также для этих целей применяются биореакторы барабанного типа (чаны цилиндрической формы, которые медленно вращают вокруг горизонтальной оси) (рис. 4.4, 6), колонновидные биореакторы с пневматическим перемешиванием, например, барботажного типа (перемешивание и аэрация за счет пузырьков продуваемого воздуха) (рис. 4.4, в).
Рис. 4.4. Типы биореакторов (а-г) для культуры клеток и органов растений и примеры разных биореакторов (д-з): а - биореакторы с механическим перемешиванием культур различными импеллерами; б - биореакторы барабанного типа; в - биореакторы с пневматическим перемешиванием (барботированием); г - биореакторы одноразового использования с гидродинамическим перемешиванием; д - простейший биореактор - колбы с суспензионной культурой на программируемой механической качалке; е и ж - лабораторные автоматические биореакторы из стекла; з - автоматизированный, программируемый биореакторный комплекс, используемый в Национальном институте биотехнологических исследований и испытаний (NIBRT) Ирландии, расположенном в г. Дублин
(по О. Yesil-Celiktas и др., 2010)
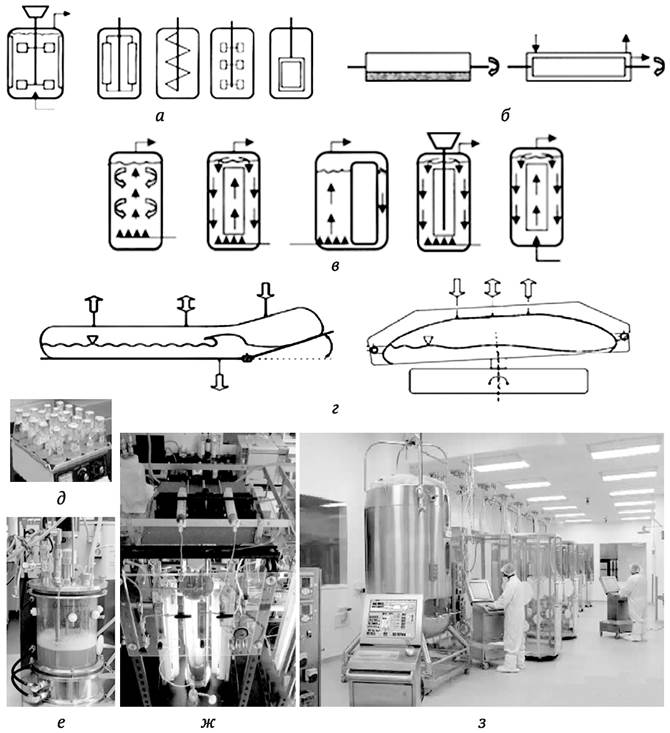
Чаны для культивирования чаще всего изготавливают из нержавеющей стали. Это долговечные, однако весьма дорогостоящие изделия (рис. 4.4, з). В связи с этим наиболее перспективно использование дешевых одноразовых биореакторов из гибкого пластика. В них перемешивание и аэрация культур может производиться гидродинамическим способом (рис. 4.4, г). Для эмбриогенных и стеблевых культур могут использоваться биореакторы, изготовленные из стекла, так как культивирование производится с применением подсветки лампами, расположенными снаружи (рис. 4.4, е, ж). Впрочем, подсвечивание культур лампами в виде труб или полых волокон может осуществляться и внутри реактора.
Если для суспензионной культуры клеток и эмбриогенных культур пригодны, в принципе, биореакторы, произведенные для культивирования микроорганизмов, то для корневых культур такие реакторы требуют существенной модификации. Это связано со значительным механическим повреждением корней при перемешивании культур. Поэтому в биореакторах для культивирования корней применяют различные корзины, сетчатые перегородки и другие приспособления для иммобилизации корневых культур и предотвращения их контакта с импеллерами. Перспективным представляется культивирование корней в биореакторах, оборудованных «грядками» (подложками, на которых располагаются корневые культуры), смачиваемыми питательной средой приспособлениями мелкокапельного полива или туманообразующими установками.
Попытки масштабного культивирования клеток растений относятся к концу 50-х гг. XX в. Уже в 1960 г. была показана возможность выращивания биомассы табака в чанах из нержавеющей стали. В 1977 г. в Японии биомассу табака Nicotiana tabacum выращивали в биореакторах объемом 20 м3, оборудованных системой механического перемешивания. В настоящее время объем биореакторов для выращивания биомассы табака доведен до 75 м3. Ее используют для производства сигарет с пониженным содержанием никотина.
В 1974 г. М. Tabata и сотрудники впервые показали, что в каллюсной культуре воробейника Lythospermum erythrorhizon могут синтезироваться производные шиконина. Позднее с помощью специальной селекции была отобрана клеточная линия, которая в 20 раз превосходила исходную культуру по накоплению шиконина, достигнув уровня 1,2 мг/г сырой массы клеток. Результатом интенсивных исследований по оптимизации промышленных условий культивирования этой линии стало начавшееся в 1983 г. коммерческое производство шиконина японской компании Mitsui Petrochemical Industry. Шиконин - красный нафтохиноновый пигмент, аккумулируемый в коре корней многих растений семейства Boraginaceae. Он обладает антимикробным, противовоспалительным, ранозаживляющим и противоопухолевым действием.
В Японии в 1988 г. началось коммерческое производство биомассы женьшеня, которую используют преимущественно в косметической промышленности
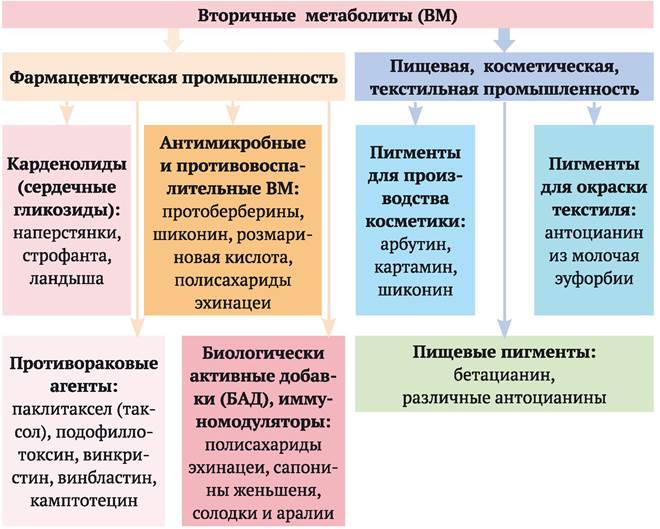
и в виде пищевой добавки. В настоящее время в разных странах культуры клеток около ста видов растений используются в биосинтетической промышленности для получения важных для фармакопеи веществ. Это, например, различные сердечные гликозиды (карденолиды); противораковые агенты: паклитаксел (таксол), подофиллотоксин, винкристин, винбластин, камптотецин; ВМ, обладающие антибактериальным и противовоспалительным действием: протоберберины, шиконин, розмариновая кислота, полисахариды эхинацеи (последние обладают также иммуностимулирующим действием). Гераниол является ценным источником незаменимых жирных кислот. Скополамин обладает выраженным антихолинергическим действием, его используют как успокаивающее и противорвотное средство (входит в состав таблеток от укачивания «Аэрон»). Ряд ВМ используется в качестве пигментов в косметике (арбутин, картамин, шиконин), а также в пищевой промышленности (бетацианин, различные антоцианины), красителей в текстильной промышленности (антоцианин из молочая эуфорбии). Существующие в настоящее время направления промышленного производства ВМ с помощью культуры клеток растений представлены на рис. 4.5.
Рис. 4.5. Направления промышленного производства вторичных метаболитов с помощью культуры клеток растений
Однако говорить о действительно широкомасштабном производстве ВМ с помощью методов культуры клеток растений можно лишь в отношении небольшого количества продуктов: шиконина, таксола, берберина, а также биомассы женьшеня (лидеры - компании Японии и США). Основным сдерживающим фактором для экономически обоснованного производства каких-либо веществ с помощью клеточных культур растений является их недостаточно высокая продуктивность. Исследования, проводимые во многих странах, направленные на повышение эффективности производства ВМ с помощью культур клеток растений, позволяют рассчитывать на значительный прогресс в этой области. Особенно большие перспективы связывают с выяснением путей биосинтеза ВМ, применением генно-инженерных подходов для целенаправленных воздействий на отдельные этапы биосинтеза ВМ.
Заключение
Высшие растения обладают способностью синтезировать разнообразные биологически активные соединения, присутствие которых в растительной клетке не строго обязательно для поддержания жизни - вторичные метаболиты (ВМ). Многие ВМ представляют интерес для фармакопеи, косметики, сельского хозяйства, пищевой и текстильной промышленности.
Биосинтез ВМ в культуре клеток растений in vitro по сравнению с интактными растениями имеет свои особенности. В растении синтез ВМ, их транспорт и запасание находятся под строгим контролем всего организма, заложенной программой его развития. Имеются специализированные клетки, ткани и органы, в которых накапливаются ВМ. Важнейшим условием получения культуры клеток растений является дедифференцировка, в результате которой специализированные клетки эксплантата могут терять и такое свойство, как способность к синтезу ВМ. Если это свойство сохраняется, то, как правило, биосинтез ВМ в культуре клеток происходит менее интенсивно, чем в интактном растении, спектр синтезируемых ВМ значительно уже.
Особенность культивируемых клеток заключается в том, что их деления, приводящие к увеличению клеточной биомассы, и синтез ВМ разобщены во времени. Накопление ВМ возрастает в фазе замедленного роста клеточной популяции (в конце клеточного цикла) и достигает максимума в стационарной фазе. Некоторые алкалоиды активно синтезируются в фазе максимальной митотической активности, т. е. при экспоненциальном росте, но это исключение из правил.
Суспензионные культуры клеток представляют собой наиболее гомогенную и менее дифференцированную клеточную популяцию, которая растет намного быстрее, чем исходная каллюсная культура. Клеточные суспензии пригодны для непрерывного культивирования в биореакторах большого объема, что служит необходимым условием удешевления продукции. Однако некоторые ВМ не удалось получить до настоящего времени ни в каллюсной, ни суспензионной культуре клеток, несмотря на продолжительные и концентрированные усилия многих биотехнологических компаний. Их синтез в культуре клеток начинается только после регенерации из каллюса или в суспензии клеток соответствующего органа растения (вторичная дифференцировка). Поэтому для таких случаев используется культура органов (стеблей или корней) растений in vitro или эмбриогенная культура.
Наиболее эффективна культура «бородатого корня», которую получают путем трансформации клеток растений агробактериями A. rhizogenes. Она значительно быстрее растет по сравнению с культурой обычных корней, не требует добавки в питательную среду синтетических регуляторов роста, поскольку трансформированные клетки способны их сами синтезировать. Питательная среда для культуры «бородатого корня» проще и дешевле, не требует оптимизации состава и концентраций регуляторов роста.
Характерной особенностью клеточных популяций, культивируемых in vitro, является их гетерогенность. Значительные различия между клетками имеют место и по показателям биосинтеза ВМ. Это означает, что можно, используя культивирование отдельных клеточных агрегатов, отобрать среди них те, что способны стабильно образовывать повышенное количество целевого ВМ. Эффективность селекции продуктивных клеточных линий можно повысить с помощью мутагенов, отбора на селективных средах. Большие перспективы имеет применение для этих целей методов генетической инженерии. Удобно использовать агробактериальную трансформацию с помощью A. rhizogenes, решая одновременно две задачи: перенос отдельных генов ферментов, усиливающих биосинтез ВМ, и получение культуры «бородатого корня», которая также позволяет увеличить образование ВМ.
Применяемые в настоящее время подходы к увеличению выхода ВМ в культуре клеток растений путями физиологической регуляции метаболизма клеток растений включают в себя подбор питательных сред (состава и концентраций регуляторов роста, минеральных веществ, витаминов, сахаров, рН), режимов освещения, аэрации (соотношения СО2/О2), температуры, подбор типа и размеров биореактора.
Эффективное направление в стимулировании синтеза культивируемыми клетками растений ВМ - элиситация (от англ. elicitation). В контексте производства ВМ с помощью культуры клеток растений элиситоры - вещества или другие факторы, способные индуцировать биосинтез ВМ в культуре клеток растений. Применение элиситоров основано на том, что многие ВМ являются веществами защитного ответа растительной клетки на действие биотических или абиотических стрессов. Соответственно элиситоры микробного или растительного происхождения (например, экстракты бактериальных клеток, дрожжей, растений, хитин, хитозан) относят к биотическим элиситорам, а физические (например, УФ-облучение, тепловой или холодовой шок) и химические (например, тяжелые металлы, ионы Ca2+) стрессовые факторы определяют, как абиотические элиситоры. Во многих случаях для индукции биосинтеза ВМ в культивируемых клетках растений эффективным оказывается использование не самих элиситоров, а веществ, участвующих в системе передачи экзогенного сигнала в клетку - жасмоновой кислоты, метил жасмоната. Перспективным представляется также использование биотехнологий, основанных на иммобилизации клеточных культур.
Разработано и производится большое количество разнообразных биореакторов для микробиологической промышленности. Однако далеко не все они подходят для разных видов культуры клеток растений. Клетки растений в суспензии в десятки, сотни раз крупнее клеток бактерий и грибов, соответственно больше опасность их механического повреждения в процессе перемешивания. Особенно подвержены механическим повреждениям культуры стеблей и корней. Клетки растений тяжелее микробных и требуют эффективного перемешивания. Культура клеточных суспензий растений в основном состоит из агрегатов разного размера, что значительно увеличивает плотность культуры и затраты на ее перемешивание. Клетки растений in vitro по сравнению с микроорганизмами имеют более низкую интенсивность дыхания, следовательно, система аэрации их культур может существенно отличаться от таковой у микроорганизмов. Эффективное перемешивание и аэрация достигается в биореакторах для культуры клеток растений, оборудованных импеллерами (механическое перемешивание), а также в биореакторах барабанного типа, колонновидных биореакторах с пневматическим перемешиванием.
Для предотвращения механических повреждений в биореакторах для культивирования корней используют различные корзины, сетчатые перегородки и другие приспособления для иммобилизации корневых культур и предотвращения их контакта с импеллерами. Перспективным представляется культивирование корней в биореакторах, оборудованных «грядками», смачиваемыми питательной средой приспособлениями мелкокапельного полива или туманообразующими установками.
В настоящее время в разных странах в биосинтетической промышленности для получения важных для фармакопеи веществ используются культуры клеток около ста видов растений. Это, например, различные сердечные гликозиды (карденолиды); противораковые агенты: паклитаксел (таксол), подофиллотоксин, винкристин, винбластин, камптотецин; ВМ, обладающие антибактериальным и противовоспалительным действием: протоберберины, шиконин, розмариновая кислота, полисахариды эхинацеи (последние обладают также иммуностимулирующим действием). Ряд ВМ используется в качестве пигментов в косметике (арбутин, картамин, шиконин), а также в пищевой промышленности (бетацианин, различные антоцианины), красителей в текстильной промышленности (антоцианин из молочая эуфорбии). Однако говорить о действительно широкомасштабном производстве ВМ с помощью методов культуры клеток растений можно лишь в отношении относительно небольшого количества продуктов: шиконина, таксола, берберина, а также биомассы женьшеня.
Контрольные вопросы
1. Чем продукты вторичного метаболизма растений отличаются от продуктов первичного метаболизма?
2. В каких случаях ВМ выгоднее производить с помощью культуры клеток, чем использовать природное растительное сырье?
3. В чем заключаются различия в биосинтезе ВМ в культуре клеток и в интактном растении?
4. Почему культура органов более эффективно аккумулирует ВМ по сравнению с суспензионной или каллюсной культурой?
5. Какими преимуществами обладает культура «бородатого корня» по сравнению с суспензионной культурой клеток и культурой обычных корней?
6. Каким образом проводят селекцию высокопродуктивных клеточных линий растений?
7. Какие методы используют для сохранения продуктивных клеточных линий растений?
8. Что такое элиситация культур клеток растений? Какие элиситоры применяют для повышения выхода ВМ в культуре клеток?
9. Каким образом получают культуру иммобилизованных клеток растений?
10. В чем заключаются различия в промышленном культивировании микроорганизмов и растительных клеток?
11. Какие биореакторы пригодны для выращивания суспензионных культур клеток растений, корневых культур?
12. В каком году начато масштабное промышленное производство ВМ с помощью культуры клеток растений? Какое это было вещество?
13. Назовите основные ВМ, выпускаемые в промышленных масштабах.