БИОТЕХНОЛОГИЯ РАСТЕНИЙ И БИОБЕЗОПАСНОСТЬ - А. П. Ермишин - 2015
ГЛАВА 3. ОСНОВНЫЕ ВИДЫ КУЛЬТУРЫ КЛЕТОК РАСТЕНИЙ: КАЛЛЮСНАЯ, СУСПЕНЗИОННАЯ, КУЛЬТУРА ПРОТОПЛАСТОВ. БАЗОВЫЕ ПРИНЦИПЫ КУЛЬТУРЫ КЛЕТОК, ТКАНЕЙ И ПРОТОПЛАСТОВ РАСТЕНИЙ IN VITRO
В этой главе рассматриваются основные виды культуры клеток растений: каллюсной, суспензионной и культуры протопластов, методы культивирования единичных изолированных клеток и протопластов. Большое внимание уделяется фундаментальным процессам, связанным с получением клеточных культур и регенерацией из культивируемых клеток целых растений. Эти сведения необходимы для эффективного усвоения последующего материала, посвященного направлениям практического использования методов культуры клеток растений.
3.1. Дедифференцировка как условие перехода специализированной клетки к делению и образованию каллюсной ткани. Гормоны — индукторы дедифференцировки
Клетки формирующегося зародыша растений являются недифференцированными. Они интенсивно делятся и могут давать начало различным тканям и органам растения (тотипотентны). В процессе дифференциации клетка проходит три фазы: 1) деление; 2) растяжение; 3) дифференцировку. Характерная особенность заключительной фазы клеточного развития - это утолщение вторичной клеточной оболочки и потеря способности клетки к делению. У зародыша формируется меристема - ткань, которая сохраняет способность к делению и образованию новых клеток на протяжении всей жизни растения. Одни клетки меристемы (инициальные) задерживаются в недифференцированном состоянии и, делясь, обеспечивают непрерывный рост растения. Другие клетки постепенно дифференцируются, образуя постоянные ткани (покровные, проводящие, механические и др.).
Существует два основных типа меристем - верхушечные (апикальные) и боковые (латеральные). Апикальные меристемы располагаются на верхушках побегов и корней. Они обеспечивают их рост в длину. Такой рост получил название первичного, а сами меристемы - первичных. Латеральные меристемы (камбий и феллоген) располагаются параллельно боковым поверхностям осевых органов. Эти меристемы обеспечивают нарастание соответствующих органов в толщину. Кроме того, в процессе роста меристематическая ткань сохраняется в некоторых частях растения: в корнях (в виде перицикла), в узлах побега, в сердцевинных лучах стебля. Так называемая вставочная (интерка- лярная) меристема характерна для злаковых культур: она находится в междоузлиях стебля и в основаниях черешков листьев.
У растения могут возникать и новые, вторичные меристемы. Это происходит, например, при поранении. Раневые меристемы дают начало каллюсу - особой ткани, состоящей из однородных паренхимных клеток, которые, интенсивно делясь, покрывают место поранения. В процессе их вторичной дифференцировки происходит восстановление поврежденных тканей и органов. Свойство растений к каллюсообразованию и последующей регенерации тканей и органов используется в садоводстве при получении прививок (срастание подвоя и привоя) и размножении растений черенками (укоренение черенков).
Важно отметить, что способностью к каллюсообразованию обладают клетки специализированных органов (листа, стебля, корня, семядолей) и тканей (меристемных, покровных, проводящих, основных, выделительных, механических) растения. Начальным условием в этом процессе является де- дифференцировка: утрата специализации клеток ткани и восстановление их способности к делению, т. е. при каллюсообразовании специализированные клетки как бы возвращаются в меристематическое состояние. Установлено, что дедифференцировка клеток и образование каллюса происходит под воздействием определенных фитогормонов.
Если фрагмент специализированных тканей растения (эксплантат) поместить на питательную среду, содержащую фитогормоны, необходимые для образования каллюса, то можно получить культуру каллюсных клеток in vitro - основной тип культуры клеток растений. Процесс дедифференциации специализированных клеток индуцируют ауксины. Однако для того, чтобы дедифференцированные клетки начали делиться, необходимы цитокинины. Ауксины интенсифицируют синтез ДНК, РНК и белков, которые необходимы для прохождения клеточного цикла и обеспечивают синтетические процессы фазы G1 подготовки клетки к делению. Цитокинины действуют за ауксинами: снимают блок синтезов, необходимых для обеспечения построения митотического аппарата и имеющих место при переходе от S- к G2-фазе клеточного цикла. Ауксины индуцируют синтез главной протеинкиназы клеточного деления, а цитокинины - циклинов. Таким образом, при дедифференцировке действие этих фитогормонов проявляется последовательно: сначала «включаются» ауксины, затем - цитокинины. Поэтому в питательной среде для получения каллюсной культуры должны быть как ауксины, так и цитокинины. В зависимости от эксплантата (соответственно уровня эндогенных фитогормонов) эта закономерность может не соблюдаться. Так, зрелые и незрелые зародыши пшеницы и ячменя способны к каллюсообразованию на питательной среде только с ауксинами (2,4-Д). Очевидно, это связано с наличием у них достаточного количества эндогенных цитокининов.
Если дедифференцировка специализированных клеток обусловливается индукцией деления под влиянием фитогормонов, то дедифференциров- ка делящихся меристематических клеток связана с остановкой делений, их деспециализацией и только после этого - с индукцией делений, приводящей к каллюсообразованию.
3.2. Цитоморфологические, физиолого-биохимические особенности каллюсных культур
Каллюсная ткань in vitro не имеет конкретной анатомической структуры. В зависимости от эксплантата и условий культивирования она может быть разной консистенции: рыхлой, состоящей из сильно обводненных клеток, распадающихся на мелкие агрегаты; средней плотности или плотной консистенции, в которых дифференцируются элементы проводящей системы, меристематические очаги. При культивировании в темноте окраска тканей желтоватого цвета, на свету они могут приобретать светло-зеленую окраску (сплошную или в виде отдельных вкраплений) (рис. 3.1).
Рис. 3.1. Каллюсы различной консистенции (эксплантаты - пыльники картофеля): а - рыхлый обводненный каллюс, распадающийся на мелкие агрегаты; б - каллюс средней плотности с меристематическими очагами и регенерацией побегов; в - пальцевый каллюс: 1 - этиолированный, рыхлой консистенции; 2 - высокой и средней плотности

Переход клетки in vitro из дифференцированного состояния к дедифференцировке и активным клеточным делениям обусловлен изменением активности генов. У двудольных растений процесс репрессии и депрессии генов, лежащий в основе дедифференцировки, происходит легче, чем у однодольных. Соответственно каллюсную культуру у двудольных можно получить намного проще, чем у однодольных, и из более широкого круга различных эксплантатов. Лучшими эксплантатами для получения каллюсной культуры являются те, что содержат слабо дифференцированные клетки (незрелые зародыши) или меристематические ткани.
В процессе дедифференцировки в каллюсных клетках появляются специфические белки и одновременно исчезают другие, характерные для клеток эксплантата. Клетки эксплантатов теряют запасенные липиды, крахмал, белки. Фотосинтезирующие клетки утрачивают хлорофилл и липиды хлоропластов. При этом возрастает количество амилопластов, разрушается аппарат Гольджи, перестраивается эндоплазматический ретикулюм и элементы цитоскелета. Энергетический метаболизм каллюсных клеток в значительной мере напоминает таковой у клеток меристемы. Митохондрии у них слабо развиты, в них мало крист, что оказывает негативное влияние на активность аэробного дыхания. Они потребляют меньше кислорода по сравнению со специализированными клетками растения. У них происходит сдвиг соотношения между дыханием и брожением в сторону брожения. Имеет место повышенное потребление углеводов из-за аэробного гликолиза, сдвиг в обмене углеводов в направлении пентозофосфатного пути, который является источником пентоз, необходимых для делящихся клеток.
Вместе с тем каллюсные клетки in vitro могут сохранять некоторые физиолого-биохимические особенности растения, с которого был взят эксплантат. Так, питательная среда для каллюсной культуры растений, которые предпочитают кислые почвы (например, рододендронов, голубики, брусники и др.), должна иметь более кислую реакцию, чем у растений, растущих на нейтральных и щелочных почвах. Каллюсные культуры теплолюбивых растений лучше растут при более высоких температурах, чем культуры растений умеренного климата. Каллюсные клетки при определенных условиях сохраняют способность синтезировать вторичные метаболиты, характерные для растений-доноров эксплантатов (например, панаксазиды женьшеня). Каллюсным клеткам свойственна устойчивость к токсинам, гербицидам, антибиотикам, засолению, морозо- и жаростойкость, и другие свойства, если они имели место у интактных растений.
3.3. Гетерогенность каллюсной ткани. Генетические и эпигенетические изменения клеток в культуре in vitro
В отличие от меристемных клеток, для которых характерны высокая однородность и генетическая стабильность, рост каллюсных клеток, их вторичная дифференцировка происходят неорганизованно и асинхронно. Каллюсная ткань может содержать паренхимные клетки, меристематические, некротические, а также элементы проводящей системы. В каллюсной ткани одновременно присутствуют клетки, находящиеся на разных стадиях митотического цикла. Клеточный цикл у них более длительный, чем у клеток меристемы.
Культура каллюсных тканей обладает не только гетерогенностью по степени и направлениям дифференцировки клеток, но и гетерогенностью по цитогенетическим характеристикам. Прежде всего обращает внимание присутствие в каллюсной культуре клеток разной плоидности (в том числе с высоким уровнем плоидности - 6-8х и более) даже в тех случаях, когда в качестве эксплантата использовались меристематические ткани, содержащие исключительно диплоидные клетки. В процессе культивирования доля полиплоидных клеток, как правило, увеличивается.
Для культуры каллюсных клеток характерна высокая частота нарушений митоза, что приводит к появлению у них многочисленных хромосомных аберраций. В результате специальных генетических исследований было показано, что в процессе культивирования каллюсных клеток с относительно высокой частотой возникают разнообразные точковые мутации.
Важно отметить, что многие из перечисленных генетических изменений могут быть «перенесены» на организменный уровень путем получения из генетически измененных клеток растений-регенерантов. Явление генетической изменчивости растений-регенерантов, полученных в культуре клеток in vitro (не только из каллюсных культур, но и клеточных суспензий, культуры протопластов), получило название сомаклональной изменчивости. Оно имеет большое практическое значение и может быть использовано для получения полиплоидов, мутантных генотипов. Причины сомаклональной изменчивости и направления ее практического использования будут рассмотрены в гл. 6.
3.4. Явление «привыкания» (гормононезависимость)
Для поддержания деления каллюсных клеток в культуре in vitro необходимо присутствие в питательной среде ауксинов и цитокининов. Однако при длительном культивировании могут появляться клеточные клоны, способные расти на среде без регуляторов роста. Это явление получило название «привыкание». Ткани, образованные «привыкшими» клетками (автономными по отношению к экзогенным ауксинам и цитокининам), называются гормононезависимыми. Их еще называют «химическими опухолями», поскольку кроме «привыкших» каллюсных тканей свойством гормононезависимости в культуре in vitro обладают и растительные опухоли естественного происхождения. Наиболее изучены из них корончатые галлы - опухоли, индуцированные у двудольных растений агробактериями.
Общим свойством химических и природных опухолей растений является их гормононезависимость. У «привыкших» тканей гормононезависимость достигается в результате изменения активности генов, отвечающих за синтез ферментов, участвующих в синтезе фитогормонов. Таким образом, изменения метаболизма каллюсных клеток, связанные с синтезом собственных фитогормонов, носят у них эпигенный характер, хотя нельзя исключить и возможность появления определенных мутаций. В опухолевых тканях синтез гормонов связан с переносом в геном растительных клеток бактериальных генов, отвечающих за этот процесс, в результате которого происходит их трансформация: превращение из здоровых в опухолевые.
Работы по культуре in vitro растительных опухолей, обнаружение у них явления гормононезависимости способствовали усилению интереса ученых к раскрытию его механизма (механизм агробактериальной трансформации будет рассмотрен ниже в гл. 9). Результатом изучения природы агробактериальной трансформации стала разработка основного и наиболее эффективного метода переноса генов, сконструированных in vitro, в растительную клетку для получения трансгенных растений.
3.5. Суспензионная культура клеток растений
Подобно микроорганизмам клетки растений можно культивировать in vitro не только на полутвердых (агаризованных) питательных средах, но и с использованием жидких сред - в виде суспензии клеток. При таком культивировании обеспечение клеток кислородом достигается путем постоянного перемешивания среды на качалках, роллерных аппаратах или с помощью других приспособлений.
Для получения клеточной суспензии каллюсную ткань помещают в сосуд с жидкой питательной средой (приблизительно 2 г ткани на 100 мл среды). Предпочтительно использовать рыхлые каллюсы, которые легко распадаются на кластеры и небольшие агрегаты клеток. Суспензия перемешивается на качалке со скоростью 100-120 об/мин. В отличие от микроорганизмов получить суспензию одиночных клеток растений достаточно сложно. Поэтому примерно через две недели суспензию фракционируют на одиночные клетки, мелкие кластеры и большие агрегаты каллюсных клеток. Проще всего это сделать с помощью отстаивания суспензии в течение 1-2 мин. Крупные агрегаты оседают на дно, а одиночные клетки и мелкие агрегаты клеток остаются в поверхностной фазе. Чтобы удалить из суспензии крупные агрегаты клеток, также используют фильтрование через 1-2 слоя марли, нейлоновые сита.
Улучшить дезагрегацию каллюсных клеток при получении суспензионной культуры клеток можно, предварительно выращивая каллюс на питательной среде без ионов кальция, содержащей в качестве ауксина 2,4-Д. Хороший эффект дает добавление в среду ферментов пектиназы (около 2 мг/л) и целлюлазы (0,01 мг/л). На такой среде суспензию клеток можно получить и непосредственно из эксплантата. Для поддержания деления клеток суспензии в питательной среде должны присутствовать ауксины и цитокинины.
Как и каллюсные культуры, суспензию клеток периодически переносят на свежую питательную среду (пассируют). Для этого суспензию фильтруют через нейлоновое сито и часть объема культуры, содержащего одиночные клетки или мелкие агрегаты - инокулят (англ. inoculum), переносят в стерильных условиях в приготовленную питательную среду. Каждая линия культуры клеток растений характеризуется минимальным объемом инокулята, меньше которого культура не возобновляет рост (чем он меньше, тем лучше линия). Признаками хорошей линии также являются высокая скорость роста в конкретных условиях культивирования, высокая степень дезагрегации (не более 5-10 клеток в группе), морфологическая выравненность клеток (небольшие размеры, сферическая или овальная форма, плотная цитоплазма), отсутствие элементов проводящей системы (трахееподобных элементов).
Рост клеток в суспензионных культурах клеток оценивают по одному или нескольким из следующих параметров:
• объем осажденных клеток (ООК). Переносят небольшой объем суспензионной культуры в мерную пробирку объемом 15 мл, лучше всего коническую; центрифугируют 5 мин при 200 g. ООК - величина, равная отношению объема осадка к объему суспензии, выраженная в %;
• число клеток в единице объема питательной среды подсчитывается в камере Фукса-Розенталя;
• сырая и сухая масса. Суспензия клеток фильтруется через смоченный и взвешенный фильтр, вложенный в воронку Бюхнера под слабым вакуумом. Клетки промывают дистиллированной водой, оттягивают воду под вакуумом и взвешивают снова вместе с фильтром; сухая масса определяется аналогично, но взвешивается сухой фильтр, а клетки сушат вместе с фильтром в термостате при температуре 60 °С до постоянной массы;
• содержание белка. Для определения содержания белка клетки собирают на фильтре из стекловолокна, дважды промывают кипящим раствором 70 % этанола, сушат ацетоном, гидролизуют 1М NaОН при температуре 85 °С в течение 90 мин; затем фильтруют и определяют белок по Лоури;
• проводимость среды определяют с помощью кондуктометра - она обратно пропорциональна массе клеток;
• жизнеспособность клеток оценивают, изучая движение цитоплазмы под микроскопом, а также с помощью окраски прижизненными красителями (0,5 % раствором синего Эванса или 0,01 % раствором флюоресцеиндиацетата): живые клетки не окрашиваются красителями вследствие непроницаемости для них клеточных мембран.
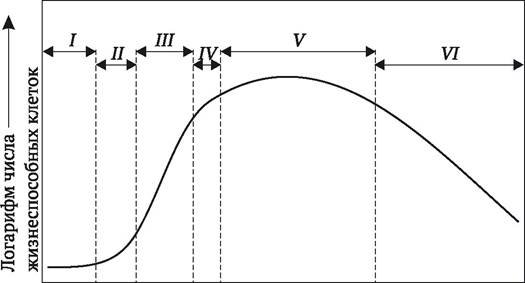
Кривая роста культур клеток имеет 5-образную форму (рис. 3.2). Во время первой, латентной фазы (лаг-фазы) увеличения числа и массы клеток не происходит. Клетки в это время подготавливаются к делениям. Следующая, логарифмическая фаза (экспоненциального роста) характеризуется наибольшей митотической активностью и наибольшим приростом массы клеток. Третья фаза - линейного роста, в которой прирост клеточной массы происходит с постоянной скоростью. Далее наступает фаза замедленного роста и, наконец, ростовая кривая выходит на плато. В этот период интенсивность отмирания каллюсных клеток еще уравновешивается их приростом за счет деления. Однако если не пассировать культуру в этот период на свежую питательную среду, деградация клеток может стать необратимой, и культура погибнет.
Рис. 3.2. Фазы кривой роста суспензионной культуры клеток растений: I - лаг-фаза; II - экспоненциальная фаза; III - фаза линейного роста; IV - фаза замедленного роста; V - стационарная фаза; VI - фаза отмирания
3.6. Культура протопластов растений
Изолированный протопласт - это часть клетки, которая остается после удаления клеточной стенки. Э. Кокинг (E. Cocking, 1960) из Ноттингемского университета предложил метод энзиматического удаления клеточной стенки, который позволяет получать большое количество протопластов, осуществлять их культивирование in vitro. Для удаления клеточной стенки в настоящее время используют целлюлазы, гемицеллюлазы и пектиназы, получаемые из грибов - Myrothecium, Aspergillus, Trichoderma и др., а также из пищеварительного сока улитки Helix pomatia.
Протопласты выделяют из разных тканей растений, клеток каллюсных и суспензионных культур. В целях получения большого числа однотипных протопластов у двудольных используют мезофилл молодых листьев. Наиболее освоены методы изоляции и культивирования протопластов у представителей семейства Solanaceae и отдельных видов Brassica. Трудными объектами для получения протопластов, способных к реализации тотипотентности, являются однодольные растения, в том числе злаки, а также хвойные.
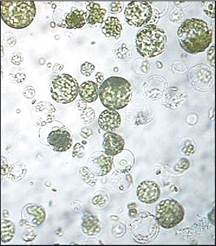
Регуляция водообмена клетки связана с наличием клеточной стенки. Выживание клетки, лишенной клеточной стенки, возможно лишь при создании оптимума осмотических свойств среды выделения и культивирования протопластов. Для этого клетки и выделенные протопласты поддерживают в плазмолизированном состоянии путем внесения 0,3-0,8 М осмотических стабилизаторов: сахаров (маннита, глюкозы, сорбита, ксилозы), ионных осмотиков (CaCl2, KCl). Под действием осмотиков протопласт уменьшается в объеме, принимает сферическую форму (рис. 3.3). Состав и концентрации осмотиков подбираются индивидуально для каждого растительного объекта. Также в зависимости от происхождения растения и взятой для изоляции протопластов ткани подбирается вид ферментов, их комбинация и концентрация. Ниже приведен типичный протокол выделения протопластов из мезофилла листа табака.
Рис. 3.3. Культура протопластов из мезофилла листа табака
Изолированные листья молодых растений стерилизуют в течение 1 мин в 70 % этаноле, а затем в течение 20 мин в 2 % растворе гипохлорита натрия (NaOCl • 5H2O). После промывания листьев стерильной водой у них удаляют нижний эпидермис, крупные жилки и нарезают полосками шириной около 5 мм. Нарезанные фрагменты листьев помещают в чашки Петри в смесь ферментов пектиназы и целлюлазы. Например, для листьев табака используют смесь 0,5 % пектиназы, 2 % целлюлазы и 13 % сорбитола, рН = 5,4. Инкубируют фрагменты листьев в ферментной смеси в термостате 15-18 ч при 25 °С. После этого следует очистка протопластов от остатков клеточных стенок посредством фильтрации через капроновую ткань. Отмывание протопластов от ферментов производится путем трехкратного центрифугирования при 170g по 2 мин. Отмытые протопласты ресуспендируют в культуральной среде, содержащей 13 % маннитола, до концентрации 4 х 105 протопластов в 1 мл. Плотность протопластов должна быть оптимальной для каждой культуры. Суспензию протопластов переносят в чашки Петри с жидкой или агаризованной средой, или культивируют методом микрокапель (будет описан ниже).
Сразу после того, как суспензия протопластов отмыта от раствора ферментов, протопласты начинают регенерировать клеточную стенку. Отмечается появление целлюлозных микрофибрилл, постепенно организующихся в типичную клеточную оболочку. Уже через 2-4 дня протопласты утрачивают сферическую форму, что означает полное восстановление клеточной стенки. Протопласты, не регенерировавшие клеточную стенку, теряют способность к нормальному митотическому делению и образованию клеточных колоний. Такие протопласты или не приступают к делению, или в результате их деления формируются многоядерные структуры, так как кариокинез не сопровождается цитокинезом.
Формирование клеточной стенки не всегда является условием, достаточным для перехода клетки к делению. В зависимости от объекта и условий культивирования к последующему делению может приступить от 0,1 до 80 % восстановивших клеточную стенку протопластов. Первые деления могут происходить через 2-10 дней с начала культивирования протопластов. Образовавшиеся клеточные колонии после переноса на среду для регенерации могут дать начало растениям-регенерантам как обычные каллюсные культуры.
3.7. Культура одиночных клеток и протопластов. Получение колоний из клеточных суспензий
Основное направление использования клеточных суспензий в биотехнологии - производство вторичных метаболитов, многие из которых - ценные лекарственные препараты (это направление будет рассмотрено в гл. 4). Клеточные суспензии также представляют значительный интерес для разделения в пространстве различных клеточных вариантов, присутствующих в культуре клеток, в целях дальнейшего получения из них измененных растений-регенерантов. В отличие от культуры микроорганизмов, высев суспензии клеток на поверхность агаризованной питательной среды не всегда позволяет получить отдельные колонии от отдельных клеток растений. Трудности связаны с тем, что единичные клетки или даже относительно большое количество клеток растений в сильно разведенной суспензии при высеве на агаризованную питательную среду теряют способность к делению, оставаясь при этом живыми. То же происходит и в суспензии клеток, если при ее пассировании инокулят меньше определенного минимального объема, т. е. при слишком большом разведении суспензии. Для достижения положительного результата необходимо использовать специальные методы культуры одиночных клеток. Они особенно актуальны для культуры протопластов, в частности, для получения колоний и дальнейшей регенерации растений соматических гибридов (в случае визуального отбора под микроскопом гибридных протопластов, см. гл. 8).
Наибольшее распространение получила методика «плэйтинга» (высева), предложенная Л. Бергманном (L. Bergmann, 1960). В качестве исходного материала используют хорошо растущую суспензию клеток растений в концентрации в два раза большей, чем предполагается получить при высеве на агаризованную питательную среду. Предварительно суспензию фильтруют через нейлоновый фильтр, чтобы в ней остались единичные клетки или мелкие клеточные агрегаты. Готовят 0,6-1 % агаровую среду того же состава, который был использован для поддержания роста суспензии, нагревают среду для растворения агара и после ее охлаждения до температуры 35 °С перемешивают с равным количеством клеточной суспензии. Смесь разливают в чашки Петри слоем около 1 мм, чашки заклеивают парафильмом (специальной эластичной пленкой, которая предохраняет чашки от контаминации, обеспечивая при этом нормальный воздухообмен). С помощью инвертированного микроскопа определяют местоположение отдельных клеток, которое отмечают маркером на крышках чашек. Проводят культивирование в термостате, периодически наблюдая под микроскопом деление клеток, используя сделанные метки.
Для успешного деления клеток растений в суспензии или при высеве на агаризованную питательную среду важное значение имеет фактор кондиционирования. Было высказано предположение, что интенсивно делящиеся клетки выделяют в питательную среду какие-то вещества (фактор кондиционирования), которые оказывают стимулирующее воздействие на деление соседних клеток. При небольшом количестве клеток на единицу объема питательной среды концентрация таких веществ недостаточна для индукции деления. В экспериментах Л. Бергманна около 20 % одиночных каллюсных клеток табака делилось и образовывало колонии. Это объясняют тем, что при использовании описанной методики на агаризованную среду высевают не только одиночные клетки, но и мелкие кластеры. Деление клеток кластеров может сопровождаться выделением в среду кондиционирующих факторов, которые стимулируют деление одиночных клеток.
Химическая природа и механизм действия кондиционирующего фактора пока не выяснены. Установлено, что он термолабилен, содержит низкомолекулярную фракцию и не может быть заменен фитогормонами. Есть основание полагать, что это не одно какое-то вещество, а комплекс веществ, выделяемых клетками.
Для кондиционирования питательной среды при культивировании одиночных клеток предложено несколько методов. Самый простой из них - добавление в среду для культуры клеток питательной среды от интенсивно растущей клеточной суспензии в фазу экспоненциального роста (после фильтрации через мелкий фильтр). Для кондиционирования среды можно также использовать «кормящий слой» - агаризованный слой-подложку облученных клеток, утративших способность к делениям, но способных поддерживать рост других клеток (D. Raveh, E. Galun, 1975).
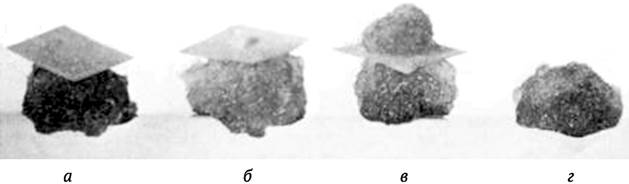
W. H. Muir и другие (1954) предложили метод культуры-«няньки». На поверхность интенсивно растущего каллюса помещают фильтровальную бумагу, на которую наносят суспензию, содержащую преимущественно одиночные клетки. Образовавшиеся на фильтровальной бумаге колонии можно далее перенести на агаризованную питательную среду (рис. 3.4). Можно поступить проще: на поверхность агаризованной среды, на которой расположено несколько интенсивно растущих каллюсов, высевают суспензию клеток тонким слоем. Как правило, раньше начинают делиться и образовывать колонии клетки, которые располагаются в непосредственной близости от каллюсных культур.
Рис. 3.4. Стадии роста клеточной культуры при использовании для ее получения «культуры-няньки»: а - единичные клетки помещены на фильтровальную бумагу поверх интенсивно растущей каллюсной культуры; б - начало формирования новой колонии клеток; в - активно растущая новая колония клеток; г - вновь полученная колония, готовая для высадки на искусственную питательную среду
Некоторые исследователи считали, что одиночные клетки в суспензии можно индуцировать к делению, если использовать питательные среды, обогащенные разными витаминами, аминокислотами, сахарами или растительными экстрактами (кокосовым молоком, гидролизатом казеина). Для некоторых культур эти подходы дали неплохие результаты, однако их круг оказался весьма ограниченным. Так, обогащенная питательная среда 8р Као - Михайлюка (K. N. Kao, M. R. Мichayluk, 1975) давала хорошие результаты при культивировании лишь разведенных суспензий протопластов бобов и сои, однако она не позволяла культивировать единичные протопласты.
M. Caboche (1980) показал, что если мезофильные протопласты табака в течение первых нескольких дней культивировать на питательной среде, содержащей высокие концентрации ауксина, а затем перенести на среду с пониженным его содержанием, то клетки оказывались способны к делениям даже при плотности высева 1-2 клетки/мл.
Другой возможный подход состоит в предельном уменьшении объема питательной среды при культивировании единичных клеток: в результате отношение объема клетки к объему питательной среды получается таким же, как и в обычных культурах при небольшом разведении. Для этого используются специальные приспособления. L. E. Jones и другие (1960) предложили для культивирования одиночных клеток использовать специальную микрокамеру, которую несложно получить следующим образом. На предметное стекло с помощью парафинового масла на небольшом расстоянии друг от друга наклеивают два покровных стекла, между ними наносят квадрат из парафинового масла и в него помещают каплю кондиционированной питательной среды с изолированной клеткой. Сверху кладут покровное стекло, которое двумя
краями опирается на покровные стекла. В результате под этим стеклом остается полость, в которой проходит культивирование клетки. Подсыхание питательной среды не происходит, так как камера изолирована от окружающей среды парафиновым маслом, при этом возможен воздухообмен. За делением клетки можно наблюдать под микроскопом. Когда колония станет достаточно большой, ее переносят на свежую питательную среду (жидкую или агаризованную). Используя описанную выше методику, В. Вазил и А. Хильдебрандт (1965) смогли получить не только колонию от единичной клетки, но и регенерировали из каллюса нормальное цветущее растение табака. При этом в отличие от L. E. Jones они использовали свежую питательную среду, обогащенную пантотенатом кальция и кокосовым молоком.
Ю. Ю. Глеба (1978) разработал метод культивирования протопластов в микрокаплях питательной среды объемом до 1 мкл. В микрокаплях такого объема, если в них находится лишь одна клетка, отношение объема клетки к объему питательной среды такое же, как в макрокультуре с плотностью 103 клеток/мл. Этот метод нашел широкое применение для механической изоляции с помощью микроманипулятора единичных слившихся протопластов, последующего их клонирования и регенерации растений соматических гибридов.
Опыты по получению растений-регенерантов при культивировании единичных соматических клеток растений предоставили прямое доказательство гипотезы Г. Габерландта о тотипотентности растительной клетки.
3.8. Тотипотентность растительных клеток
В отличие от животных, у которых клеточная дифференциация необратима, у растений даже дифференцированные зрелые клетки специализированных тканей сохраняют способность к возврату в меристематическое состояние (при условии, что у них имеется жизнеспособное ядро и мембранная система). При определенных условиях (in vivo или в культуре in vitro) дедифференцированные клетки могут дифференцироваться, что позволяет регенерировать ткани, органы или даже целое растение. Способность отдельных клеток растений менять программу развития, претерпевать дедифференцировку, вторичную дифференцировку и, в результате, давать начало целому растению, т. е. реализовать заключенную в них генетическую информацию, получило название тотипотентности (от лат. totus - весь, целый и potentia - сила).
В природе свойство тотипотентности клеток обеспечивает растениям возможность заживления ран (с участием быстро делящихся недифференцированных клеток каллюса), а также вегетативного размножения. У разных видов растений это свойство выражено в разной степени: сильнее у двудольных, слабее - у однодольных. Имеются существенные различия и в тотипотентности клеток разных тканей растений (наиболее тотипотентны эмбриональные и меристемные ткани).
Разработка методов культуры клеток растений in vitro дала возможность реализовать тотипотентность даже тех клеток, у которых она в растении практически не выражена, например, микроспор. Первоначально считалось, что это свойство при создании определенных условий культивирования реализуется любой растительной клеткой. Однако в настоящее время экспериментально доказано, что даже у отзывчивых к культуре in vitro видов растений не каждая клетка эксплантата тотипотентна. Тем не менее именно применение методов культуры клеток растений позволяет целенаправленно индуцировать дедифференциацию и вторичную дифференциацию клеток многих видов растений, что дает возможность значительно расширить возможности использования свойства тотипотентности растительной клетки в практической деятельности.
3.9. Вторичная цитодифференцировка: гистогенез, органогенез, эмбриогенез
Развитие клетки специализированной ткани после ее дедифференцировки в каллюсную может проходить в следующих направлениях:
✵ клетка претерпевает вторичную дифференцировку и прекращает делиться, т. е. превращается в дифференцированную каллюсную клетку. Это нормальный цикл развития каллюсной клетки, заканчивающийся ее старением и отмиранием;
✵ стойкая дедифференцировка каллюсной клетки, приобретение ею способности расти на среде без гормонов, т. е. превращение в опухолевую (свойственно некоторым клеткам старых пересадочных культур);
✵ вторичная дифференцировка, сопровождающаяся гистогенезом (образованием в каллюсе различных тканей) или морфогенезом (возникновением организованных структур). Гистологическая дифференцировка каллюсных клеток может приводить к образованию млечников, волокон, трихом, элементов сосудистой системы - трахей и трахеид ксилемы, ситовидных трубок и клеток-спутниц флоэмы. Морфогенез проходит в виде органогенеза или соматического эмбриогенеза. Органогенез - это регенерация в культуре клеток in vitroотдельных органов растения: стеблей, корней, реже - флоральных элементов, зачатков листьев. Соматический эмбриогенез - образование эмбриоидов, т. е. структур, напоминающих зиготические зародыши. Явление соматического эмбриогенеза впервые было обнаружено Ф. Стюардом и другими (1958) и Й. Райнертом (1959) при культивировании суспензии клеток растений. Однако позднее было установлено, что формирование эмбриоидов может происходить и в каллюсной культуре, при культивировании пыльников и в других случаях. Органогенез и соматический эмбриогенез могут иметь место не только в культуре клеток, но и в растениях in vivo (пример - адвентивная полиэмбриония у цитрусовых), а также в культуре in vitro непосредственно из эксплантата (прямой морфогенез).
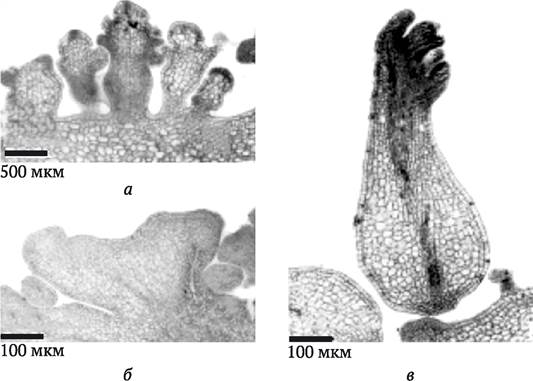
С практической точки зрения наибольший интерес представляют стеблевой органогенез и соматический эмбриогенез, которые позволяют регенерировать из культуры клеток или непосредственно из эксплантата целое растение. В результате стеблевого органогенеза образуется однополярная структура, содержащая апикальную меристему стебля. При этом формирующийся стебель сохраняет контакт с помощью сосудистой системы с материнской тканью (рис. 3.5, а, б). Образовавшиеся в культуре клеток проростки можно укоренить (invitro или in vivo) и получить таким образом целое растение. В результате соматического эмбриогенеза формируется двуполярная структура (эмбриоид), которая содержит как стеблевую, так и корневую меристему (рис. 3.5, в). Эмбриоиды не имеют сосудистого сообщения с материнскими тканями. В культуре in vitro при определенных условиях эмбриоиды также способны развиться в растение.
Рис. 3.5. Морфогенные структуры Melia azedarach: а и б - однополярные структуры, содержащие апикальные меристемы и сохраняющие связь с сосудистой системой материнской ткани (органогенез; при разном увеличении); в - двуполярная структура с зачатками стебля и корневой системы (эмбриоид), не имеющая сообщения с материнской тканью (по S. Vila и др., 2010)
Уже в начале 1990-х гг. сообщалось, что растения-регенеранты были получены в культуре клеток более чем 1000 видов растений. В результате установлены общие закономерности в протекании этого процесса. У двудольных растений легче, чем у однодольных, добиться не только каллюсообразования из эксплантатов, но и морфогенеза (органогенеза или эмбриогенеза) из каллюса. Среди двудольных более высокую регенерационную способность имеют виды, относящиеся к пасленовым, крестоцветным, зонтичным, а пониженную - к бобовым. Наиболее низкую регенерационную способность имеют злаковые культуры. В рамках отдельных видов имеются генотипы с относительно высокой и низкой способностью к морфогенезу.
На способность изолированных растительных клеток к морфогенезу оказывают влияние различные факторы, связанные как с самим растением, так и условиями культивирования. Большое значение имеет возраст растения (особенно для древесных культур и злаковых), его физиологическое состояние, состояние здоровья растения, условия, в которых оно выращивалось, а также часть растения (орган), из которого берется эксплантат, физиологический и онтогенетический возраст органа, время года, когда производится эксплантация, размер эксплантата и даже его ориентация и степень погружения при помещении на питательную среду. Наиболее высокую регенерационную способность имеют, как правило, клеточные культуры, полученные из эксплантатов, происходящих от молодых здоровых растений из эмбриональных (зрелые или незрелые зародыши) или меристематических тканей. В процессе субкультивирования регенерационная способность культуры клеток постепенно снижается (сначала к стеблевому органогенезу, позднее к корневому) и во многих случаях утрачивается. Гормононезависимые культуры и культуры опухолевых клеток, как правило, не способны к регенерации органов и формированию эмбриоидов. Если стеблевые зачатки и формируются, то они чаще всего имеют неправильную форму, получить из них здоровое растение не удается.
Из факторов, связанных с культивированием клеток растений, наибольшее значение для морфогенеза имеет состав питательной среды, в особенности состав и соотношение фитогормонов (регуляторов роста), ее консистенция (жидкая или агаризованная), а также условия культивирования: температура, выращивание в темноте или с освещением, характер освещения (спектральные характеристики света, интенсивность освещения и длина фотопериода), использование стрессовых воздействий на культуры (например, перепад температур), воздействие на культуры электрическим током и другие.
3.10. Индукция морфогенеза. Гормоны — индукторы морфогенеза
Под влиянием того или иного стимула морфогенеза каллюс- ная клетка становится детерминированной, т. е. определившей путь, по которому будет проходить ее развитие. Однако не все клетки, а лишь одна из 400-1000 становится на путь вторичной дифференцировки, приводящей к морфогенезу. Следовательно, для перехода к морфогенезу недостаточно индуктора (стимула), а необходимо, чтобы клетка была готова к ответу на него. Способность воспринимать индуцирующее воздействие и специфически реагировать на него изменением программы развития называют компетентностью клетки.
Наиболее мощным индуктором органогенеза, который принято называть стимулом или сигналом морфогенеза, является изменение соотношения между концентрациями цитокининов и ауксинов, входящими в состав питательных сред. В своей ставшей классической статье Ф. Скуг и К. Миллер (1957) показали, что при культивировании каллюса, полученного из паренхимы стебля табака на питательной среде, содержащей ауксин (ИУК) и цитокинин (кинетин) приблизительно в равных молярных концентрациях, имеет место интенсивная пролиферация клеток, при преобладании цитокининов над ауксинами часто начинается стеблевой органогенез, а в случае преобладания ауксинов - корневой (рис. 3.6).
Рис. 3.6. Стеблевой и корневой органогенез в культуре клеток табака в зависимости от соотношения в питательной среде концентраций ауксинов (индолил уксусная кислота, ИУК) и цитокининов (кинетин)
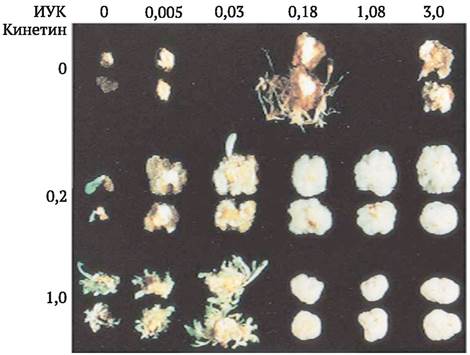
Использование экзогенных гормональных препаратов до настоящего времени является одним из основных подходов для получения растений-регенерантов у разных видов растений. При этом значительно расширился круг применяемых ауксинов и цитокининов и их аналогов, вошли в обиход для этих целей и другие регуляторы роста: гиббереллин, абсцизовая кислота, этилен. Выяснилось, что установленная Ф. Скугом и К. Миллером закономерность во многих случаях не соблюдается. Так, обнаружены виды, например, люцерна, у которых, в отличие от табака, преобладание ауксинов над цитокининами приводит к стеблевому органогенезу. Это объясняют различным уровнем эндогенных фитогормонов в тканях эксплантата, различной чувствительностью к регуляторам роста компетентных каллюсных клеток. Следовательно, в каждом конкретном случае для эффективной индукции морфогенеза и получения растений-регенерантов необходимо искать оптимальное соотношение фитогормонов, максимально учитывать другие факторы, которые могут оказывать влияние на этот процесс, их возможное взаимодействие.
Органогенез в каллюсной ткани начинается с того, что под влиянием соответствующих воздействий (прежде всего при изменении соотношения концентраций ауксинов и цитокининов в питательной среде) компетентная клетка или группа компетентных клеток обособляются от окружающих их каллюсных клеток, образуя зоны повышенной митотической активности - так называемые меристемоиды (J. G. Torrey, 1966) (иногда используется термин «инициаль»). Меристемоиды обычно располагаются в нижней части каллюса, вблизи трахееподобных элементов, что обеспечивает контакт с питательной средой и восприятие гормонального стимула. Клетки меристемоидов отличаются от остальных каллюсных клеток небольшими размерами, имеют изодиаметрическую форму, тонкие стенки, многочисленные мелкие вакуоли. Крупное ядро обычно занимает центральное положение. В дальнейшем в меристематическом очаге дифференцируются зачатки стебля, корня, листа или цветочной почки и соответственно происходит стеблевой, корневой, листовой или флоральный органогенез (рис. 3.7). Формированию меристемоидов предшествует аккумуляция крахмала в зонах их расположения. Сам процесс органогенеза характеризуется значительными затратами энергии (усиление гликолиза и пентозофосфатного пути окисления углеводов). Показано, что морфогенез в культуре каллюсных тканей табака характеризуется включением и выключением синтеза определенных белков-маркеров. Индуцированная детерминация клеток каллюсной ткани сопряжена с появлением в ней антигена - маркера клеток меристемы стебля.
Рис. 3.7. Внешний вид и стадии развития почковидного меристемоида, формирующегося в культуре in vitro листового эксплантата Sclerocarya birrea (а-г) (по M. Moyo и др., 2009); анатомическое строение меристемоида, развивающегося в культуре in vitro листового эксплантата Passiflora edulis (д и е) (по B. Gloria и др., 1999): а - внешний вид меристемоида (тонкая стрелка) и побегоподобной структуры (жирная стрелка), формирующихся в культуре листового эксплантата; б - электронная микрофотография глобулярной стадии развития меристемоида; в - электронная микрофотография кластера начинающих дифференцироваться меристемоидов, стрелка указывает на одну из закладывающихся вегетативных почек; г - микрофотография сформировавшейся вегетативной почки с дифференцированной стеблевой апикальной меристемой (А) и листовыми примордиями (L); д и е - гистологический срез листового эксплантата Passiflora edulis на 21 (д) и 28 (е) день культивирования эксплантата на питательной среде Мурасиге - Скуга с добавлением 1 мг/л нафтилуксусной кислоты; стрелкой показано место формирования корневого меристемоида, формирующегося в сосудистой системе листового эксплантата

Для индукции соматического эмбриогенеза обычно необходимо присутствие в питательной среде ауксина (чаще всего это 2,4-Д). Считается, что ауксин, а также другие индукторы эмбриогенеза (например, электрическое поле), применяемые для индукции соматического эмбриогенеза, изменяют полярность компетентных клеток, что приводит к появлению градиентов эндогенного ауксина, биоэлектрических потенциалов и кальция. Кроме того, в клетках происходит перестройка элементов цитоскелета, которая связана с их поляризацией и последующими асимметричными делениями. Именно мелкие дочерние клетки, образовавшиеся в результате асимметричного деления, являются эмбриогенными (детерминированными к эмбриогенезу). Предетерминированные эмбриогенные клетки могут также изначально присутствовать в тканях эксплантата, что позволяет получать соматические эмбриоиды непосредственно из клеток эксплантата (прямой соматический эмбриогенез) (рис. 3.8) или получать из таких эксплантатов «эмбриогенный каллюс», из которого несложно получить большое количество эмбриоидов (рис. 3.9).
Рис. 3.8. Соматический эмбриогенез из листового эксплантата Coffea canephora Pierre (по M. Priyono и др., 2010)
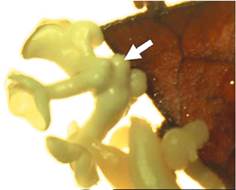
Рис. 3.9. Соматический эмбриогенез из каллюса винограда (www.itg.beckman.illinois.edu)

Эмбриогенные клетки отличаются от остальных каллюсных клеток малыми размерами, угловатой формой, более плотной цитоплазмой, мелкими вакуолями (около 30 % объема клетки), множеством крахмальных зерен. Они имеют крупное ядро и большое количество рибосом. Микротрубочки у них имеют линейную ориентацию параллельно оси клетки. Между эмбриогенными клетками восстанавливаются плазмодесмы, которые практически отсутствуют в массе каллюсных клеток.
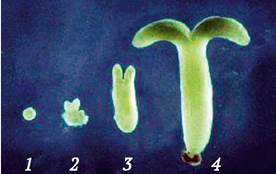
В результате деления эмбриогенных клеток формируется глобулярный проэмбрио. Условием его дальнейшего развития является перенос культур на питательную среду, содержащую пониженные концентрации ауксинов, или на полностью безгормональную среду. Устранение из питательной среды дедифференцирующего фактора (ауксина) приводит к тому, что проэмбрио превращается в глобулярный зародыш, который далее проходит стадии, характерные для развития зиготических зародышей: «сердечко», «торпедо», зрелый соматический эмбриоид (рис. 3.10). Соматические эмбриоиды имеют как стеблевые, так и корневые меристемы. Из стеблевого апекса формируется проросток. «Корневой» конец эмбриоида, как правило, направлен в сторону каллюса, в который «прорастают» образующиеся корни и откуда формирующееся растение получает необходимые элементы питания.
Рис. 3.10. Стадии гистодифференциации соматических эмбриоидов сои: 1 - глобулярный зародыш; 2 - «сердечко»; 3 - «торпедо»; 4 - зрелый соматический эмбриоид
(www.parrotlab.uga.edu)
Сравнительный анализ развития соматических и половых зародышей позволяет говорить о параллелизме их развития, который проявляется в основных закономерностях морфогенеза: биполярности, симметрии, клеточной и тканевой дифференциации. Изолировано несколько генов, которые экспрессируются в ходе соматического эмбриогенеза. Они классифицированы на три категории: 1) гены, вовлеченные в процесс деления клеток (21D7 и СЕМ1); 2) гены, связанные с формированием органов зародыша (СAR3, СAR4 и СНВ4 - с формированием гипокотиля; СAR5, СAR6 и СНВ - с формированием гипокотиля и/или корней на стадии глобулярного зародыша и «торпедо»); 3) эмбрио-специфические гены (СНВ2 и СЕМ6) (Л. Коmamine, 2001).
3.11. Получение растений-регенерантов
Индукция стеблевого органогенеза или соматического эмбриогенеза позволяет получить растения-регенеранты. Посредством стеблевого органогенеза растения регенерируют из каллюсных культур, а также из клеток эксплантата: путем индукции адвентивных почек или из пазушных почек стеблевых черенков. Адвентивные (придаточные) почки образуются у интактных растений не на верхушке побега или в пазухе листа, а на различных органах растения (корнях, листьях, стеблях). При этом они не связаны с апикальными меристемами, а формируются из различных тканей, как поверхностных, так и глубоко расположенных. Использование культуры клеток позволяет получать адвентивные побеги из эксплантатов листа, клубня, стебля и других частей растения в больших количествах. То же относится к индукции побегов из пазушных почек стеблевых эксплантатов. Получение растений-регенерантов из пазушных и адвентивных почек - основные методы вегетативного (клонального) размножения растений in vitro. Образовавшиеся из почек побеги отделяют от эксплантата, укореняют на питательной среде с ауксинами (или без регуляторов роста), затем переносят в условия in vivo, где из них выращивают взрослые растения.
Соматический эмбриогенез индуцируют в суспензионной культуре клеток, у каллюсных культур, в культуре пыльников. Образовавшиеся эмбриоиды переносят на питательную среду без гормонов, где при культивировании на свету из эмбриоидов развиваются пробирочные растения, которые после подращивания высаживают в грунт. Соматический эмбриогенез также представляет интерес для клонального размножения растений. Подробно методы клонального размножения растений in vitro будут рассмотрены в гл. 5.
Заключение
Клетки формирующегося зародыша растений являются недифференцированными. Они интенсивно делятся и могут давать начало различным тканям и органам растения. В процессе дифференциации клетки становятся специализированными; при этом они теряют способность к делению. Лишь клетки меристем сохраняются в эмбриональном состоянии. Однако у растений при определенных условиях, например, при поранении, могут возникать новые, вторичные меристемы. Раневые меристемы дают начало каллюсу - особой ткани, состоящей из недифференцированных паренхимных клеток, которые, интенсивно делясь, покрывают место поранения. В процессе их вторичной дифференцировки происходит восстановление поврежденных тканей и органов.
Процесс каллюсообразования и регенерации тканей, органов и целого растения из дифференцированных специализированных клеток может быть воспроизведен в культуре клеток растений на искусственных питательных средах, содержащих определенные фитогормоны или регуляторы роста. Процесс дедифференциации специализированных клеток индуцируют ауксины. Однако для того, чтобы дедифференцированные клетки начали делиться, необходимы цитокинины. Начальное условие в этом процессе - дедифференцировка: утрата специализации клеток ткани и восстановление их способности к делению. В результате дедифференцировки происходит существенное изменение метаболизма клеток. Клетки эксплантатов теряют запасенные липиды, крахмал, белки. Фотосинтезирующие клетки утрачивают хлорофилл и липиды хлоропластов. При этом возрастает количество амилопластов, разрушается аппарат Гольджи, перестраивается эндоплазматический ретикулюм и элементы цитоскелета. Энергетический метаболизм каллюсных клеток в значительной мере напоминает таковой у клеток меристемы. Митохондрии у них слабо развиты, в них мало крист, что оказывает негативное влияние на активность аэробного дыхания. Они потребляют меньше кислорода по сравнению со специализированными клетками растения. У них происходит сдвиг соотношения между дыханием и брожением в сторону брожения.
В отличие от меристемных клеток, для которых характерны высокая однородность и генетическая стабильность, рост каллюсных клеток, их вторичная дифференцировка происходят неорганизованно и асинхронно. В каллюсной ткани одновременно присутствуют клетки, находящиеся на разных стадиях митотического цикла. Культура каллюсных тканей характеризуется цитогенетической нестабильностью: изменением плоидности клеток, появлением хромосомных аберраций и точковых мутаций.
Деление клеток в культуре in vitro требует присутствия в питательной среде фитогормонов или синтетических регуляторов роста. Однако при длительном культивировании могут возникать клетки со стойкой дедифференциров- кой, характерной особенностью которых является гормононезависимость. Гормононезависимостью характеризуются и культуры опухолевых клеток корончатого галла. Установлено, что это заболевание вызывают агробактерии, которые способны трансформировать клетки растений путем переноса и встраивания в их геном фрагментов ДНК бактерий, несущих гены, кодирующие биосинтез ауксинов и цитокининов.
В процессе культивирования клетки могут сохранять стойкую дедифференцировку либо претерпевать вторичную дифференцировку, сопровождающуюся гистогенезом (образованием в каллюсе различных тканей) или морфогенезом (возникновением организованных структур). Морфогенез проходит в виде органогенеза или соматического эмбриогенеза. Органогенез - это регенерация в культуре клеток in vitro отдельных органов растения: стеблей, корней, реже - флоральных элементов, зачатков листьев. Соматический эмбриогенез - образование эмбриоидов, т. е. структур, напоминающих зиготические зародыши. Как органогенез, так и соматический эмбриогенез могут иметь место не только в культуре клеток, но и в растениях in vivo, а также в культуре in vitro непосредственно из эксплантата (прямой морфогенез).
Способность отдельных клеток растений менять программу развития, претерпевать дедифференцировку, вторичную дифференцировку и в результате давать начало целому растению, т. е. реализовать заключенную в них генетическую информацию, получила название тотипотентности.
Наиболее мощным индуктором органогенеза является изменение соотношения между концентрациями цитокининов и ауксинов, входящими в состав питательных сред. Ф. Скуг и К. Миллер показали, что при культивировании каллюса на питательной среде, содержащей ауксин и цитокинин приблизительно в равных молярных концентрациях, имеет место интенсивная пролиферация клеток, при преобладании цитокининов над ауксинами часто начинается стеблевой органогенез, а в случае преобладания ауксинов - корневой. Органогенез в каллюсной ткани начинается с того, что под влиянием соответствующих воздействий (прежде всего при изменении соотношения концентраций ауксинов и цитокининов в питательной среде) компетентная клетка или группа компетентных клеток обособляются от окружающих их каллюсных клеток, образуя зоны повышенной митотической активности - меристемоиды. В дальнейшем в меристематическом очаге дифференцируются зачатки стебля, корня, листа или цветочной почки и соответственно происходит стеблевой, корневой, листовой или флоральный органогенез.
Для индукции соматического эмбриогенеза обычно необходимо присутствие в питательной среде ауксина (чаще всего это 2,4-Д). Считается, что ауксин изменяет полярность компетентных клеток, что приводит к последующим асимметричным делениям. Мелкие дочерние клетки, образовавшиеся в результате асимметричного деления, являются эмбриогенными (детерминированными к эмбриогенезу). В результате деления эмбриогенных клеток формируется глобулярный проэмбрио. Условие его дальнейшего развития - перенос культур на питательную среду, содержащую пониженные концентрации ауксинов, или на полностью безгормональную среду.
В результате стеблевого органогенеза образуется однополярная структура, содержащая апикальную меристему стебля. Образовавшиеся в культуре клеток проростки можно укоренить (in vitro или in vivo) и получить таким образом целое растение. В результате соматического эмбриогенеза формируется двуполярная структура (эмбриоид), которая содержит как стеблевую, так и корневую меристему. В культуре in vitro при определенных условиях эмбриоиды также способны развиться в растение.
Основные типы культуры клеток растений - каллюсная (культивирование производится на агаризованной питательной среде), суспензионная (глубинное культивирование на жидких средах при искусственной аэрации культур) и культура протопластов (культура клеток, лишенных целлюлозной оболочки). Суспензионную культуру легче всего получить из каллюсной. Клетки, культивируемые в суспензии, можно высеять на агаризованную питательную среду, чтобы получить каллюсную культуру. Протопласты до восстановления клеточной стенки, начала клеточных делений и образования колоний культивируют на жидких питательных средах, затем колонии переносят на агаризованную питательную среду и получают каллюсную культуру. Индукцию морфогенеза и получение растений-регенерантов чаще всего производят из каллюсной культуры клеток.
Разработаны методы культивирования единичных клеток и протопластов, основанные на кондиционировании питательных сред, оптимизации их состава и применении приемов культивирования клеток в малых объемах питательной среды. Опыты по получению растений-регенерантов при культивировании единичных соматических клеток растений предоставили прямое доказательство гипотезы Г. Габерландта о тотипотентности растительной клетки. Эти методы имеют большое практическое значение для разделения в пространстве различных клеточных вариантов (клеточных линий), присутствующих в культуре клеток, дальнейшего получения из них измененных растений-регенерантов (мутантов, соматических гибридов).
Контрольные вопросы
1. Чем вторичные меристемы отличаются от первичных?
2. Какие фитогормоны индуцируют переход специализированной клетки растений к дедифференцировке?
3. Какие изменения в структуре и метаболизме клеток происходят при де- дифференцировке?
4. В чем заключаются различия в гормононезависимости «привыкших» и опухолевых клеток растений?
5. По каким параметрам оценивают интенсивность роста и жизнеспособность клеток суспензионных культур?
6. Для какой цели вводят в питательную среду осмотики при получении протопластов?
7. Какие основные подходы используют для индукции делений и получения растений-регенерантов в культуре единичных клеток и протопластов?
8. В какой форме может проходить вторичная дифференцировка в культуре клеток растений?
9. Какие основные факторы индуцируют переход клеток к органогенезу в культуре in vitro?
10. Опишите процессы, происходящие при соматическом эмбриогенезе в культуре клеток растений.
11. Чем отличаются проростки, регенерированные в культуре клеток с помощью стеблевого органогенеза и соматического эмбриогенеза?