БІОТЕХНОЛОГІЯ - В. Г. Герасименко - 2006
Частина І. Загальна біотехнологія
Розділ 3. ОСНОВИ МОЛЕКУЛЯРНОЇ БІОЛОГІЇ
3.1. НУКЛЕЇНОВІ КИСЛОТИ
3.1.2.Структура нуклеїнових кислот
Первинна структура. Залишки нуклеотидів у полінуклеотидному ланцюзі з’єднані фосфодіефірними зв’язками між 5'-ОН-групою пентози одного нуклеотиду і З'-ОН-групою пентози іншого нуклеотиду. При скороченому зображенні формул НК вуглеводний компонент має вигляд вертикальних ліній, над якими знаходяться символи азотистих основ. Іноді обмежуються позначенням приналежності азотистих основ до пуринів (Пу, Рu) чи піримідинів (Пі, Ру). Фосфодіефірні зв’язки між залишками сусідніх нуклеотидів мають вигляд косих ліній, посередині яких знаходиться хімічний знак фосфору (Р):
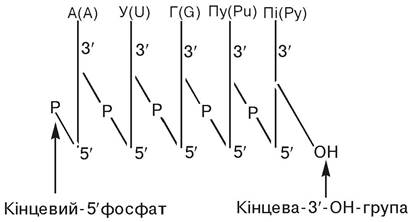
У таких і ще більш скорочених формулах полінуклеотидів 5/-кінець нуклеотидного залишку прийнято розташовувати ліворуч:
![]()
чи
![]()
Гідроліз полінуклеотидного з’єднання приведе до утворення гуанілової кислоти як кінцевого нуклеотида з вільним фосфатом у 5'-кінці і вільного аденозину в 3'-кінці.
Послідовність розташування чи порядок чергування залишків мононуклеотидів у полінуклеотидному ланцюзі визначає первинну структуру ДНК і РНК. В утворенні первинної структури беруть участь глікозидний зв’язок, що з’єднує азотисті основи з пентозою, ефірний зв’язок між рибозою чи дезоксирибозою і фосфорною кислотою та фосфодіефірний зв’язок між нуклеотидами. Усі ці зв’язки ковалентні, досить міцно стабілізують первинну структуру. При цьому встановлено, що нуклеотиди в полінуклеотидні ланцюги зв’язані в ДНК і РНК за допомогою 3', 5'-фосфодіефірних зв’язків. Послідовність нуклеотидів у полінуклеотидному ланцюзі ДНК подається у вигляді різних варіантів схем:
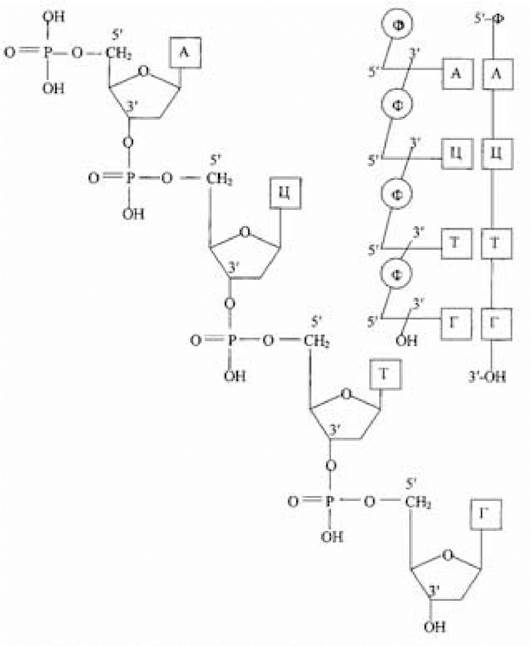
Взаємодії між пурин-піримідиновими парами основ, що забезпечують зв’язок поліпептидних ланцюгів у ДНК, представлені на рис. 3.1. Розгалужень у поліпептидному ланцюзі ДНК не виявлено.
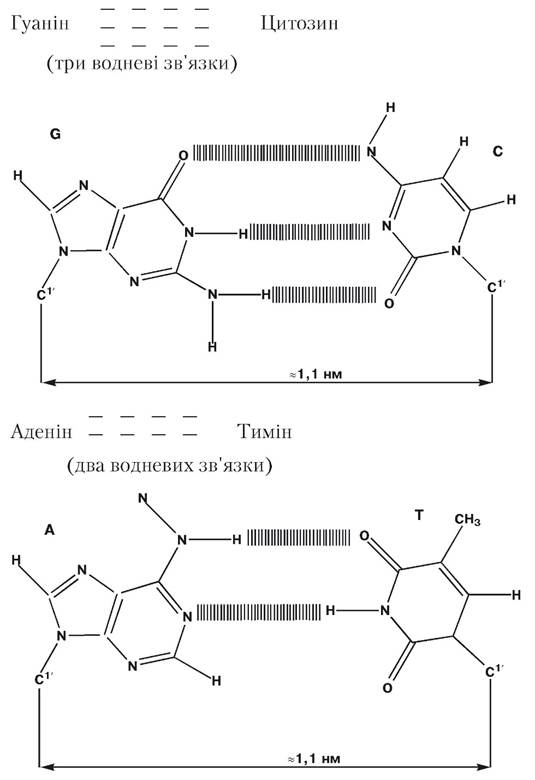
Рис. 3.1. Пурин-піримідинові пари основ у ДНК
(за Бохінські Р., 1986)
Питання щодо встановлення первинної структури ДНК пов’язано з величезними труднощами, які полягають у тому, що молекулярна маса навіть найменших молекул ДНК обчислюється мільйонами дальтон. З огляду на це за ініціативою і участю СРСР і США у 1988 році було розпочато виконання важливої Міжнародної програми «Геном людини», кінцевою метою якої стало визначення повної генетичної карти людини і розшифрування нуклеотидних послідовностей не тільки в екзонних, але й в інтронних фрагментах ДНК. У 2001 році, але вже без участі СРСР, який на цей час припинив своє існування, вперше було опубліковано відомості про первинну структуру ДНК людини. У вирішенні цього питання брали участь тисячі науковців з більш ніж 20 країн світу. Вони встановили, що у 23-х парах хромосом ядра соматичної клітини людини знаходяться близько 3,2 млрд. мононуклеотидних пар, не враховуючи нуклеотидний склад мітохондрій. Цікавим є повідомлення про те, що загальна довжина ДНК у ядрах всіх клітин людини досягає астрономічної величини -1011 км, що майже в 1000 разів перевершує відстань від Землі до Сонця.
Вторинна структура. При вивченні хімічного складу нуклеїнових кислот були встановлені значні розходження у відносному вмісті азотистих основ у різних ДНК, однак молярне співвідношення між аденіном і тиміном, а також між цитозином і гуаніном у всіх досліджених ДНК залишалося рівним приблизно 1:1, тобто число залишків аденіну дорівнює числу залишків тиміну, а число залишків гуаніну — числу залишків цитозину. На основі цих даних Чаргаффом Є. (1950) була висунута концепція про спарювання основ у ДНК, чи правило комплементарності, відповідно до якого азотисті основи взаємодіють між собою при біосинтезі молекул ДНК у будь-яких організмах: аденін — з тиміном, а гуанін — з цитозином.
Франклін Р. та Уілкінс М. методом рентгеноструктурного аналізу одержали дані, з яких випливало, що молекули ДНК, напевно, мають будову спіралі, що складається з декількох ланцюгів.
Модель ДНК у вигляді подвійної спіралі була запропонована в 1953 р. Уотсоном Дж. та Кріком Ф. на підставі аналізу отриманих Франклін Р. та Уілкінсом М. картин рентгенівської дифракції волокон ДНК. Уотсон Дж. та Крік Ф. встановили, що ДНК — це подвійна спіраль, що складається з двох антипаралельних полінуклеотидних ланцюгів. У запропонованій структурі найважливішим моментом є спарювання азотистих основ антипаралельних ланцюгів шляхом утворення між ними водневих зв’язків, що можуть виникнути тільки за умови, що по ходу біспіральної структури ДНК аденін утворить пару з тиміном, а гуанін — з цитозином. З’єднані за допомогою водневих зв’язків азотисті основи називають комплементарними, а процес виборчої взаємодії аденіну з тиміном, гуаніну з цитозином — комплементарністю. Схему спарювання азотистих основ вже можна вважати експериментально доведеною. Послідовність нуклеотидів у ланцюгах біспіральної структури ДНК комплементарна, але не ідентична. Стійкість біспіральної структури ДНК забезпечується за рахунок двох водневих зв’язків між тиміном і аденіном і трьох водневих зв’язків між цитозином і гуаніном (рис. 3.2). Комплементарність окремих азотистих основ приводить до того, що комплементарними виявляються дезоксирибонуклеотидні ланцюги ДНК у цілому. Зі схеми випливає, що в одному ланцюзі зв’язок між нуклеотидами йде в напрямку 5'→3', а в іншому — у протилежному напрямку — 3'-6'. Антипаралельна спрямованість комплементарних ланцюгів має біологічну основу при реплікації і транскрипції ДНК.
Крім водневих зв’язків між атомами водню, азоту і кисню в комплементарних азотистих основах у стабілізації біспіральної структури ДНК важливу роль відіграють так звані стекингвзаємодії, що виникають між азотистими основами в зв’язку з гідрофобними силами, що діють на відстані ван-дер-ваальсового радіуса.
Рентгеноструктурний аналіз волокон і кристалів показав, що існує три типи подвійної спіралі ДНК (А-, В- і Z-форма) і один тип подвійної спіралі РНК. А- і В-ДНК є правозакручени- ми спіралями, а Z-ДНК — лівозакручена форма. В-форма ДНК стійка при відносній вологості, що перевищує 92 %; якщо ж вологість зменшується нижче 76 %, більшість дезоксирибонуклеотидних послідовностей приймає А-форму. Обидві форми нагадують гнучкі сходи, спірально закручені навколо центральної осі. Залишки дезоксирибози і фосфатні групи, що чергуються, слугують поручнями «драбини», а сходинками є комплементарні пуринпіримідинові пари основ.
Місця приєднання азотистих основ до залишків дезоксирибози в комплементарних ланцюгах ДНК розташовані не чітко один проти одного стосовно осі спіралі. Це позначається на всій конформації ДНК. З того боку від осі спіралі, де кут між дезоксирибозними кільцями менше 180°, міститься жолоб, іменований малою чи глікозидною борозною (у її бік спрямовані глікозидні зв’язки, що з’єднують дезоксирибозні залишки з азотистими основами); з протилежного боку знаходиться велика борозна, або неглікозидний жолоб. У біспіральній структурі ДНК фосфатні групи складають ніби стінки великого і малого жолобів, а «краї» пуринових і пірамідинових основ утворюють дно. На дні великої борозни знаходяться атоми азоту і кисню, що можуть з’єднуватися водневими зв’язками з бічними ланцюгами амінокислотних залишків білка і відігравати важливу роль у процесі розпізнавання.
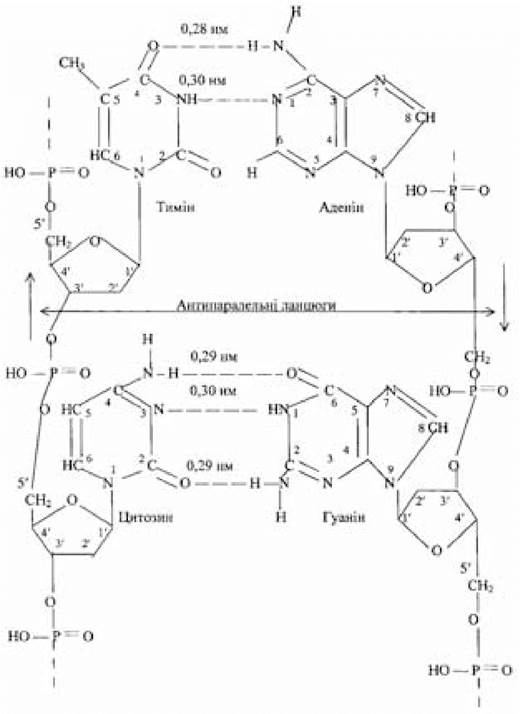
Рис. 3.2. Антипаралельні комплементарні ланцюги фрагмента
ДНК (за Березовим Т.Т. та Коровкіним Б.Ф., 1983)
У пуринових і піримідинових основах, що утворюють комплементарні пари, розташування груп, здатних до утворення водневих зв’язків, різне. У парі А-Т у напрямку від аденіну до тиміну спочатку розташовується атом азоту — акцептор водню, далі — N^-група — донор водню і, нарешті, атом кисню — знову акцептор. У комплементарній парі G—С спочатку йде атом азоту — акцептор, далі кисень — знову акцептор і потім NH2-група — донор водню. У зв’язку з тим, що кожну комплементарну пару можна розглядати у протилежному напрямку Т-А і С-G, то можливі чотири варіанти сполучень донорських і акцепторних угруповань у ланцюзі ДНК, що можуть розпізнаватися репресором чи іншими регуляторними білками. Отже, інформація, закодована в ДНК у вигляді послідовності азотистих основ, з боку великої борозни може бути розшифрована будь-якою іншою великою молекулою. Мала борозна менш інформативна й у В-формі ДНК вона відіграє іншу роль.
А- і В-форми ДНК відрізняються між собою в основному розташуванням і кутом нахилу пари основ стосовно осі спіралі. У В-формі площини основ майже перпендикулярні осі спіралі, що проходить через центри пар основ. Мала борозна вужча за велику через несиметричність місць приєднання азотистих основ до залишків дезоксирибози, а глибина обох борозен приблизно однакова. В А-формі ДНК площина пари основ відхиляється від перпендикуляра до осі спіралі на 13-19°; пари основ зміщені до зовнішньої поверхні, внаслідок чого вісь спіралі лежить у великій борозні, не проходячи через пари основ. Така конфігурація А-форми ДНК зумовила значні розбіжності в глибині борозен: мала борозна виявляється неглибокою, а велика навпаки — глибокою. У В-ДНК на один виток спіралі припадає у середньому 10 пар основ, відстань по осі між сусідніми парами — 0,34 нм; в А-формі ДНК до складу витка входить близько 11 пар основ, а відстань у зв’язку з цим зменшено до 0,29 нм; відстань між витками (крок спіралі) дорівнює 3,4 нм (для моделі Кріка-Уотсона і В-форми) і 2,8 нм — для А-форми. Z-форма містить близько 12 залишків у одному витку. Діаметр подвійної спіралі — 1,8 нм (2 нм між атомами фосфору) для моделі Кріка- Уотсона й А-форми; для В-форми — 1,7 нм. Названі параметри, отримані при вивченні волокон ДНК, є усередненими.
Дані, отримані при дослідженні кристалів ДНК і оброблені математичним шляхом, свідчать про наявність значних відхилень від середніх значень. Порівняння моделі Кріка-Уотсона з характеристиками В- і А-форм ДНК показує, що за кількістю пар основ, які входять в один виток, за розташуванням площини пар основ щодо осі спіралі В-форма збігається з моделлю Кріка-Уотсона; зрушення пар основ щодо осі і наявний у зв’язку з цим центральний канал, розташування дезоксирибозних залишків більше відповідають їхній конформації в А-спіралі ДНК. Такі параметри, як кут спірального обертання (кут повороту між двома сусідніми парами основ), кількість пар азотистих основ, що містяться в одному витку, відстань між сусідніми парами основ по осі спіралі і деякі інші, визначені при рентгеноструктурному аналізі і передбачені на підставі досліджень волокон ДНК, добре узгоджуються.
Викликають інтерес і вимагають пояснення значні відхилення від середніх показників локальних значень кута спірального обертання, кута «пропелера» (кут «пропелера» вимірює поворот двох основ пари в протилежних напрямках навколо з’єднуючої їхньої подовжньої осі), кута «відкриття» (в А-формі спіраль ДНК обгинає центральну вісь, внаслідок чого між парами основ існують щілини, що відкриваються в малу борозну на зразок міхів акордеона) та інших параметрів. Локальні значення кута спірального обертання для В-ДНК коливаються від 28 до 42°, а для А-форми ДНК — від 16 до 44°. На підставі цих даних висловлюється думка, що такі варіації в конформації спіралі розпізнає репресор чи інший регуляторний білок. Крім того, передбачається, що послідовність залишків нуклеотидів впливає не тільки на генетичну інформацію, але й на регуляцію її експресії, а локальний перехід визначених регуляторних ділянок, скажімо, з правоспіральної В-конформації в лівоспіральну Z-форму зможе істотно впливати на доступність генетичної інформації і на процес її зчитування (наприклад, зміною ступеня суперспіралізації ковалентно замкнутих кільцевих ДНК). ДНК у В-формі знаходиться в процесі реплікації (синтез ДНК на молекулі ДНК), а гібрид ДНК-РНК, що утвориться на певний час, у процесі транскрипції, імовірно, має структуру А-спіралі.
Вторинна структура РНК поки що вивчена недостатньо. Наявність гідроксилу у другого вуглецевого атома рибози призводить до того, що РНК, очевидно, не може утворювати подвійну спіраль В-типу. У гіпотетичній подвійній спіралі В-типу відстань між атомом кисню 2'-гідроксильної групи рибози і деякими з навколишніх її атомів стає настільки малим, що В-форма РНК стереохімічно неможлива; в А-формі 2'-ОН-група рибози розташовується на поверхні спіралі й у зв’язку з цим віддалена від сусідніх атомів. Отже, самокомплементарні двонитчасті ділянки в тРНК повинні бути варіантами А-спіралі. Короткі само- комплементарні двонитчасті ділянки в РНК (так звані шпильки), швидше за все, також мають бути виражені А-формою. Поки що є один приклад В-форми РНК: це синтетичний гібрид, що складається з ланцюга аденілових рибонуклеотидів у ланцюзі тимідилових дезоксирибонуклеотидів. Даних про Z-форму РНК поки що немає. Найбільш ймовірно вторинною структурою всієї молекули тРНК є модель, запропонована Холлі, плоске зображення якої за формою схоже на листок конюшини (рис. 3.3).
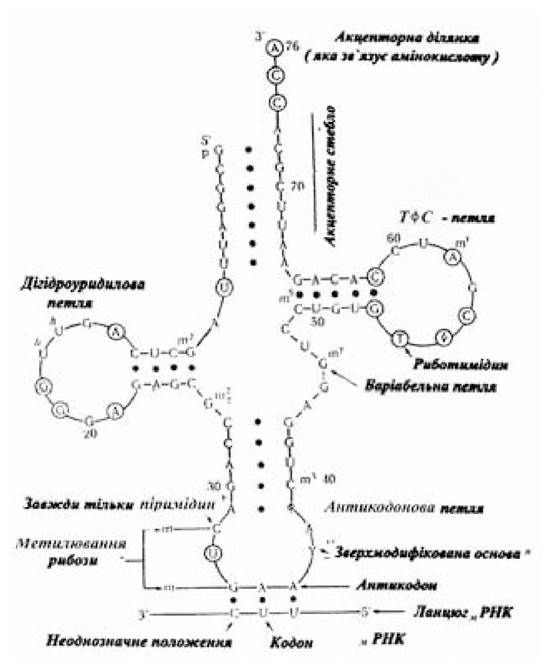
Рис. 3.3. Схема молекули фенілаланінової ТРНК
(за Мецлером Д., 1980)
Третинна структура. Для вивчення третинної структури ДНК необхідно мати її в інтактному (неушкодженому) вигляді. На сьогодні таким чином виділені деякі ДНК вірусів, мітохондрій і хлоропластів. Довжина двоспіральної молекули в хромосомі людини у витягнутому стані могла б досягти 8 см; насправді її довжина 5 нм. Таке надзвичайно ощадливе упакування досягається за рахунок суперспіралізації вторинної структури. Ступінь суперспіралізації (наявність додаткових супервитків чи суперспіралей) встановлюється за зміною константи седиментації. Суперспіралі часто зустрічаються в кільцевих молекулах ДНК. Так, хромосома Е.СОІІ — це єдине замкнуте кільце. Кільцеві молекули ДНК часто виявляються в мітохондріях, деяких вірусах, ядрі еукаріот. Кільцеві молекули, як правило, закручуються самі на себе, утворюючи суперспіральні молекули із супервитками. Скручування подвійної спіралі самої на себе призводить до утворення суперскрученої правозакрученої структури. Це явище називається негативною суперспіралізацією. У результаті суперспіралізації на кожен супервиток припадає 20-25 витків подвійної спіралі. Завдяки суперспіралізації дуже довга молекула ДНК (1360 мкм в Е.соіі І 990 тис. мкм у людини) упаковується в малому об’ємі бактеріальної клітини чи ядрі клітини еукаріот. Виділено ферменти ДНК-топоізомерази, що каталізують процес суперспіралізації (ДНК-гірази), а також переводять суперспіралізовані структури в релаксований стан (ДНК-розплітази); факт перебування ДНК у стані суперспіралізації підтверджений за допомогою методу електронної мікроскопії. Процес суперспіралізації ДНК у еукаріот проходить за участю гістонових білків, серед яких залежно від вмісту лізину й аргініну розрізняють п’ять основних класів (табл. 3.2).
Таблиця 3.2.
Вміст лізину і аргініну в гістонах, %
Гістон |
Лізин |
Аргінін |
Н1 |
24,8 |
2,6 |
Н2а |
10,9 |
9,3 |
Н2Ь |
16,0 |
6,4 |
НЗ |
9,6 |
13,3 |
Н4 |
10,8 |
13,7 |
Полікатіонна природа гістонів забезпечує їхню взаємодію з поліаніонним пентозофосфатним каркасом І поряд з водневими зв’язками стабілізує структуру ДНК еукаріот. У ДНК мітохондрій, хлоропластів І прокаріотичних клітин фактором, що стабілізує структуру цих поліаніонних макромолекул, є неорганічні
катіони, а не білок. Значний внесок у стабілізацію структури ДНК вносять гідрофобні взаємодії в щільно упакованих азотистих основах, укладених у серцевині спіралі. Взаємодія ДНК із гістонами приводить до формування нуклеосом — структурних одиниць хроматину (рис. 3.4). У кожній нуклеосомній часточці фрагмент ДНК довжиною 100-200 нуклеотидних пар закручений навколо гістонового кора, що являє собою октамерну структуру, до складу якої входить по дві молекули кожного з гістонів Н2а, Н2b, Н3 і Н4. Сусідні нуклеосоми зв’язані між собою ділянками лінкерної ДНК (спейсерні ділянки) довжиною близько 50 пар основ; спейсерні ділянки включають по одній молекулі гістона Н1, а також негістонові білки. Висловлюється думка про можливу участь гістонів у регулюванні генної активності. Структурна гетерогенність хроматину і зв’язана з його структурою функціональна активність значною мірою обумовлені ковалентними модифікаціями (ацетилювання, фосфорилювання, метилювання й ін.) амінокислот гістонових білків. Суперспіралізовану молекулу ДНК можна перевести у відкриту (релаксовану) кільцеву форму, розірвавши один чи обидва ланцюги подвійної спіралі за допомогою короткочасної обробки її ферментом. Релаксована форма молекули, що утворюється, седиментує повільніше. Суперспіральність впливає на в’язкість розчинів ДНК і на електрофоретичну рухливість макромолекул. У деяких випадках наявність супервитків можна спостерігати за допомогою електронного мікроскопа. ДНК являє собою динамічну структуру, що легко модифікується. Перехід суперспіральної ДНК у відкриту кільцеву молекулу є необхідним етапом процесу реплікації.
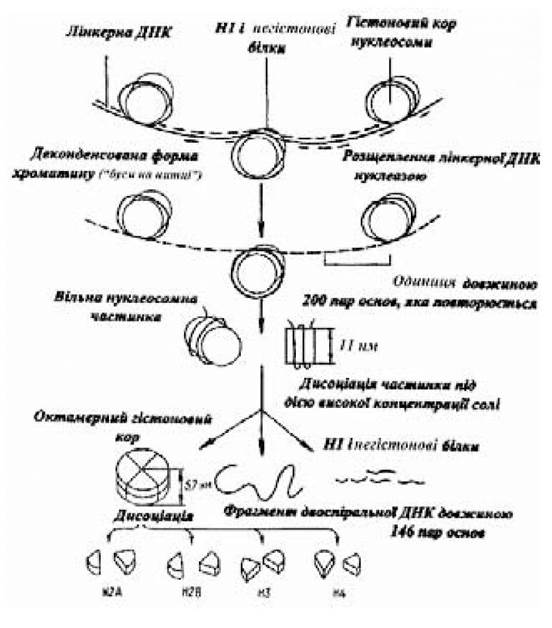
Рис. 3.4. Схема будови нуклеосоми
(за Албертсом Б. та ін., 1986)
Суперспіральна структура ДНК може бути також виявлена розривом спіралі (одного чи обох ланцюгів) під впливом інтеркаліруючих з’єднань (інтеркаляція — це вбудовування плоских ароматичних кілець між парами основ ДНК). До реагентів, які викликають інтеркаляцію, належать деякі лікарські препарати, барвники й інші речовини. Застосування таких речовин пов’язане з певним ризиком, тому що інтеркалюючі сполуки мають мутагенну дію. В міру зростання ступеня інтеркаляції відбувається розкручування витків вторинної структури ДНК: кожне інтеркалююче кільце викликає розкручування спіралі на 26°. В інтактних клітинах інтеркалюючими агентами можуть бути ароматичні кільця бічних ланцюгів амінокислот при взаємодії білків з ДНК. Зміна в щільності супервитків, викликана інтеркаляцією чи зміною іонного оточення, може мати біологічне значення щодо генетичної регуляції і насамперед у дотриманні послідовності
у взаємодії ДНК із внутрішньоклітинними ферментними системами. Можливі й інші способи укладання ДНК у просторі.
Одноланцюгові рибонуклеїнові кислоти (інформаційна, ри- босомна і транспортна) при фізіологічних значеннях рН, іонної сили і температури мають велику кількість комплементарних ділянок (так званих шпильок), що визначають стійкість їхньої третинної структури. Плоска структура нативних молекул тРНК, що нагадує за формою листок конюшини, за рахунок укладання різних частин перетворюється в компактну структуру.
У деяких фагів молекула ДНК побудована з однієї спіралі; у той же час є віруси, у яких РНК складається з двох ланцюгів і за структурою нагадує ДНК.
Таким чином, варто наголосити, що спіраль ДНК містить інформацію двох типів, що кодується і зчитується по-різному: власне генетична інформація, що визначає структуру білка, та інформація, що є свого роду «інструкцією» для вибіркового читання того чи іншого фрагмента запису. В основі збереження і реалізації інформації обох типів лежать фізико-хімічні процеси, багато в чому обумовлені функціональними групами, що входять до складу нуклеїнових кислот. Іонізовані фосфатні групи, що входять до складу нуклеїнових кислот, обумовлюють їхній негативний заряд, завдяки чому ДНК в організмі знаходиться у вигляді комплексів з білками, які несуть позитивний заряд (гістони і протаміни), поліамінами і металами. Наявність вільних ОН-груп біля другого вуглецевого атома рибозного залишку РНК значною мірою визначає конформацію полімерних макромолекул. Полярні групи![]() азотистих основ нуклеїнових кислот здатні утворювати водневі зв’язки з білками, а також між комплементарними азотистими основами в біс- піральній структурі ДНК. У зв’язку з цим ДНК і РНК є реакційно здатними сполуками. Порівняно легко проходять реакції метилювання азотистих основ, завдяки чому уявлення про ДНК як про ланцюг, що містить тільки чотири види нуклеотидів, варто вважати спрощеним. Метильовані азотисті основи гідрокси- люються і виникають їх оксиметильні похідні. Метилювання відбувається після синтезу полінуклеотида. Метилювання і гидроксилювання метильних похідних мають біологічний сенс.
азотистих основ нуклеїнових кислот здатні утворювати водневі зв’язки з білками, а також між комплементарними азотистими основами в біс- піральній структурі ДНК. У зв’язку з цим ДНК і РНК є реакційно здатними сполуками. Порівняно легко проходять реакції метилювання азотистих основ, завдяки чому уявлення про ДНК як про ланцюг, що містить тільки чотири види нуклеотидів, варто вважати спрощеним. Метильовані азотисті основи гідрокси- люються і виникають їх оксиметильні похідні. Метилювання відбувається після синтезу полінуклеотида. Метилювання і гидроксилювання метильних похідних мають біологічний сенс.
Метилювання захищає ДНК від впливу ферментів при потраплянні в клітину вірусів. Крім того, існує припущення, що метильовані азотисті основи є маркерами деяких специфічних ділянок генетичних копій. Модифікації в молекулі РНК досить розповсюджені. Між азотистими основами здійснюється стекинг-взаємодія, вбудовуються плоскі ароматичні кільця бічних ланцюгів амінокислот та інших ароматичних з’єднань (інтерка- ляція). Під впливом азотистої кислоти NH2-група азотистих основ переходить в ОН-групу:
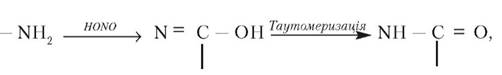
у зв’язку з чим цитозин перетворюється в урацил, аденін — у гіпоксантин, гуанін — у ксантин; реагує з NH2-групою формальдегід. Гідроксиламін (H2N-OH) вступає в реакцію навіть з тими карбонільними![]() групами, особливо в піримідинах, що є частиною циклічної структури. Урацил і тимін більшою, а цитозин, які входять до складу нуклеїнових кислот, меншою мірою, під впливом ультрафіолетових променів димеризуються і гідруються. Це в остаточному підсумку може викликати мутагенний ефект.
групами, особливо в піримідинах, що є частиною циклічної структури. Урацил і тимін більшою, а цитозин, які входять до складу нуклеїнових кислот, меншою мірою, під впливом ультрафіолетових променів димеризуються і гідруються. Це в остаточному підсумку може викликати мутагенний ефект.
Діапазон змін дезоксирибонуклеотидного складу ДНК у живих організмів дуже широкий: у представників прокаріот цитозину і гуаніну міститься 22-74 %; в еукаріотичних організмів — 28-58, а в ссавців — 35-45 %. За вмістом цитозину і гуаніну в ДНК іноді стверджують про філогенетичну спорідненість організмів. Слід при цьому враховувати високу фотохімічну чутливість тиміну до ультрафіолетового світла, у зв’язку з чим високий вміст гуаніну і цитозину спостерігається в бактерій, що живуть у добре освітлених місцях, і низьке — у тих, що живуть у захищеному від сонця середовищі.
Нуклеотидний склад ДНК в організмів одного виду не залежить від віку, умов харчування й інших факторів. Чіткою сталістю характеризується також кількісний вміст ДНК у розрахунку на одну клітину незалежно від того, з яких тканин вона виділена (винятковими є статеві клітини, де ДНК міститься удвічі менше, ніж у соматичних клітинах); у клітинах однієї тканини в різних видів тварин кількість ДНК має істотні розходження (пікограм на одну клітину): у людини — 6,8; курки — 2,3; крокодила — 5,0; коропа — 3,5; дріжджів — 0,05; кишкової палички — 0,014; вірусу віспи птахів — 2,7·10-4; фага Х174 — 2,6·10-6.
Реплікація ДНК. Побудова моделі двоспіральної молекули ДНК дозволило Д. Уотсону і Ф. Кріку в тому ж 1953 р. сформулювати гіпотезу про механізм реплікації цієї макромолекули. У своєму припущенні, що підтвердилося експериментально в дослідах зі стабільним 14N і важким 15N ізотопами азоту (Месельсон М. і Сталь Ф., 1958), Д. Уотсон і Ф. Крік посилалися на важливі властивості структури і функції ДНК — специфічності спарювання основ і комплементарності ланцюгів. Таким чином, підтвердилося припущення про те, що реплікація ДНК напівконсервативна; при такому способі реплікації один з ланцюгів кожної дочірньої молекули ДНК синтезується заново, а другий ланцюг походить від батьківської молекули. Подвійна спіраль може бути розділена на вихідні комплементарні ланцюги шляхом нагрівання розчину ДНК (рис. 3.5), або за рахунок іонізації азотистих основ при додаванні кислоти чи лугу. При нагріванні подвійна спіраль при чітко визначеній температурі розкручується майже миттєво — цей процес називається плавленням, а температура, за якої відбувається поділ половини подвійної спіралі, називається температурою плавлення (Тпл), що залежить від співвідношення G-С- і А-Т-пар основ. Перевага G-С-пар, з’єднаних трьома водневими зв’язками, обумовлює підвищення Тпл. Ділянки ДНК, у яких А-Т-пари переважають, плавляться раніше. Охолодження розчину нижче Тпл призводить до спонтанного утворення вихідної подвійної спіралі. Ця властивість подвійної спіралі, пов’язана з руйнуванням і відновленням водневих зв’язків між комплементарними азотистими основами в комплементарних ланцюгах, відіграє істотну біологічну роль.
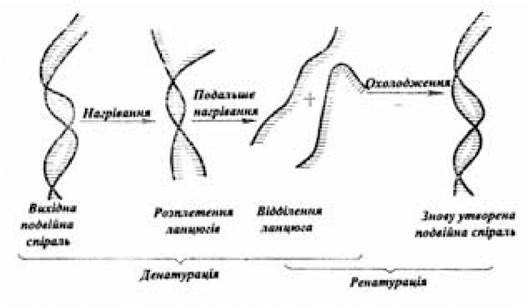
Рис. 3.5. Схема денатурації і ренатурації ДНК
(за Бохінські Р., 1987)
У складному процесі реплікації ДНК беруть участь багато білків, що виконують ферментативну функцію. У результаті Корнбергом А. і його співробітниками (1965) був виділений, очищений до гомогенного стану і докладно вивчений фермент ДНК-полімераза І, яка бере участь у реплікації. Для здійснення біосинтетичної функції поряд із ДНК-полімеразою І у середовищі повинні бути присутні: повний набір дезоксирибонуклеозид-5'- фосфатів (ОАТФ, ОГТФ, ОТТФ, ОЦТФ), іони магнію, затравний ланцюг з вільним 3'-ОН-кінцем (роль затравки виконує попередній ланцюг ДНК чи РНК), матричний ланцюг, у ролі якої може бути одно- чи дволанцюгова ДНК (матричну функцію дволанцюгова ДНК виконує за умови порушення цілісності її дезоксирибозофосфатного каркаса). Синтез полінуклеотидного ланцюга здійснюється в результаті нуклеофільної атаки 3'-ОН-кінцем матриці найближчого до рибозного залишку атома фосфору тільки того дезоксирибонуклеозидтрифосфату, основа якого комплементарна відповідній основі матричного ланцюга. При цьому утвориться фосфодіефірний зв’язок і звільняється ФФн, гідроліз якого задовольняє енергетичні потреби реакції полімеризації. Елонгація ланцюга йде в напрямку 5'>3'. Протягом однієї секунди молекула ДНК-полімерази подовжує ланцюг приблизно на 10 нуклеотидних залишків:
![]()
ДНК-полімераза І проявляє також 3'→5'-екзонуклеазну і 5'→3'-нуклеазну активність. У першому випадку ДНК-полімераза І завжди видаляє з 3'-ОН-кінця некомплементарні залишки основ, перед тим як здійснити приєднання чергового нуклеотида, тобто вона здійснює функцію редагування; видалений нуклеотид при цьому не має бути включений до складу подвійної спіралі (Страйер Л., 1985). У випадку прояву 6'→3'-нукле- азної активності ДНК-полімераза І гідролізує ДНК тільки на ділянках двоспіральної структури починаючи з 5'-кінця. Таким шляхом здійснюється елімінація піримідинових димерів, що утворюються при ушкодженні ДНК ультрафіолетовим випромінюванням. Слідом за ДНК-полімеразою І були виділені і вивчені ДНК-полімерази II і III. Вони, як і ДНК-полімераза І, здійснюють синтез ДНК, починаючи з 3'-ОН-кінця в напрямку 6'→3', використовуючи для цього ті самі дезоксирибонуклеозидтрифосфатні попередники; крім того, ДНК-полімераза III є, як і ДНК-полімераза І, 6'→3' — нуклеазою. Участь ДНК-полімераз у процесі реплікації полягає в тому, що ДНК-полімераза ІІІ забезпечує синтез більшої частити новоутвореної ДНК; внесок ДНК-полімерази І зводиться до видалення затравки і заповнення прогалин. Про біологічну роль ДНК-полімерази II поки що відомо небагато. У механізмах реплікації і репарації ДНК бере участь ще один фермент, відкритий у 1967 р., — ДНК-лігаза, що каталізує утворення фосфодіефірного зв’язку за наявності вільної ОН-групи в 3'-кінці ланцюга ДНК і фосфатної групи в б'-кінці цього ж ланцюга в каркасі двоспіральної структури ДНК. Завдяки цій реакції усуваються одноланцюгові розриви. Участь ДНК-лігази необхідна також для нормального синтезу ДНК, репарації ушкоджень цієї макромолекули і для з’єднання (сплайсингу) ланцюгів у біотехнології одержання рекомбінантних ДНК.
Було підтверджено експериментальне припущення про чітку локалізацію місця реплікації ДНК. У ДНК Е.соil таким місцем є унікальна послідовність поблизу гена. Ділянка, в якій одночасно відбуваються розплетення і реплікація ДНК, називається реплікаційною вилкою, від якої одночасно в двох протилежних напрямках здійснюється біосинтез дочірніх ланцюгів ДНК. Зустріч реплікаційних вилок у точці, діаметрально протилежній початку реплікації, свідчить про те, що полімеризація в обох напрямках проходить з однаковою швидкістю.
ДНК-полімерази І, II і III синтезують дочірні ланцюги ДНК у напрямку 5'→3'. Оскільки батьківські ланцюги антипаралельні, напрямок синтезу в одній з дочірніх ланцюгів має бути 3'→5', що суперечить раніше викладеній точці зору. Протиріччя розв’язалося, коли Оказакі Р. визначив, що частина дочірньої ДНК синтезується у вигляді фрагментів довжиною приблизно в 1000 нуклеотидних залишків кожний. Той з дочірніх ланцюгів, що синтезується в напрямку 5'→3' називається ведучим і синтезується безперервно; ланцюг, що складається з фрагментів Оказакі, називається відстаючим і також синтезується в напрямку 5'→3'. У міру синтезу фрагменти Оказакі з’єднуються між собою за допомогою ДНК-лігази, що дозволяє одержати загальний напрямок росту ланцюга 3→5/ При цьому процес синтезу і ведучого, і відстаючого ланцюгів ДНК починається з 3'-кінця РНК-затравки, що містить вільну ОН-групу. Процес синтезу короткого ланцюга (близько10 нуклеотидів) РНК-затравки на матриці однієї з ланцюгів ДНК каталізується особою РНК-полімеразою (праймазою), що не потребує затравки. 3/-ОН-кінцева група затравки використовується надалі для нарощування ланцюга ДНК за допомогою ДНК-полімерази III, а олігонуклеотидний фрагмент РНК-затравки гідролізується ДНК-полімеразою І; за участю цього ферменту заповнюються відповідними нуклеотидними послідовностями прогалину, що утворилися після видалення РНК-затравки, а ДНК-лігаза зшиває кінці фрагментів. Обов’язкова умова реплікації — необхідність розплетення подвійної спіралі батьківської ДНК у ділянці реплікаційної вилки. У ході розплетення на поділ однієї пари основ за участю ферменту гер (хелікази) витрачається енергія приблизно двох молекул АТФ. Потім одноланцюгові ділянки стабілізуються ОЦ-білком, що їх зв’язує. Позитивні супервит- ки, що виникають при розплетенні кільцевої ДНК, долаються за участю ферменту ДНК-гірази, яка відіграє роль молекулярного шарніра за рахунок введення в батьківську ДНК негативних супервитків. Складний механізм реплікації необхідний для забезпечення його високої надійності. За даними генетичного аналізу одна помилка з’являється при зчитуванні 109-1010 пар азотистих основ (Страйєр Л., 1985).
Синтез РНК. Процес транскрипції в клітинах прокаріот каталізується однією РНК-полімеразою. До складу транскрипційного апарату в клітинах еукаріот входять три РНК-полімерази, одна з яких (РНК-полімераза II) транскрибує гени, що кодують білки; РНК-полімераза І бере участь у біосинтезі високомолекулярної рибосомної РНК, а РНК-полімераза III — у синтезі низькомолекулярних РНК (рибосомна 5S-РНК, тРНК і ін.). Процес транскрипції, початок якого визначається специфічною послідовністю ДНК (промотор), триває в напрямку 5'→3'. Закінчення транскрипції регламентується другою специфічною нуклеотидною послідовністю ДНК (сигнал терміна- ції). РНК-полімерази як бактеріального, так і еукаріотичного походження мають приблизно однакову молекулярну масу — 500 тис., однак будова прокаріотичної РНК-полімерази простіша. До її складу входить п’ять поліпептидних ланцюгів, натомість як РНК-полімераза еукаріотичних клітин складається з 9-11 поліпептидних субодиниць.
На вміст РНК-полімераз у клітині впливає такий інтегральний показник функціонального стану клітини чи організму, як швидкість росту. Однак дані (Албертс Б., та ін., 1986) свідчать про те, що в одній клітині вищих еукаріот знаходиться приблизно 40 тис. молекул РНК-полімерази І і II; кількість молекул РНК-полімерази І приблизно удвічі менше. Середня довжина нуклеотидної послідовності, синтез якої здійснений за участю РНК-полімерази II на транскрипційній одиниці (ділянка ДНК, обмежена специфічним промоторним сигналом і сигналом закінчення транскрипції для РНК-полімерази II), складає в середньому 8 kb. Ця величина більш ніж у 6 разів перевищує той обсяг інформації, що необхідний для синтезу білкової молекули середньої довжини (400 амінокислотних залишків).
Із сумарної кількості РНК, що міститься в цитоплазмі клітини ссавців, 95-97 % — це рибосомна РНК, а близько 3-5 %, або 360 тис. молекул, складає іРНК, тобто одна молекула іРНК припадає на десяток рибосом.
Упакування знову синтезованих молекул РНК шляхом взаємодії з білками додають їм на мікрофотографіях подібності з ДНК-білковими комплексами у складі нуклеосом. Про функціональне значення цієї взаємодії немає переконливих даних.
Висловлюється припущення, що утворення комплексів РНК з ядерними білками необхідно для забезпечення процесингу первинних РНК-транскриптів і їх наступного переміщення в цитоплазму. Полінуклеотидні послідовності, швидкість росту яких складає 30 нуклеотидів за секунду й у біосинтезі яких бере участь РНК-полімераза II, утворюють фракцію гетерогенної ядерної РНК (гяРНК). Багато молекул цієї фракції, що знаходяться у ядрі, піддаються ковалентним модифікаціям, набуваючи при цьому функціональної спеціалізації. Процес ковалентних модифікацій включає добудовування (кепірування) 5'-кінця РНК, синтезованого РНК-полімеразою II, і приєднання до 3-ОН-кінця цієї ж молекули РНК за допомогою полі(А)-полімерази полінуклеотидного фрагмента, що складається з 100-200 залишків аденозинмонофосфату. Названі ковалентні модифікації, що приводять до утворення первинного РНК-транскрипта, очевидно, необхідні для нормального процесингу РНК і транспорту зрілих молекул іРНК із ядра в цитоплазму. Приблизно через 30 хв первинні транскрипти РНК-по- лімерази II виявляються в цитоплазмі. їхня загальна кількість складає близько 5 % тієї маси РНК, що входила у фракцію гяРНК. Решта 95 % первинних транскриптів РНК-полімерази ІІ приблизно протягом години від моменту їхнього синтезу руйнуються у ядрі. При цьому розміри первинних транскриптів РНК зменшуються з 6-8 тис. нуклеотидних залишків (фракція гяРНК) до 1,5 тис. (цитоплазматична іРНК). Досягається це в ході процесингу РНК і перетворення її в зрілу іРНК за рахунок відщеплення інтронів (некодуючих послідовностей) розміром від 0,1 до 10 kb, кількість яких може досягати кількох десятків (понад 50 у гені α-ланцюга прокологена). Фрагменти РНК, що залишилися після видалення інтронних послідовностей, з’єднуються між собою у стик (сплайсинг) і у вигляді зрілих іРНК, що складає 1-2 % нуклеотидних послідовностей геному, транспортуються в цитоплазму і транслюються. РНК-транскрипти прокаріот транслюються в тому вигляді, у якому вони синтезуються (рис. 3.6).
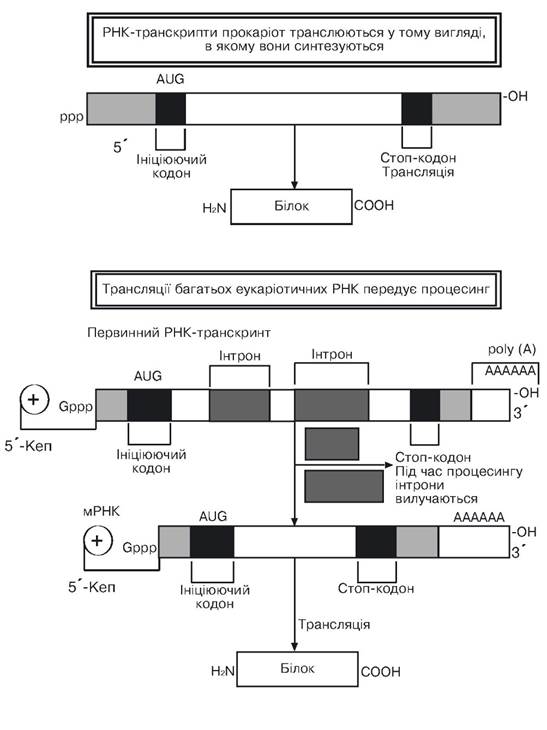
Рис. 3.6. Первинна структура прокаріотичних і еукаріотичних РНК транскриптів
(за Албертс Б. та ін., 1986)
Висловлюється думка про можливу участь малих ядерних рибонуклеопротеїнових часток (мяРНП) у механізмі відщеплення інтронних послідовностей і сплайсингу РНК. Важливодотримуватися оптимального співвідношення між конкретними генними продуктами для забезпечення визначеного рівня метаболічної активності. Так, деякі білки (гемоглобін еритроцитів, міоглобін м’язових клітин), що містяться в клітині у великій кількості, кодуються генами, представленими в гаплоїдному геномі поодинокими екземплярами. Однак за рахунок трансляції, коли за участі однієї молекули іРНК протягом 1 хв утвориться близько десяти молекул білка, а протягом одного клітинного циклу більше 104 білкових молекул, досягається високий рівень гемоглобіну і міоглобіну в спеціалізованій клітині. В іншому випадку кінцевим продуктом генів є рибосомні і транспортні (рРНК і тРНК) НК, потреба в яких досить висока (за один обіг клітинного циклу необхідно синтезувати близько 107 молекул кожної з чотирьох типів рибосомних PHK-28S, 18S, 5,8S і 5S, яких би вистачило для збірки 107 рибосом). Вихід з цього положення досягається за рахунок кількості копій генів, що кодують відповідні рРНК і тРНК (у гаплоїдних клітинах людини до 200 копій генів рРНК, у жаби Хепориз — близько 600).
Розташовані гени у вигляді тандемно повторюваних дезоксирибонуклеотидних послідовностей, розділених ділянками (спейсерами), що не транскрибуються. Первинними транскриптами РНК-полімерази І при транскрибуванні генів рРНК є 45S-PHK (13 kb), з яких утворюється по одному примірнику молекул 28S-РНК (близько 5 kb), 18S-РНК (2 kb) і 5,8S-РНК (0,16 kb), що використовуються при збірці рибосоми, а певна кількість маси первинного транскрипту РНК-полімерази І (близько 6 kb) розщеплюється у ядрі. Місцем утворення рибосом є ядерце. Однак після виходу з ядра в цитоплазму процес дозрівання рибосом продовжується. РНК-полімеразою III транскрибуються кластери тандемно повторюваних генів 5S-РНК, а також гени різних тРНК (Албертс Б. і ін., 1985).