БІОТЕХНОЛОГІЯ - В. Г. Герасименко - 2006
Частина І. Загальна біотехнологія
Розділ 3. ОСНОВИ МОЛЕКУЛЯРНОЇ БІОЛОГІЇ
3.2. БІОСИНТЕЗ БІЛКА І ЙОГО РЕГУЛЯЦІЯ
3.2.3. Регуляція синтезу білка
Здатність бактерій швидко пристосовуватися до умов, що змінюються, і ощадливо використовувати різноманітні поживні речовини досягається контролем білкового синтезу на рівні транскрипції за рахунок зміни швидкості утворення іРНК. Інший шлях регуляції швидкості протеїносинтезу здійснюється на рівні трансляції. Механізм його вивчений недостатньо і для бактерій він має другорядне значення.
У клітинах еукаріот провідну роль відіграє контроль біосинтезу білка на рівні трансляції. За рахунок регуляції швидкості синтезу ферментів у клітині створюється таке співвідношення їхніх концентрацій, яке забезпечує оптимальний рівень метаболізму, адекватний умовам навколишнього середовища. При цьому варто враховувати ту обставину, що деякі ферменти незалежно від напруги метаболізму містяться в клітинах бактерій у постійній концентрації (конститутивні ферменти); кількість інших, залежно від умов, змінюється в тисячу і більше разів (індуковані ферменти).
У першому випадку як приклад можна назвати ферменти гліколізу, у другому — β-галактозидазу, що здійснює гідролітичне розщеплення лактози на глюкозу і галактозу.
Молекулярні і генетичні механізми регуляції швидкості білкового синтезу в прокаріот були розроблені Жакобом Ф. та Моно Ж. (1961-1964) і сформульовані в гіпотезі оперона, що одержала повне підтвердження в результаті прямих біохімічних досліджень. Було виявлено, що клітини Е.соlі у середовищі, що містить замість глюкози лактозу, починають синтезувати у великих кількостях, які перевищують первинний вміст більш ніж у 103 разів, β-галактозидазу і два інших зв’язаних з нею функціонально ферменти — β-галактозидпермеазу і білок А. Лактоза в даному процесі виступає як індуктор, а сам процес має назву координованої індукції.
Для пояснення механізму дії індуктора Жакоб Ф. Та Моно Ж. запропонували схему (рис. 3.12). На ній три структурних гени (lac-гени) z, у і a та ланцюг ДНК, що їм передує, включає дві регуляторні ділянки — промотор (р) і оператор (о), а також регуляторний ген і, який кодує білок-репресор, розташовані поруч. Ці гени були названі опероном. Крім lас-оперона у бактерій ідентифіковані й інші, переважаючі за складністю лактозний. Так, his-оперон кодує дев’ять ферментів, необхідних для біосинтезу амінокислоти гістидину.
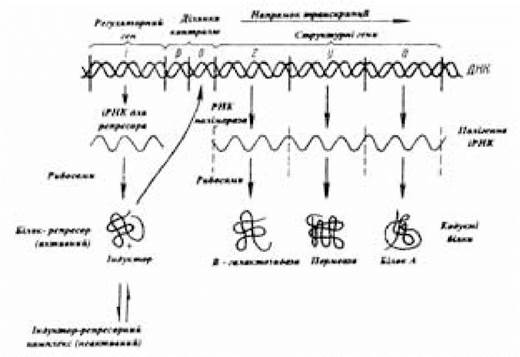
Рис. 3.12. Схема регуляції синтезу білка
(за Жакобом Ф. та Моно Ж., 1964)
Транскрипція lac-оперона може індукуватися лактозою. Індуктор взаємодіє з другим специфічним центром білка-репресора (першим центром білок-репресор зв’язується з опероном). Утворення індуктор-репресорного комплексу призводить до зниження спорідненості репресора до оператора і відділення комплексу від оператора. Звільнена від білкової репресії ділянка ДНК (оперон) стає доступною для РНК-полімерази, за допомогою якої здійснюється транскрипція z-, у- і а-генів, потім
відбувається трансляція іРНК, завдяки чому з’являється доступ до нового джерела вуглецю й енергії — лактози. Заміна лактози в традиційному поживному середовищі для Е.соlі субстратом D-глюкозою, що легко метаболізується, супроводжується дисоціацією комплексу індуктор-репресор, що веде до відновлення в останнього властивої йому високої спорідненості до взаємодії з оператором та інгібування процесу транскрипції структурних генів lac-оперону.
Молекулярна маса виділеного Гілбертом У. та Мюллер-Хіллом В. (1967) lac-репресора — майже 150 тис., а в клітині E.coli, як правило, знаходиться лише близько 10 молекул цього білка. До складу деяких оперонів входить ще промотор, що включає 85 пар нуклеотидних залишків; розташований він між інгібіторною ділянкою (ген і) та оператором. Частина промотора, що розташована ближче до оператора (близько 40 пар залишків нуклеотидів), є місцем зв’язування РНК-полімерази. Функціональна роль нуклеотидної послідовності, що знаходиться з боку і-гена (близько 38 пар залишків азотистих основ), полягає в зв’язуванні особливого білка, що активує катаболітний ген, — БАК, чи САР (від англ. catabolite protein activator). Під контролем САР-ділянки знаходиться місце зв’язування РНК-полімерази. Коли в середовищі відсутня глюкоза, білок САР і циклічний АМФ, (цАМФ чи сАМР) утворюють комплекс, який при з’єднанні із САР-ділянкою ДНК, створює необхідні стеричні умови для надходження РНК-полімерази в ділянку первинного зв’язування і подальшого просування ферменту через зону вільного від інгібування оператора (індуктор- репресорний комплекс не здатний інгібувати оператор) до Іас-генів і їх транскрипції.
Наявність у середовищі глюкози в кількості, що забезпечує потребу клітини, супроводжується зменшенням умісту сАМР; створюється перешкода для утворення САР-сАМР-комплексу, що не дозволяє РНК-полімеразі зв’язатися з оператором і розпочати транскрипцію структурних z-, у- і а-генів. Таким чином, сАМР виконує роль зонда, що чутливо реагує на наявність в середовищі глюкози. Концентрація сАМР залежить від відношення активностей аденілатциклази, яка каталізує реакцію утворення сАМР з АТФ, і фосфодиестерази, що здійснює гідроліз сАМР. Описаний механізм регуляції синтезу ферментів дозволяє клітинам прокаріот підтримувати метаболізм на рівні, що забезпечує досягнення максимального ККД.