БІОТЕХНОЛОГІЯ - В. Г. Герасименко - 2006
Частина І. Загальна біотехнологія
Розділ 3. ОСНОВИ МОЛЕКУЛЯРНОЇ БІОЛОГІЇ
3.2. БІОСИНТЕЗ БІЛКА І ЙОГО РЕГУЛЯЦІЯ
3.2.2.Етапи біосинтезу білка
У синтезі білка беруть участь близько трьохсот різних макромолекул, представлених у клітинах еукаріот більш ніж 70-ма рибосомними білками, 20-ма ферментами активації амінокислот і більш ніж десятьма допоміжними ферментами, майже 100 ферментами, що беруть участь у процесі дозрівання білків (процесингу), а також транспортними і рибосомними РНК у кількості, що перевищує сім десятків. Сьогоднішнім знанням про механізм синтезу білка передували відкриття, зроблені на початку 50-х років XX ст. колективом піл керівництвом П. Замечника: білкові молекули утворюються з амінокислот у фракції рибонуклсонротеїдних часток, що знаходяться в цитоплазмі (рибосомах). У 1957 р. Замочник П. і Хогланд М. дослілили, що активація амінокислот і їхні приєднання до молекули тРНК ферментативний процес, у якому беруть участь специфічні аміноацил-тРНК-синтетази. Крім того, Крік Ф. обгрунтував роль тРНК у ньому процесі: одним кінцем вона з'єднується з карбоксильною групою активованої амінокислоти, а іншою ділянкою (антикодоном) із триплетною нуклеотидною послідовністю іPНК, що коду. відповідну амінокислоту. Складний процес біосинтезу білка можна розглядати поетапно (табл. 3.5).
Таблиця 3.5.
Компоненти, що беруть участь на різних етапах біосинтезу білка я Е.соlі (за Ленінджером А, 1985)
Етапи трансляції |
Необхідні компоненти |
Активація амінокислот |
20 амінокислот, 20 амінозцил-тРНК-синтетаз. 20 або більше тРНК, АТФ. Mg2+ |
Ініціація пептидного ланцюга |
іРНК, N-формідметіоніп тРНК, що ініціює кодон іРИК (AUG). ЗОS-рибосомна субчастина. 50S рибосомна субчастина, ГТФ. Мg2+ фактори ініціації (іF=1, iF=2, iF=3) |
Елонгація |
70S· рибосома (ініціюючий комплекс), набір аміноацил-тРНК, відповідних кадонам іРНК, Мg2+, фактори елонгації (Тu, Тв, і G). ГТФ, пептидилтрамсфераза |
Термінація |
АТФ, термінуючий кодом іРНК. фактори звільненя поліпептида (R1, R2, S) |
Згортання і процесинг |
Специфічні ферменти і кофактори |
Активація амінокислот. На першому етапі трансляції. що проходить у всіх тинах клітин у цитозолі, здійснюється АΤΦ-залежне перетворення амінокислот на аміноацил-тРНК. Реакція двостадійна: 1. з амінокислоти й АΤΦ утворюється аміноациладенілат - активована сполука, що являє собою змішаний ангідрид, у якому карбоксильна група амінокислоти з'єднана з фосфатною групою аденілової кислоти (АМФ): 2. аміноаннльна група (залишок амінокислоти) аміноациладенілату (аміноацил-АМФ) переноситься на молекулу відповідної тРНК з утворенням аміноацил-тРНК — активованої проміжної сполуки, що бере участь у синтезі білка. Процес активації амінокислот і їхнє наступне приєднання до тРНК каталізуються специфічними аміноацил-тРНК-синтетазами, що називаються ще активуючими ферментами. Кожний з ферментів строго специфічний як стосовно тРНК, так і щодо відповідної їй амінокислоти. Двостадійний процес активації амінокислот здійснюється в каталітичному центрі ферменту:
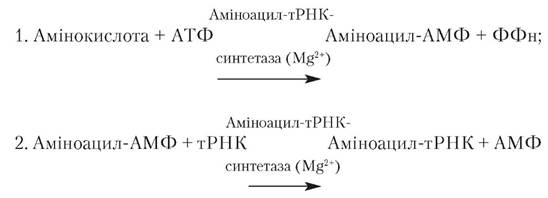
В усіх випадках на другій стадії активована амінокислота приєднується до залишку аденілової кислоти або аденінового нуклеотиду (А) у триплеті ССА на 3'-кінці молекули тРНК.
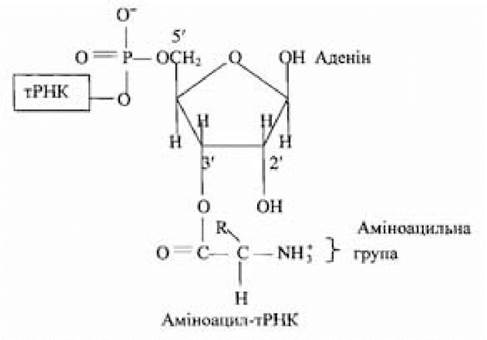
Перенесення аміноацильної групи на 2'- чи 3'-ОН-групу рибозного залишку аденінового нуклеотиду ССА-послідовності на 3'-кінці тРНК залежить від амінокислоти й аміноацил-тРНК-синтетази, що каталізує утворення аміноацил-тРНК. Активована амінокислота може дуже швидко переміщатися з 2'- у 3'-положення і назад. Стадія активації і перенесення певної амінокислоти каталізується однією і тією самою аміноацил-тРНК-синтетазою. На активацію кожної амінокислоти витрачається енергія двох високоенергетичних фосфатних зв’язків, що робить сумарну реакцію активації амінокислот практично незворотною. У ході перетворення амінокислот в аміноацил-тРНК-комплекси підвищується реакційна здатність мономерних компонентів, що використовуються у реакції полімеризації; при взаємодії амінокислоти зі специфічною тРНК здійснюється добір необхідних для синтезу поліпептидного ланцюга відповідних амінокислот. Позбавлені спроможності впізнавати кодони в іРНК, амінокислоти набувають цієї функції у складі аміноацил-тРНК; одночасно активовані карбоксильні групи амінокислот стають реакційно здатними й утворюють пептидні зв’язки з аміногрупами сусідніх амінокислот.
з аміногрупами сусідніх амінокислот.
Молекули тРНК відіграють роль кінцевих адапторів, що переводять інформацію, укладену в нуклеотидній послідовності іРНК, на мову білка. Не менше значення у процесі декодування має і другий набір адапторів — молекул аміноацил-тРНК-синтетаз.
Таким чином, генетичний код розшифровується за допомогою двох взаємозалежних наборів адапторів, що здійснюють високоспецифічну функцію, у результаті чого кожна амінокислота може зайняти місце, яке визначене її триплетною нуклеотидною послідовністю у молекулі іРНК, тобто своїм кодоном.
На етапах ініціації поліпептидного ланцюга, елонгації і термінації для здійснення реакцій білкового синтезу необхідні рибосоми.
Рибосома. Найкраще вивчені рибосоми Е.соlі. Їхня кількість у прокаріотичній клітині перевищує 1,5·104, діаметр — 18-20 нм, маса коливається у межах 2500-2800 кДа, коефіцієнт седиментації — 70S. У рибосомах прокаріот міститься 65 % рРНК і 35 % білка. Рибосоми становлять майже чверть сухої маси клітини. Рибосоми еукаріотичних клітин значно більші бактеріальних (діаметр — приблизно 21 нм, маса — майже 4000 кДа, коефіцієнт седиментації — 80S, співвідношення між білком і рРНК дорівнює приблизно 1:1, а їхня кількість у еукаріотичній клітині - ~105). Синтез білків, що входять до складу рибосомної структури, відбувається в цитоплазмі, самозборка рибосомних субодиниць — у ядерці за рахунок взаємодії молекул білків і рРНК за участю іонів магнію. Рибосоми прокаріот і еукаріот складаються з двох субчастин неоднакового розміру. У рибосом прокаріот коефіцієнт седиментації більшої субчастини 50S, а меншої — 30S, їхня маса — відповідно 1800 і 1000 кДа; у рибосом еукаріот коефіцієнт седиментації більшої субчастини знаходиться на рівні 60S, меншої — 40S.
Велика субчастина (50S) прокаріотичної рибосоми містить одну молекулу 23S-рРНК (~3200 нуклеотидів), одну молекулу 5S-рРНК (~120 нуклеотидів) і 34 білка; менша субчастина (30S) — 21 білок і одну молекулу 16S-рРНК.
Подібно до бактеріальної рибосоми, рибосома еукаріотичної клітини дисоціює на велику (60S) і малу (40S) субчастини, що, у свою чергу, можуть дисоціювати на складові їхніх білків і РНК. До складу більшої субчастини входять три молекули РНК (28S, 7S і 5S) і понад 40 різних рибосомних білків; мала субчастина містить одну молекулу 18S-рРНК і приблизно 33 різних рибосомних білків.
Білки великої і малої субчастин рибосоми прокаріот мають нумерацію. У 50S-субчастині — від L1 до L34 (від англ. Large — велика), у 30S-субчастині — від S1 до S21 (від англ. Small — мала). Усі білки, що входять до складу рибосом E. coli, індивідуалізовані, у більшості з них встановлені амінокислотна послідовність, первинна структура, молекулярна маса, що коливається в межах 6,5-75 тис., визначені також нуклеотидні послідовності рРНК Е.соlі.
Усі рРНК і більшість білків еукаріотичних рибосом також виділені в чистому вигляді і вивчені. Рибосомні 30S- і 50S-субчастини при відповідних умовах можуть бути реконструйовані
у функціонально активні структури з набору індивідуальних компонентів (білків і рРНК), отриманих при дисоціації субчастин, шляхом самозбірки цих макромолекул; для мимовільного утворення 50S-субчастин необхідна присутність у системі в зібраному вигляді 30S-субчастини.
Висловлюється думка (Ленинджер А., 1985), що рРНК виконують роль каркасів для упорядкованого розташування рибосомних поліпептидів, ферментативні й інші специфічні функції яких поки що не встановлені для всіх білків. За даними рентгеноструктурного аналізу й електронної мікроскопії, субчастини в рибосомі розташовані несиметрично, мають неправильну геометричну форму і з’єднані один з одним таким чином, що між ними залишається борозна, через яку проходить молекула іРНК у процесі синтезу поліпептидного ланцюга, а також друга борозна, що утримує зростаючий поліпептидний ланцюг. У першій борозні розміщується 35 нуклеотидів РНК, а в другій — приблизно 30 амінокислот. Рибосоми мітохондрій і хлоропластів відрізняються від цитоплазматичних рибосом еукаріот; вони мають більшу подібність з 70S-частками прокаріотичних організмів.
Синтез білків у мітохондріях, хлоропластах і бактеріях проходить за загальною схемою (Ленинджер А., 1985; Страйер Л., 1985; Албертс Б. та ін., 1986).
Ініціація поліпептидного ланцюга. Було встановлено, що в Е.соlі й інших прокаріот N-кінцевою амінокислотою при збірці поліпептидного ланцюга завжди є залишок N-формілметіоніну. Цей та інший факти стали підставою для припущення про значення формільованого метіоніну як ініціатора в процесі синтезу поліпептидного ланцюга. Формільований метіонін одержується в результаті двох послідовних реакцій. При цьому варто вказати на існування двох тРНК: тРНКМеt і тРНКfМеt, що здійснюють акцепцію метіоніну, а також звернути увагу на те, що фермент формілтрансфераза (трансформілаза) не спроможний формілювати метіонін, що знаходиться у вільному стані. Однак і в комплексі з тРНК не завжди можливе формілювання залишку метіоніну. Ця реакція можлива тільки в тому випадку, коли тРНК виявляється специфічною тРНКfМеt:
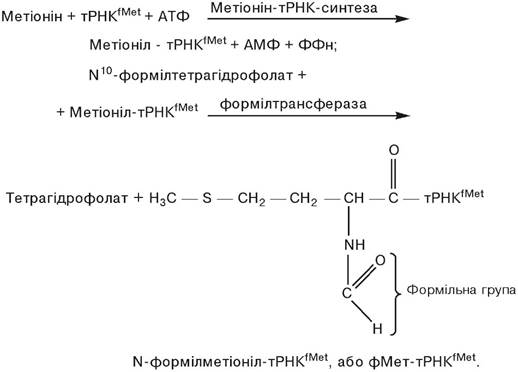
Комплекс метіоніну з іншою тРНК — метіоніл-тРНК (тРНКМеt) не формілюється і використовується для включення метіоніну у внутрішні ділянки синтезованого поліпептидного ланцюга. Хоча первинна структура тРНКfМеt і тРНКМеt різна, загальним для них є наявність того самого антикодону UАС, завдяки чому обидві тРНК здатні взаємодіяти з кодоном АUG. Однак антикодоновий триплет комплексу фМет — ТРНКfМеt взаємодіє з кодоном AUG тільки в тому випадку, якщо той розташований на початку кодуючої послідовності іРНК. Розташування кодону AUG усередині нуклеотидної послідовності іРНК передбачає взаємодію з ним неформільованого Мет- тРНКМеt. Наявність N-формільної групи в залишку метіоніну в складі ініціаторного комплексу фМет-тРНКfМеt обумовлює взаємодію останнього з особливим місцем ініціації на рибосомі, з яким не вступає в реакцію ні Мет-тРНКМеt, ні жодна інша аміноацил-тРНК; блокування аміногрупи метіоніну формільним залишком перешкоджає включенню такої амінокислоти у внутрішні ділянки поліпептидного ланцюга.
У поліпептидних ланцюгах, синтезованих у рибосомах еукаріотичних клітин, N-кінцевою амінокислотою завжди є метіонін, що приєднується за допомогою спеціальної ініціюючої метіоніл-тРНК; у мітохондріях і хлоропластах еукаріот так само, як і в бактеріях, синтез білка починається з N-формілметіоніну, що підтверджує висловлену точку зору про походження цих субклітинних структур, які знаходяться в клітинах еукаріот, від бактерій.
На етапі ініціації поліпептидного ланцюга істотним моментом є тристадійний процес утворення ініціюючого комплексу (рис. 3.8). Спочатку в результаті взаємодії 30S-субчастини і фактора ініціації XF-3 утворюється структура, у якій білок IF-3 перешкоджає її асоціації з 50S-субчастиною. Приєднання до 30S-субчастини іРНК досягається за допомогою особливого іні- ціюючого сигналу, що являє собою багату пуриновими основами (А, G) послідовність, центр якої знаходиться на відстані приблизно 10 нуклеотидів від 5'-кінця ініціюючого кодона (5') АUG(3') іРНК, тож трансляція не може розпочатися безпосередньо на 5'-кінці іРНК. Перший трансльований кодон, як правило, розташовується на відстані майже 25 нуклеотидів від 5'-кінця. Ініціюючий сигнал, представлений короткою ділянкою (6-10 нуклеотидів) іРНК, у результаті взаємодії з комплементарною послідовністю нуклеотидів, розміщених із 3'-кінця 16S-РНК 30S-субчастини, сприяє фіксуванню іРНК у потрібному для ініціації положенні. Завдяки цій взаємодії забезпечується правильне розташування ініціюючого кодону AUG на 30S-субчастині. Потім до комплексу, що складається із 30S-субчастини, фактора IF-3 і іРНК, приєднуються раніше зв’язані з формілметіоніл-тРНКМе1 білковий фактор ініціації IF-2 і ГТФ (2-а стадія). У результаті подальшого приєднання до 50S-рибосомної субчастини раніше виниклої макромолекулярної комплексної структури, що складається з 30S-субчастини, білкового фактора ініціації IF-3, іРНК, ГТФ, білкового фактора ініціації IF-2, N-формілметіоніл-тРНКМеt, виникає функціонально активна 70S-рибосома. При її утворенні на стадії приєднання 50S-субчастини молекула ГТФ, яка зв’язана з IF-2, гідролізується до ГДФ і Фн, які разом з IF-3 і IF-2 утворюють комплекс. Таким чином, точне місце початку синтезу білка (ко- дон AUG, генетичний сигнал ініціації) визначається в результаті спарювання лідерної послідовності азотистих основ з боку 5’-кінця кодона AUG іРНК із нуклеотидною послідовністю, що розташовується з 3'-кінця 16S-pPHK 30S-субчастини, а також комплементарною взаємодією кодона АUG іРНК з антикодоном (3')UАС(5') N-формілметіоніл-тРНКfMet.
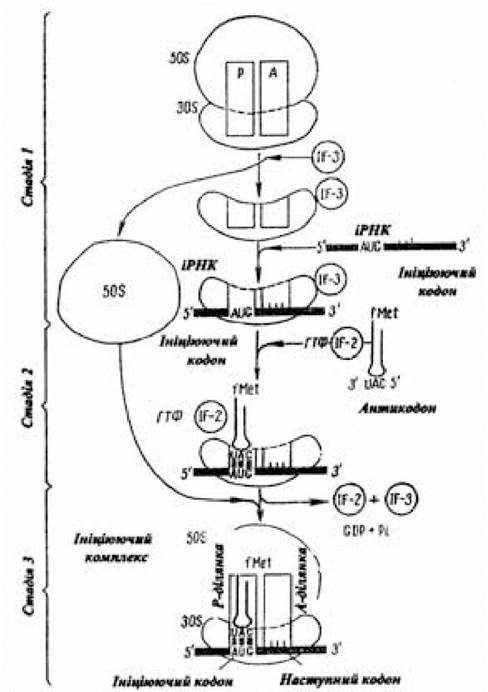
Рис. 3.8. Схема тристадійного процесу утворення ініціюючого комплексу
(за Ленінджером А., 1985)
Для надання правильного положення у функціонально активному ініціюючому 70S-комплексі N-формілметіоніл- тРНКfMet останній приєднується до пептидильної ділянки (Р-ділянки) 70S-комплексу; друга ділянка для приєднання аміноацил-тРНК називається аміноацильною (А-ділянка). Утворюються вони за рахунок сполучення специфічних ділянок 30S- і 50S-субодиниць. У такому стані (Р-ділянка зайнята ініціюючою фМет-тРНКfMet, А-ділянка — вільна) ініціюючий комплекс готовий до продовження процесу трансляції.
Елонгація. Елонгація синтезу поліпептидного ланцюга є циклічним процесом, що включає три стадії. Цикл починається взаємодією ГТФ з одним із трьох факторів елонгації — Ти, що є розчинними білками цитоплазми. Аміноацил-тРНК, антикодон якої комплементарний наступному за ініціюючим кодоном у напрямку 5'-3' іРНК, взаємодіючи з ГТФ-Tu утворює потрійний комплекс аміноацил-тРНК — Tu — ГТФ, що за допомогою активованого фактора елонгації (Tu — ГТФ) вводиться у вільну А-ділянку функціонально активної 70S-рибосоми і зв’язується з цією ділянкою. Правильність положення аміноацил-тРНК контролюється двічі (рис. 3.9). З одного боку, це комплементарна кодон-антикодонова взаємодія, з іншого — специфічний зв’язок між ділянками молекул тРНК і рРНК. Тільки при дотриманні цієї умови процес елонгації може продовжитися.
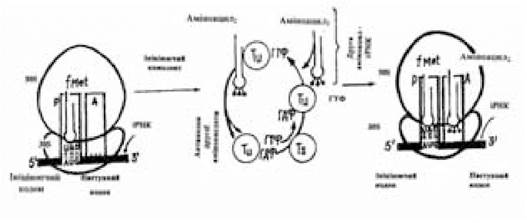
Рис. 3.9. Схема першої стадії елонгації
(за Ленінджером А., 1985)
Наступна реакція — гідроліз ГТФ і елімінація з 70S-рибосоми Ти — ГДФ-комплексу. Залишок ГДФ з останнього витісняється іншим фактором елонгації Тs. Новий комплекс Tu-Tsрозпадається під впливом ГТФ, а ГТФ-Tu, що утворюється, знову доставляє комплементарну аміноацил-тРНК в А-ділянку, що звільнилася, 70S-рибосоми. ГТФ-Tu не вступає в реакцію з фМет-тРНКfMet, у зв’язку з чим вона не потрапляє в А-ділянку і внутрішні кодони AUG не зчитуються з ініціюючої тРНК. До моменту початку другої стадії циклу елонгації Р-ділянка виявляється зайнята фМет-тРНКfMet, а в А-ділянці розташовується відповідна аміноацил-тРНК. Усе підготовлено для вступу залишків амінокислот у реакцію й утворення пептидного зв’язку (рис. 3.10).
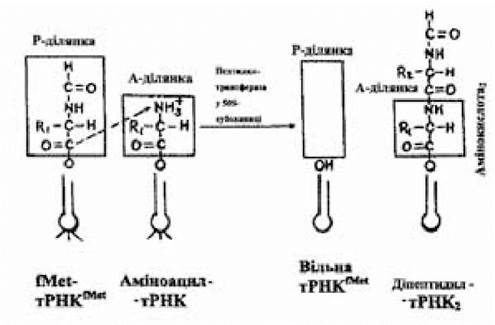
Рис. 3.10. Схема утворення пептидного зв'язку
(за Ленінджером А., 1985)
Цю реакцію каталізує пептидилтрансфераза, що є одним з білків 50S-субодиниць, активність якої реалізується в присутності К+. Активований залишок формілметіоніну, що знаходиться у складі фМет-тРНКfMet і розташований у Р-ділянці, переноситься на аміногрупу аміноацил-тРНК, що займає А-ділянку. Нова сполука, що виникла внаслідок цієї реакції (діпептидил-тРНК), включає залишки двох амінокислот, з’єднаних пептидним зв’язком, і розташовується в А-ділянці 70S-рибосоми; у Р-ділянці залишається звільнена від активованого амінокислотного залишку ініціююча тРНКfMet.
Третя стадія елонгації — транслокація — пов’язана з трьома переміщеннями (рис. 3.11). У зв’язку з переміщенням 70S-рибосоми на відстань в один кодон уздовж іРНК у напрямку її 3'-кінця; діпептидил-тРНК, що знаходиться в А-ділянці, переміщується в Р-ділянку, завдяки чому вільна тРНК відокремлюється від Р-ділянки й надходить до цитоплазми. Таким чином, у пептидильній ділянці виявляється діпептидил-тРНК, а аміноацильна ділянка знову підготовлена для зв’язування чергової аміноацил-тРНК, антикодон якої комплементарний наступному кодону іРНК, що знаходиться в зоні аміноацильної ділянки 70S-рибосоми.
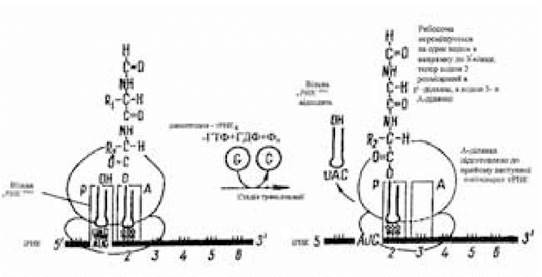
Рис. 3.11. Схема транслокації
(за Ленінджером А., 1985)
Починається новий тристадійний цикл елонгації, у результаті завершення якого буде утворена трипептидил-тРНК. Переміщення рибосоми уздовж іРНК на один кодон називається
транслокацією. Пересування здійснюється за участю третього фактора елонгації G, чи транслокази, і енергії, що утвориться при гідролізі ще однієї молекули ГТФ. На утворення однопептидного зв’язку (приєднання однієї амінокислоти) витрачається енергія гідролізу двох молекул ГТФ.
Термінація. У синтезі поліпептидного ланцюга настає момент, коли А-ділянка рибосоми зайнята одним з кодонів UAA, UGA чи UAG. У цьому випадку кодон-антикодонової взаємодії не відбувається, тому що нормальні клітини не містять тРНК з антикодонами, комплементарними сигналам термінації. Термінуючі триплети не кодують амінокислот і називаються в зв’язку з цим безглуздими кодонами.
З високою специфічністю термінуючі триплетні послідовності іРНК вступають у взаємодію з білковими факторами звільнення R1 R2 i S (рилізинг-факторами); перший з них розпізнає кодон UAA чи UAG, другий — UAA чи UGA. Взаємодія одного з рилізинг-факторів з термінуючим кодоном в місці розташування аміноацильної ділянки 70S-рибосоми активує пептидилтрансферазу і змінює її специфічність, у результаті чого настає гідролітичне відщеплення поліпептиду від поліпептидил-тРНК, акцепція активованим пептидильним залишком Н2О і вивільнення знову синтезованої білкової молекули, відділення від Р-ділянки, що звільнилася, тРНК, дисоціація 70S-рибосоми на 30S- і 50S-субодиниці і їхня підготовка до синтезу нової білкової молекули (Ленинджер А, 1985; Страйер Л, 1985).
На одній молекулі іРНК одночасно можуть знаходитися декілька функціонально активних рибосом; при цьому одна рибосома на іРНК займає місце, еквівалентне 80 нуклеотидам. Завдяки такій можливості ефективність використання іРНК значно збільшується. Кілька рибосом, що одночасно знаходяться на одній і тій самій іРНК, формують полірибосомну структуру чи полісому, у складі якої кожна з рибосом функціонує автономно і синтезує свій поліпептидний ланцюг.
Упаковка і процесинг поліпептидного ланцюга.
Первинна структура (послідовність амінокислот) є визначальним моментом у формуванні тривимірної структури, завдяки якій білок стає функціонально активним. Однак нерідко білкова молекула набуває біологічно активної конформації тільки в результаті процесингу чи ковалентної (посттрансляційної) модифікації, що проходить у різних білків по-різному і включає реакції видалення чи приєднання атомних груп. Так, формільна група, що входить до складу N-кінцевого N-формілметіоніну, у білків бактеріального походження в ході процесингу деформілюється. Під дією особливих амінопептидаз відбувається гідролітичне відщеплення одного чи декількох N-кінцевих амінокислотних залишків, у зв’язку з чим у багатьох остаточно сформованих білках їх не вдається знайти. У процесі посттрансляційного дозрівання відщеплюються поліпептидні N-кінцеві лідерні послідовності, що виконують роль специфічних сигналів, за допомогою яких білок досягає місця свого призначення. Дуже часто N-кінець поліпептидного ланцюга піддається модифікаційним змінам ще тоді, коли синтез решти поліпептидного ланцюга продовжується.
З інших найбільш розповсюджених реакцій, за участю яких відбувається модифікація поліпептидної структури і тим самим здійснюється вплив на формування її остаточної конформації, варто назвати ацетилювання аміногрупи N-кінцевої амінокислоти, фосфорилювання НО-груп залишків оксіамінокислот (серину, треоніну, тирозину), що призводить до збільшення негативного заряду відповідних білків, карбоксилювання залишків аспарагінової і глутамінової кислот, метилювання залишків лізину і карбоксильних груп деяких залишків глутамінової кислоти, приєднання бічних вуглеводних ланцюгів, додавання простетичних груп, а також утворення дисульфідних містків.