БІОТЕХНОЛОГІЯ - В. Г. Герасименко - 2006
Частина І. Загальна біотехнологія
РОЗДІЛ 4. КЛІТИННА ІНЖЕНЕРІЯ
4.5.БІОТЕХНОЛОГІЯ ПЕРЕНЕСЕННЯ ГЕНІВ У ЕУКАРІОТИЧНІ КЛІТИНИ ЗА ДОПОМОГОЮ ДНК (ДНК-ТЕХНОЛОГІЯ)
Для перенесення генів у соматичні клітини використовують як тотальну ДНК, отриману шляхом очищення препаратів ДНК зі сперми лосося, або ДНК з клітинних ліній найчастіше миші, китайського хом’ячка і людини, так і клоновані гени. При трансформації соматичних клітин, що ростуть у культурі, і мутантних ліній, створених на основі клітинних культур, препаратами сумарної ДНК і клонованими генами в більшості випадків як донорські маркерні гени використовуються ТК, НРRT, APRT і DFR, що кодують відповідно ферменти ТК (тимідинкіназу), ГФРТ (гіпоксантинфосфорибозилтрансферазу), АФРТ (аденінфосфорибозилтрансферазу) і ДФР (дегідрофолатредуктазу). Таким чином, для трансформації клітин ссавців у культурі необхідне джерело донорської ДНК, середовище з придатним буфером і маркіровані реципієнтні клітини і (чи) придатне селективне середовище для рідких трансформантів.
При обробці клітинної культури препаратами екзогенної ДНК трансформується приблизно одна з мільйона чи одна з 100 мільйонів (10-6-10-8) реципієнтних клітин. Одночасно варто нагадати, що частота трансформації соматичних реципієнт- них клітин при використанні як вектора метафазних хромосом була, як правило, на один-два порядки вищою. Вирішальне значення для досягнення високої частоти трансформації соматичних клітин екзогенної ДНК мають джерело високомолекулярної ДНК-носія, належним чином забуферене середовище і стан свіжовисіяних реципієнтних клітин.
В експериментах з трансформації як донорську зазвичай використовують отриману із соматичних клітин ДНК, розміри якої перевищують 100 кb, а оптимальною вважається концентрація 500 мкг/мл.
Для підвищення ефективності трансформації Сєров О.Л. (1985) пропонує обробляти DEAE-декстраном препарати очищеної вірусної ДНК, що підвищує стійкість останньої до температурної денатурації, гідролітичної дії ДНКази, що міститься в реципієнтній клітині. Це в остаточному підсумку обумовлює підвищення ефективності трансформації. В останні роки сторазового підвищення ефективності трансформації удалося досягти за рахунок обробки культури соматичних реципієнтних клітин ДНК-кальцій-фосфатним комплексом (преципітатом). Успіх трансформації залежить від реакції середовища, при якій відбувається осадження екзогенної ДНК-кальцій-фосфатним преципітатом, від концентрації ДНК, узятої для утворення комплексу, від обробки реципієнтних клітин диметилсульфоксидом, тривалості інкубації в культурі соматичних реципієнтних клітин з кальцій-фосфатним преципітатом ДНК. Деякі з перерахованих параметрів не мають універсального трансформуючого ефекту, а збільшують число трансформованих реципієнтних клітин тільки стосовно конкретних клітинних ліній.
Схеми добору для рецесивних і домінантних генів різні. ДНК-кальцій-фосфатний преципітат проникає в реципієнтну клітину в результаті адсорбції комплексу на поверхні клітинної мембрани і активного фагоцитозу, що відбувається в перші години інкубації кальцій-фосфатного преципітату ДНК реципієнтними клітинами. При цьому встановлено, що адсорбція та фагоцитоз є енергозалежними процесами і при інгібуванні клітинного дихання вони пригнічуються. На першу годину інкубації кальцій-фосфатний преципітат ДНК виявляється на цитоплазматичній мембрані, потім у вакуолях цитоплазми, а через 8 год після початку інкубації невелика частина екзогенної донорської ДНК досягає ядра реципієнтних клітин, що знаходяться у культурі. На всіх етапах проникнення в клітину екзогенна ДНК залишається зв’язаною з кальцій-фосфатним преципітатом, а розміри і структура донорської ДНК у клітині-реципієнті зберігаються протягом 24 год з моменту початку інкубації.
Перенесення генів у складі сумарної ДНК у реципієнтні соматичні клітини можливе за допомогою таких переносників, як ліпосоми (фосфоліпідні пухирці) чи тіні еритроцитів, у які попередньо поміщають тим чи іншим способом виділений препарат нуклеїнової кислоти. Цим способом можна одержати більшу кількість трансформованих соматичних клітин, ніж при перенесенні ДНК іншими методами. Крім того, трансформація реципієнтних клітин препаратами сумарної ДНК, попередньо укладеної в ліпосоми, відрізняється порівняною простотою.
Ліпосоми мають слабку токсичність, вони здатні захищати нуклеїнові кислоти, що знаходяться всередині й інші макромолекули від деградації. Немає істотних обмежень на виготовлення ліпосом таких розмірів, що дозволили б укласти в них біополімери з молекулярною масою, що коливається в широких межах (від очищених генів до хромосом). Для забезпечення вибіркової спорідненості до певних реципієнтних клітин і збільшення здатності приєднувати до мембран певних клітинних популяцій поверхні ліпосом можна модифікувати за допомогою гліколіпідів, лектинів або ковалентно зв’язаних антитіл. Висловлюється думка, що використання ліпосом для введення ДНК підвищує ефективність трансформації соматичних клітин і дозволяє проводити дослідження з трансформацією тих клітин, для яких інші способи перенесення ДНК неприйнятні.
З відомих методів виготовлення ліпосом найбільш придатним для перенесення сумарної ДНК у реципієнтні соматичні клітини є метод випарювання з оберненням фаз, коли в ліпосо- ми може включатися ДНК масою 108 дальтон. З метою підвищення ефективності перенесення ДНК ліпосомами в соматичні клітини використовують диметилсульфоксид, етиленгліколь, гліцерол, поліетиленгліколь. Остання з названих речовин підвищує здатність ДНК, що знаходиться в ліпосомах, трансформувати реципієнтні клітини в 10 разів, однак ще більш ефективними є помірні концентрації гліцеролу, у якому витримуються клітини після їхнього контакту з ліпосомами. Є дані про те, що екзогенна ДНК вірусу SV40, поміщена в негативно заряджені ліпосоми, виявляється на три порядки інфекційнішою, ніж у випадку її включення в нейтральні ліпосоми. Що стосується динаміки процесу, то найбільш ефективна трансформація соматичних клітин ДНК, укладеної в ліпосоми, відбувається в перші 30 хв інкубації. Є також приклади, що свідчать про високу ефективність трансформації рослинних протопластів препаратами очищеної ДНК Ті-плазміди, укладеної в ліпосоми.
В останні роки успішно розробляється питання про компетенцію до трансформації препаратами екзогенної ДНК реципієнтних соматичних клітин, що знаходяться у культурі. Переконливі приклади свідчать, з одного боку, про генетичну природу високої компетенції клітин до трансформації, з іншого — показують, що ефективність перенесення екзогенної ДНК залежить від фізіологічного стану реципієнтних клітин, їхньої тканинної природи і диференціації.
Перенесення клонованих і очищених генів у соматичні клітини. При вивченні процесу трансформації соматичних і статевих клітин Сєров О.Л. найчастіше використовував клонований ген ТК вірусу герпеса (Herpes simplex), для чого обробляв геномну ДНК вірусу рестрикційними ендонуклеазами Hpal і BamHI. Отримані в результаті ферментативного гідролізу фрагменти ДНК, які містять 8,3 тис. і 3,4 тис. пар нуклеотидних послідовностей, включають ген ТК; іРНК, що утворюється при транскрипції інтактного гена ТК вірусу герпеса, являє собою послідовність, що складається майже з 1,3 тис. залишків нуклеотидів. Крім того, було встановлено, що при біосинтезі ферменту тимідинкінази 107-нуклеотидна ділянка, починаючи від 5’-кінця, іРНК не транслюється. Фрагменти геномної ДНК вірусу герпеса, що включають ген ТК, клонують, використовуючи як вектор плазміди і фаги.
Трансформацію соматичних і статевих клітин геном ТК здійснюють за допомогою рекомбінантних ДНК, сконструйованих шляхом вбудовування фрагментів ДНК вірусу герпеса, що містять ген, який кодує тимідинкіназу. Щоб збільшити ефективність трансформації, соматичні чи статеві клітини обробляють очищеними чи клонованими генами шляхом осадження донорської ДНК кальцій-фосфатним методом. У цьому випадку вдається домогтися введення очищеного або клонованого гена в одну з кожних 105-107 оброблених реципієнтних клітин.
Більш ефективним у порівнянні з описаним методом перенесення генів є введення мікроголкою ДНК, що знаходиться в розчині, у ядра реципієнтних клітин. У цьому випадку трансформується 50-100 % оброблених клітин. Така ж частота трансформації досягається й у тому випадку, коли ядро тільки проколюється мікроголкою. ДНК, що представляє очищений чи клонований ген, у цьому випадку не вводиться безпосередньо в ядро, а використовується для обробки клітин ссавців, що знаходяться в культурі. З інших методів, за допомогою яких переносяться клоновані чи очищені гени в соматичні реципієнтні клітини ссавців, варто вказати на можливість обробки реципієнтних клітин включеними в ліпосоми препаратами ДНК чи високими концентраціями поліетиленгліколю; в останньому випадку вдається домогтися частоти трансформації, порівняної з показником, досягнутим при застосуванні методу мікроін’єкції розчину ДНК у ядро реципієнтної клітини.
Варто також звернути увагу на метод котрансформації, який набуває широкого розповсюдження при введенні в реципієнтні клітини чужорідних неселектованих генів чи фрагментів ДНК. Розробляється також спосіб трансформації реципієнтних клітин за допомогою електричного розряду в полі високої напруги.
Якщо при трансформації як донорський використовується очищений або клонований ген, що кодує тимідинкіназу, то реципієнтними є мутантні клітини, які знаходяться в культурі, у геномі котрих відсутній ген ТК, а для поділу трансформованих і нетрансформованих клітин використовують селективне середовище ГАТ (рис. 4.3). Трансформовані геном ТК реципієнтні клітини здатні рости на середовищі ГАТ, нетрансформовані — гинуть. Істотний вплив на частоту перенесення клонованого гена ТК вірусу герпеса в еукаріотичні реципієнтні клітини робить наявність чи відсутність ДНК-носія. Трансформація клонованим геном ТК вірусу герпеса реципієнтних клітин китайського хом’ячка без ДНК-носія виявилася більш ніж у 200 разів нижчою порівняно з дослідами, у яких клонований ген ТК вірусу герпеса в реципієнтні клітини переносили за участю ДНК-носія. Роль ДНК-носія, на думку дослідників, полягає в захисті клонованого чи очищеного гена, що переноситься, від деградуючого впливу гідролітичних ферментів реципієнтних клітин. Успіх введення очищених чи клонованих генів у соматичні клітини за допомогою кальцій-фосфатного методу значною мірою залежить від концентрації донорської ДНК. Хоча чимало механізмів участі ДНК-носія в забезпеченні успіху трансформації реципієнтних клітин очищеним чи клонованим генетичним матеріалом, а також роль ДНК-носія у формуванні трансгенома залишаються нез’ясованими, факт зміни структури очищених чи клонованих генів, введених у реципієнтні клітини в присутності ДНК-носія, вважається установленим. Установленим, мабуть, варто вважати також те, що структурні зміни екзогенного клонованого генетичного матеріалу при формуванні трансгенома спостерігаються лише в тому випадку, якщо одночасно в реципієнт- ну клітину надходить ДНК-носій. Роль останньої полягає в тому, що структурні зміни, яким піддаються селектовані гени від подальшої деградації захищаються ДНК-носієм шляхом включення селектованого генетичного матеріалу в структуру ДНК- носія і створення трансгенома, що має нові властивості. За відсутності ДНК-носія селектовані гени, в яких під впливом в основному ферментативної дії клітин-реципієнтів відбулися структурні зміни, елімінують, а в реципієнтній клітині залишаються введені інтактні очищені чи клоновані гени.
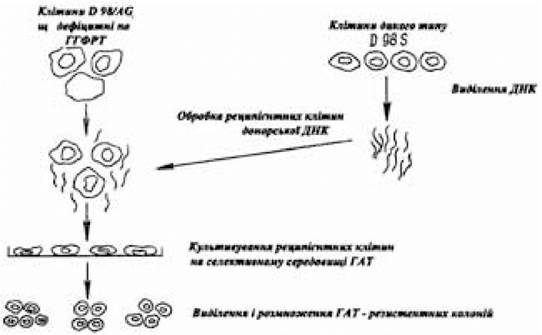
Рис.4.3. Схема експериментів по трансформації соматичних клітин з допомогою ДНК
(за Шибальською Є. та Шибальським В., 1982)
У зв’язку з цим у трансформованих клітинах одночасно можуть знаходитися інтактні молекули екзогенної ДНК і молекули ДНК, в яких відбулися структурні зміни. Трансформовані за допомогою сумарної ДНК реципієнтні клітини характеризуються фенотипом, що може мати стабільний чи нестабільний прояв. Є дані, які свідчать про те, що стабілізація трансформованого фенотипу є наслідком ампліфікації донорського гена чи включення цього гена в геном реципієнтної клітини, хоча поряд з цим є можливість функціонування механізмів, що перешкоджають включенню екзогенної ДНК у геном клітини-реципієнта.
Появу стабільних трансформантів спостерігали при інтеграції донорського генетичного матеріалу, у тому числі ДНК клонованих генів, у хромосоми реципієнтних клітин, що приводило до дестабілізації останніх і виникнення у зв’язку з цим великої кількості хромосомних перебудов. В утворених у результаті інтеграції донорських генів, введених у геномний матеріал реципієнтних клітин як за допомогою тотальної ДНК, так і очищених чи клонованих генів, у стабільних трансформантах через їхню нестійкість настає процес дестабілізації. Цей процес не завжди є наслідком втрати інтегрованого донорського гена, іноді змінюється експресія донорського гена, у зв’язку з чим трансформований фенотип не реалізується.
Взаємозв’язок між станом трансгеному (стабільне — нестабільне), частотою інтеграції донорського генетичного матеріалу в геном реципієнтної клітини і частотою порушення стабільності трансгеному в стабільних трансформантах, з одного боку, та ступенем диференціації і станом каріотипу реципієнтних клітини — з іншого, прослідковується досить чітко. Так, лінії реципієнтних клітин, що мають змінені гетероплоїдні каріотипи (фібробластоподібні клітини), здатні зберігати у своїх геномах донорський генетичний матеріал, що автономно реплікується, з нестабільним трансформованим фенотипом і дестабілізувати трансформований фенотип у стабільних клонах. Навпаки, у реципієнтних клітинах із близьким до нормального чи нормальним каріотипом (статеві клітини) немає умов, що сприяють перебуванню трансгеному в нестабільному автономному стані. Тому при трансформації реципієнтних статевих клітин екзогенною ДНК спостерігається велика кількість стабільних трансформантів.