Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Молекулярная биотехнология микробиологических систем
Генная инженерия растений: применение
Выведение растений, устойчивых к насекомым-вредителям, вирусам и гербицидам
Основной целью биотехнологических экспериментов на растениях является создание новых сортов культурных растений. Большинство ранних исследований было направлено на получение высокоурожайных сортов растений без изменения их пищевой ценности. В растения вводили гены, обеспечивающие их устойчивость к насекомым-вредителям, вирусам, гербицидам, неблагоприятным условиям окружающей среды, и гены, замедляющие старение. Часть этих работ мы рассмотрим ниже. Кроме того, проводились эксперименты по изменению окраски цветов и качества растительных продуктов, а также по использованию растений в качестве «биореакторов».
Растения, устойчивые к насекомым-вредителям
Если бы хлебные злаки можно было изменять методами генной инженерии так, чтобы они продуцировали функциональные инсектициды, то мы получили бы культуры, устойчивые к насекомым-вредителям и не требующие опрыскивания дорогостоящими и опасными химическими пестицидами (зачастую такое опрыскивание приходится проводить от шести до восьми раз в течение вегетационного периода). По оценкам, в 1995 г. на химические инсектициды во всем мире было израсходовано примерно 4 млрд, долларов. Отсюда следует, что себестоимость зерна при возделывании культур, устойчивых к насекомым-вредителям, была бы ниже, чем для неустойчивых. Кроме того, биологические инсектициды обычно действуют лишь на строго ограниченное число видов насекомых и безопасны для человека и других высших животных.
Для создания растений, устойчивых к насекомым-вредителям, с помощью генноинженерных методов были разработаны различные стратегии. В одном случае использовали ген инсектицидного протоксина, продуцируемого одним из подвидов Bacillus ihuringiensis (гл. 15). В другом — гены растительных белков типа ингибиторов амилазы или протеиназ, эффективных в отношении широкого круга насекомых. Насекомое, в организм которого попадал один из этих ингибиторов, было не способно переваривать растительную пищу, потому что ингибиторы препятствовали гидролизу крахмала или растительных белков.
Протоксин В. Ihuringiensis — это безопасное средство защиты растений: попадая в окружающую среду, он теряет активность. К сожалению, множество вредителей хлебных злаков питаются внутренними тканями растения, так что препараты В. thuringiensis, распыляемые на поверхность растений, оказываются малоэффективными. Эту проблему можно решить, если обеспечить экспрессию генов токсинов в самих растениях. Распылять инсектициды в этом случае не потребуется и токсины не попадут в окружающую среду, а кроме того, не возникнет проблем, связанных с ограничением времени их действия в результате разложения. Задача биотехнологов состоит в создании трансгенного растения, которое синтезировало бы активную форму бактериального инсектицида в количестве, достаточном для защиты растения от вредителя. Гены cryIA(a), cryIA(b) и cryIA(c), ответственные за синтез инсектицидных белков В. thuringiensis ssp. kurstaki, практически не экспрессируются в растениях (табл. 18.1), а для выведения представляющих коммерческий интерес жизнеспособных растений, устойчивых к насекомым-вредителям, необходимо, чтобы эти белки синтезировались в большом количестве.
Таблица 18.1. Экспрессия некоторых генов, кодирующих инсектициды Bacillus thuringiensis, в трансгенных растениях1),2)
|
Растение |
Ген |
Экспрессия, % |
Устойчивость к насекомым |
|
Табак |
cryIA(b), полн. |
0,0001-0,0005 |
Нет |
|
Табак |
cryIА(b), укороч. |
0,003-0,012 |
Да |
|
Табак |
сrуIА(а), полн. |
Не определяется |
Нет |
|
Табак |
сrуIА(а), укороч. |
0,00125 |
Да |
|
Табак |
сrуIА(с), укороч. |
<0,014 |
Да |
|
Томат |
cryIA(b), укороч. |
0,0001 |
Да |
|
Хлопок |
cryIA(b), укороч., WT |
<0,002 |
Нет |
|
Хлопок |
cryIA(b), укороч., РМ |
0,05-0,1 |
Да |
|
Томат, табак |
cryIA(b), укороч., WT |
0,002 |
Да |
|
Томат, табак |
сrуIА(b), укороч., РМ |
0,002-0,2 |
Да |
|
Томат, табак |
сrуIA(b), укороч., FM |
0,3 |
Да |
1) По данным работы Ely, р. 105-124, in Entwistle et al. (ed)., Bacillus thuringiensis, an Environmental Biopesticide: Theory and Practice, 1 < 393.
2) Обозначения: полн. — полноразмерный ген протоксина; укороч. — укороченная версия гена протоксина; WT — кодоны дикого типа; РМ — частично измененные кодоны; FM — полностью измененные кодоны.
Пытаясь решить эту проблему, уменьшили размер встроенного гена так, чтобы синтезировалась только N-концевая часть молекулы токсина, и снабдили его сильным растительным промотором, чтобы повысить уровень экспрессии. Количество синтезируемого токсина при этом значительно увеличилось, и трансгенные растения получили некоторую защиту от насекомых-вредителей.
Далее была поставлена задача найти минимальную длину нуклеотидиной последовательности, обеспечивающей активность токсина.
Чтобы определить, есть ли у разных токсинов одинаковый домен, сравнили аминокислотные последовательности протоксинов, продуцируемых различными штаммами В. thuringiensis. Оказалось, что N-концевой участок молекул протоксинов разных штаммов В. thuringiensis ssp. kurstaki высококонсервативен (гомология 98%), а С-концевой более вариабелен (гомология 45%). Дальнейшие исследования показали, что вся инсектицидная активность токсина обеспечивается первыми 646 N-концевыми аминокислотными остатками молекулы протоксина, общая длина которой составляет 1156 аминокислот. Участок гена протоксина, кодирующий высококонсервативную аминокислотную последователь, клонировали, экспрессировали в бактериях и обнаружили, что в отношении защиты растений от насекомых отряда чешуекрылых в лабораторных условиях укороченный белок столь же эффективен, как и его нативная форма.
Для всестороннего изучения способности укороченного гена протоксина обеспечивать защиту растений от различных насекомых-вредителей были выведены трансгенные растения томата. Укороченный ген, снабженный сильным конститутивным 358-промотором вируса мозаики цветной капусты и сайтом терминации транскрипции/полиаденилирования гена нопалинсинтазы, клонировали в Т-ДНК коинтегративного Ті-плазмидного вектора (рис. 18.1). Вектор содержал также: 1) ген устойчивости к спектиномицину (Spcr), позволяющий проводить отбор либо в Е. coli, либо в A. tumefaciens; 2) сайт инициации репликации Е. coli; 3) ген неомицинфосфотрансферазы под контролем промотора и сайта терминации транскрипции/полиаденилирования гена нопалинсинтазы, позволяющий проводить отбор трансформированных растительных клеток в присутствии канамицина. Кроме того, коинтегративный вектор содержал правую фланкирующую последовательность Т-ДНК нопалиновой Ti-плазмиды и сегмент октопиновой Ti-плазмиды, обеспечивающий образование коинтеграта с «разоруженной» Ті-плазмидой с помощью гомологичной рекомбинации. Сконструированной плазмидой трансформировали Е. coli, а затем с помощью конъюгации перенесли ее в штамм A. tumefaciens, содержащий «разоруженную» Ті-плазмиду. После рекомбинации в A. tumefaciens укороченный ген протоксина включался в хромосомную ДНК томата.

Рис. 18.1. Коинтегративный клонирующий вектор, несущий ген инсектицидного токсина В. thuringiensis (B.t). Ген находится под контролем сильного конститутивного 35S-пpoмотоpa (p35S) вируса мозаики цветной капусты и сайта терминации транскрипции/полиаденилирования гена нопалинсинтазы (tNOS). Вектор содержит также: сайт инициации репликации Е. coli (on) и ген устойчивости к спектиномицину (Spcr), что обеспечивает его амплификацию в Е. coli и позволяет проводить отбор соответствующих клеток; правую фланкирующую последовательность Т-ДНК; растительный селективный маркерный ген; последовательность, гомологичную неонкогенной Ті-плазмиде и обеспечивающую интеграцию двух плазмид. Ген неомицинфосфотрансферазы (NPT) находится под контролем элементов регуляции транскрипции гена нопалинсинтазы (pNOS и tNOS) и используется для отбора канамицинустойчивых трансформированных растительных клеток.
И в оранжерее, и при полевых испытаниях трансгенные растения томата, которые синтезировали укороченную форму протоксина, проявляли некоторую защищенность от таких насекомых, как бражник (Manduca sexta), совка, повреждающая плоды томата (Heliothis zea), выемчатокрылая моль (Keiferia lycopersicellа) (табл. 18.2). Эффект был неодинаков для разных насекомых и не абсолютен: наиболее выражен он был в первых двух случаях. Иногда хороший результат давала обработка растений, синтезирующих протоксин, химическим инсектицидом в низких дозах. Однако для того чтобы определить, как еще больше уменьшить ущерб, причиняемый указанными выше и другими насекомыми-вредителями, необходимы дальнейшие исследования.
Для кардинального повышения уровня экспрессии использовались два других подхода (табл. 18.1). В первом случае методом сайт-специфического мутагенеза изменяли те участки выделенного гена токсина, которые могли бы быть ответственны за снижение эффективности транскрипции или трансляции в растении-хозяине (в этих экспериментах использовали и табак, и томаты). При этом нуклеотидная последовательность измененного гена на 96,5% совпадала с таковой у гена дикого типа. Трансгенные растения, в которых экспрессировался такой «слабо» модифицированный ген, синтезировали в 10 раз больше токсина, чем растения, трансформированные геном дикого типа.
Во втором случае была разработана и синтезирована химическими методами «полностью» измененная форма гена токсина. Такой ген содержал кодоны, чаще используемые растениями по сравнению с теми, которые «предпочитают» грамположительные бактерии. Были внесены также изменения, предотвращающие образование вторичной структуры у мРНК или исключающие появление сайтов полиаденилирования, характерных для растений, что могло бы снизить уровень экспрессии. GC-содержание «полностью» измененного гена было равно 49% (для гена дикого типа эта величина составляла 37%), а нуклеотидная последовательность была только на 78,9% гомологична таковой гена дикого типа.
Таблица 18.2. Чувствительность трансгенных растений томата и растений дикого типа к насекомым-вредителям1)
|
Насекомое |
Доля поврежденных растений или плодов, % |
|||
|
растения дикого типа |
трансгенные растения |
|||
|
без инсектицида |
с инсектицидом |
без инсектицида |
с инсектицидом |
|
|
Бражник |
47,5 |
3,75 |
1,25 |
0,00 |
|
Совка |
20,1 |
Не определяется |
6.4 |
Не определяется |
|
Выемчатокрылая моль |
99,7 |
95,1 |
94,2 |
80,4 |
1) По данным работы Delannay et al., Bio/Technology 7: 1265—1269, 1989.
Трансгенные растения, трансформированные сильно измененным геном протоксина, синтезировали в 100 раз больше токсина, чем растения, трансформированные геном дикого типа, при этом наблюдалась прямая корреляция с увеличением инсектицидной активности. Полученные данные позволяют надеяться, что аналогичным образом удастся повысить уровень экспрессии в растениях множества других чужеродных генов.
Количество синтезируемого в растениях протоксина попытались увеличить, осуществив экспрессию «полностью» измененного гена протоксина под контролем промотора гена малой субъединицы рибулозобисфосфат-карбоксилазы, помещенного после хлоропласта ой сигнальной последовательности этого фермента, таким образом, чтобы сверхпродуцируемый протоксин был локализован в хлоропластах. Эта стратегия привела к радикальному повышению уровня экспрессии гена протоксина, так что на долю протоксина стало приходиться до 1% всех белков листа. В другом эксперименте ген протоксина вводили непосредственно в хлоропластную ДНК растения-хозяина. Это дает следующие преимущества. Во-первых, вводимый ген не нужно модифицировать, поскольку транскрипционный и трансляционный аппараты хлоропластов относятся к прокариотическому типу. Во-вторых, на одну клетку приходится много хлоропластов, а на один хлоропласт — много копий хлоропластной ДНК, поэтому ген протоксина присутствует в большом числе копий, и эффективность его экспрессии повышается. В-третьих, хлоропласти передаются только через яйцеклетку, а не через пыльцу, так что растения наследуют хлоропластную ДНК по материнской линии и нет никакого риска нежелательного переноса гена протоксина с пыльцой на другие растения.
Одна из форм гена протоксина уже введена и экспрессируется в таких растениях, как томаты, табак, картофель, рис, кукуруза, яблоня, баклажан, канола, люцерна, орех, тополь, ель, клюква и хлопок. Перспективы применения этого метода защиты растений кажутся весьма обнадеживающими. Так, в трансгенных растениях картофеля осуществлена эффективная экспрессия синтетического гена на основе гена инсектицидного токсина В. thuringiensis ssp. tenebrionis с кодовым словарем, используемым растениями. Полученные растения оказались высокоустойчивыми к колорадскому жуку, основному вредителю картофеля. Уже проведены успешные полевые испытания культуры в течение нескольких лет и получено разрешение на коммерческое ее использование в США. Следует помнить, однако, о необходимости постоянного контроля популяции насекомых-вредителей, с тем чтобы вовремя обнаружить устойчивые организмы. Возможно, в будущем для защиты трансгенного картофеля придется использовать более мощный протоксин В. thuringiensis или, что более вероятно, идентифицировать и клонировать в растениях другие инсектицидные гены в дополнение к генам протоксинов В. thuringiensis.
В настоящее время разрабатываются способы сниженияь селективного давления со стороны трансгенных растений, экспрессирующих ген протоксина В. thuringiensis, на устойчивых насекомых-вредителей. В одном случае экспрессию гена В. thuringiensis в трансгенном растении ограничивали по времени. Для этого его помещали под контроль промотора гена табака PR-la (от англ. pathogenesis-related), экспрессия которого представляет собой часть естественного механизма защиты табака от болезнетворных организмов. Ген PR-la индуцируется любым патогенным организмом или химическим агентом типа салициловой или полиакриловой кислоты Обработав трансгенные растения, несущие ген протоксина В. thuringiensis под контролем PR-lа-промотора, химическим индуктором, обнаружили, что они синтезируют инсектицид в заметном количестве в течение 1 сут после обработки, и этого достаточно для последующей защиты растений от насекомых-вредителей. Таким образом, можно индуцировать синтез протоксина, обработав трансгенное растение недорогим и безопасным химическим веществом в определенный момент вегетационного периода. Такая периодичность синтеза протоксина приводит к снижению селективного давления на устойчивых насекомых. Аналогичные системы могут оказаться полезными для регуляции синтеза самых разных чужеродных белков в трансгенных растениях. Ни один из конкретных типов протоксина В. thuringiensis не может быть эффективным в отношении всех видов насекомых. В ходе эволюции растения выработали общие механизмы защиты от насекомых, обеспечивающие их выживание, однако степень этой зашиты не всегда достаточна. Некоторые растения синтезируют ингибиторы протеиназ, которые, попадая в кишечник насекомого, блокируют гидролиз растительных белков. Разумно было предположить, что если выделить растительный ген ингибитора протеиназ и снабдить его сильным промотором, то можно будет создать трансгенные сельскохозяйственные культуры, способные синтезировать ингибитор протеиназ в количестве, достаточном для защиты от насекомых-вредителей. В одном из таких экспериментов с помощью химически синтезированного ДНК-зонда из банка клонов комплементарной ДНК (кДНК) был выделен клон, кодирующий ингибитор трипсина вигны китайской. (При синтезе ДНК-зонда руководствовались аминокислотной последовательностью этого белка.) Полноразмерную кДНК субклонировали в бинарном векторе на основе Ті-плазмиды (рис. 18.2) и ввели в штамм A. tumefaciens, содержащий неонкогенную Ті-плазмиду с активными vir-генами. После инфицирования листовых дисков табака A. tumefaciens этим вектором клетки, содержащие комплементарную ДНК, отбирали по способности к росту в присутствии канамицина и регенерировали из них трансгенные растения. Ущерб, наносимый личинками Heliothis virescens (совки) трансгенным растениям, синтезирующим более 2 мкг ингибитора трипсина на 1 мг растительного белка, был значительно меньше, чем в случае обычных растений.
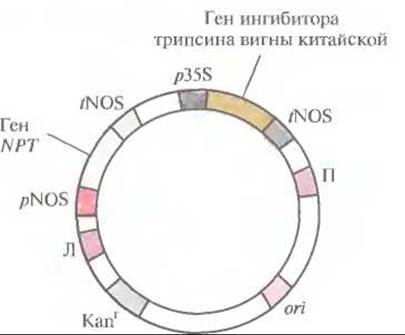
Рис. 18.2. Бинарный клонирующий вектор, несущий ген ингибитора трипсина вигны китайской. Вектор содержит сайт инициации репликации ДНК для широкого круга хозяев (on) и ген устойчивости к канамицину (Каnr), который функционирует как в Е. coli, так и в A. tumefaciens. Между правой (П) и левой (Л) фланкирующими последовательностями Т-ДНК находятся: 1) ген неомицинфосфотрансферазы (NPT) под контролем элементов регуляции транскрипции гена нопалинсинтазы (pNOS и tNOS), что позволяет проводить отбор канамицинустойчивых трансформированных растительных клеток; 2) ген ингибитора трипсина вигны китайской, находящийся под контролем 35S-пpoмотора (p35S) вируса мозаики цветной капусты и сигнала терминации транскрипции/полиаденилирования гена нопалинсинтазы (tNOS).
Семена вигны китайской, содержащие указанное выше количество ингибитора, нетоксичны для животных и человека. Впрочем, если бы такая опасность и существовала, можно было бы ограничить экспрессию гена ингибитора теми тканями растения, которыми предпочитают питаться основные насекомые-вредители, но которые не используют в пищу человек и животные. Так, клонированный ген ингибитора протеиназ мог бы «работать» в листьях и корнях растения, но не в его плодах.
Введение гена ингибитора II протеиназы картофеля в растения риса защищает их от розового стеблевого точильщика (Sesamia inferens), основного насекомого-вредителя для этой культуры; заражение приводит к образованию полых стеблей и мертвых метелок без семян. Была сконструирована плазмида, содержащая ген ингибитора II протеиназы картофеля под контролем его собственного промотора и сигнала терминации транскрипции. Между промотором и кодирующей областью гена ингибитора был встроен первый интрон гена актина риса. Эту конструкцию ввели в суспендированные клетки риса методом бомбардировки микрочастицами (рис. 18.3) и регенерировали из них трансгенные растения. Когда личинок розового стеблевого точильщика наносили на полученные таким образом растения, только от 15 до 20% последних оказывались поврежденными, в то время как для растений дикого типа эта величина составляла 70—100%. Поскольку растительные ингибиторы протеиназ являются обычными компонентами рациона человека и животных и в процессе приготовления пищи быстро инактивируются, их введение в новые зерновые культуры можно считать безопасным.
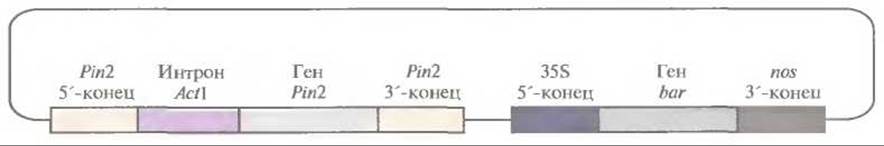
Рис. 18.3. Плазмидный вектор, несущий ген ингибитора II протеиназы картофеля. Обозначения: Ріn2— ген ингибитора II протеиназы картофеля; 5'-конец — сегмент ДНК, предшествующий данному гену; 3'-конец — сегмент ДНК, следующий за геном; интрон Actl — первый интрон гена актина 1 риса; 35S 5'-конец — 35S-промотор вируса мозаики цветной капусты; bar — бактериальный ген фосфинотрицин-ацегилтрансферазы; nos 3'-конец — сегмент ДНК, следующий за геном нопалинсинтазы. Ген bar служит селективным маркером для трансгенных растений, обусловливая устойчивость к гербициду Basta (глюфозинату аммония).
Другой подход к увеличению эффективности защиты растений с помощью токсина В. thuńngiensis основан на параллельном использовании этого токсина и ингибитора сериновой протеиназы. Показано, что смесь очищенного токсина В. thuńngiensis в количестве, обеспечивающем минимальную смертность насекомых, и ингибитора протеиназ в низких концентрациях обладает в 20 раз большей инсектицидной активностью, чем один протоксин В. thuringiensis. Чтобы проверить, будет ли эта система функционировать в трансгенных растениях, был сконструирован фрагмент ДНК, кодирующий гибридный белок «ингибитор протеиназ/укороченный токсин». Трансгенные растения табака, которые синтезировали небольшие количества такого рекомбинантного белка, были в значительной мере защищены от насекомых-вредителей.
Еще один способ защиты растений предполагает введение в них гена, кодирующего ингибитор а-амилазы. Большой ущерб зерновым приносят такие насекомые, как зерновка (Callosobruchus maculatus) и долгоносик лучистой фасоли (С. chinensis), питающиеся семенами. Если в рацион личинок этих насекомых включить обычную фасоль (Phaseolus vulgaris), то рост насекомых замедляется. Это связано с присутствием в семенах обычной фасоли ингибитора а-амилазы. Ген ингибитора а-амилазы, выделенный из обычной фасоли, был помещен под транскрипционный контроль сильного семяспецифичного промотора гена фитогемагглютинина бобов и использован для трансформации гороха (Pisum sativum), обычно весьма чувствительного к упомянутым выше насекомым. Трансгенные растения гороха, которые синтезировали ингибитор а-амилазы, были устойчивы к обоим насекомым, при этом в случае зерновки эффект оказался пропорциональным количеству ингибитора, синтезированному растением (рис. 18.4). Альтернативный подход к выведению трансгенных растений, устойчивых к насекомым, основан на использовании бактериального гена холестеролоксидазы. Этот фермент, синтезируемый различными бактериями, катализирует окисление 3-гидроксистероидов с образованием кетостероидов и пероксида водорода. Его часто используют при определении уровня холестерола в сыворотке крови у человека, а в небольших количествах он проявляет высокую инсектицидную активность против личинок хлопкового долгоносика (Anthonomus grandis grandis) (рис. 18.5). Это широко распространенное насекомое отряда жесткокрылых наносит ощутимый ущерб хлопковым плантациям. В отношении насекомых-вредителей отряда чешуекрылых холестеролоксидаза менее эффективна. Действие фермента, по-видимому, заключается в разрушении мембраны эпителиальных клеток средней кишки насекомого, что приводит к его гибели. Ген холестеролоксидазы, кодирующий белок мол. массой 55 000 Да (504 аминокислотных остатка) и лидерный пептид мол. массой 5000 Да (43 аминокислотных остатка), был выделен из штамма Streptomyces и встроен в вектор вместе с промотором вируса мозаики норичника шишковатого и сигналом терминации из 3'-области гена нопалинсинтазы A. tumefaciens. Когда такую конструкцию ввели в протопласты клеток табака, трансформированные клетки стали активно экспрессировать холестеролоксидазу. В будущем, вероятно, этот ген будет введен в растения хлопка, и тогда — либо самостоятельно, либо в комбинации с генами других биологических инсектицидов — он станет эффективным инструментом защиты растений от насекомых-вредителей.

Рис. 18.4. Зависимость смертности личинок зерновки, развивающихся на трансгенных растениях гороха, от количества ингибитора а-амилазы, синтезируемого растениями.
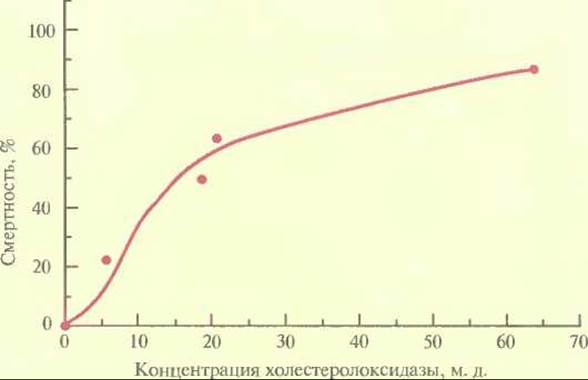
Рис. 18.5. Зависимость смертности личинок хлопкового долгоносика от концентрации холестеролоксидазы. (Corbin et al., Appl. Environ. Microbiol. 60: 4239—4244, 1994.)
Растения, устойчивые к вирусам
Вирусы растений часто причиняют значительный ущерб растениям и существенно снижают урожай. Чтобы не прибегать к обработке культур химическими препаратами, селекционеры попытались перенести природные гены устойчивости к вирусам от одной линии растений к другой. Однако устойчивые растения часто вновь становятся чувствительными, а устойчивость к одному вирусу не гарантирует устойчивости к другим. Природный иммунитет к вирусным инфекциям обусловливается разными причинами: блокированием проникновения вируса в растение, предотвращением его распространения, подавлением симптомов вирусной инфекции. Чтобы получить растения, устойчивые к вирусам, проводили их «иммунизацию» вирусными генами, кодирующими белки оболочки, другими вирусными генами или антисмысловыми последовательностями вирусного генома.
Если в трансгенном растении экспрессируется ген, кодирующий белок оболочки вируса, который обычно инфицирует это растение (а данный белок зачастую является основным белковым компонентом вируса), то способность вируса проникать в растение и распространяться в нем часто значительно уменьшается. Механизм ингибирования пролиферации вируса в присутствии генов белка оболочки точно не установлен, однако ясно, что противовирусное действие начинает проявляться на ранних стадиях репликации вируса, так что вирусные частицы не образуются. Это снижает вероятность возникновения спонтанных вирусных мутантов, способных к репликации в присутствии вирусного белка оболочки. С помощью этого подхода были получены устойчивые к различным вирусам трансгенные растения множества различных зерновых культур (табл. 18.3). И хотя абсолютной устойчивости при этом достичь не удавалось, ее уровень был весьма высок. Более того, обнаружилось, что ген белка оболочки одного вируса иногда обеспечивает устойчивость к широкому кругу неродственных вирусов. Ценность подхода повышается и благодаря тому, что трансгенные растения развиваются одинаково как в полевых условиях, так и в лаборатории.
Молекула РНК, комплементарная транскрипту нормального гена (мРНК), называется антисмысловой, а сама мРНК, участвующая в трансляции, — смысловой. Антисмысловая РНК образует дуплекс с мРНК, блокируя тем самым трансляцию, так что в ее присутствии синтез белкового продукта соответствующего гена уменьшается. Кроме того, дуплекс антисмысловая РНК—мРНК быстро деградирует, что уменьшает содержание конкретной мРНК в клетке. Учитывая все сказанное выше, можно попытаться предотвратить репликацию растительных вирусов и защитить от них растения, введя в них ген, обеспечивающий синтез антисмысловых РНК, комплементарных мРНК вирусного белка оболочки.
Таблица 18.3. Некоторые устойчивые к вирусам трансгенные растения, синтезирующие белки оболочки вирусов1)
|
Растение |
Вирусы — источники генов |
|
Nicotiana beulhamiana, |
Вирус скрытой мозаики сливы |
|
N. clevelandii |
|
|
N. beulhamiana, тыква |
Вирус 2 мозаики арбуза |
|
N. beulhamiana, тыква |
Вирус желтой мозаики кабачков |
|
Папайя, табак |
Вирус кольцевой пятнистости папайи |
|
Картофель |
Вирус скручивания листьев картофеля |
|
Картофель |
Вирус Y картофеля |
|
Картофель, |
Вирус S картофеля |
|
Nicotiana debneyii |
|
|
Картофель, табак |
Вирус X картофеля |
|
Рис |
Вирус полосатости риса |
|
Табак |
Вирус мозаики резухи |
|
Табак |
Вирус мозаики сои |
|
Табак |
Вирус гравировки табака |
|
Табак |
Вирус полосатости табака |
|
Табак |
Вирус бронзовости томата |
|
Табак, люцерна, томат |
Вирус мозаики люцерны |
|
Табак, огурец |
Вирус мозаики огурца |
|
Табак, N. beulhamiana |
Вирус погремковости табака |
|
Табак, томат |
Вирус табачной мозаики |
|
Томат |
Вирус мозаики томатов |
1) Поданным работы Fitchen, Beachy, Аnnu. Rev. Microbiol. 47: 739-763. 1993.
Для сравнения эффективности подходов, основанных на использовании вирусного гена белка оболочки, с одной стороны, и антисмысловой РНК — с другой, клонировали кДНК белка оболочки вируса мозаики огурца (CuMV) в растениях табака в двух ориентациях, «смысловой» и «антисмысловой» (в каждом конкретном растении — одна из этих ориентаций), а затем определили чувствительность трансгенных растений к вирусной инфекции (рис. 18.6). Геном CuMV представлен тремя отдельными одноцепочечными молекулами РНК, каждая из которых кодирует определенный вирусный белок. In vivo одна из этих молекул — PHК3 — подвергается процессингу; часть ее последовательности удаляется и образуется РНК4, кодирующая вирусный белок оболочки. Создание трансгенных растений, которые синтезируют либо нормальную мРНК и вирусный белок оболочки, либо соответствующую антисмысловую РНК, включает следующие
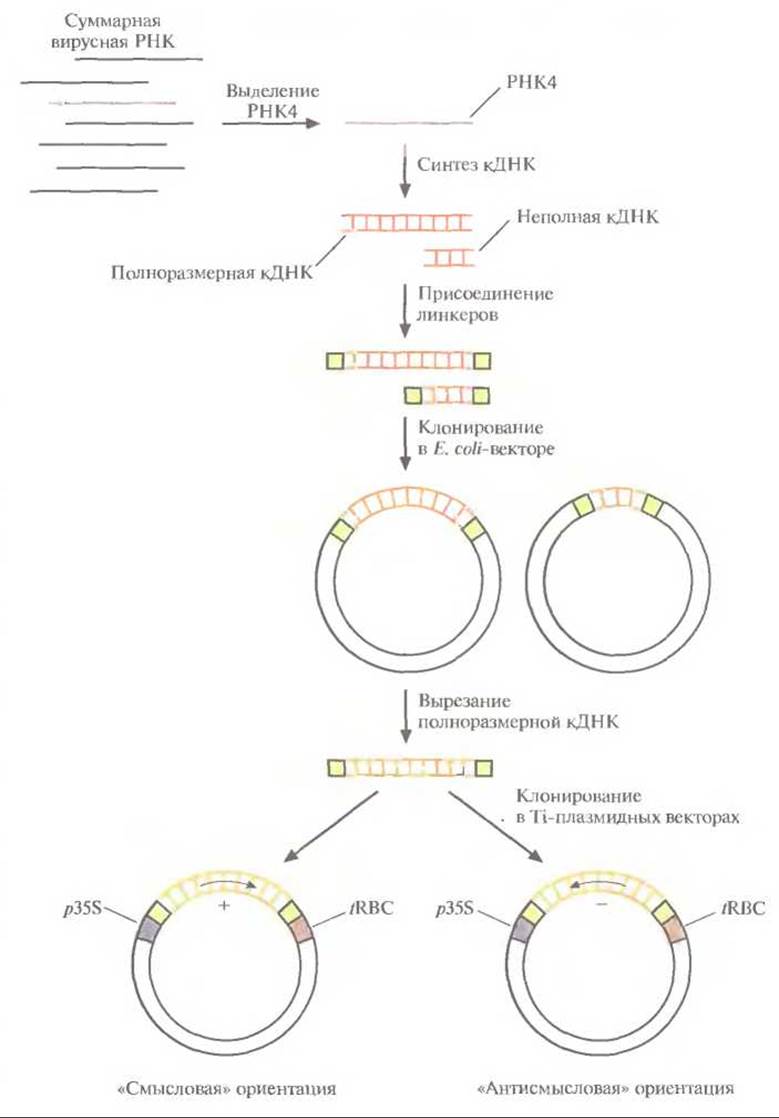
Рис. 18.6. Процедура введения кДНК белка оболочки вируса мозаики огурца в растительные клетки. РНК4, кодирующую белок оболочки, выделяют из суммарного препарата вирусной РНК и используют в качестве матрицы для синтеза двухцепочечной кДНК. К кДНК присоединяют линкерные последовательности и встраивают ее в вектор на основе Е. соli-плазмиды. Отбирают клоны, содержащие полноразмерную кДНК, вырезают ее из Е. coli-вектора и встраивают в Ti-плазмидный вектор между 35S-пpoмoтopoм вируса мозаики цветной капусты (p358) и сигналом терминации транскрипции гена малой субъединицы рибулозобисфосфат-карбоксилазы (fRBC). При этом кДНК РНК4 встраивается в двух ориентациях, так что в одном случае транскриптом является смысловая РНК и синтезируется белок оболочки, в другом образуется РНК, комплементарная мРНК белка оболочки, — антисмысловая РНК.
1. Выделение РНК4.
2. Ферментативный синтез in vitro кДНК на РНК4.
3. Присоединение к кДНК линкерных последовательностей.
4. Встраивание полноразмерной кДНК в векторы для клонирования в обеих ориентациях, в каждой из которых она находится под контролем 35S-пpoмотopa вируса мозаики цветной капусты и регуляторных сигналов терминации транскрипции растительного гена малой субъединицы рибулозобисфосфат-карбоксилазы.
5. Регенерация отдельных трансгенных растений, в геном которых встроена кДНК в одной из двух возможных ориентаций. Для введения кДНК, кодирующих смысловую (белок-кодирующую) и антисмысловую РНК, в отдельные клетки табака использовали бинарную векторную систему на основе Ті-плазмид (рис. 18.7). В трансгенных растениях, синтезирующих белок оболочки вируса CuMV, вирусные частицы не накапливались и симптомы инфекции не проявлялись независимо от титра инокулята. В отличие от этого трансгенные растения, синтезирующие антисмысловую РНК белка оболочки CuMV, проявляли устойчивость только при малых концентрациях вирусных частиц в инокуляте.
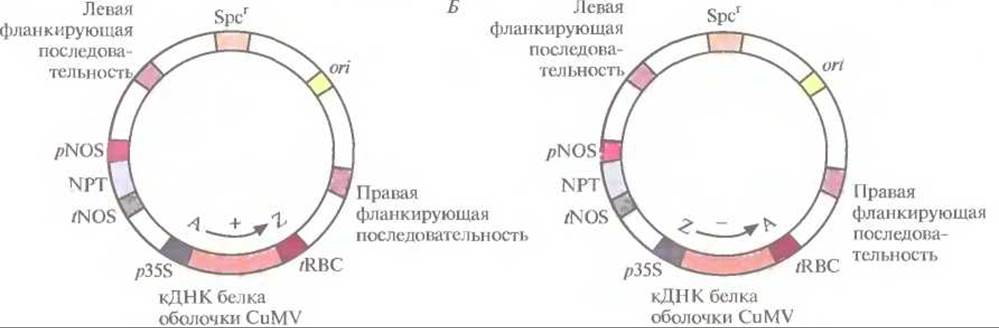
Рис. 18.7. Бинарные клонирующие векторы на основе Ті-плазмид, содержащие кДНК белка оболочки вируса мозаики огурца (CuMV) в «смысловой» (А) или «антисмысловой» (Б) ориентации. кДНК находятся под контролем 35S-пpoмотopa (p35S) вируса мозаики цветной капусты и сигнала терминации транскрипции/полиаденилирования гена малой субъединицы рибулозобисфосфат-карбоксилазы (tRBC). Векторы содержат также ген неомицинфосфотрансферазы (ген NPT), находящийся под контролем элементов регуляции транскрипции гена нопалинсинтазы (pNOS и tNOS), ген устойчивости к спектиномицину (Spcr), правую и левую фланкирующие последовательности Т-ДНК и сайт инициации репликации ДНК для широкого круга хозяев (orі). А → Z — «смысловая» ориентация кДНК, Z → А — «антисмысловая».
Сходные результаты были получены в других лабораториях, где были созданы трансгенные растения, синтезирующие антисмысловые РНК-копии генов вирусных белков оболочки, и проверено, смогут ли эти растения противостоять вирусной инфекции. Во всех случаях растения проявляли устойчивость к инфекции, только если титр используемого инокулята был мал. Общий вывод, который можно сделать из подобных экспериментов, состоит в следующем: антисмысловые РНК-копии генов вирусных белков оболочки обеспечивают гораздо худшую защиту трансгенных растений от вирусных инфекций, чем смысловые копии генов белков оболочки вируса. Возможно, не стоит совсем отказываться от стратегии защиты, основанной на использовании антисмысловой РНК, однако прежде чем внедрять эту методику, ее необходимо значительно усовершенствовать.
Часто сельскохозяйственные культуры бывают подвержены нескольким вирусным инфекциям; любая из них может нанести ущерб растениям и снизить урожай. В идеале трансгенные растения должны быть устойчивы более чем к одному вирусу. Чтобы достичь этой цели, для трансформации растений желтой яйцевидной тыквы (Cucurbita реро) использовали бинарные векторы на основе Ті-плазмид, несущие один или несколько генов белков оболочки CuMV, вируса желтой мозаики кабачков и вируса 2 мозаики арбуза (рис. 18.8). Трансгенные растения, в которых экспрессировались все три гена, в лабораторных условиях были устойчивы ко всем указанным вирусам. Растения, экспрессирующие гены белков оболочки вируса желтой мозаики кабачков и вируса 2 мозаики арбуза, были проверены в полевых условиях на устойчивость к тлям — насекомым, являющимся природным переносчиком этих вирусов в растущие растения. Если в растении экспрессировались оба гена белков оболочки, то они проявляли полную устойчивость к одновременной инфекции этими вирусами (рис. 18.9), а если наблюдалась экспрессия только одного из вирусных белков оболочки, то заражение происходило не сразу, но в конце концов все симптомы вирусной инфекции проявлялись, и растение утрачивало коммерческую ценность. Итак, ясно, что наиболее эффективной стратегией при выведении трансгенных растений, устойчивых ко всем основным вирусам, замедляющим их рост и развитие, является введение в них нескольких генов, детерминирующих синтез белков оболочки вирусов.
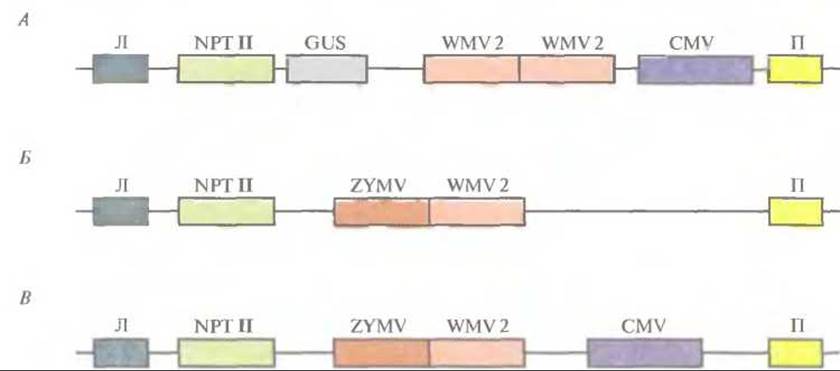
Рис. 18.8. А. Т-ДНК, несущая ген неомицинфосфотрансферазы (NPT II) в качестве селективного маркера, ген ß-глюкуронидазы (GUS) в качестве репортерного гена, две копии гена белка оболочки вируса 2 мозаики арбуза (WMV2) и ген белка оболочки вируса мозаики огурца (CMV). Левая и правая фланкирующие последовательности Т-ДНК обозначены Л и П соответственно. Б. Конструкция, аналогичная конструкции А, но без CMV и NPT II, содержащая одну копию WMV2 и ген белка оболочки вируса желтой мозаики кабачков (ZYMV). В. Конструкция, аналогичная конструкции Б, но содержащая CMV. Во всех трех конструкциях присутствуют соответствующие промоторы и сигналы терминации транскрипции.
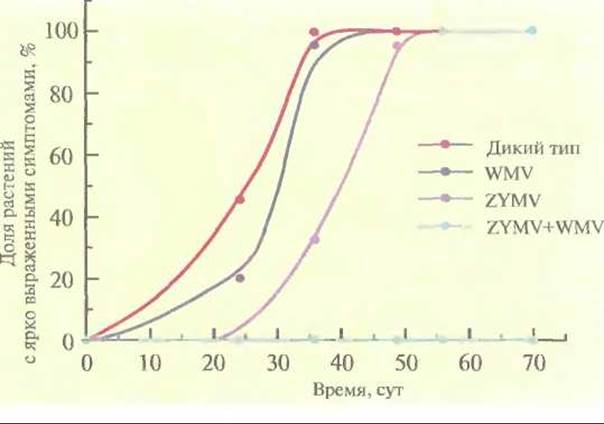
Рис. 18.9. Частота заболеваний трансгенных растений желтой яйцевидной тыквы и растений дикого типа в полевых условиях. Для передачи растениям тыквы смеси вируса желтой мозаики кабачков (ZYMV) и вируса 2 мозаики арбуза (WMV) использовали тлю. (По данным работы Fuchs, Gonsalves, Bio/Technology 13: 1466-1473, 1995.)
Имеются предварительные данные о том, что трансгенные растения, в которых экспрессируются вирусные гены, отличные от генов белков оболочки (например, ген вирусных сателлитных РНК или ген репликации вируса), также оказываются в какой-то мере защищенными от вирусных инфекций, но насколько эффективными и применимыми будут соответствующие подходы, пока неясно.
Защита растений от патогенных вирусов может осуществляться не только их «иммунизацией» генами вирусных белков, но и при участии противовирусных белков, синтезируемых самими растениями. Например, в клеточной стенке фитолакки американской (Phytolacca americana) присутствуют три разных противовирусных белка: РАР, синтезируемый в листьях весной, PAPII, обнаруживаемый в листьях летом, и РАР-S, содержащийся в семенах. Эти белки легко выделить из водных экстрактов измельченных тканей растения. Если небольшое количество РАР нанести на листья других растений, то последние также окажутся устойчивыми к нескольким вирусам. Таким образом, ген белка РАР вполне можно использовать для получения трансгенных растений, устойчивых к широкому спектру вирусов растений.
Выделенную кДНК РАР вводили в геном табака и картофеля с помощью бинарных векторов на основе Ті-плазмид. Трансформанты, синтезирующие РАР в большом количестве (> 10 нг на 1 мг суммарного белка), были чахлыми, пятнистыми и бесплодными, растения же с более низким содержанием РАР (1—5 нг на 1 мг белка) имели нормальный внешний вид и были фертильны. Эти данные говорят о том, что если концентрация РАР превышает некоторый пороговый уровень, то нормальное функционирование клетки нарушается. Противовирусный эффект белка РАР в трансгенных растениях проявляется в основном в уменьшении числа повреждений; однако, если уж повреждение возникало, то растение систематически инфицировалось. Отсюда следует, что РАР подавляет вирусную инфекцию на ранней стадии. Тем не менее, когда трансгенные растения табака и картофеля, экспрессирующие РАР в небольших количествах, инфицировали вирусами картофеля X или Y, на листьях обнаруживалось значительно меньше повреждений, чем в случае нетрансформированных контрольных растений. Поскольку противовирусное действие РАР проявляется при относительно небольших его концентрациях, можно попытаться создать трансгенные растения, синтезирующие этот белок в малом количестве, и параллельно использовать другие способы защиты растений от вирусов.
Растения, устойчивые к гербицидам
Несмотря на то что на производство более 100 различных химических гербицидов во всем мире ежегодно расходуется 10 млрд, долларов, примерно 10% урожая теряется из-за большого количества сорняков. Кроме того, многие гербициды оказывают одинаковое действие на сорняки и сельскохозяйственные культуры; нередко обработку полей необходимо проводить еще до появления сорняков, а некоторые гербициды накапливаются в окружающей среде. Чтобы решить хотя бы некоторые из этих задач, можно попытаться создать сельскохозяйственные культуры, устойчивые к гербицидам.
Для этого можно
✵ уменьшить поглощение гербицида растением
✵ обеспечить синтез белка, чувствительного к гербициду, в таком количестве, чтобы его хватало на выполнение присущих ему функций в присутствии гербицида
✵ уменьшить способность белка, чувствительного к гербициду, к связыванию с ним
✵ обеспечить инактивацию гербицида в растении в ходе метаболизма.
Из этих подходов были реализованы три последних. Выведенные с их помощью гербицид- устойчивые трансгенные растения перечислены в табл. 18.4.
Были получены растения, устойчивые к глифосфату — гербициду, быстро разлагающемуся в почве на нетоксичные составляющие и потому безопасному для окружающей среды. Глифосфат является ингибитором 5-енолпирувилши- кимат-3-фосфатсинтазы (EPSPS) — фермента, играющего важную роль в синтезе ароматических аминокислот и у бактерий, и у растений. Из глифосфатустойчивого штамма Е. coli был выделен ген, кодирующий EPSPS, помещен под контроль растительного промотора и сигналов терминации транскрипции/полиаденилирования и введен в растительные клетки. Трансгенные растения табака, петуньи, томата, картофеля и хлопка, синтезировавшие EPSPS в количестве, достаточном для замены ингибированного гербицидом растительного фермента, были устойчивы к глифосфату и при обработке, в отличие от сорняков, не погибали.
Другой способ приобретения устойчивости — с помощью инактивации гербицида — был реализован для бромоксинила (3,5-дибром-4-гидроксибензонитрила) — гербицида, который ингибирует фотосинтез. Устойчивые растения создавали путем введения в их геном бактериального гена, кодирующего нитрилазу, которая инактивирует бромоксинил еще до того, как он начинает действовать (рис. 18.10). Из почвенной бактерии Klebsiella ozaenae был выделен ген нитрилазы, помещен под контроль светочувствительного промотора гена малой субъединицы рибулозобисфосфат-карбоксилазы и встроен в геном табака. Трансгенные растения синтезировали активную нитрилазу и были устойчивы к бромоксинилу.
Таблица 18.4. Некоторые примеры генетически обусловленной устойчивости к гербицидам
|
Гербицид |
Способ приобретения устойчивости |
|
Триазины |
Изменение гена psbA. кодирующего хлоропластный белок D-1, на который этот гербицид действует |
|
Сульфонилуреазы |
Введение в растительный геном генов, кодирующих устойчивые формы ацетолактатсинтетазы (гены вводились в растения тополя, канолы, льна и риса) |
|
Имидазолиноны |
Отбор в культуре клеток линий, синтезирующих устойчивые формы ацетолактатсинтетазы |
|
Арилоксифеноксипропионаты, циютогександионы |
Эти гербициды ингибируют ацетил СоА—карбоксилазу. Отбор проводился в культуре тканей. Устойчивость обеспечивалась либо изменением фермента, так что он становился нечувствительным к гербициду, либо разрушением гербицида |
|
Глифосфат |
Устойчивость обеспечивается сверхпродукцией фермента EPS PS, на который действует этот гербицид. Устойчивость приобретается трансформацией сои геном EPSPS. устойчивой к глифосфату, и табака геном глифосфатоксидоредуктазы, которая разрушает глифосфат |
|
Бромоксинил |
Устойчивость к этому ингибитору фотосистемы II обеспечивается трансформацией табака или хлопка бактериальным геном нитрилазы, кодирующим фермент, разрушающий гербицид |
|
Феноксикарбоксильные кислоты (например. 2,4-D и 2,4.5-Т) |
Устойчивые растения табака и хлопка были созданы трансформацией геном tfdA из Alcaligenes. кодирующим диоксигеназу, которая разрушает гербицид |
|
Глюфозинат (фосфинотрицин) |
Более 20 различных растений были трансформированы либо геном bar из Streptomyc.es hygroscopicus, либо геном pat из S. viridochromogenes. Фосфинотрицинацетилтрансфераза, кодируемая этими генами, обеспечивала детоксикацию |
|
Цианамид |
Устойчивые растения табака получали при введении гена цианамидгидратазы из гриба Myrothecium verrucaria. Фермент, кодируемый этим геном, катализирует превращение цианамида в мочевину |
|
Далапон |
Растения табака трансформировали геном дегалогеназы Pseudomonas putida, которая обеспечивала детоксикацию |
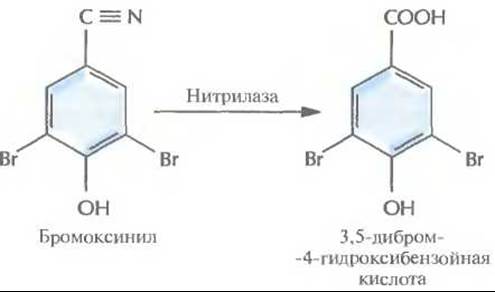
Рис. 18.10. Инактивация гербицида бромоксинила при помощи нитрилазы К. ozaenae.
Растения, устойчивые к грибам и бактериям Фитопатогенные грибы наносят весьма ощутимый вред сельскохозяйственным культурам. По оценкам, убытки, которые терпят фермеры Юго-Восточной Азии, Японии и Филиппин в результате поражения грибом, вызывающим пирикуляриоз, одного из основных зерновых этого региона, риса, исчисляются примерно 5 млрд. долл. в год. Сейчас основной способ борьбы с фитопатогенными грибами состоит в обработке растений химическими веществами, которые накапливаются в окружающей среде и представляют опасность для животных, в том числе и для человека. Поэтому очень важно выработать другие, простые, недорогие, эффективные и безопасные для окружающей среды нехимические методы защиты сельскохозяйственных культур от грибов.
Рис. 18.11. Плазмидный вектор, содержащий кластер генов хитиназы риса и кластер генов устойчивости к гигромицину, использовавшийся для трансформации протопластов риса. Трансформацию осуществляли обработкой протопластов полиэтиленгликолем в присутствии плазмидного вектора. Затем отбирали клетки, устойчивые к гигромицину, и проводили тестирование клеток на наличие генов хитиназы с помощью гибридизации по Саузерну и на наличие самой хитиназы методом Вестерн-блоттинга. Далее из клеток регенерировали целые растения.
Часто в ответ на проникновение патогенов растения начинают синтезировать группу специфических PR-белков (от англ. pathogenesis- related proteins). В эту группу входят ß-1,3-глюканаза, хитиназа, тауматинподобные белки (тауматин — небольшой, очень сладкий белок) и ингибиторы протеиназ; все они так или иначе воздействуют на патогены. Имея это в виду, ученые попытались вывести растения, устойчивые к болезнетворным грибам, способные конститутивно экспрессировать гены одного или нескольких PR-белков. Так, были получены трансгенные растения, синтезирующие в большом количестве хитиназу, фермент, гидролизующий ß-1,4-связи в молекуле N-ацетил-D-глюкозамина, основного компонента клеточной стенки грибов (рис. 18.11).
Среди таких растений были рис, табак и канола. Соответствующие гены, введенные в растительный геном, были поставлены под контроль 355-промотора вируса мозаики цветной капусты. Кроме того, были созданы трансгенные растения табака, которые конститутивно синтезировали не только хитиназу, но и ß-глюканазу. Такие растения были получены скрещиванием одного трансгенного растения, экспрессирующего ген хитиназы, с другим, экспрессирующим ген ß-глюканазы. Трансгенные растения, синтезирующие хитиназу, были более устойчивы к болезнетворным грибам, чем контрольные, даже при том, что последние синтезировали собственные PR-белки в ответ на инфицирование грибами. Кроме того, при этом способность полезного гриба Glomus mosseae закрепляться на корнях растений никак не нарушалась. Возможно, это связано с различиями в составе клеточных стенок данных грибов. Существенно, что трансгенные растения, конститутивно синтезирующие хитиназу, не были подвержены грибковым заболеваниям в полевых условиях. По-видимому, описанный подход окажется весьма эффективным способом защиты растений от патогенных грибов. По оценкам, ущерб, наносимый урожаю картофеля в результате поражения этой культуры патогенной почвенной бактерией Erwinia саrоtovora, составляет примерно 100 млн. долл. в год. Положение усугубляется тем, что у растений не выявлено никаких способов защиты от данной инфекции, которые можно было бы использовать для выведения устойчивых коммерческих сортов. Чтобы решить эту проблему, группа исследователей вывела трансгенные растения картофеля, активно экспрессирующие ген лизоцима бактериофага Т4. При этом лизоцим секретировался в апопласт (межклеточное пространство), компартмент, в который проникает и где распространяется Е. carotovora. Чтобы обеспечить специфичность секреции, к гену лизоцима фага Т4 была «пришита» последовательность, кодирующая сигнальный пептид а-амилазы ячменя, и ген помещен под транскрипционный контроль 35S-пpомотоpa вируса мозаики цветной капусты, сигнала терминации транскрипции и сайта полиаденилирования. Хотя ген лизоцима находился под контролем столь сильного промотора, синтезировалось лишь очень небольшое количество лизоцима. Однако трансгенные растения, геном которых содержал такую конструкцию, оказались устойчивыми к большим количествам Е. carotovora и в лабораторных условиях, и в оранжерее. В естественных условиях эти болезнетворные бактерии присутствуют в гораздо меньших количествах, чем те, которые использовались в лабораторных испытаниях, так что есть надежда, что упомянутая генетическая конструкция сможет обеспечить надежную защиту растений. Кроме того, поскольку лизоцим лизирует различные грамположительные и грам-отрицательные бактерии, этот подход можно будет использовать для защиты растений от самых разных болезнетворных бактерий.
