Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Молекулярная биотехнология микробиологических систем
Генная инженерия растений: применение
Изменение пищевой ценности растений
За многие годы агрономы и селекционеры достигли больших успехов в улучшении качества и повышении урожайности самых разных сельскохозяйственных культур. Однако традиционные методы выведения новых сортов растений, основанные на их скрещивании, весьма трудоемки и требуют много времени, а их возможности ограничены вследствие ограниченности набора генов у скрещиваемых линий. Генноинженерные методы не только позволяют ускорить процесс получения растений с улучшенными свойствами, но и создавать сорта с новыми признаками, которые невозможно было бы передать растениям с помощью традиционных методов скрещивания. Например, в лабораторных условиях уже получены такие культуры с улучшенными пищевыми качествами, как кукуруза и горох. При этом был изменен аминокислотный состав некоторых запасных белков их семян. Кроме того, созданы сорта масличных культур (как пищевых, так и непищевых) с измененным жирнокислотным составом плодов, а также предпринята попытка улучшить вкус фруктов путем введения в растения гена монеллина, белка, имеющего сладкий вкус.
Аминокислоты
Запасные белки, которые служат источниками углерода и азота прорастающих семян, состоят из ограниченного повторяющегося набора аминокислот. Пищевая ценность этих белков невелика, поскольку в них отсутствуют одна или несколько незаменимых аминокислот (обычно лизин или метионин). Аминокислотный состав запасных белков семян можно немного изменить обычным скрещиванием, а недавно для этих целей были использованы генноинженерные методы.
В одном из предварительных экспериментов в растения табака был введен ген фазеолина из фасоли, кодирующий запасной белок, который состоит из самых разных аминокислот. Ген эффективно экспрессировался, а белковый продукт доставлялся в нужный компартмент. Кроме того, специфически изменив in vitro нуклеотидную последовательность генов запасных белков семян, можно было синтезировать белок с нужным аминокислотным составом. Если аминокислотные замены происходят вблизи гипервариабельной области С-концевого участка молекулы, то ее структура не нарушается. Правильная укладка цепи остается и при прорастании семян.
Чтобы увеличить содержание лизина в семенах, была предпринята попытка нарушить регуляцию его биосинтеза. Аминокислоты лизин, треонин, метионин и изолейцин синтезируются из аспартата (рис. 18.16) в несколько этапов. Первый этап состоит в фосфорилировании аспартата аспартаткиназой (АК) с образованием ß-аспартилфосфата. Далее, при биосинтезе лизина, происходит конденсация аспарагинового ß-полуальдегида с пировиноградной кислотой, катализируемая синтазой дигидродипиколиновой кислоты (DNDPS). Регуляция обеих ферментативных активностей (АК и DNDPS) осуществляется с помощью лизина по принципу обратной связи, которую нужно разорвать, чтобы синтез лизина ничем не ограничивался. Для этого использовали гены DNDPS и АК, не чувствительные к ингибированию лизином, из Corynebacterium и Е. coli соответственно. К каждому из этих генов «пришивали» нуклеотидную последовательность, кодирующую лидерный пептид, транспортирующий белки в хлоропласта, снабжали каждый из генов семяспецифичным промотором и вводили их в растения канолы и сои в составе бинарного вектора на основе Ті-плазмид (рис. 18.17). В семенах трансгенных растений содержалось в 100 раз больше свободного лизина, чем в семенах обычных растений; при этом содержание лизина во всех белках семян канолы было в два раза больше, а в белках сои — в пять раз.
Когда кукуруза используется в качестве корма для скота, к ней добавляют соевую муку и очищенный лизин. Однако вместо того чтобы использовать дорогостояющий лизин, можно добавлять к кукурузе дешевую соевую муку, полученную из трансгенных растений сои, которые синтезируют в больших количествах лизин. Возможно, используя этот подход, успешно примененный на сое, удастся вывести сорт кукурузы, в семенах которой повышено содержание лизина. Такая кукуруза имела бы большую пищевую ценность.
Липиды
По оценкам, в 1995 г. во всем мире было выработано растительного масла на сумму примерно 45 млрд. долл., а к 2010 г. эта величина составит 70 млрд. долл. Более 90% масла расходуется на производство маргарина, жиров, масла для салата и для жарки. Примерно 75% всех масличных культур приходится на долю сои, пальмы, рапса (канолы) и подсолнечника, а получаемые из них масла состоят главным образом из следующих жирных кислот: пальмитиновой, стеариновой, олеиновой, линолевой и линоленовой (табл. 18.5).

Рис. 18.16. Схема биосинтеза аминокислот — производных аспартата (здесь представлены не все реакции и промежуточные продукты). Штриховыми стрелками показано ингибирование по принципу обратной связи. DHDPS — синтаза дигидродипиколиновой кислоты, АК — аспартаткиназа.
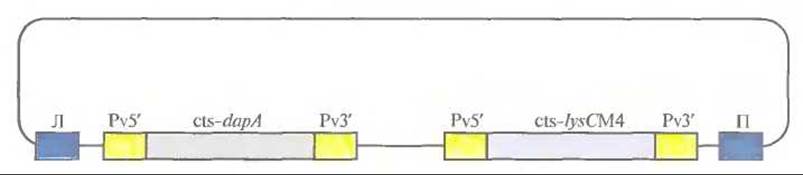
Рис. 18.17. Ti-плазмидный вектор, использующийся для трансформации сои и канолы с целью повышения содержания лизина в этих растениях. Pv5' — промотор гена ß-фазеолина бобов, Pv3' — сигнал терминации транскрипции гена ß-фазеолина бобов, cts — последовательность, кодирующая сигнальный хлоропластный пептид малой субъединицы рибулозобисфосфат-карбоксилазы, dapA — ген Corynebacterium, кодирующий синтазу дигидродипиколиновой кислоты, не чувствительной к лизину, /ysCM4 — мутантный ген lysC Е. coli, кодирующий не чувствительную к лизину аспартаткиназу, Л и П — левая и правая фланкирующие последовательности Т-ДНК соответственно.
С помощью генной инженерии можно изменять степень ненасыщенности (т. е. число двойных связей С=С) и длину цепи этих кислот. Было создано и проверено в полевых условиях множество трансгенных сортов канолы, которые синтезировали масла с измененным жирнокислотным составом (табл. 18.6). Каждый трансгенный сорт содержал один дополнительный ген. Например, растения, синтезирующие в большом количестве стеариновую кислоту, несли антисмысловую копию гена стеаратдесатуразы Brassica; при этом подавлялась экспрессия нормального гена канолы, что приводило к накоплению стеариновой кислоты, которая обычно превращалась в олеиновую. Успехи, достигнутые в получении трансгенных сортов канолы, позволяют надеяться, что в будущем этот подход найдет широкое применение и позволит создать новые, представляющие коммерческую ценность сорта.
Таблица 18.5. Некоторые важные растительные жирные кислоты
|
Тривиальное название |
Сокращенное обозначение1) |
|
Каприловая кислота |
С8:0 |
|
Каприновая кислота |
С10:0 |
|
Лауриновая кислота |
С12:0 |
|
Миристиновая кислота |
С14:0 |
|
Пальмитиновая кислота |
С16:0 |
|
Стеариновая кислота |
С18:0 |
|
Петрозелиновая кислота |
∆6С18:1 |
|
Олеиновая кислота |
∆9С18:1 |
|
Линолевая кислота |
∆9,12С18:2 |
|
Линоленовая кислота |
∆9,12,5С18:3 |
|
Рицинолеиновая кислота |
12ОН∆9С18:1 |
|
Эруковая кислота |
∆13С22:1 |
1) Первая цифра в индексе при С означает число атомов углерода, вторая — степень ненасыщенности, т. е. число двойных связей С=С; значок А с последующим числом обозначает номер первого атома углерода, который образует связь С=С; число перед ОН указывает положение боковой гидроксильной группы. Все связи С=С — цис. В системе нумерации атомов, принятой для жирных кислот, номер 1 присваивают карбоксильной группе.