Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Молекулярная биотехнология микробиологических систем
Молекулярная генетика человека
Построение генетических карт хромосом человека
Генетический полиморфизм Сцепление между локусом АВО и геном наследственного онихоартроза удалось обнаружить по двум причинам. Во-первых, каждый из основных аллелей системы АВО (IA, IB, IO) можно точно идентифицировать при помощи простого лабораторного теста, так что генотипы всех исследуемых родителей и детей оказываются известными. Во-вторых, каждый аллель системы АВО встречается в популяции с высокой частотой, и вероятность того, что родители будут гетерозиготны, достаточно высока. В Великобритании, где были проведены первые работы по изучению сцепления АВО-NPS, частоты аллелей IA, IB и IO составляют примерно 0,66; 0,28 и 0,06 соответственно.
Термин «частота аллеля» обозначает долю конкретного аллеля среди всех аллелей данного локуса в популяции. Например, для двухаллельного локуса (А1, А2) в популяции из 13 000 человек, где 3800 человек имеют генотип A1A1, 6400 — А1А2 и 2800 — A2A2, частота аллеля А1 составляет
![]()
а частота аллеля А2 —
![]()
Для большинства локусов частота одного аллеля (≥0,999) значительно превышает частоту другого (других) (≤0,001). Вследствие этого в больших популяциях подавляющее большинство (99,8%) особей оказываются гомозиготными по более часто встречающемуся аллелю, около 0,198% — гетерозиготными и 0,001% — гомозиготными по редкому аллелю. В подобных условиях практически невозможно установить сегрегацию аллелей данного локуса или его сцепление с другим локусом, поскольку большинство родителей будут гомозиготны по часто встречающемуся аллелю. Если же частоты двух аллелей данного локуса составляют 0,99 и 0,01, то гетерозиготными будут примерно 2% особей, и шансы обнаружить сегрегацию или сцепление возрастают, поскольку в популяции много особей, гетерозиготных по данному локусу (табл. 20.3). Таким образом, изучение сцепления у человека возможно только для локусов с часто встречающимися аллелями. Если два или больше аллелей данного локуса встречаются в популяции с частотой 0,01 и выше, то говорят, что имеет место генетический полиморфизм, и локус называют полиморфным. Поскольку генетический полиморфизм, подобный полиморфизму аллелей системы АВО, встречается редко, для осуществления проектов по картированию хромосом необходимо разрабатывать методы, которые позволяют с легкостью обнаруживать большое количество полиморфных сайтов.
Таблица 20.3. Частоты аллелей и генотипов в большой популяции со случайным скрещиванием1)
|
Частоты аллелей |
Частоты генотипов |
|||
|
А1 |
А2 |
А1А1 |
А1А2 |
А2А2 |
|
1,0 |
0 |
1,0 |
0 |
0 |
|
0,999 |
0.001 |
0.998001 |
0.001998 |
0,000001 |
|
0,99 |
0,01 |
0.9801 |
0,0198 |
0,0001 |
|
0,90 |
0,10 |
0,81 |
0,18 |
0,01 |
|
0,75 |
0,25 |
0,5625 |
0,3750 |
0,0625 |
|
0,50 |
0,50 |
0,25 |
0,50 |
0,25 |
|
0,25 |
0,75 |
0,0625 |
0,3750 |
0,5625 |
|
0,10 |
0,90 |
0,01 |
0,18 |
0,81 |
|
0,01 |
0,99 |
0,0001 |
0,0198 |
0,9801 |
|
0,001 |
0,999 |
0,000001 |
0,001998 |
0,998001 |
|
0 |
1,0 |
0 |
0 |
1,0 |
1) Серым цветом указаны те частоты аллелей, при которых имеет место полиморфизм.
Полиморфизм длины рестрикционных фрагментов
Для возникновения аллелей достаточно, чтобы два гомологичных гена различались всего одним нуклеотидом. Во многих случаях замена одного нуклеотида приводит к значительным различиям между продуктом измененного гена и нормальным белком. Однако множество однонуклеотидных замен не приводит к синтезу измененных генных продуктов, а кроме того, замены могут происходить в некодирующих областях ДНК и не приводить ни к каким последствиям. Такие «безвредные» замены, распределяясь по всей длине хромосомы, порождают полиморфные сайты (маркерные локусы, генетические маркеры), которые можно использовать для генетического картирования. Но сначала эти полиморфные сайты нужно обнаружить.
В 1980 г. Д. Ботштейн, Р. Уайт, М. Сколник и В. Дэвис (D. Botstein, R.L. White, М.Н. Skolnick, R.W. Davis) разработали теоретические основы идентификации однонуклеотидных полиморфных сайтов и использования их в качестве маркеров для построения хромосомных карт человека. Смысл методологии состоит в следующем. Рестрицирующие эндонуклеазы (рестриктазы) расщепляют ДНК в специфических сайтах. Когда однонуклеотидная замена происходит внутри такого сайта, рестриктаза перестает его расщеплять, но по-прежнему узнает и расщепляет интактный сайт в другой хромосоме (рис. 20.11, А). Поскольку один из аллелей содержит сайт узнавания для данной рестриктазы, а другой — нет, то при обработке ДНК этой рестриктазой образуются фрагменты разной длины. Наличие или отсутствие полиморфного сайта рестрикции можно установить, проведя гибридизацию ДНК с зондом, строго специфичным в отношении уникального участка хромосомы.
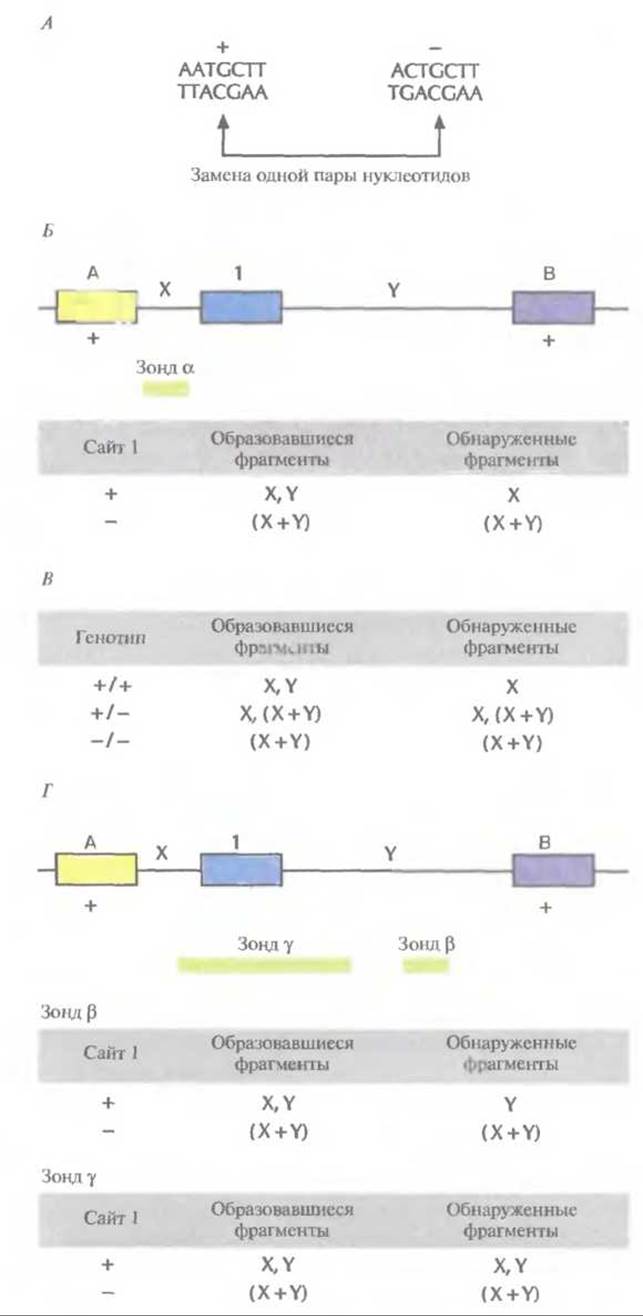
Рис. 20.11. Использование рестрикционных сайтов в качестве генетических маркеров. А. Замена одной пары нуклеотидов в рестрикционном сайте приводит к тому, что рестриктаза не распознает его и не расщепляет ДНК. Интактный и измененный сайты рестрикции отмечены знаками (+) и (-) соответственно. Б. Участок одной хромосомы, содержащий три сайта (А, 1 и В), узнаваемые одной и той же рестриктазой. X — расстояние между сайтами А и 1, Y — расстояние между сайтами 1 и В, X + Y — расстояние между сайтами А и В. Сайты А и В во всех случаях интактны (оба +), а сайт 1 может быть как интактным (+), так и измененным (-). Если сайт 1 интактен (+), то после обработки ДНК рестриктазой образуются фрагменты X и Y. Если же он изменен (-), то образуется единственный фрагмент (X + Y). Если провести блот-гибридизацию по Саузерну с зондом а, то мы обнаружим фрагмент X в том случае, если сайт 1 интактен (+), и фрагмент (X + Y), если он изменен (-). В. Фрагменты, образующиеся после обработки рестриктазой, и фрагменты, выявляемые при гибридизации по Саузерну с зондом а, для каждого из генотипов (+/+, +/-, -.-). Г. Фрагменты одной хромосомы, образующиеся после обработки рестриктазой, и фрагменты, выявляемые при гибридизации с зондом ß или у.
Предполжим, например, что какой-то участок хромосомы содержит три сайта, распознаваемых рестриктазой HindIII (рис. 20.11, Б), при этом у всех индивидуумов сайты А и В интактны. Это означает, что в популяции нет альтернативных аллелей по этим сайтам, т. е. отсутствует полиморфизм. В отличие от этого в сайте 1 с высокой частотой встречается однонуклеотидная замена, в результате чего он становится устойчивым к расщеплению HindIII. Таким образом, две хромосомы в популяции различаются по данному сайту: одна из них расщепляется (+), а другая нет (-).
Если расстояния от сайта А до сайта 1 и от сайта 1 до сайта В не совпадают, каждое из них не превышает 20 т. п. н. и существует однокопийный зонд, гибридизующийся с участком ДНК между сайтами А и I (рис. 20.11, Б), то после блот-гибридизации по Саузерну и разделения в агарозном геле фрагментов ДНК, полученных в результате обработки HindIII, мы сможем различить две ситуации. Первая — сайт 1 расщепляется, в результате чего образуется два фрагмента, и зонд гибридизуется с тем из них, который ограничивается сайтами А и 1. Вторая — сайт I не расщепляется и зонд гибридизуется с фрагментом ДНК, ограниченным сайтами А и В (рис. 20.11, Б).
Анализ реальных образцов ДНК несколько более сложен, поскольку хромосомы встречаются парами (рис. 20.11, В). Однако и в этом случае каждому генотипу (+/+, +/-, -/-) соответствует определенный набор фрагментов, образующийся в результате гибридизации с зондом. Кроме того, для выявления сайта рестрикции на участке 1 можно использовать зонды, гибридизующиеся с другими участками ДНК между сайтами А и В (рис. 20.11, Г). Феномен, состоящий в том, что наличие часто встречающегося в популяции измененного рестрикционного сайта приводит к образованию специфического набора фрагментов ДНК, называют полиморфизмом длины рестрикционных фрагментов (ПДРФ). Полиморфные сайты рестрикции образуют маркерные локусы на той хромосоме, где они присутствуют.
Генетический статус каждого ПДРФ-локуса на одной хромосоме называют гаплотипом. В случае одного сайта существуют два возможных гаплотипа (+ или -), в случае двух разных сайтов — четыре (++, + -, - + и - -); для n локусов число гаплотипов равно 2n. Определение аллелей ПДРФ-локуса (или любых других полиморфных локусов), присутствующих на хромосомах данного индивидуума, называется гаплотипированием (генотипированием, ДНК- типированием). Наследование ПДРФ-локусов происходит в соответствии с законами Менделя, и можно проследить их передачу в пределах родословной. Если изучается наследование двух и более ПДРФ-локусов в данной семье, то можно выявить рекомбинацию. На рис. 20.12 представлена следующая ситуация: отец (1-1) гетерозиготен по трем разным ПДРФ-локусам, расположенным на одной хромосоме, а у матери (1-2) сайты рестрикции в трех рассматриваемых локусах отсутствуют. Генетический статус хромосомы, унаследованной от отца каждым из детей, можно установить путем генотипирования. Сын II-2 получил от отца хромосому, в которой произошел кроссинговер; остальные дети унаследовали от него нерекомбинантные хромосомы. На практике ДНК каждого индивидуума в отдельной пробирке обрабатывают различными рестриктазами, а затем гибридизуют с клонированными однокопийными фрагментами ДНК, которые используются в качестве зондов для выявления ПДРФ. Гибридизация ДНК-зонда с препаратом метафазных хромосом человека, распластанных на предметном стекле (гибридизация in situ), позволяет определить, соответствует ли данный зонд уникальному участку хромосомы (однокопийной ДНК). Для обозначения тысяч ПДРФ-локусов разработана стандартная номенклатура. Например, запись D21S18 соответствует локусу, идентифицированному с помощью ДНК-зонда (D), который гибридизуется с хромосомой 21 (21), представлен одной копией (S) и зарегистрирован Комитетом по систематизации карт сцепления человека (DNA Committee of the International System for Human Linkage Maps — ISLM) под восемнадцатым номером (18). Полиморфные маркерные сайты, расположенные внутри известных генов, обозначают по названию гена. Например, ADH — это полиморфный локус в гене алкогольдегидрогеназы (ADH1). Никакого стандартного обозначения для ПДРФ-аллелей не существует. В одних лабораториях аллели нумеруют по порядку (D1S34*1, D1S43*2 и т. д.), в других — по длине фрагмента (в т.п.н.), образующегося при наличии или в отсутствие сайта (сайтов) рестрикции (D4S56*8, D4S56*12, D4S56*4 ит. д.).

Рис. 20.12. Выявление сегрегации и рекомбинации ПДРФ-локусов в родословной. Знаками плюс (+) и минус (-) обозначены аллели, содержащие интактные и измененные сайты рестрикции, трех ПДРФ-локусов (А, В, С), расположенных на одной хромосоме. Генетический статус I-1 определен исходя из генотипов его родителей, +++/+++ и - - - / - - - (не показаны). Определение гаплотипов у детей показывает, что 11-2 получил от 1-1 рекомбинантную хромосому, а II-1 и II-3 — нерекомбинантные. Вертикальная черта, разделяющая наборы ПДРФ-аллелей под символом, обозначающим каждого члена семьи, разделяет гомологичные хромосомы.
Уже идентифицированы тысячи ПДРФ-локусов, благодаря чему значительно увеличилось число аллелей, которые можно использовать для генетических исследований. Сцепление между ПДРФ-локусом (локусами) и геном того или иного заболевания можно установить, подсчитав «парный» («двухлокусный») лод-балл для гаплотипированных семей, в которых выявлены случаи изучаемого генетического заболевания. Аналогично, сцепление между ПДРФ-локусами можно обнаружить, проанализировав данные по родословным, представленным несколькими поколениями. Использование ПДРФ для картирования имеет несколько ограничений. Эти локусы распределены по хромосомам неравномерно, зонды в виде клонов поддерживать неудобно, а гаплотипирование большого числа индивидов из нескольких семей методом блот-гибридизации по Саузерну весьма трудоемко. К счастью, в геноме человека в большом количестве (>100 000) встречаются другие полиморфные локусы, содержащие простые повторяющиеся элементы из двух, трех или четырех пар нуклеотидов — короткие тандемные повторы (STR, от англ. short tandem repeats), которые легко регистрируются с помощью полимеразной цепной реакции (ПЦР).
Полиморфизм коротких тандемных повторов
По геному человека равномерно распределены примерно 100 000 блоков динуклеотидных повторов CA/GT [(СА) ∙ (GT)] (рис. 20.13), содержащих от 1 до 40 повторяющихся CA/GT-элементов. Любой такой блок, локализованный в определенном участке хромосомы, передается из поколения в поколение с сохранением числа повторяющихся элементов. Для CA/GT-повтора принято обозначение (СА)n, где n — число СА-повторов. В геноме человека встречаются и другие динуклеотидные повторы [например, (АТ)n и т. д.], а также три-[(ATG)n и т. д.] и тетрануклеотидные [(ATCG)n и т. д.]. Чтобы идентифицировать полиморфные STR-локусы, нужно прежде всего провести скрининг геномной библиотеки человека, содержащей вставки небольшого размера (примерно 1000 п. н.), используя подходящий олигонуклеотидный зонд. Для идентификации клонированных (СА)n-повторов обычно используют зонд, состоящий из 15 СА-элементов. Каждую позитивную вставку секвенируют, чтобы установить длину СА-повтора и нуклеотидные последовательности фланкирующих его участков. Чтобы определить, являются ли фланкирующие последовательности однокопийными, проводят гибридизацию in situ с комплементарными им зондами, и если обнаруживается, что эти последовательности встречаются в геноме один раз, то синтезируют пару комплементарных им праймеров и проводят амплификацию СА-повтора. Далее, используя эту пару праймеров, проводят ПЦР-тестирование ДНК, полученной от большого числа индивидуумов. ПЦР-продукты, длина которых для удобства электрофоретического разделения выбирается примерно 200 п. н., разделяют в полиакриламидном геле. Если длина амплифицированного таким образом сегмента ДНК одинакова для всех образцов ДНК, значит, повтор не полиморфен (рис. 20.14, А), и наоборот, если образуются ПЦР-продукты разной длины, это указывает на полиморфизм по данному STR (STR-полиморфизм, STRP) (рис. 20.14, Б). Различающиеся по длине СА-повторы данного локуса представляют собой аллели (рис. 20.15). Такие аллели нередко встречаются с частотой 0,20 и даже больше.
![]()
Рис. 20.13. Динуклеотидный тандемный повтор (СА)24, содержащий 24 повторяющихся элемента.

Рис. 20.14. Типирование STR-локусов. А. ДНК, полученную от разных индивидов (и = 7), амплифицировали с помощью ПЦР, используя пару праймеров (X), фланкирующих (CA)-(GT)-пoвтop. Размер всех образовавшихся ПЦР-продуктов одинаков (дорожки 1—7), следовательно, одинакова и длина STR. Судя по полученным данным, STR-локус представлен только одним аллелем. Б. То же, что и на рис. А, но с использованием другой пары праймеров (Y) для другого STR-локуса. Образование двух разных ПЦР-продуктов означает, что данный локус представлен двумя аллелями. Дорожки 1—3 соответствуют амплифинированному фрагменту ДНК индивидов, гомозиготных по одному STR-аллелю, дорожки 4 и 5 — амплифицированному фрагменту ДНК гетерозиготных индивидов, несущих два разных STR-аллеля, дорожки 6 и 7 — амплифипированному фрагменту ДНК индивидов, гомозиготных по другому STR-аллелю.
К настоящему времени уже обнаружены тысячи STRP-локусов. Для их обозначения используются те же правила, что и для ПДРФ-локусов. В то же время названия STRP-праймеров часто отличаются от названий локусов. Многие STRP-локусы были идентифицированы французскими исследователями при финансовой поддержке со стороны Фразцузской ассоциации по мышечным дистрофиям (Association Franęaise contrе les Myopathies), и это нашло свое отражение в том, что обозначения многих пар STRP-праймеров начинаются с аббревиатуры AFM, после которой идет идентификационный номер (AFM349xc5). Обозначение пары праймеров часто сопровождается обозначением соответствующего локуса [АРМ349хс5 (D3S2017)].
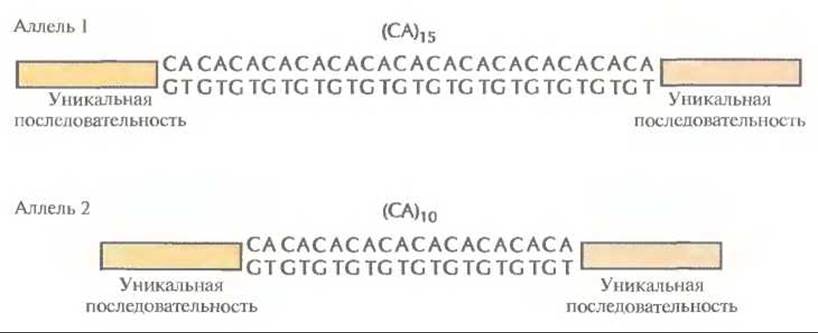
Рис. 20.15. Два STR-аллеля. Один из них (аллель 1) содержит повтор (СА)15, другой (аллель 2) — (СА)10. Повторы в обоих случаях фланкированы одинаковыми уникальными последовательностями.
В настоящее время для картирования генома человека используются в основном не ПДРФ-локусы, a STRP. В отличие от ПДРФ-зондов, которые необходимо клонировать в векторе, очищать и метить, в случае STRP-локусов нужна информация лишь о нуклеотидной последовательности пары праймеров, которая может храниться в компьютерной базе данных. Кроме того, STRP-локусы равномерно распределены в геноме человека; частоты STR-аллелей очень высоки, что обеспечивает высокую гетерозиготность, а сами аллели без труда идентифицируются после ПЦР-амплификации.