Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Молекулярная биотехнология микробиологических систем
Генная терапия
Вирусные системы доставки генов
Ретровирусные векторы
Опыт клинических испытаний с участием более 200 пациентов показывает, что дефектные по репликации ретровирусные векторы не оказывают каких-либо неблагоприятных побочных эффектов. Тем не менее безопасности их применения продолжают придавать большое значение. Создана конструкция, называемая плазмовирусом, которая содержит ретровирусные гены gag и pol, находящиеся под контролем 5'-LTR-промотора, а также «терапевтический» ген и ген еnv, управляемые цитомегаловирусным промотором. После трансфекции плазмовирус запускает образование дефектных по репликации вирусных частиц, причем вероятность рекомбинации с образованием компетентных по репликации ретровирусов очень мала. Вектор может переносить не более 3,5 т. п. н. ДНК, но и длина большинства потенциальных «терапевтических» кДНК и генов — супрессоров опухолей составляет 0,5—2 т. п. н.
В ретровирусную векторную систему внесены дополнительные усовершенствования: увеличено число образующихся вирусных частиц, повышена эффективность трансдукции, осуществлена генноинженерная модификация, обеспечивающая их проникновение в неделяшиеся клетки, повышена специфичность инфекции. В последнем случае геном рекомбинантного ретровирусного вектора упаковывается в оболочку другого вируса, белок которой и определяет специфичность связывания ретровируса и спектр инфицируемых им клеток. Это явление называется фенотипическим смешиванием (pseudotype formation). Фенотипически смешанный вирус получают с помощью котрансфекции клеточной линии, которая синтезирует продукты генов gag и pol, рекомбинантным ретровирусным вектором и вектором, экспрессирующим ген env другого вируса. Изменяя ген env, можно как сузить спектр инфицируемых вирусом клеток до строго определенного типа, так и расширить его. Кроме того, в ген env ретровируса можно встроить нуклеотидную последовательность, кодирующую пептид, который связывается с определенным клеточным рецептором и обеспечивает внедрение рекомбинантного ретровируса в нужные клетки. И наконец, можно добиться специфичности экспрессии терапевтического гена, осуществляя ее под контролем промотора, специфичного для определенных клеток.
Аденовирусные векторы
Аденовирусы инфицируют неделящиеся клетки человека и широко используются в качестве живых вакцин, которые предотвращают респираторные инфекции и гастроэнтериты, не оказывая побочного действия. Эти свойства делают аденовирусы перспективными для доставки генов в клетки-мишени.
Для получения аденовирусного вектора провели котрансфекцию клеточной линии, синтезирующей продукты аденовирусного гена El, двумя участками генома аденовируса (рис. 21.7). Один из них может существовать в виде плазмиды в Е. coli и содержит вместо El-области «терапевтический» ген, фланкируемый нуклеотидными последовательностями аденовируса, а второй представляет собой молекулу ДНК аденовируса, которая лишена 5'-концевого участка, включающего El-область, и имеет перекрывающийся участок с несущей терапевтический ген плазмидой. Рекомбинация между двумя трансфицирующими фрагментами ДНК в области их перекрывания приводит к восстановлению полноразмерного аденовирусного гена, в котором вместо El-области находится терапевтический ген. Продукты гена El, поставляемые клеткой-хозяином, инициируют образование вирусных частиц, высвобождающихся из клетки в результате лизиса. Клонирующая емкость аденовирусного вектора составляет около 7,5 т. п. н. В отсутствие рекомбинации трансфицирующие молекулы ДНК, обладающие недостаточной длиной, не могут упаковываться в вирусные частицы. Вероятность того, что между областью El в геноме клетки-хозяина и ДНК рекомбинантного аденовируса произойдет рекомбинация с образованием компетентных по репликации вирусов, чрезвычайно мала.
После того как рекомбинантный аденовирус инфицирует клетку-мишень, его ДНК проникает в ядро, где и происходит экспрессия «терапевтического» гена. Рекомбинантная ДНК не интегрирует в хромосому и сохраняется непродолжительное время, поэтому при проведении генотерапии с использованием аденовирусных векторов необходимо вводить их с определенной периодичностью.
Аденовирусные векторы использовали в клинических испытаниях по генной терапии муковисцидоза. Первые результаты не обнадеживали: ген трансмембранного регуляторного белка, нарушения в котором приводят к муковисцидозу (CFTR, от англ. cystic fibrosis transmembrane regulator), был перенесен лишь в небольшое число клеток пациента, а многократное введение рекомбинантного аденовируса и низкий уровень экспрессии некоторых аденовирусных генов привели к развитию у пациентов выраженного иммунного ответа и гибели трансдуцированных клеток. Эту проблему решали разными путями. Например, сконструировали «пакующую» клеточную линию, содержащую El-область и ряд аденовирусных генов, которые не входят в состав трансдуцирующей ДНК и не попадают в клетки-мишени. Затем удалось добиться того, чтобы ни один из аденовирусных генов не включался в трансдуцирующую ДНК. Для этого линеаризовали плазмиду Е. coli (28 т. п. н.), которая обеспечивает экспрессию одного или большего числа терапевтических генов и не содержит аденовирусных генов, и пришили к ее концам фрагменты ДНК (по 4 т. п. н.), содержащие точку начала репликации аденовирусной ДНК, последовательность, ответственную за ее упаковку, и сигнал терминации. Длина продукта лигирования (36 т. п. н.) соответствует длине полноразмерного генома аденовируса. Затем полученным продуктом и аденовирусным геномом без El-области и последовательности, ответственной за упаковку, провели котрансфекцию клетки-хозяина, экспрессирующей El-гены. Молекула ДНК аденовируса, дефектная по репликации и упаковке, поставляет гены для синтеза компонентов вируса, а продукт лигирования реплицируется и упаковывается в вирусные частицы. При этом около 99% высвобождаемых вирусных частиц содержат молекулу ДНК с «терапевтическим» геном (генами). С помощью центрифугирования их можно отделить от дефектных по репликации вирусов, которые все же образуются в незначительном количестве. ДНК-клонирующая емкость такой системы достигает 28 т. п. н.
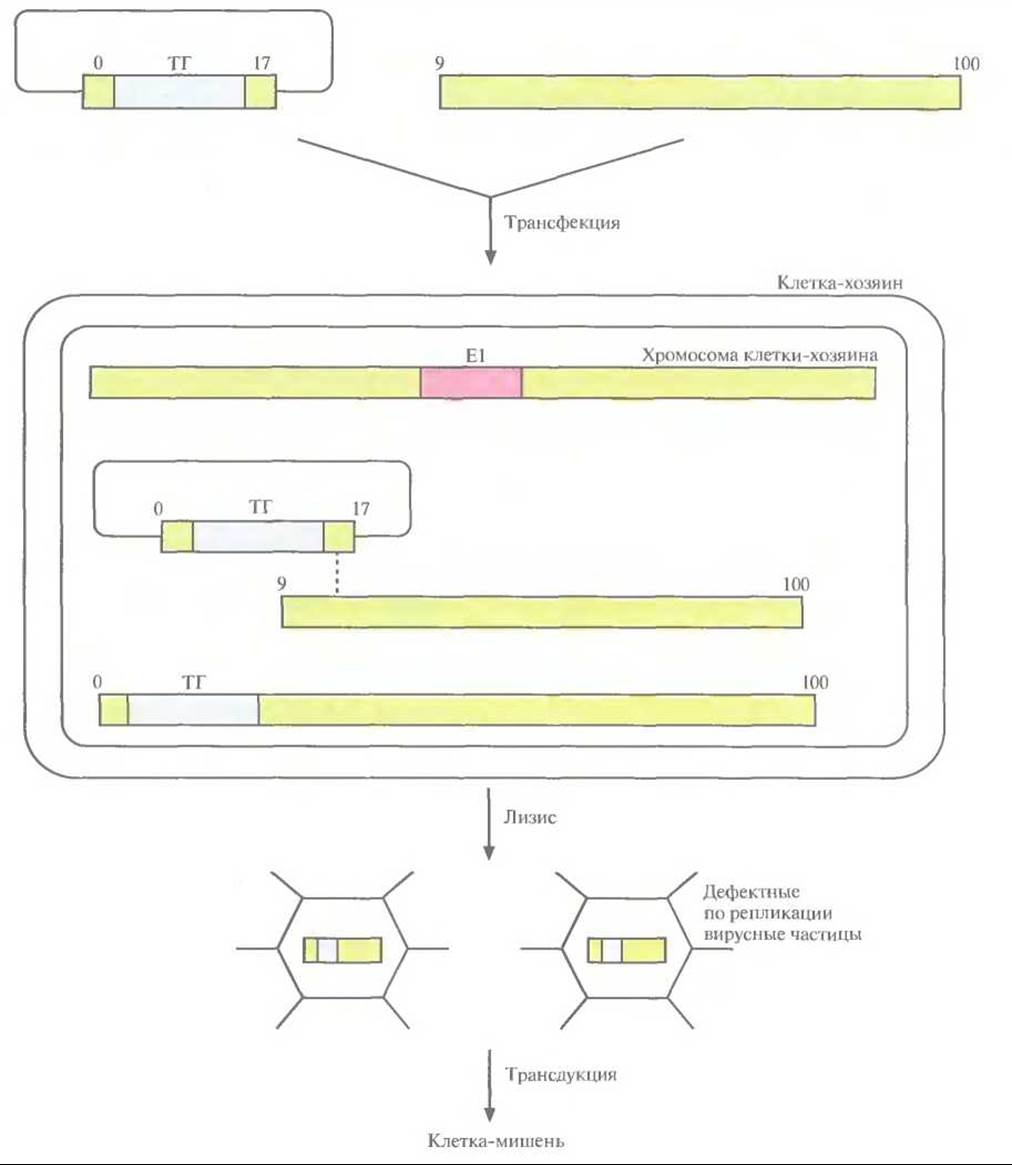
Рис. 21.7. Аденовирусный вектор. В клетку-хозяина, несущую интегрированный в геномную ДНК функциональный ген El аденовируса, вводят встроенную в сегмент аденовирусного генома (0—17 единицы карты) плазмиду с «терапевтическим» геном (ТГ) и участок геномной ДНК аденовируса (9—100 единицы карты). Длина генома аденовируса равна 100 единицам. В результате рекомбинации (штриховая линия) между перекрывающимися участками плазмиды и ДНК аденовируса образуется молекула ДНК, эквивалентная полноразмерному вирусному геному. Рекомбинантная ДНК, содержащая «терапевтический» ген, упаковывается и высвобождается из клетки после лизиса. Образующиеся вирусные частицы дефектны по репликации. Плазмидная ДНК, входящая в состав конечной генетической конструкции, не влияет на упаковку рекомбинантной ДНК (не показано)
Эффектавность аденовирус-опосредованного переноса генов можно повысить, если сконструировать вирус, проникающий преимущественно в определенную клетку-мишень. Для этого в ген, ответственный за образование нитей аденовируса, следует включить последовательность, кодирующую домен белка, который связывается с клеточноспецифичным рецептором.
Векторы на основе аденоассоциированных вирусов
Аденоассоциированные вирусы (ААВ) - это небольшие непатогенные вирусы человека с одноцепочечным ДНК-геномом (4,7 т. п. н.), который может интегрировать в специфический сайт 19-й хромосомы. Такое название они получили потому, что для продуктивной инфекции им необходимы белки другого вируса (вируса-помощника), например аденовируса. После того как ААВ попадает в ядро, его геном с помощью полимераз клетки-хозяина преобразуется в двухцепочечную ДНК и транскрибируется.
Отсутствие патогенности делает ААВ весьма перспективным вектором для доставки в организм человека «терапевтических» генов. Рекомбинантный ААВ получают с помощью котрансфекции клетки-хозяина, инфицированной каким-нибудь аденовирусом (вирусом-помощником), двумя плазмидами (рис. 21.8). Одна из них несет «терапевтический» ген, фланкированный инвертированными концевыми повторами (длиной от 125 п. н.) ААВ, а вторая — два его гена, rep и cap, ответственные за репликацию генома и синтез капсида соответственно. После лизиса инфицированных клеток рекомбинантные ААВ отделяют от аденовируса с помощью центрифугирования и диализа, а оставшиеся в образце аденовирусы (вирусы герпеса) инактивируют нагреванием. Рекомбинантный ААВ может нести ДНК-вставку размером до 4,5 т. п. н., не вызывает развития иммунного ответа, поскольку не содержит ААВ-генов, но и не может интегрировать в 19-ю хромосому из-за отсутствия гена rep.
В одном из доклинических испытаний эффективность in vivo трансдукции гепатоцитов мыши (рекомбинантный ААВ вводили внутривенно) была повышена в 900 раз с помощью предварительного облучения печени нетоксическими дозами и введения нерекомбинантного (дикого типа) ААВ. В этом случае кДНК фактора IX системы свертывания крови («терапевтический» ген) экспрессировалась в течение как минимум 5 мес на уровне, достаточном для коррекции дефекта при гемофилии. В I фазе клинических испытаний по генной терапии муковисцидоза в легкие вводили CFTR-AAВ-вектор; при этом не развивалась воспалительная реакция, а вектор сохранялся до 70 сут. Чтобы определить, образуется ли продукт гена CFTR в количестве, достаточном для достижения терапевтического эффекта, нужны дальнейшие клинические испытания.
Векторы на основе вируса простого герпеса
Для того чтобы ретро- и аденовирусные векторы инфицировали специфические типы клеток, нужно модифицировать их с помощью генной инженерии, однако в природе существуют вирусы, уже обладающие сродством к определенному типу клеток. Так, вирус простого герпеса 1 типа (HSV) инфицирует нейроны и персистирует в них, часто вызывая у человека так называемые «простудные» высыпания, а иногда — энцефалит с летальным исходом. Вирус присутствует в нейронах в латентной форме, а при стрессе и гормональных нарушениях инициируется литический цикл.

Рис. 21.8. Вектор на основе аденоассоциированного вируса (ААВ). Проведена котрансфекция клетки-хозяина, инфицированной аденовирусом-помощником, двумя плазмидами, одна из которых содержит «терапевтический» ген (ТГ). фланкированный инвертированными концевыми повторами (ITR) ААВ, а другая — гены ААВ, ответственные за репликацию (rep) и формирование капсида (cap), которые находятся под контролем промотора (р), и последовательность полиаденилирования (ра). Высвободившиеся после лизиса частицы рекомбинантного ААВ и аденовируса разделяют центрифугированием, а оставшиеся аденовирусные частицы инактивируют нагреванием.
Существует множество заболеваний, поражающих центральную и периферическую нервную систему: опухоли, метаболические и иммунные нарушения, нейродегенеративные заболевания (болезнь Альцгеймера, болезнь Паркинсона). Неврологические заболевания, как правило, бывают хроническими и приводят к госпитализации больного чаще, чем все остальные болезни вместе взятые. Вследствие тропности HSV к нервным клеткам он является подходящим вектором для генной терапии таких заболеваний.
Геном HSV представляет собой двухцепочечную молекулу ДНК длиной 152 т. п. н. Капсид вируса сливается с мембраной нейрона, и его ДНК транспортируется в ядро. Репродуктивный цикл вируса состоит из литической (репликация ДНК и образование вирусных частиц) и латентной (конденсация вирусного генома и активация как минимум двух так называемых латентно-ассоциированных промоторов) фаз.
Замена сегмента геномадлиной примерно 30 т. п. н. ДНК-вставкой не оказывает заметного влияния на репликацию HSV, его упаковку или инвазионную способность. С другой стороны, большой размер генома HSV затрудняет генетические манипуляции с ним. Для решения этой проблемы в плазмиду Е. coli, которая может переносить до 8 т. п. н. чужеродной ДНК, встроили «усеченный» геном HSV, состоящий из точки инициации репликации и последовательности, ответственной за упаковку. Полученные HSV-производные назвали ампликонами (ампликон-плазмидами).
Большинство систем доставки генов на основе HSV предполагает использование вируса-помощника, который поставляет белки, необходимые для репликации и сборки вируса, но не образует инфекционные вирусные частицы, поскольку его геном модифицирован и не способен упаковываться. Для получения рекомбинантного HSV осуществляют трансфекцию ампликон-плазмиды в инфицированную вирусом-помощником клетку-хозяина. ДНК ампликона реплицируется по типу «катящегося кольца»: внутренняя кольцевая цепь играет роль матрицы, а во внешней происходит разрыв, и к свободной 3'-концевой ОН-группе ковалентно присоединяются нуклеотиды. Растущая цепь представляет собой линейную тандемную последовательность сегментов, комплементарных внутренней цепи, и, отсоединяясь от нее, сама становится матрицей для синтеза комплементарной цепи. В результате образуется линейная двухцепочечная молекула — множественная копия ампликона. Длина каждого ампликона составляет 15 т. п. н., поэтому набор из 10 тандемных копий соответствует полноразмерному геному HSV и упаковывается в HSV-капсид (рис. 21.9).
Рекомбинантный HSV можно получить и с помощью котрансфекции клеток-хозяев, в которых вирус может реплицироваться, с помощью ДНК HSV дикого типа и плазмиды, которая содержит «терапевтический» ген, фланкированный последовательностями ДНК из вспомогательных участков HSV-генома. ДНК HSV дикого типа реплицируется в ядре клетки-хозяина, при этом в результате рекомбинации «терапевтический» ген может встроиться в HSV-гeном. Затем частицы как рекомбинантного, так и дикого типа HSV упаковываются и высвобождаются из клеток. Доля рекомбинантных HSV в общем вирусном пуле очень мала, поэтому вирусы размножают, а затем с помощью ПЦР или гибридизации выявляют «терапевтический» ген в образовавшихся бляшках. Рекомбинантный вирус хранят в условиях, не допускающих его загрязнения HSV дикого типа (рис. 21.10).
Доклинические испытания на экспериментальных животных показали, что гены, доставленные с помощью HSV-векторов в клетки мозга и периферической нервной системы, экспрессируются и поддерживаются длительное время. Однако до начала I фазы клинических испытаний HSV-векторов необходимо провести дополнительные исследования.