Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Молекулярная биотехнология микробиологических систем
Генная терапия
Лекарственные средства на основе олигонуклеотидов
В большинстве протоколов генной терапии ех vivo и in vivo используются клонированные генетические конструкции, возмещающие функциональную форму белка, который не синтезируется в организме больного или синтезируется в дефектной форме. Однако многие заболевания человека (рак, воспаления, вирусные и паразитарные инфекции) связаны, напротив, с гиперпродукцией нормального белка. Для лечения таких состояний разработаны терапевтические системы с использованием олигонуклеотидов. Небольшой олигонуклеотид может гибридизоваться со специфическим геном или мРНК и снижать уровень транскрипции или трансляции, уменьшая тем самым количество синтезируемого белка, ответственного за патологию. Олигонуклеотид, который гибридизуется с самим геном и блокирует его транскрипцию, называется «антигенным», а тот, который гибридизуется с соответствующей мРНК, — «антисмысловым». Снизить уровень транскрипции и трансляции гена-мишени может также олигонуклеотид, который связывается с фактором транскрипции, контролирующим экспрессию специфического гена. Для предотвращения активации транскрипции специфических генов можно использовать и двухцепочечные олигонуклеотиды, присоединяющиеся к ДНК-связывающим белкам. Можно создать также синтетические молекулы ДНК, которые присоединяются к специфическим белкам-мишеням, исходно не являющимся ДНК-связывающими, и тем самым блокируют их функционирование. Наконец, для уменьшения количества определенной мРНК и синтезируемого на ней белка можно модифицировать рибозимы — природные РНК-последовательности, которые связываются со специфическими молекулами РНК и разрезают их. В будущем лекарственные средства на основе нуклеиновых кислот, по-видимому, найдут широкое применение, при этом главным объектом научных исследований и клинических испытаний будут «антисмысловые» последовательности и особенно — «антисмысловые» олигонуклеотиды.
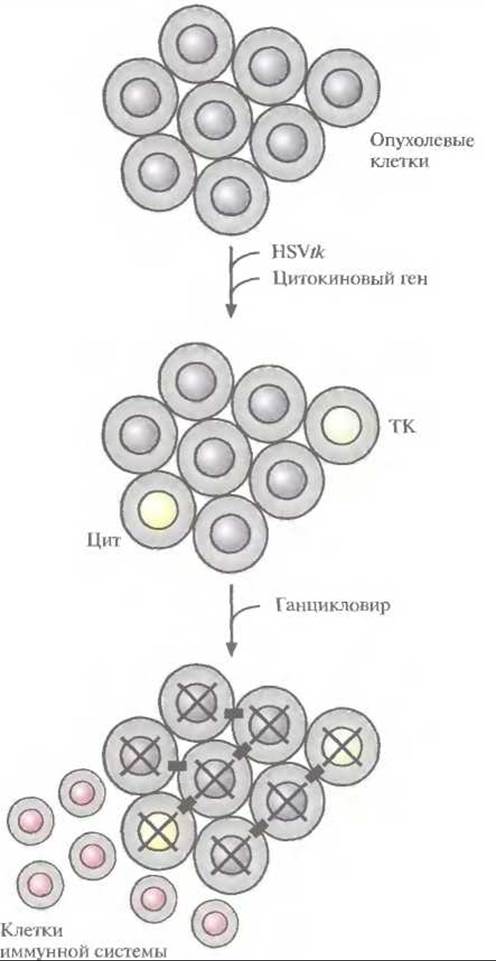
Рис. 21.12. Комбинированный подход с использованием GСV—НSVtk-терапии и генной иммунотерапии. Опухолевые клетки трансдуцировали in vivo геном тимидинкиназы вируса простого герпеса (НSVtk) и цитокиновым геном. Трансдуцированные клетки опухоли, которые синтезируют цитокин (Цит), привлекают иммунные клетки, а те, которые синтезируют тимидинкиназу (ТК), фосфорилируют ганциковир. Фосфорилированный ганцикловир проникает через межклеточные контакты (черные прямоугольники) в соседние клетки и, связываясь с ДНК, уничтожает их (X).
Синтез «антисмысловых» мРНК in vivo
«Антисмысловая» РНК, которую предполагается использовать в качестве лекарственного средства, должна связываться с определенной мРНК и ингибировать трансляцию кодируемого ей белка, подавляя тем самым патологический процесс (рис. 21.13). Для получения таких РНК использовали экспрессирующие векторы, несущие ДНК-вставки в такой ориентации, чтобы их транскрипты были антисмысловыми по отношению к мРНК. В качестве примера можно привести эписомные экспрессирующие векторы, в которые встроены кДНК инсулиноподобного фактора роста 1 (IGF-1) или его рецептора (IGF-IR), находящиеся в обратной ориентации под контролем металлотионеинового промотора, активируемого ZnSО4. IGF-1 вырабатывается в избыточном количестве клетками злокачественной глиомы, наиболее распространенной опухоли головного мозга, a IGF-1R — клетками карциномы предстательной железы.
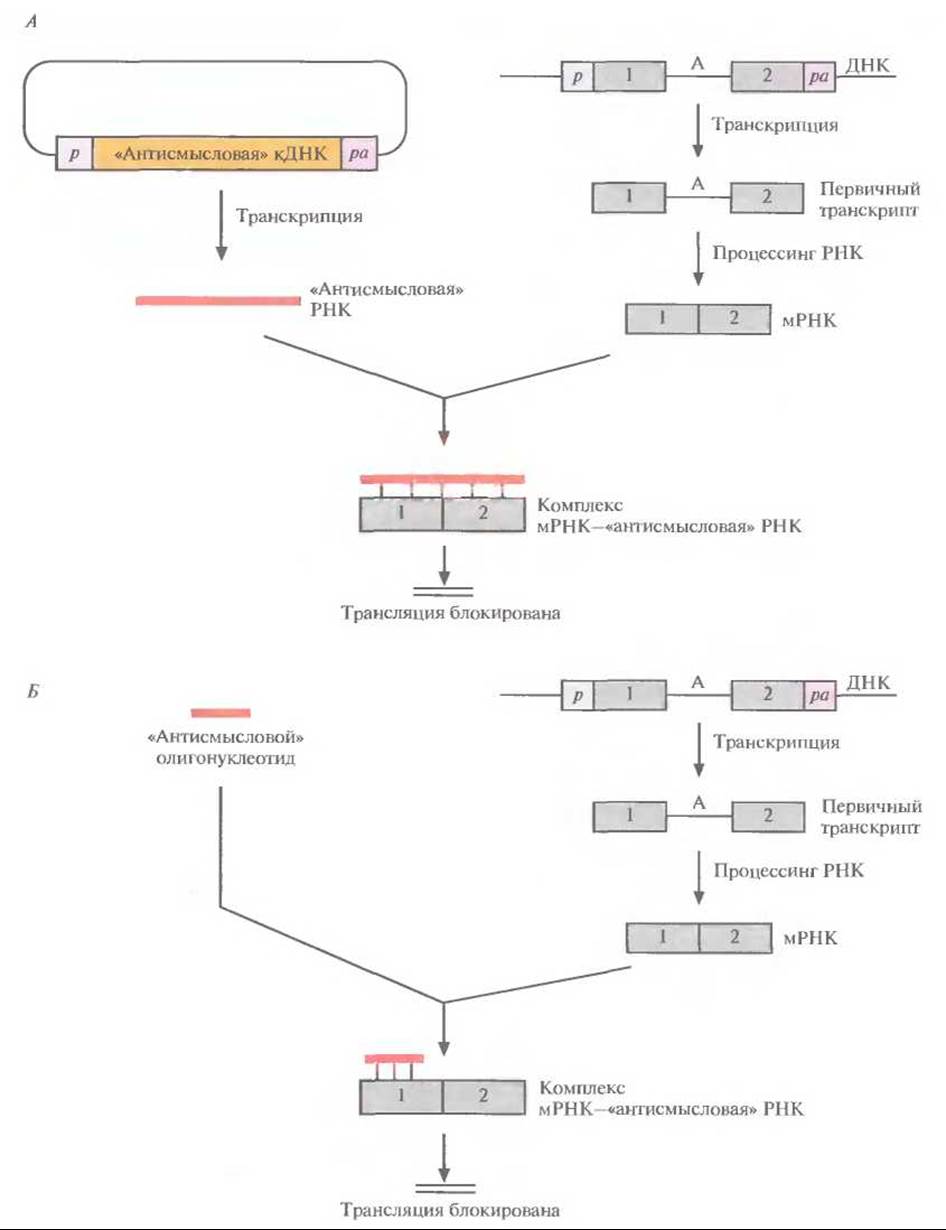
Рис. 21.13. Ингибирование трансляции специфических мРНК с помощью «антисмысловых» нуклеиновых кислот. А. кДНК встраивают в экспрессирующий вектор в обратной ориентации и полученную генетическую конструкцию вводят в клетки, где происходит синтез «антисмысловой» РНК. Эта РНК гибридизуется с мРНК-мишенью и блокирует трансляцию. Б. В клетку вводят антисмысловой олигонуклеотид, который гибридизуется с мРНК-мишенью и блокирует трансляцию. Обозначения: р — промотор, ра — сигнал полиаденилирования, А — интрон, 1 и 2 — экзоны.
Вектор, обусловливающий синтез «антисмысловой» мРНК FGF-1, трансфицировали в культуру клеток глиомы. Если ZnSО4 в культуральной среде отсутствовал, то гиперпродукция IGF-1 опухолью сохранялась, если же в среду добавляли ZnSО4, то она исчезала. В другом эксперименте изучали последствия введения крысам нетрансфицированных клеток глиомы и клеток, трансфицированных «антисмысловой» кДНК IGF-1. В первом случае опухоли развивались, а во втором — нет.
Если клетки карциномы предстательной железы крыс, трансфицированные «антисмысловой» кДНК IGF-1R, вводили мышам, то у них образовывались лишь небольшие опухоли или не образовывались совсем. Если же им вводили нетрансфицированные или трансфицированные нормальной кДНК IGF-1R клетки, то развивались опухоли большого размера. По-видимому, в обоих случаях «антисмысловая» РНК гибридизуется с комплементарной ей мРНК и ингибирует трансляцию IGF-1 и IGF-1R, предотвращая пролиферацию опухолевых клеток.
«Антисмысловые» олигонуклеотиды как лекарственные средства
Терапевтический эффект синтетических «антисмысловых» олигонуклеотидов зависит от специфичности их гибридизации с доступным сайтом мРНК-мишени, устойчивости к действию клеточных нуклеаз и наличия системы доставки в клетку. 15—20-нуклеотидные последовательности гибридизуются с уникальными мРНК с достаточно высокой специфичностью. Потенциальные сайты-мишени определяют тестированием набора «антисмысловых» олигонуклеотидов с использованием культуры клеток, синтезирующих мРНК-мишень. Для этого проводят электрофоретическое разделение клеточных белков, в которые включают радиоактивную метку во время трансляции, и с помощью
радиоавтографии устанавливают, в присутствии какого из «антисмысловых» олигонуклеотидов снижается синтез определенного белка. Никаких общих критериев выбора наилучших сайтов-мишеней в разных РНК-транскриптах не существует. Эффективными могут оказаться олигонуклеотиды, комплементарные 5'- или 3'-концам мРНК, границам экзонов и нитронов и даже двухцепочечным областям. Олигодезоксинуклеотиды разрушаются внутриклеточными нуклеазами, поэтому важно защитить их от действия последних так, чтобы они не утратили способности к гибридизации с мишенью. Для этого можно модифицировать определенным образом пиримидиновые основания и дезоксирибозу (рис. 21.14). Так, у наиболее широко применяющихся сейчас «антисмысловых» олигонуклеотидов свободный атом кислорода фосфодиэфирной связи заменен на сульфо-группу (рис. 21.14, Б), в результате чего образуется тиофосфатная связь. Модифицированные таким образом олигонуклеотиды растворяются в воде, несут отрицательный заряд и не расщепляются под действием эндонуклеаз. При гибридизации с сайтом-мишенью они образуют РНК—ДНК-дуплексы, которые активируют рибонуклеазу (РНКазу) Н, эндогенный фермент, расщепляющий мРНК в гибридной молекуле. Проведены первые клинические испытания таких олигонуклеотидов — лекарственных средств «первого поколения». Мишенями являются РНК цитомегаловируса, вируса иммунодефицита человека, а также мРНК генов, ответственных за развитие рака, болезней кишечника и других заболеваний.
Синтезированы «антисмысловые» олигонуклеотиды с фосфорамидитной и полиамидной (пептидной) связями (рис. 21.14, В и 1). Такие молекулы очень устойчивы к действию нуклеаз. Химические группы, присоединенные к 2'-углеродному атому сахарного остатка и C-5-атому пиримидинов, также защищают «антисмысловые» олигонуклеотиды и облегчают их связывание с сайтом-мишенью (рис. 1.14, Д и Е). Все преимущества этих и других модификаций сейчас интенсивно изучаются.
Проникновение «антисмытовых» олигонуклеотидов в клетку можно значительно облегчить, поместив их в липосомы. Такая высоко-эффективная система доставки позволяет использовать «антисмысловые» олигонуклеотиды в небольших концентрациях. Если же конъюгировать липосомы с сайтами связывания, специфичными для определенных клеток, то можно будет осуществлять адресную доставку олигонуклеотидов.
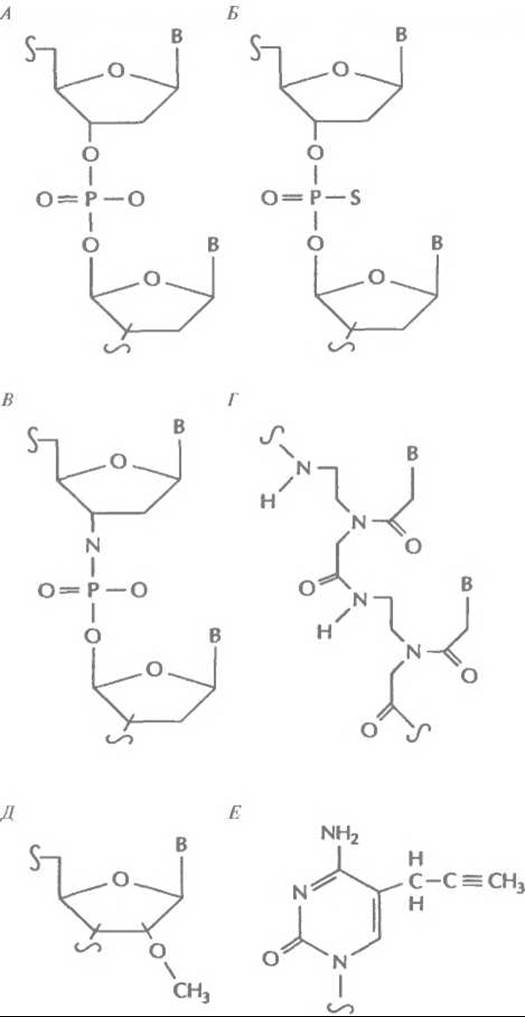
Рис. 21.14. Модификации «антисмысловых» олигонуклеотидов. А. Фосфодиэфирная связь. Б. Тиофосфатная связь. В. Фосфорамидитная связь. Г. Полиамидная связь (пептидная нуклеиновая кислота). Д. 2'-0-метилрибоза. Е. C-5-пропинилцитозин.
Проведенные доклинические испытания показали, что «антисмысловые» олигонуклеотиды являются весьма эффективными лекарственными средствами. Изучена возможность их применения для лечения стеноза коронарных и сонных артерий, который приводит к инфарктам и инсультам. В этих случаях часто прибегают к ангиопластике, расширению артерий с помощью баллонного катетера, но примерно у 40% больных через 6 мес вновь возникают стенозы, поскольку ангиопластика стимулирует пролиферацию гладкомышечных клеток и секрецию межклеточного вещества во внутренний слой артерии в месте ее расширения. В одном из экспериментов в сонные артерии крыс после ангиопластики вводили «антисмысловые» олигонуклеотиды с тиофосфатными связями, комплементарные мРНК, которые кодируют важные для клеточного цикла млекопитающих белки; в результате частота повторных стенозов уменьшилась на 90%. Пролиферация гладкомышечных клеток происходит также при атеросклерозе, сахарном диабете, осложнениях после коронарного шунтирования. Вероятно, все эти состояния можно будет контролировать аналогичными способами.
«Антисмыловые» олигонуклеотиды можно применять и для лечения вирусных инфекций и малярии. Кроме того, результаты I фазы клинических испытаний лечения болезни Крона с помощью орального введения «антисмыслового» олигонуклеотида проиллюстрировали четко выраженный терапевтический эффект без заметных побочных эффектов. В этом случае мРНК-мишень кодировала межклеточный адгезии типа 1, который вырабатывается в избытке у пациентов с болезнью Крона. Предполагается исследовать эффективность этого же олигонуклеотида для терапии других воспалительных заболеваний, например ревматоидного артрита, псориаза и язвенного колита.
В принципе «антисмысловые» олигонуклеотиды могут образовывать тройную спираль с хромосомной ДНК-мишенью и блокировать транскрипцию. Однако пока специфичность «антигенных» олигонуклеотидов не соответствует стандартам, принятым для лекарственных средств.
Олигонуклеотиды, связывающиеся с белками: антитромбиновый аптамер
Блокировать экспрессию гена-мишени можно не только с помощью «антисмысловой» терапии, но и введением в клетку олигонуклеотида, связывающегося с фактором транскрипции или трансляции, однако этот подход пока недостаточно изучен. Далее, поскольку нуклеиновые кислоты способны связываться с белками, можно синтезировать такой олигонуклеотид (так называемый аптамер), который будет присоединяться к определенному белку, в норме не связанному ни с какими нуклеиновыми кислотами, и блокировать его функцию. Так, антитромбиновый аптамер может стать недорогим средством профилактики тромбообразования при различных хирургических вмешательствах.
Для его получения использовали набор химически синтезированных олигонуклеотидов, состоящих из 18-нуклеотидных фланкирующих областей (праймеров) и центрального 60-нуклеотидного участка, где в каждом из 60 положений может находиться любой из четырех нуклеотидов. Теоретически такой набор содержит примерно 1,3 ∙ 1036 (460) олигонуклеотидов с разной центральной последовательностью. Образец пропустили через колонку, содержащую связанные молекулы тромбина, присоединившиеся к тромбину олигонуклеотиды элюировали и повторно пропустили через колонку со связанным тромбином. Эту процедуру повторяли не менее трех раз. Конечный набор тромбиновых аптамеров амплифицировали с помощью ПЦР и клонировали, после чего определили физические и биологические свойства каждого из них. Те аптамеры, которые обладали высокими сродством, специфичностью и антитромбиновой активностью, отбирали для более детального анализа.
Таким образом был получен эффективный антитромбиновый аптамер. К сожалению, вследствие малого времени жизни in vivo его можно использовать только для временного ингибирования функции тромбина (например, при кардиопульмонарном шунтировании), а в тех случаях, когда необходимо длительное введение противосвертывающих веществ (например, при ангиопластике), он неприменим. Очевидно, что описанную процедуру идентификации аптамеров можно использовать и в случае других белков-мишеней.
Рибозимы как лекарственные средства
Рибозимы — это природные РНК, обладающие каталитической активностью (РНК-ферменты); их субстратсвязывающий домен присоединяется к комплементарной РНК-мишени с помощью водородных и, возможно, других связей, а каталитический расщепляет ее в специфическом сайте. Модифицируя субстратсвязывающую последовательность, можно получить рибозим, специфичный в отношении определенной мРНК (рис. 21.15). Создание «терапевтического» рибозима — сложный процесс. Связано это с трудностью получения больших количеств синтетических РНК и сохранения их в нативном состоянии в клетке-мишени. В одном из экспериментов синтезировали олигодезоксинуклеотид, который содержал каталитический домен (примерно 20 нуклеотидов), фланкированный гибридизующимися с мРНК-мишенью последовательностями (они же выступали в роли праймеров), амплифицировали его, встроили в эукариотический экспрессирующий вектор и трансфицировали полученной конструкцией клетки. Образовавшийся после транскрипции рибозим расщеплял мРНК-мишень и подавлял трансляцию белка, ответственного за развитие того или иного заболевания. Рибозимы, созданные методами генной инженерии, можно использовать для лечения рака и вирусных инфекций.
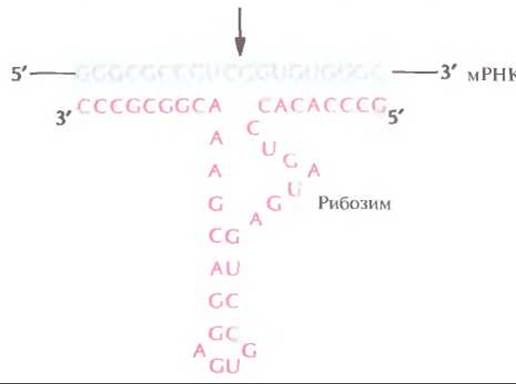
Рис. 21.15. Расщепление мРНК под действием рибозима. Рибозим, субстратсвязывающий домен которого модифицирован с помощью генной инженерии, гибридизуется с мРНК-мишенью и расщепляет ее в специфическом сайте (показано стрелкой). (Из работы Tone et al., In Vivo 7: 471—476, 1993, с изменениями.)
Природных ДНК-ферментов (дезоксирибозимов) пока не обнаружено, но уже синтезированы олигодезоксинуклеотиды, обладающие каталитической активностью. Преимущество дезоксирибозимов состоит в том, что для их получения не нужно использовать экспрессирующий вектор: ДНК-ферменты можно упаковать в липосомы и доставить в клетку-мишень. Однако создание эффективных ДНК-ферментов находится пока на начальном этапе развития.