Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Молекулярная биотехнология микробиологических систем
Генная терапия
Коррекция генетических дефектов с помощью олигонуклеотидов
Многие генетические дефекты можно скорректировать, заменив связанную с данным дефектом пару нуклеотидов в мутантном гене на «правильную» пару. В одном из экспериментов для этой цели использовался 68-членный химерный (ДНК-РНК) олигонуклеотид, который образует шпильку с двумя головками и содержит метилированный кислород при 2'-углеродном атоме рибозы (рис. 21.16). Выбор такого необычного олигонуклеотида основывается на следующих экспериментальных данных: 1) гетеродуплексы РНК-ДНК легче, чем двухцепочечные ДНК, спариваются с гомологичными нуклеиновыми последовательностями; 2) головки шпилек, не участвующие в спаривании, защищают олигонуклеотид от экзонуклеаз; 3) 2'-0-метилирование предотвращает разрушение молекулы РНКазой Н. Важно и расположение нуклеотидов в химерной молекуле: десять рибонуклеотидов фланкируют пять центральных дезоксирибонуклеотидов, причем этот сегмент имеет одинаковую с мишенью последовательность и содержит нормальную пару нуклеотидов.
Возможность коррекции мутаций с помощью химерных олигонуклеотидов изучали с использованием как кДНК, входящей в состав плазмиды, так и хромосомной ДНК. В обоих случаях мутантный сайт с высокой частотой заменялся нормальным. Но для того чтобы химерные олигонуклеотиды стали эффективными лекарственными средствами, необходимы дополнительные исследования. Если мутация в интроне распознается системой процессинга РНК как аутентичный сайт сплайсинга, то в процессированную мРНК включается часть интрона (рис. 21.17, А). Это приводит к сдвигу рамки считывания и образованию укороченного белка. При этом количество нормального белка снижается, что может стать причиной заболевания. Разумно предположить, что если «антисмысловой» олигонуклеотид, комплементарный мутантному интрону, гибридизуется с ним, то ошибочный сплайсинг блокируется, что повысит вероятность сплайсинга в нормальном сайте. Это предположение проверили на ß-глобиновом гене с мутацией во втором интроне (рис. 21.17, Б), обусловливающей одну из форм ß-талассемии, наследственного заболевания крови, которое приводит к разрушению эритроцитов (анемии). В клетки, гомозиготные по мутантному гену (IVS2-654), ввели содержащий тиофосфатные связи «антисмысловой» 2'-О-метилолигонуклеотид, комплементарный мутантному сайту сплайсинга. В результате число нормальных ß-глобиновых цепей увеличилось на 50%. Дальнейшие исследования покажут, является ли этот подход достаточно эффективным для лечения талассемии и других состояний, вызванных подобными мутациями.
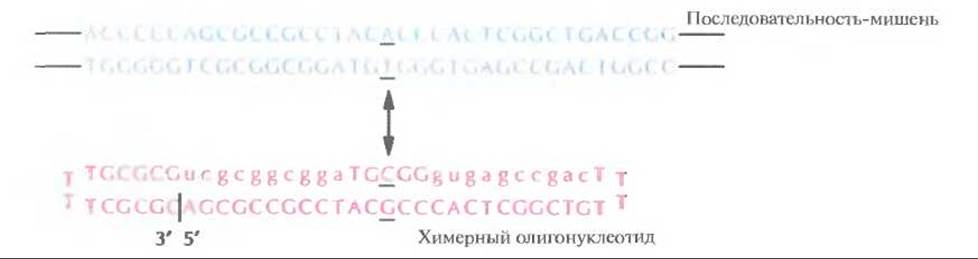
Рис. 21.16. Исправление генетического дефекта, состоящего в замене одной пары нуклеотидов, с помощью химерного олигонуклеотида. Стрелкой указаны мутантный сайт в последовательности-мишени и нормальная пара оснований в химерном олигонуклеотиде. Соответствующие нуклеотиды подчеркнуты. Прописными буквами обозначены дезоксирибонуклеотиды, а строчными — рибонуклеотиды. Жирным шрифтом выделены нуклеотиды, образующие головки шпильки. Вертикальная черта указывает 3’ - и 5'-концы химерного олигонуклеотида. (Из работы Yoon et al., Proc. Natl. Acad. Sсi. USA 93: 2071—2076, 1996, с изменениями.)

Рис. 21.17. Коррекция дефекта, приводящего к ошибочному сплайсингу, с помощью «антисмыслового» олигонуклеотида. А. Результат мутации, приводящей к ошибочному сплайсингу. Обозначения: цифры — экзоны, А — первый интрон, Б — второй интрон, содержащий мутацию (красный кружок), разделяющую его на две части (Б1 и Б2). Штриховые линии охватывают сегменты РНК, вырезаемые при процессинге. Возможны два варианта сплайсинга: вариант а приводит к образованию функциональной мРНК, вариант б — к образованию РНК, включающей часть второго интрона (Б2). Б. «Антисмысловой» олигонуклеотид (АС), связывающийся с мутантным сайтом сплайсинга, препятствует его распознаванию при процессинге, и в результате образуется только функциональная мРНК.